
Перечень вопросов к экзамену
Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
Органические соединения – соединения углерода с другими элементами. Основанием для выделения органических соединений в отдельную группу является то, что число известных в настоящее время соединений углерод чрезвычайно велико и во много раз превышает число всех неорганических веществ (если последних известно около 600 тысяч, то число органических соединений превышает в настоящее время 10 млн.). Многообразие соединений углерода представляет собой удивительное и единственное в своем роде явление и обусловлено способностью атомов углерода соединяться друг с другом с образованием цепей, циклов и других каркасов с практически неограниченным числом атомов углерода. Для органических соединений в значительно большей степени характерно явление изомерии. При этом между органическими веществами существует более тесная связь, чем между многими неорганическими.
К настоящему времени органическая химия сложилась в стройную науку, позволяющую планировать и осуществлять синтез практически любых типов органических соединений, а также надежно предсказывать их химические и физико-химические свойства. Развитие органической химии в историческом аспекте можно условно разделить на четыре периода: эмпирический (середина XVII — конец XVIII веков), аналитический (конец XVIII — середина XIX веков), структурный (вторая половина XIX — начало XX веков) и современный (начало XX века — до наших дней).
Органическая химия имеет исключительно важное познавательное и народнохозяйственное значение. Природные органические веществаи их превращения лежат в основе явлений Жизни. Поэтому органическая химия является химическим фундаментом биологической химии и молекулярной биологии – наук, изучающих процессы, происходящиев клетках организмов на молекулярном уровне. Исследования в этой области позволяют глубже понять суть явлений живой природы. Из современной органической химии выросли и успешно развиваются такие самостоятельные направления, как химия гетероциклических соединений, химия высокомолекулярных соединений, антибиотиков, гормонов, витаминов, химия элементоорганических соединений и др.
Источники органических соединений. Их можно разделить на две группы: а) природные (нефть, газ, уголь, торф, продукты, лесного хозяйства)
б) синтетические (органический синтез).
Из природных источников органические вещества получают в готовом виде или путем переработки природного сырья. Синтетические получают искусственно. Из нефти– получают бензины, ГСМ. Природный газ – на 95% состоит из метана.
Формирование и основные положения теории строения органических соединений (А.М. Бутлеров, А. Кекуле, А. Купер).
Теория строения органических веществ сформировалась во второй половине XIX века. К этому времени были получены и исследованы многие органические соединения, установлен их качественный и количественный состав, описаны свойства.
Так, в конце XVIII — начале XIX века были выделены важнейшие углеводороды и установлены их молекулярные формулы. К середине XIX века уже было предложено понятие валентности атомов, а после предположено, что атомы углерода четырёхвалентны.
Накопление необъяснимых на тот момент фактов стало предпосылкой создания новой теории — теории строения органических соединений. Её основные положения в середине XIX века сформулировал А. М. Бутлеров.
Создание такой теории, заложившей научные основы органической химии, принадлежит великому русскому ученому А. М. Бутлерову. Используя открытие немецкого химика Фридриха Августа Кекуле о четырехвалентности атома углерода и шотландского химика Арчибальда Скотта Купера о способности атомов углерода соединяться в длинные цепи, А. М. Бутлеров создал теорию химического строения органических соединений, основные принципы которой изложил в докладе «О теории химического строения»
Важнейшие положения теории строения органических соединений А. М. Бутлерова:
Атомы, входящие в состав органических соединений, связаны друг с другом в определённой последовательности в соответствии с их валентностью.
Свойства вещества зависят не только от того, атомы каких элементов и в каком количестве входят в состав молекул, но и от последовательности соединения атомов в молекулах.
Образующие молекулу атомы или группы атомов, связанные непосредственно или через другие атомы, оказывают взаимное влияние друг на друга, от чего зависит реакционная способность молекулы.
Изучив реакционную способность вещества, можно установить его строение и, наоборот, по строению вещества судить о его свойствах.
Таким образом, теория Бутлерова позволила объяснить, почему соединения, имеющие совершенно одинаковый состав, могут обладать различными свойствами. Вещества, молекулы которых имеют одинаковый качественный и количественный состав, но разное строение, называются изомерами.
Основные типы структурных фрагментов органических молекул: простые и кратные связи, углеродные цепи и циклы, функциональные группы. Структурные формулы как средство отображения строения органических соединений.
Простые связи имеют элементы, у которых имеется одна связь. Кратные, – у которых имеются две, три связи. Если между двумя атомами образуется только одна общая электронная пара, то такая ковалентная связь называется простой (одинарной) связью.
π-Связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов. s-Облака не могут образовать π-связи. В образовании π-связей могут участвовать p- и d-облака. Например, π-связь образуется при перекрывании двух p-облаков.π-Связь образуется в тех случаях, когда между двумя атомами возникает две или три общие электронные пары. Число общих электронных пар между связанными атомами характеризует кратность связи. Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойной связью. Любая двойная связь состоит из одной σ-связи и одной π-связи. Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройной связью. Любая тройная связь состоит из одной σ-связи и двух π-связей.

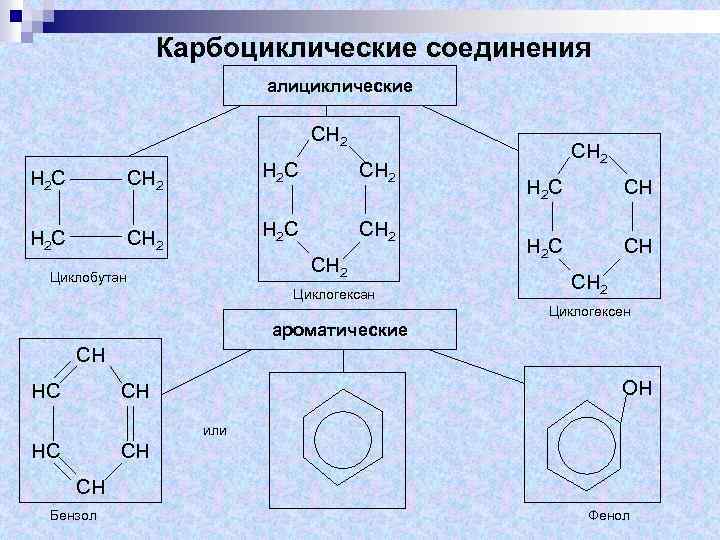
К алициклическим соединениям относят ряд карбоциклов, не обладающих ароматическим характером. Алициклические соединения по степени насыщенности делят на предельные и непредельные. Для ароматических соединений характерно наличие ароматической системы. Гетероциклические соединения могут быть насыщенными, ненасыщенными и ароматическими.
Функциональная группа-это группа атомов в молекуле с отличительными химическими свойствами, независимо от других атомов в молекуле. Атомы в функциональной группе связаны друг с другом и с остальной частью молекулы ковалентными связями. Для повторяющихся звеньев полимеров функциональные группы присоединяются к их неполярному ядру атомов углерода и таким образом придают химический характер углеродным цепям.
|
Структурная (графическая) формула отражает природу атомов, входящих в состав молекулы, их число и последовательность связывания, а также тип связей между ними. Химические связи в структурной формуле условно принято обозначать валентным штрихом. Для удобства записи часто используют сокращенную структурную формулу, в которой часть связей не обозначается, а приводятся лишь те, которые необходимы для однозначного описания структуры молекулы. Существует также упрощенный способ написания структурных формул, заключающийся в том, что углеродный остов молекулы изображают только посредством валентных связей без обозначения атомов углерода и связей С—Н. Предполагают, что координационное число каждого углеродного атома дополняется до четырёх атомами водорода. Таким образом, концевые прямые линии обозначают метильные группы, а не атомы водорода. Этот способ широко используется для изображения молекул карбоциклических и гетероциклических соединений.
|
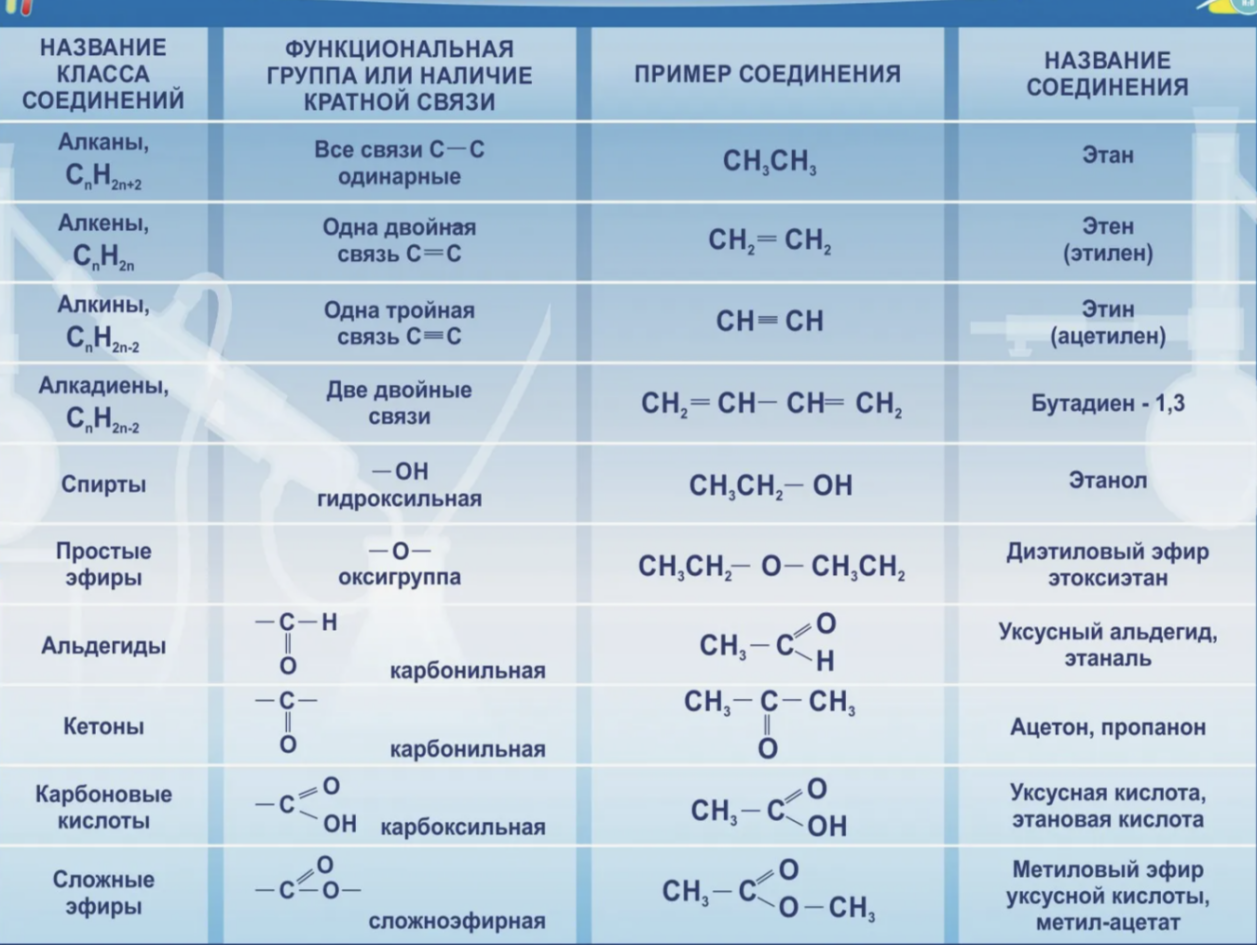
Основные признаки классификации органических веществ. Основные классы органических веществ.
Классификация органических соединений:
А) по строению углеродного скелета (вопрос 3); Б) по природе функциональных групп (вопрос 3).
Основные классы органических в-в:
Номенклатура органических соединений. Основные принципы построения названий органических соединений.
Органическая номенклатура - это система классификации и наименований органических веществ. В настоящее время для органических соединений применяют три типа номенклатуры: тривиальная, рациональная и систематическая номенклатура – номенклатура IUPAC
Тривиальная (историческая) номенклатура – первая номенклатура, возникшая вначале развития органической химии, когда не существовало классификации и теории строения органических соединений. Органическим соединениям давали случайные названия по источнику их получения (щавелевая кислота, яблочная кислота, ванилин), по цвету или запаху (ароматические соединения) реже по химическим свойствам (парафины). Многие из этих названий применяются до сих пор. Например: мочевина, индиго, фуксин, масляная, винная и валериановая кислота.
Рациональная номенклатура – по этой номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматриваются как производные этого соединения, образованные замещением в нем атомов водорода углеводородными или иными радикалами (например: триметилуксусный альдегид, метиламин, хлоруксусная кислота, метиловый спирт). В настоящее время такая номенклатура применяется только в тех случаях, когда она дает особенно наглядное представление о соединении.
Систематическая номенклатура - номенклатура IUPAC – международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия функций (заместителей) и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать правильную структурную формулу.
Основные принципы построения названий органических соединений:
В структурной формуле выбирают основную цепь, используя алгоритм выбора основной цепи:
А) В основную цепь входит «старшая» характеристическая группа.
Б) В основную цепь максимально включены характеристические группы и кратные связи.
В) Основная цепь максимально длинная из всех возможных.
Г) Основная цепь – самая разветвленная.
Основную цепь нумеруют так, чтобы старшая характеристическая группа получила наименьший номер. Если такая группа отсутствует, наименьший номер получает кратная связь, причем, принято, что двойная связь старше тройной. В случае отсутствия кратных связей нумерацию проводят так, чтобы заместители получили наименьшие номера.
Перечисляют заместители с их номерами в алфавитном порядке, затем записывают корень названия, отвечающий числу атомов углерода в основной цепи, добавляют суффикс кратных связей и суффикс старшей характеристической группы.
Если в молекуле присутствует несколько одинаковых заместителей или кратных связей, то употребляют приставку, обозначающую их число (ди-, три-, тетра-, пента-, гекса- и т. д.). Числа в названиях отделяют дефисами, между числами ставят запятые.
Типы изомерии: структурная и пространственная. Способы изображения пространственного строения молекул. Конформации, конформеры. Энантиомеры. Понятие об оптической активности и хиральности. Рацематы. Принципы R-, S-номенклатуры; D- и L-ряды. Диастереомеры. Пространственная изомерия алкенов: цис-, транс- и Z-, E- номенклатуры.
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается. Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.

Способы изображения пространственного строения молекул:
Шаростержневые модели.
Модели Дрейдннга. Такие модели достаточно точно передают валентные углы и соотношение длин связей в молекулах. Ядра атомов в них, в отличие от шаростержневых моделей, обозначаются не шариками, а точками соединения стержней.
Полусферические модели. Полусферические модели точно передают как соотношение длин связей и валентных углов, так и заполненность межъядерного пространства в молекулах. Однако эта заполненность не всегда позволяет получить наглядное представление о взаимном расположении ядер атомов в молекуле.
Стереохимические формулы. Их используют для изображения молекул, содержащих тетраэдрические и тригональные 12C, т. е. в sp3- и sp2-гибридном.
Проекционные формулы Ньюмена. Эти формулы применяют для изображения двухуглеродных фрагментов молекул
Проекционные формулы Фишера. С помощью этих формул изображают молекулы, имеющие в своем составе асимметрические атомы углерода.
Итак, конформации - это различные неидентичные пространственные формы молекулы, имеющие определенную конфигурацию.
Конформеры - это стереоизомерные структуры, находящиеся в подвижном равновесии и способные к взаимопревращению путем вращения вокруг простых связей.
Энантиомеры -- Пара стереоизомеров, представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве.
Оптическая активность – способ-ность среды (кристаллов, растворов, па-ров) вызывать вращение плоскости поля-ризации плоскополяризованного света. Стереоизомеры – молекулы, отличаю-щиеся только пространственным располо-жением заместителей.
Хиральность – свойство молекулы не совмещаться в пространстве со своим зер-кальным отражением.
Рацема́т — эквимолярная смесь двух энантиомеров. Рацематы не обладают оптической активностью, а также отличаются по свойствам от индивидуальных энантиомеров.
Для обозначения конфигурации 12С*в хиральных молекулах в настоящее время используется R,S-система. В ее основе лежит принцип старшинства заместителей, окружающих центр хиральности, или, как его называют, правило последовательности. Для установления порядка старшинства лигандов руководствуются правилами:
Старшинство заместителей определяется по порядковому номеру элемента, связанного непосредственно с центром хиральности. Чем больше номер элемента в периодической системе элементов, тем старше заместитель.
Неподеленная пара электронов считается самым младшим заместителем.
В более сложных случаях старшинство групп, окружающих центр хиральности, определяют по второму, третьему и более дальним слоям атомов. Например, группа — СН2ОН старше группы — СН2СН3. Это записывается так: С(О,Н,Н), атомы в скобках в порядке уменьшения их атомных номеров. В приведенных ниже примерах старшая группа записана слева:
![]()
В тех случаях, когда атом углерода имеет кратные связи с атомами последующего слоя, формально полагают, что он связан с двумя или соответственно тремя атомами этого вида:
![]()
Группы с реально существующими атомами старше тех группировок, где такие же атомы появляются за счет двойных или тройных связей. Так, группа — СН(ОСН3)2 имеет приоритет перед группой —СН=О.
Из двух изотопов старше тот, у которого больше массовое число, например, дейтерий D (2Н) старше протия 1Н.
Заместитель с R-конфигурацией старше заместителя с S-конфигурацией, а группировка атомов с Z-конфигурацией двойной углерод-углеродной связи старше, чем группа с E-конфигурацией.
D,L-Система обозначения конфигурации. Проблема, заключалась в том, что технические возможности времени не позволяли установить абсолютную конфигурацию (истинное взаимное расположение атомов в молекуле). Было найдено решение — левовращающему глицериновому альдегиду была произвольно приписана формула (I), а правовращающей форме — структура (II):
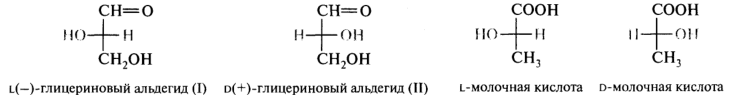
Согласно этой концепции, конфигурацию других хиральных молекул сравнивают с конфигурацией одного из энантиомеров глицеринового альдегида. Соединения, имеющие конфигурационное сходство с оптически активным левовращающим глицериновым альдегидом, относят к L-стереохимическому ряду, и соответственно соединения, в которых расположение атомов и атомных групп похоже на конфигурацию правовращающего глицеринового альдегида, относят к D-ряду.
Абсолютная конфигурация одного из известных ранее оптических веществ — D-винной кислоты — была определена методом рентгеноструктурного анализа при изучении дифракции рентгеновского излучения на кристаллах смешанной натриеворубидиевой соли D-винной кислоты. К счастью, она оказалась такой же, какую для нее установили путем химической корреляции с глицериновым альдегидом. Следовательно, и конфигурации остальных веществ, соотнесенные ранее с винной кислотой, оказались истинными, что позволило избежать путаницы в литературе. В настоящее время рентгеноструктурный анализ является одним из основных методов установления пространственного строения органических молекул.
Однако D,L-система имеет ограниченное применение из-за невозможности отнесения к D- или L-рялу соединений многих классов. При отнесении к стереохимическим рядам стереоизомеров, имеющих два и более центра хиральности, приходится вводить некоторые оговорки. В настоящее время D,L-система находит применение в основном в химии углеводов, аминокислот и родственных с ними соединений.
Энантиомеры — это стереоизомеры, молекулы которых относятся друг к другу как предмет и несовместимое с ним зеркальное изображение. Диастереомеры — это стереоизомеры, молекулы которых не относятся друг к другу как предмет и несовместимое с ним зеркальное изображение.
Пространственные изомеры имеют одинаковую последовательность соединения атомов и одинаковое положение двойной связи, но различаются пространственным расположением атомов в молекуле.
Возникновение пространственной изомерии у алкенов обусловлено невозможностью вращения вокруг двойной связи.
Алкены, имеющие заместители у атомов углерода, связанных двойной связью, могут существовать в виде пространственных цис- и транс-изомеров.
Цис-транс-изомеры отличаются друг от друга физическими и некоторыми химическими свойствами: транс-изомер обычно термодинамически более стабилен, поскольку объемные заместители удалены друг от друга на большее расстояние. Если в молекуле этилена атомы водорода замещены на три или четыре различных заместителя, то для обозначения конфигурации двойных связей цис- и транс-изомеров используют Е,Z-систему, в основе которой лежит принцип старшинства заместителей. Старшим заместителем является тот, который имеет наибольший атомный номер. Например, бром старше хлора, а хлор, соответственно, старше углерода. E,Z-система однозначно указывает расположение заместителей, что при использовании префиксов цис- и транс- не всегда возможно. Если старшие заместители каждой пары находятся по одну сторону от двойной связи, то конфигурацию обозначают префиксом Z- (сокр. от нем. zusammen — вместе), если по разные стороны, соответствующий стереоизомер обозначают префиксом Е- (сокр. от нем. entgegen — напротив).
Типы связей в молекулах органических соединений. σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле. По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь
является дополнительной к σ-связи, она
менее прочная и легче разрывается при
химических реакциях.

Гибридизация орбиталей — это изменение формы и энергии некоторых электронов при образовании ковалентной связи, приводящее к более эффективному перекрыванию орбиталей и повышению прочности связей. Гибридизация орбиталей происходит всегда, когда в образовании связей участвуют электроны, принадлежащие к различным типам орбиталей.
Молекулярная орбиталь — математическая функция, описывающая волновое поведение электронов в молекуле.
Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
Понятие используется в основном в двух смыслах. Для сложных реакций, состоящих из нескольких стадий, механизм реакции -- это совокупность стадий, в результате которых исходные вещества превращаются в продукты. Механизм реакции (или путь химической реакции) — это последовательность этапов протекания химической реакции на молекулярном уровне. На каждом этапе происходит создание или разрушение молекулярных связей Механизм реакции – детальное описание реакции с учетом всех промежуточных стадий и промежуточных веществ, природы взаимодействия реагирующих частиц, характера разрыва связей, изменения энергии химической с-мы на всем пути её перехода из исходного в конечное состояние. Цель изучения механизма реакции – возможность управлять ходом реакции, её направлением и эффективностью. Механизм реакции всегда следует рассматривать как гипотезу с достаточной степенью достоверности.
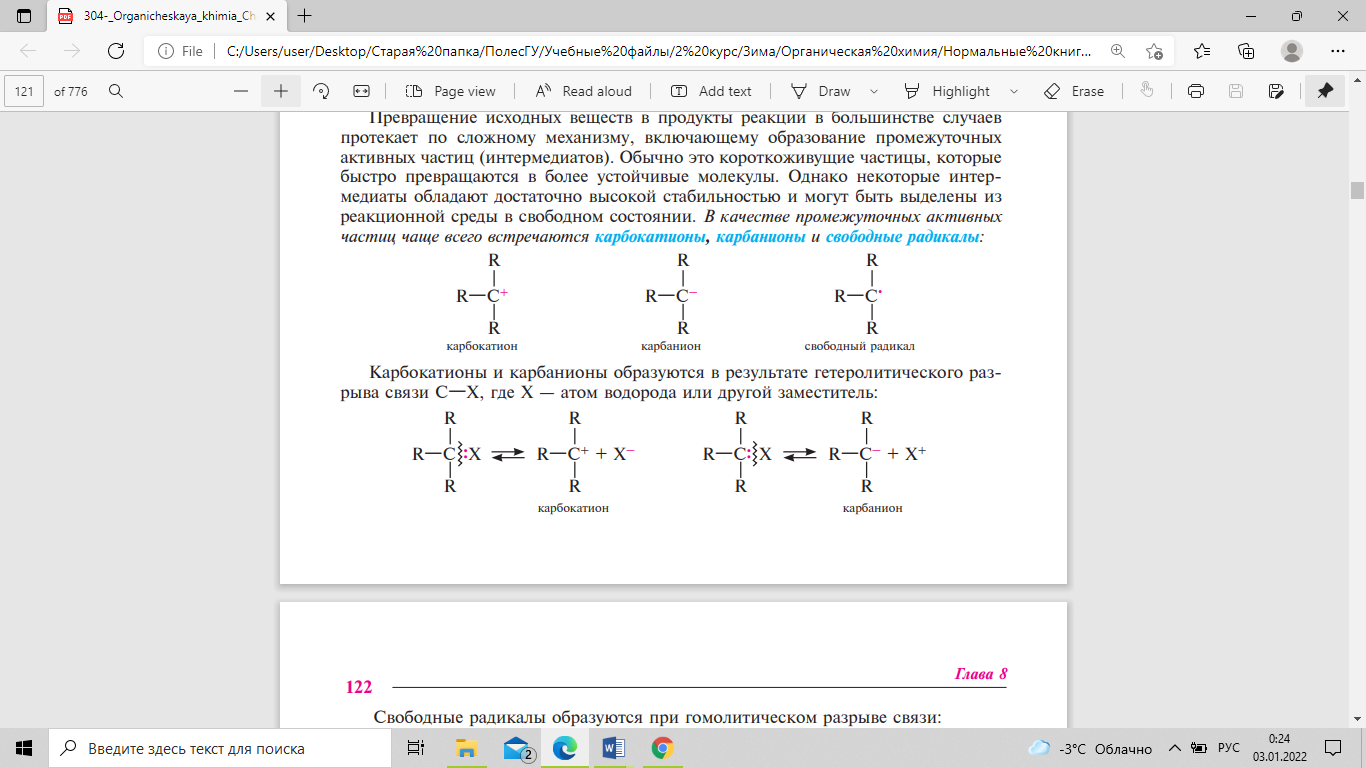
Промежуточные активные чатсицы -- это короткоживущие частицы, которые быстро превращаются в более устойчивые молекулы. Однако некоторые интермедиаты обладают достаточно высокой стабильностью и могут быть выделены из реакционной среды в свободном состоянии.
Атом или группа атомов, имеющие неспаренный электрон, называются свободным радикалом. Свободные радикалы образуются при гомолитическом разрыве связи:

Свободными радикалами называют незаряженные частицы, содержащие неспаренный электрон (одноэлектронную орбиталь). В органических свободных радикалах неспаренный электрон может находиться у атома углерода, а также у атомов азота, кислорода и других элементов. Чаще всего встречаются свободные радикалы, несущие неспаренный электрон на атоме углерода. В таких радикалах атом углерода с неспаренным электроном может иметь плоскостную и тетраэдрическую конфигурацию. Простые алкильные радикалы, а также радикалы, в которых атом углерода с неспаренным электроном находится в сопряжении с π-электронами кратной связи или бензольного кольца, имеют плоское строение радикального центра, то есть атом углерода находится в sp2-гибридизации; неспаренный электрон занимает р-атомную орбиталь. Третичные алкильные радикалы имеют тетраэдрическое строение радикального центра; неспаренный электрон занимает sp3-гибридную орбиталь. Как и в случае карбанионов, если атом углерода с неспаренным электроном принимает участие в образовании двойной связи, радикальный центр имеет плоское строение, а неспаренный электрон находится на sp2-гибридизованной орбитали. Свободные радикалы образуются в результате гомолитического разрыва ковалентной связи в молекуле, который происходит в основном при термических и фотохимических воздействиях. Устойчивость свободных радикалов аналогично карбокатионам и карбанионам зависит от их структуры и определяется возможностью делокализации неспаренного электрона. Чем больше делокализация, тем выше устойчивость. Поскольку свободные радикалы имеют неспаренный электрон, они обладают магнитным моментом и являются парамагнитными частицами. Это свойство используют для их обнаружения. Метод, основанный на измерении магнитных свойств неспаренных электронов, получил название «электронного парамагнитного резонанса» (ЭПР). Этот метод аналогичен ЯМР, только вместо ядерного спина в нем фиксируют спин электрона.
Карбокатионы и карбанионы образуются в результате гетеролитического разрыва связи С—X, где Х — атом водорода или другой заместитель:
Карбокатионами называют органические катионы, содержащие положительно заряженный атом углерода. Атом углерода, несущий положительный заряд, находится в карбокатионе в sp2-гибридизации: три его σ-связи с соседними атомами расположены в одной плоскости; p-атомная орбиталь, ось которой перпендикулярна к плоскости σ-связей, является вакантной. Названия карбокатионов составляются добавлением к наименованию соответствующего радикала слова «катион».
Существует несколько основных способов образования карбокатионов. Прямая ионизация соединений в сильно полярных средах характерна для веществ, в которых атом углерода связан с заместителем сильно полярной ковалентной связью. Процесс ионизации заметно активизируется в присутствии катализатора, в частности кислот Льюиса (AlCl3, FeBr3, ZnCl2 и др.), или протона. Присоединение протона или другой электрофильной частицы к одному из атомов, связанных между собой кратной связью. Устойчивость карбокатионов определяется возможностью делокализации (рассредоточения) заряда в молекуле. Чем в большей степени положительный заряд распределен между другими атомами в молекуле, тем более устойчивым является катион. Степень рассредоточения заряда в карбокатионе обусловлена его строением. Наряду со структурными особенностями большое влияние на стабильность карбокатионов оказывают внешние факторы, в частности сольватация катионов молекулами растворителя, то есть образование вокруг каждого катиона оболочки из молекул растворителя. Чем в большей степени сольватирован катион, тем выше его устойчивость. При прочих равных условиях сольватационный эффект тем выше, чем меньше размер иона и чем менее делокализован в нем заряд. Сольватная оболочка в значительной степени экранирует заряд катиона и ослабляет его взаимодействие с другими ионами, препятствуя таким образом взаимной нейтрализации разноименно заряженных ионов. Сольватационная способность растворителя определяется значением диэлектрической проницаемости ε. Наибольшей сольватационной способностью обладает вода (ε = 80) и серная кислота (ε = 84). Поскольку карбокатионы чаще всего являются короткоживущими промежуточными частицами, которые при небольшой энергии активации вступают в дальнейшие химические превращения, обнаруживают их в основном с помощью инструментальных методов ЯМР- и УФ-спектроскопии.
Карбанионами называют органические анионы, содержащие отрицательно заряженный атом углерода, то есть трехвалентный атом углерода с неподеленной парой электронов. Анионный центр в зависимости от структуры аниона может иметь тетраэдрическое или плоскостное строение. Тетраэдрическое строение характерно для насыщенных карбанионов и карбанионов, в которых анионный центр не находится в сопряжении с π-электронами кратной связи. В таких карбанионах отрицательно заряженный атом углерода находится в sp3-гибридизации, а свободная электронная пара занимает sp3-гибридную орбиталь. Карбанионы, в которых неподеленная пара электронов анионного центра находится в сопряжении с π-электронами кратной связи, имеют плоское строение. При этом отрицательно заряженный атом углерода находится в sp2-гибридизации, а свободная электронная пара занимает р-атомную орбиталь. Плоскую структуру имеют также карбанионы, в которых анионный центр содержит двойную или тройную связь. В таких карбанионах свободная электронная пара занимает sp2- или sp-гибридную орбиталь соответственно. Названия карбанионов составляются добавлением к наименованию соответствующего радикала слова «анион» (метил-анион, пропил-анион, трифенилметил-анион).
Существуют несколько основных способов образования карбанионов. Взаимодействие соединений с достаточно полярной связью С—Н с активными реагентами (щелочами, амидами щелочных металлов и др.). Ионизация металлорганических соединений. Устойчивость карбанионов определяется возможностью делокализации отрицательного заряда. Чем в большей степени заряд рассредоточен между другими атомами в молекуле, тем более устойчив карбанион. Степень делокализации отрицательного заряда определяется прежде всего строением карбаниона. К структурным факторам, определяющим устойчивость, относятся состояние гибридизации атома углерода анионного центра, а также природа и число заместителей, с которыми он связан. При равных других условиях устойчивость карбанионов возрастает с увеличением s-характера гибридной орбитали, которую занимает неподеленная пара электронов анионного центра. Существенное влияние на устойчивость карбанионов оказывают электронная природа и число заместителей, с которыми связан анионный центр. Электронодонорные заместители повышают электронную плотность в анионном центре и тем самым дестабилизируют карбанион. Так, устойчивость простых алкиланионов уменьшается в ряду. Устойчивость карбанионов значительно повышается вследствие сопряжения неподеленной пары электронов анионного центра с π-электронами кратных связей или π-электронной системой бензольного кольца. В этом случае отрицательный заряд делокализуется по всей сопряженной системе. Еще более устойчивы карбанионы, в которых анионный центр сопряжен с кратной связью углерод-кислород. Для обнаружения карбанионов чаще всего используют спектроскопию в УФ и видимой областях, а также метод ЯМР.
В зависимости от способа разрыва связей в атакующем реагенте и субстрате различают три типа механизмов реакций: гомолитический (радикальный), гетеролитический (ионный) и перициклический (молекулярный). Гомолитическим, или свободнорадикальным, называют механизм, в котором при разрыве связей в реагирующих молекулах у каждого из образующихся фрагментов остается по одному электрону. Такие частицы называют радикалами. Свободнорадикальный механизм обозначают символом R. Гетеролитическим, или ионным, называют механизм, в котором при разрыве связей в реагирующих молекулах оба электрона остаются на одном из образующихся фрагментов. Такие частицы называют ионами. Реакции, протекающие по ионному механизму, в зависимости от электронной природы атакующего реагента делят на нуклеофильные (символ N) и электрофильные (символ Е ). В нуклеофильных реакциях атакующим реагентом является нуклеофил (Nи), в электрофильных — электрофил (Е).
Нуклеофильными (ищущими ядра) называют реагенты, которые отдают электронную пару при образовании химической связи с субстратом. К нуклеофильным реагентам относят анионы и нейтральные молекулы, содержащие атомы с неподеленными парами электронов или центры с повышенной электронной плотностью. Типичными нуклеофильными реагентами являются: 1. Ионы, несущие отрицательный заряд (анионы): OH–, CN–, RO–, NH2– и др.; 2. Нейтральные молекулы, содержащие одну или несколько неподеленных пар электронов: NH3, R—NH2, R2NH, R3N, H2O, R—OH, R—O—R и др.; 3. Молекулы, имеющие центры с повышенной электронной плотностью (алкены, алкадиены, алкины, арены). Нуклеофилы способны образовывать ковалентную связь с субстратом, атакуя в его молекуле центры с пониженной электронной плотностью.
Электрофильными (ищущими электроны) называют реагенты, принимающие электронную пару от субстрата при образовании с ним химической связи. К электрофильным реагентам относят катионы и нейтральные молекулы, имеющие вакантную орбиталь или центры с пониженной электронной плотностью. Типичными электрофильными реагентами являются: 1. Ионы, несущие положительный заряд (катионы): протон (Н+), катионы металлов (Мn+), протонированный серы (VI) оксид (HSO3+), нитрозил-катион (NO+) и др.; 2. Нейтральные молекулы, имеющие вакантную орбиталь: SO3, кислоты Льюиса (АlСl3, FeВr3, SnCl4, ВF3 и др.); 3. Молекулы, имеющие центры с пониженной электронной плотностью: галогенопроизводные углеводородов, карбонилсодержащие соединения, а также галогены3 Cl2, Br2, I2. Электрофильные реагенты способны образовывать ковалентную связь с субстратом, атакуя в его молекуле центры с повышенной электронной плотностью.
Энергетический профиль реакции, энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
Энергетический профиль реакции - график зависимости потенциальной энергии от координаты реакции
Активация вызывается повышением температуры, действием электрического поля, действием квантов света и т.д. Энергия активации Еа постоянна в данном температурном интервале и определяется механизмом реакции.
Энергетический профиль реакции – это графическая зависимость энергии системы от сложной функции расстояния между реагирующими веществами, которую обычно называют «координатой реакции» или «ходом реакции».
Разница между средней энергией молекул А и Б и средней энергией переходных состояний (которые тоже рассматриваются как молекулы), называется энергетическим барьером или энергией активации Еа этой реакции. Итак, мы видим, что начальное и конечное состояние вещества в химической реакции разделены неким энергетическим барьером. Его величину обычно выражают в кДж на моль А (или на моль Б). Этот барьер называется энергией активации реакции и обозначается символом Еа.
Энергия активации Еа - это та дополнительная энергия (к средней энергии Е сталкивающихся частиц), которая необходима, чтобы столкновение привело к химической реакции.
Переходное состояние — состояние системы, при котором уравновешены разрушенные и созданные связи. В переходном состоянии система находится в течение небольшого времени. Энергия, которую необходимо затратить, чтобы привести систему в переходное состояние, называется энергией активации.
Тепловой эффект реакции — это энергия, которая выделяется или поглощается, когда химические вещества претерпевают превращения в процессе химической реакции. Этот параметр отражает изменение содержания энергии при превращении реактантов в продукты.
Кинетический и термодинамический контроль:
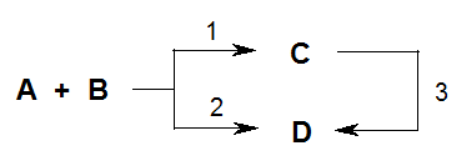
В ряде случаев могут образовываться 2 продукта, один из которых может превращаться в другой. При низкой температуре, когда энергия реагирующих молекул невелика, основное направление реакции – образование соединения С. Этот процесс контролируется скоростью и называется кинетически контролируемой реакцией, а соединение С – продуктов кинетического контроля. Образование соединения D требует большей энергии, однако продукт D более устойчив, чем С. Поэтому с ростом температуры наблюдается преобладание соединения D. Процесс образования соединения D контролируется энергетическими факторами и называется термодинамически контролируемой реакцией, а соединение D – продукт термодинамического контроля.
Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа).
Для оценки кислотности и основности органических соединений в современной органической химии используют две теории — протонную (протолитическую) теорию Брёнстеда и электронную теорию Льюиса. Согласно теории Брёнстеда кислотой называют любое вещество, способное отдавать протон (донор протона), а основанием — вещество, способное присоединять протон (акцептор протона). Отсюда теория получила название «протонной» или «протолитической». Для взаимодействия с протоном основание должно иметь неподеленную пару электронов или π-молекулярную орбиталь. Кислотность и основность являются относительными свойствами вещества. Кислотный характер может проявляться лишь в присутствии основания, и, наоборот, основный характер — только в присутствии кислоты. В целом кислотно-основный процесс состоит в переносе протона от кислоты к основанию и может быть представлен следующей схемой:
 .
.
Кислота А—Н, отдав протон, превращается в основание А–, которое называют сопряженным основанием данной кислоты. Основание В, присоединив протон, переходит в сопряженную кислоту В+—Н. Кислота А—Н и основание А–, а также основание В и кислота В+—Н являются сопряженными кислотно-основными парами. Мерой силы кислоты А—Н является константа кислотности Kа, которая обычно определяется по отношению к стандартному основанию — воде. Чем больше значение Kа, тем сильнее кислота. Как правило, константы кислотности очень малы.
Г. Н. Льюис в 1923 году предложил электронную теорию кислот и оснований, которая не противоречит Брёнстеду, но является более общей. Согласно теории Льюиса основание — любая частица (атом, молекула или анион), способная отдавать электронную пару для образования ковалентной связи, а кислота — любая частица (атом, молекула, катион), способная принимать пару электронов с образованием ковалентной связи. Основание по теории Льюиса является донором, а кислота — акцептором пары электронов. Из приведенного определения видно, что основания Льюиса тождественны основаниям Брёнстеда. Однако кислоты Льюиса охватывают более широкий круг органических соединений. Кислотой Льюиса считается любая частица, имеющая вакантную орбиталь. Если в теории Брёнстеда кислота — это донор протона, то согласно теории Льюиса сам протон является кислотой, поскольку имеет вакантную орбиталь. В представлении электронной теории кислота Брёнстеда является соединением, которое образует кислоту Льюиса. Поэтому согласно теории Льюиса к кислотам относят не только соединения, отщепляющие протон (протонные кислоты), но и другие вещества, имеющие вакантную орбиталь и способные принимать пару электронов (апротонные кислоты). Кислотами Льюиса являются такие соединения, как BF3, AlCl3, SbCl3, ZnCl2, HgCl2 и др. Кислотно-основный процесс по Льюису состоит в образовании ковалентной связи между основанием и кислотой за счет электронной пары основания и вакантной орбитали кислоты. Так, основания Льюиса, имеющие неподеленные пары электронов, образуют с кислотами Льюиса n-комплексы:
![]()
Основания Льюиса, содержащие в своей структуре π-связь, образуют с кислотами Льюиса π-комплексы. Лёгкость протекания кислотно-основной реакции определяется силой кислоты и основания, а также жесткостью или мягкостью кислоты и основания.
Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
реакционная способность органических соединений определяется характером распределения электронной плотности в молекуле и подвижностью (поляризуемостью) электронов ковалентных связей. В органических соединениях различают два вида электронных смещений: смещение электронной плотности по цепи σ-связей — индуктивный эффект; смещение по системе π-связей — мезомерный эффект. При образовании ковалентной связи между двумя атомами с одинаковой электроотрицательностью электронная пара в равной мере принадлежит связанным атомам (неполярная связь). Если же атомы имеют разную электроотрицательность, электронная плотность ковалентной связи смещается к более электроотрицательному атому (полярная связь). В сложных органических молекулах полярная ковалентная связь оказывает влияние на соседние связи, вызывая их поляризацию. В результате такого смещения на одном атоме появляется частичный отрицательный заряд (δ–), а на другом — равный по значению частичный положительный заряд (δ+). Понижение электронной плотности на С1 частично компенсируется оттягиванием в его сторону электронной плотности с соседнего атома углерода, что приводит к поляризации связи С-2—С-1 и возникновению частичного положительного заряда на атоме С-2. Тот, в свою очередь, вызывает поляризацию связи С-3—С-2 и т. д. По мере удаления связи дробный заряд на атомах углерода уменьшается: δ+ > δ'+ > δ''+ > δ'"+. Таким образом, поляризация связи С—Сl вызывает электронную асимметрию молекулы и появление дипольного момента. Передачу электронного влияния заместителя вдоль цепи σсвязей называют индуктивным (индукционным) эффектом, обозначается символом I, направление смещения электронной плотности σ-связей — прямой стрелкой. Действие индуктивного эффекта наиболее сильно проявляется на двух ближайших σ-связях. Индуктивный эффект из-за слабой поляризуемости σ-связей затухает через 3—4 связи. В зависимости от направления электронного влияния заместителя различают +І и –І. В качестве стандарта для оценки индуктивного влияния заместителя принят индуктивный эффект атома водорода, который из-за небольшого дипольного момента связи С—Н принято считать равным нулю. Заместители, притягивающие к себе электроны σсвязи в большей степени, чем атом водорода, проявляют отрицательный индуктивный эффект (–І), а заместители, отталкивающие от себя электроны σсвязи сильнее атома водорода - положительный индуктивный эффект (+І ). Отрицательный индуктивный эффект заместителя, как правило, тем больше, чем выше электроотрицательность атома, связанного с углеродной цепью. Более эффективно происходит передача электронного влияния заместителя по сопряженной системе, состоящей из чередующихся простых и кратных связей, или же когда рядом с углеродным атомом, образующим кратную связь, находится атом, р-АО которого заполнена одним электроном, двумя или вакантна. Системы делятся на системы с открытой и замкнутой цепью. В сопряженных системах имеет место сопряжение связей — дополнительное перекрывание π- или р-орбиталей заместителя с πорбиталями связей углеродной цепи или ароматического кольца. Различают π,π-сопряжение (перекрывание двух π-орбиталей) и р,π-сопряжение (перекрывание р- с π-орбиталью). Сопряжение возможно лишь в случае параллельности осей симметрии (компланарности) взаимодействующих орбиталей; является для молекулы энергетически выгодным процессом, сопровождается уменьшением энергии системы и приводит к повышению термодинамической устойчивости молекулы. Процесс передачи электронного влияния заместителя по сопряженной системе πсвязей называют мезомерным эффектом (М) или эффектом сопряжения (С); проявляется лишь в том случае, если заместитель включен в сопряженную систему молекулы, обозначают символом М, а смещение электронной плотности в сопряженной системе — изогнутой стрелкой. Начало стрелки указывает, какие именно электроны смещаются, а конец стрелки — связь или атом, к которым направлено смещение. Различают положительный (+М) и отрицательный (–М) мезомерный эффект. +М проявляют заместители, подающие электроны в сопряженную систему. +М-Эффект проявляют атомы, содержащие неподеленные пары электронов/несущие отрицательный заряд, а также атомные группы, имеющие на первом атоме неподеленные электронные пары или отрицательный заряд. –М проявляют заместители, смещающие на себя электронную плотность сопряженной системы. -М-Эффект проявляют заместители, первый атом которых несет положительный заряд, а также атомные группы, в которых первый атом связан с более электроотрицательным атомом кратной связью. Максимальный отрицательный мезомерный эффект проявляют заместители, несущие положительный заряд. –М-Эффект ненасыщенных группировок тем больше, чем больше разность электроотрицательностей атомов, связанных кратной связью. Максимальным положительным мезомерным эффектом обладают атомы, несущие отрицательный заряд. +М-Эффект заместителей, содержащих атомы с неподеленными парами электронов тем больше, чем меньше в пределах периода электроотрицательность атома, несущего неподеленную электронную пару. В пределах группы периодической системы +М-эффект заместителей ослабевает сверху вниз (–F > –С1 > –Вr), что объясняют большей энергетической выгодностью при перекрывании близких по размерам р-орбиталей. Типы. 1. Взаимодействие заместителя, обладающего +М-эффектом, с π-электронной системой молекулы. 2. Взаимодействие заместителя, обладающего –М-эффектом, с π-электронной системой молекулы. 3. Взаимодействие двух заместителей с +М-эффектом и –М-эффектом, непосредственно связанных σ-связью. 4. Взаимодействие заместителей, обладающих +М-эффектом и –М-эффектом, через π-электронную систему молекулы. В отличие от индуктивного эффекта передача электронного влияния заместителя по сопряженной системе происходит на значительно большее расстояние, практически не затухая. В большинстве случаев индуктивный и мезомерный эффекты заместителей совпадают по направлению. У заместителей, содержащих атомы с неподеленными электронными парами, индуктивный и мезомерный эффекты имеют противоположные направления и как бы «гасят» друг друга. В молекулах некоторых органических соединений имеет место сверхсопряжение (гиперконъюгация) — взаимодействие, возникающее в молекуле, карбокатионе или в свободном радикале в результате перекрывания σорбитали с—н связей с соседними π или pорбиталями и приводящее к дополнительной стабилизации системы (σ,π или σ,рсопряжения). Характерно для соединений, в молекулах которых sp3-гибридизованный атом углерода, имеющий по крайней мере один атом водорода, расположен рядом с кратной связью, ароматической системой (σ,π-сопряжение) или фрагментом молекулы с вакантной или частично заполненной р-орбиталью (σ,р-сопряжение). Обозначают символом Mh и схематично изображают с помощью изогнутой стрелки. Эффект сверхсопряжения зависит от количества атомов водорода при α-углеродном атоме и уменьшается в ряду: СH3— > СH3—CH2— > CH— СH3 – СH3 . В результате сверхсопряжения атомы водорода при α-атоме углерода активируются (протонируются) и проявляют повышенную реакционную способность.
Перегонка, перекристаллизация как методы выделения и очистки органических соединений. Химические и физические методы установления структуры. Качественный Функциональный анализ органических соединений.
Одним из важнейших методов очистки и выделения органических веществ является перегонка, представляющая собой процесс разделения жидкой смеси на составные части путем нагревания жидкости до кипения и конденсации ее паров в виде дистиллята в холодильнике. Температуру, при которой давление пара становится равным внешнему давлению, называют температурой кипения. Любая жидкость, не разлагающаяся при нагревании до температуры, при которой давление пара становится равным 760 мм рт. ст., имеет свою характерную температуру кипения при обычном давлении. Поскольку температура кипения сильно зависит от давления, всегда надо указывать давление, при котором эта температура кипения наблюдалась. Если давление не указано, то подразумевается атмосферное давление. Перегонке могут подвергаться не только жидкие, но и твердые при комнатной температуре вещества. По сравнению с перекристаллизацией перегонка дает, как правило, более высокий выход чистого продукта при меньших затратах времени.
+С помощью перегонки в лабораторных условиях за одну операцию можно, например, легко очистить до килограмма вещества
+ может быть использована для очистки сильно загрязненных соединений, в том числе для выделения продуктов непосредственно из реакционной массы.
+ перегонка не связана с затратами каких-либо вспомогательных веществ, например адсорбентов или органических растворителей.
- Многие вещества разлагаются при температуре кипения даже при пониженном давлении.
- перегонка не всегда обеспечивает полное разделение.
-Довольно распространенное явление, мешающее перегонке, - способность некоторых высококипящих веществ перегоняться с парами других веществ. В то же время это свойство используют для эффективной очистки высококипящих веществ, например при перегонке с водяным паром.
Способы перегонки разделяются на две группы: простая перегонка и ректификация.
По условиям проведения различают три вида перегонки: при атмосферном давлении, при уменьшенном давлении (перегонка в вакууме) и с водяным паром. Первые два вида перегонки могут быть использованы для решения любой из указанных выше задач. Перегонку с водяным паром применяют для удаления растворителей и для отделения основного вещества от примесей.
Перекристаллизация – наиболее общий метод очистки твердых органических веществ, он часто применяется как в лаборатории, так и на производстве. Метод основан на том, что растворимость твердых соединений в горячих растворителях намного выше, чем в холодных. Если приготовить насыщенный горячий раствор органического соединения и дать ему остыть, то раствор станет пересыщенным и из него начнут выпадать кристаллы очищаемого вещества. Однако раствор не будет пересыщенным по отношению к небольшому количеству примесей, содержащихся в продукте, и последние останутся в растворе. В результате чистый кристаллический продукт отделяют от маточного раствора фильтрованием.
Для очистки продукта иногда перекристаллизацию проводят несколько раз и из различных растворителей. Успешная перекристаллизация определяется прежде всего правильным выбором растворителя. Растворитель подбирают экспериментальным путем, основываясь на знании температуры плавления вещества и предполагая, что «подобное растворяется в подобном». Это означает, что, например, высшие спирты могут кристаллизоваться из низших спиртов, высшие карбоновые кислоты – из низших кислот; однако углеводороды часто кристаллизуются из метанола или этанола.
Растворитель для перекристаллизации должен отвечать следующим требованиям:
не должен вступать в химическое взаимодействие с очищаемым веществом;
должен иметь температуру кипения на 15-20 градусов ниже температуры плавления очищаемого вещества (чтобы продукт не выделялся из пересыщенного раствора в расплавленном виде);
должен хорошо растворять кристаллизуемое вещество при нагревании и почти не растворять его на холоду;
должен растворять примеси не хуже, чем очищаемое вещество, иначе примеси будут выпадать из раствора вместе с продуктом; в этом случае для очистки применяют колоночную хроматографию или перегонку с водяным паром.
Если не удается найти подходящего растворителя, то пробуют перекристаллизацию из смеси растворителей, один из которых хорошо растворяет продукт, а другой – плохо. Если выбранный растворитель оказался высококипящим и медленно испаряющимся, то для его удаления с поверхности кристаллов (при сушке) можно использовать легколетучий растворитель, не растворяющий продукт. Если удалось найти несколько подходящих растворителей, то из них выбирают наименее токсичный и более дешевый.
МЕТОДИКА ПЕРЕКРИСТАЛЛИЗАЦИИ
1. Растворение.
2. Фильтрование горячего раствора.
3. Охлаждение.
4. Фильтрование кристаллов.
5. Сушка.
После сушки взвешивают очищенный продукт, определяют выход очищенного вещества в граммах и в процентах от взятого для кристаллизации и определяют его температуру плавления для подтверждения структуры и чистоты.
Химические методы установления строения основываются на проведении с помощью реагентов таких реакций, которые позволяют судить о наличии определенных атомных группировок (функциональных групп) или ионов в молекуле исследуемого соединения. Физические методы установления строения получают все большее развитие. С их помощью устанавливается не только строение исследуемого соединения, но также оказывается возможным определить детали структуры молекулы, например размеры молекулы, атомные расстояния и углы между связями. Физические методы определения строения имеют не только большие возможности по сравнению со старыми методами классической химии, но также позволяют значительно сократить время исследования.
Ка́чественный ана́лиз — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др.
Функциональный анализ (химический) — это совокупность химических и физических методов анализа органических веществ. Определение активного водорода в спиртах. аминах, амидах, карбоновых и сульфоновых кислотах, меркаптанах и сульфонамидах основано на их взаимодействии с реактивами Гриньяра (обычно с метилмагнийиодидом; см. Церевитинова метод) или с Li. Al. H 4 и измерении объема выделившегося метана или водорода соответственно.
Качественный функциональный анализ – это реакции, характерные для функциональных групп и сопровождающиеся видимыми признаками: образованием осадка, появлением или исчезновением окраски, запаха, выделением газа, изменением рН раствора и т.д.
Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
Алканами называют алифатические углеводороды, в молекулах которых атомы углерода связаны простыми ковалентными σсвязями, также называют предельными, или насыщенными, углеводородами. Общая формула алканов СnН2n+2. Алканы образуют гомологический ряд, родоначальником которого является метан. Каждый гомолог этого ряда отличается от последующего на звено СН2 (гомологическая разность). Начиная с углеводорода С4Н10, алканы могут иметь как неразветвленную, так и разветвленную углеродную цепь. Алканы с неразветвленной цепью атомов углерода называют нормальными, или н-алканами. Все атомы углерода в алканах находятся в состоянии sp3-гибридизации и имеют тетраэдрическую конфигурацию. Валентные углы между связями равны 109°28′ (тетраэдрический угол). Если углеродный атом связан с четырьмя разными заместителями, то углы несколько отклоняются от тетраэдрического. Расстояние между атомами углерода в алканах составляет 0,154 нм, а между углеродным и водородным атомами — 0,110 нм. Вокруг углерод-углеродных связей происходит свободное вращение, в результате которого молекула может принимать разные пространственные формы — конформации (зигзагообразная; нерегулярная; клешневидная). На основании данных рентгеноструктурного анализа установлено, что алканы нормального (неразветвленного) строения в кристаллическом состоянии имеют зигзагообразную конформацию. Такое строение для молекулы наиболее выгодно, поскольку в данном случае все атомы углерода по отношению друг к другу находятся в заторможенной антибутановой конформации. При разветвленном строении углеродной цепи конформация может изменяться. Первые четыре представителя гомологического ряда алканов имеют тривиальные названия — метан, этан, пропан, бутан. Название последующих углеводородов с нормальной углеродной цепью образуется от названия греческого числительного, указывающего количество атомов углерода в молекуле, с добавлением суффикса ан: пентан, гексан и др. В названиях алканов с разветвленной цепью, в которых две метильные группы находятся на одном конце углеродной цепи, не имеющей других ответвлений, используется приставка изо, если же на конце углеродной цепи имеются три метильные группы, в название алкана вводится приставка нео: Названия алканов с разветвленной углеродной цепью составляют согласно заместительной номенклатуре IUPAC:
1. За основу принимают название углеводорода, которому в рассматриваемом алкане отвечает наиболее длинная неразветвленная углеродная цепь (главная углеродная цепь). Если в углеводороде имеется несколько цепей одинаковой длины, за главную из них принимается та, которая имеет наибольшее число разветвлений.
2. Нумеруют атомы углерода главной цепи с того конца, к которому ближе находится заместитель. Если в молекуле алкана заместители расположены на равном расстоянии от обоих концов, то нумерацию проводят с того конца, к которому ближе расположен заместитель с названием, стоящим в алфавитном порядке раньше. Если же на одинаковом расстоянии от обоих концов главной цепи расположены идентичные заместители, но с одной стороны количество разветвлений больше, чем с другой, нумерацию начинают с того конца, где большее число заместителей.
3. Составляют название соединения в целом, соблюдая определенные правила: А). Сначала перечисляют в алфавитном порядке названия заместителей, указывая цифровой локант, соответствующий положению каждого заместителя в главной углеродной цепи. Если углеводород содержит несколько одинаковых заместителей, число их обозначают множительными приставками ди-, три-, тетра- и так далее, а положение в главной цепи, как обычно, цифрами. Б). Затем называют углеводород, которому отвечает в рассматриваемом соединении главная углеродная цепь. Заместителями при главной углеродной цепи в алканах являются одновалентные остатки алканов, так называемые алкильные группы, или алкильные радикалы, которые обозначают Аlk или R. Названия алкильных групп образуют из названий соответствующих алканов, заменяя суффикс -ан на -ил. Для названия сложных разветвленных радикалов используют нумерацию углеродной цепи радикала, причем начинают нумерацию всегда с атома углерода, имеющего свободную валентность. Названия остатков молекул алканов, имеющих две свободные валентности, образуют от названий соответствующих алканов путем замены суффикса -ан на -илен (если свободные валентности находятся при разных атомах углерода) или -илиден (если свободные валентности находятся у одного и того же атома углерода).
В обычных условиях четыре первых представителя гомологического ряда алканов — газообразные вещества; нормальные алканы, содержащие от 5 до 17 атомов углерода — жидкости, последующие гомологи — твердые вещества. В гомологическом ряду алканов по мере увеличения молекулярной массы возрастают температуры плавления и кипения. Температуры кипения изомеров с разветвленной углеродной цепью более низкие по сравнению с алканами нормального строения. Газообразные и твердые алканы не имеют запаха, жидкие — обладают характерным «бензиновым» запахом. Все алканы легче воды и практически не растворяются в ней. Наряду с этим, они хорошо растворимы в неполярных растворителях — диэтиловом эфире, четыреххлористом углероде, бензоле и других, причем с увеличением молекулярной массы растворимость уменьшается.
Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
В обычных условиях алканы являются малореакционноспособными соединениями. Они устойчивы к действию кислот, щелочей и окислителей. Инертность алканов используют на практике. Концентрированную серную кислоту и щелочи применяют для очистки нефтепродуктов. Щелочные металлы, для предотвращения контакта с кислородом и влагой воздуха, хранят под слоем инертного растворителя (керосин). Химическая инертность алканов обусловлена высокой прочностью σ-связей С—С и С—Н. В результате незначительного отличия электроотрицательностей sp3-гибридизованного атома углерода и атома водорода σ-связи С—С и С—Н в алканах практически не полярны и поэтому не склонны к гетеролитическому разрыву, но способны расщепляться гомолитически с образованием свободных радикалов. Несмотря на то что связь С—С менее прочная, чем связь С—Н, последняя разрывается с большей легкостью, так как более доступна для атаки реагентом. Химические превращения алканов сопровождаются гомолитическим расщеплением связей С—Н с последующим замещением атома водорода другими атомами или группами, то есть для них характерны реакции замещения, происходящие по радикальному механизму (SR). При высоких температурах может наблюдаться гомолитический разрыв связей С—С. Алканы легко реагируют с галогенами (кроме йода), образуя смеси моно- и полигалогеналканов. Галогены по реакционной способности с алканами располагаются в ряд: F2 > Сl2 > Вr2. Прямое фторирование алканов является трудно контролируемой экзотермической реакцией. Выделяющаяся энергия при замещении атома водорода на атом фтора превышает энергию диссоциации связи С—С. При фторировании алканов наряду с замещением атомов водорода атомами фтора происходит разрыв углерод-углеродных связей, и образуется сложная смесь фторалканов. Именно поэтому прямое фторирование алканов имеет ограниченное применение. Менее экзотермична реакция алканов с хлором. Она протекает в условиях фотохимического (под действием УФ-облучения) или термического (300 °С) процесса. При взаимодействии метана с хлором атомы водорода постепенно замещаются на атомы хлора:
 .
.
Реакция протекает по цепному свободнорадикальному механизму, которыйбыл изучен советским ученым Николаем Николаевичем Семеновым. В цепном процессе выделяют три стадии: инициирование, рост цепи, обрыв цепи.
Инициирование. Под действием энергии квантов света (hn) или нагревания молекула хлора активируется и претерпевает гомолитический разрыв связи с образованием двух свободных радикалов: Cl· ·Cl hn 2Cl·.
Рост цепи. Свободные радикалы хлора атакуют связь С—Н в молекуле метана, отрывая при этом атом водорода с образованием хлороводорода HCl и свободного метильного радикала СН3. Метильный радикал, в свою очередь, атакует молекулу хлора, отрывает атом галогена и образует хлорметан СН3Сl и свободный радикал хлора. Образовавшийся радикал хлора повторяет цикл указанных превращений, то есть происходит цепной процесс, в котором атом хлора, прореагировавший на предыдущей стадии роста цепи, способствует высвобождению нового радикала хлора на последующей стадии. В результате образуется смесь моно-, ди-, три- и тетрахлорпроизводных метана. Цепной процесс прекращается только после исчезновения всех свободных радикалов, образующихся в ходе реакции.
Обрыв цепи. В результате рекомбинации (димеризации) свободных радикалов происходит обрыв цепи. Аналогично протекает реакция бромирования метана, однако она значительно менее экзотермична, чем реакции фторирования и хлорирования. Следует отметить, что замещение атома водорода на атом галогена в алканах происходит в большинстве случаев региоселективно (избирательно): в первую очередь, как правило, замещается атом водорода при третичном атоме углерода, затем — при вторичном и в последнюю очередь — при первичном. Такая последовательность замещения обусловлена устойчивостью образующихся свободных радикалов. Чем устойчивее свободный радикал, тем легче он образуется. Поскольку третичные алкильные радикалы более стабильны, чем вторичные и тем более первичные, реакционная способность связей С—Н при галогенировании алканов увеличивается в ряду: первичный < вторичный < третичный атом углерода. Однако эта закономерность строго не выполняется. Региоселективность галогенирования зависит также от активности реагента (атома галогена) и температуры. Чем активнее реагент, тем ниже селективность реакции. Следовательно, у алканов реакция бромирования более селективна, чем хлорирования. Региоселективность галогенирования алканов возрастает при понижении температуры. Радикальное йодирование алканов эндотермично и вследствие низкой реакционной активности I протекает с трудом. Реакция обратима, так как образующийся йодоводород HI восстанавливает алкилйодид. Под действием серы (IV) оксида и хлора в условиях УФ-облучения алканы образуют алкансульфонилхлориды (хлорангидриды алкансульфоновых кислот):
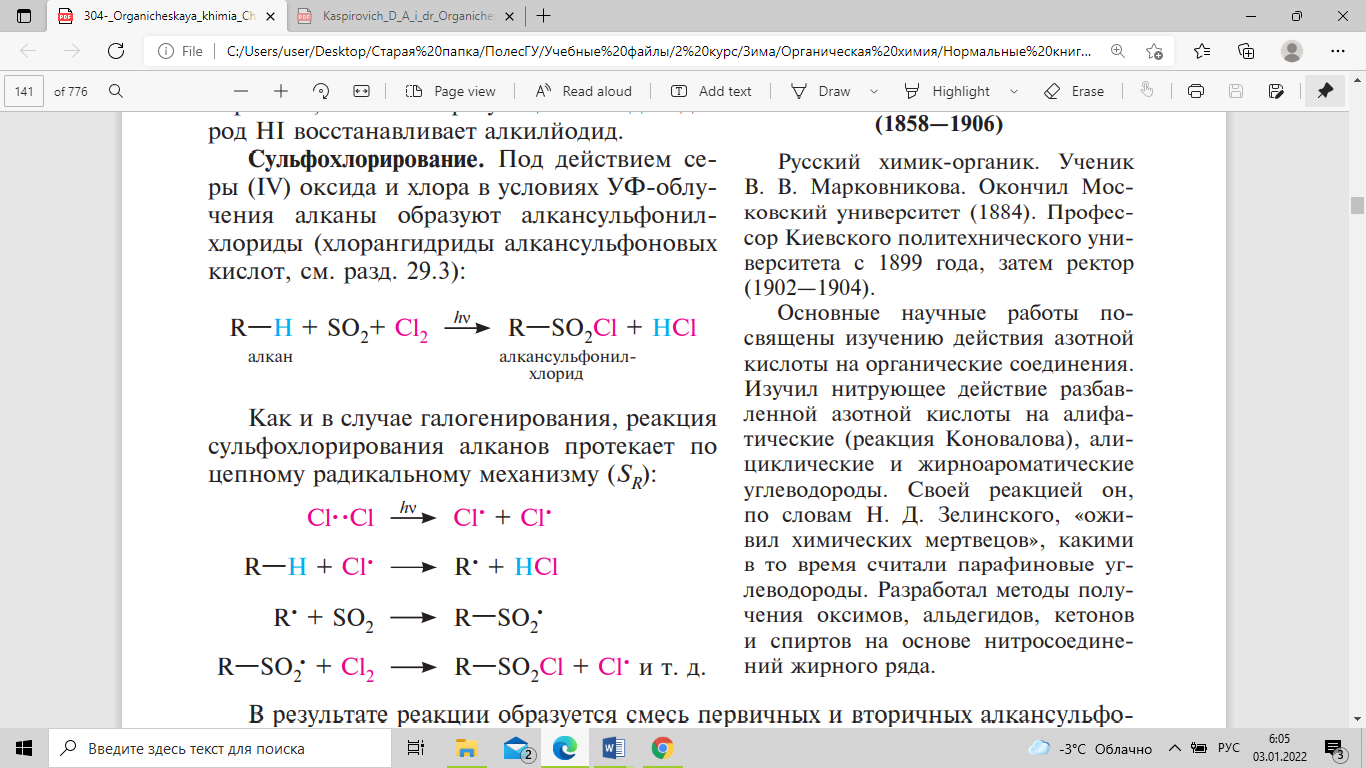 .
.
Как и в случае галогенирования, реакция сульфохлорирования алканов протекает по цепному радикальному механизму (SR): . В результате реакции образуется смесь первичных и вторичных алкансульфонилхлоридов. Третичные сульфонилхлориды не образуются, очевидно, вследствие пространственных препятствий. Реакция сульфохлорирования имеет важное значение в производстве СМС. Метод жидкофазного нитрования алканов, называемый реакцией Коновалова (1888), осуществляется с использованием разбавленной азотной кислоты (концентрация 10—20 %) при температуре 110—140 °С, нормальном или повышенном давлении:
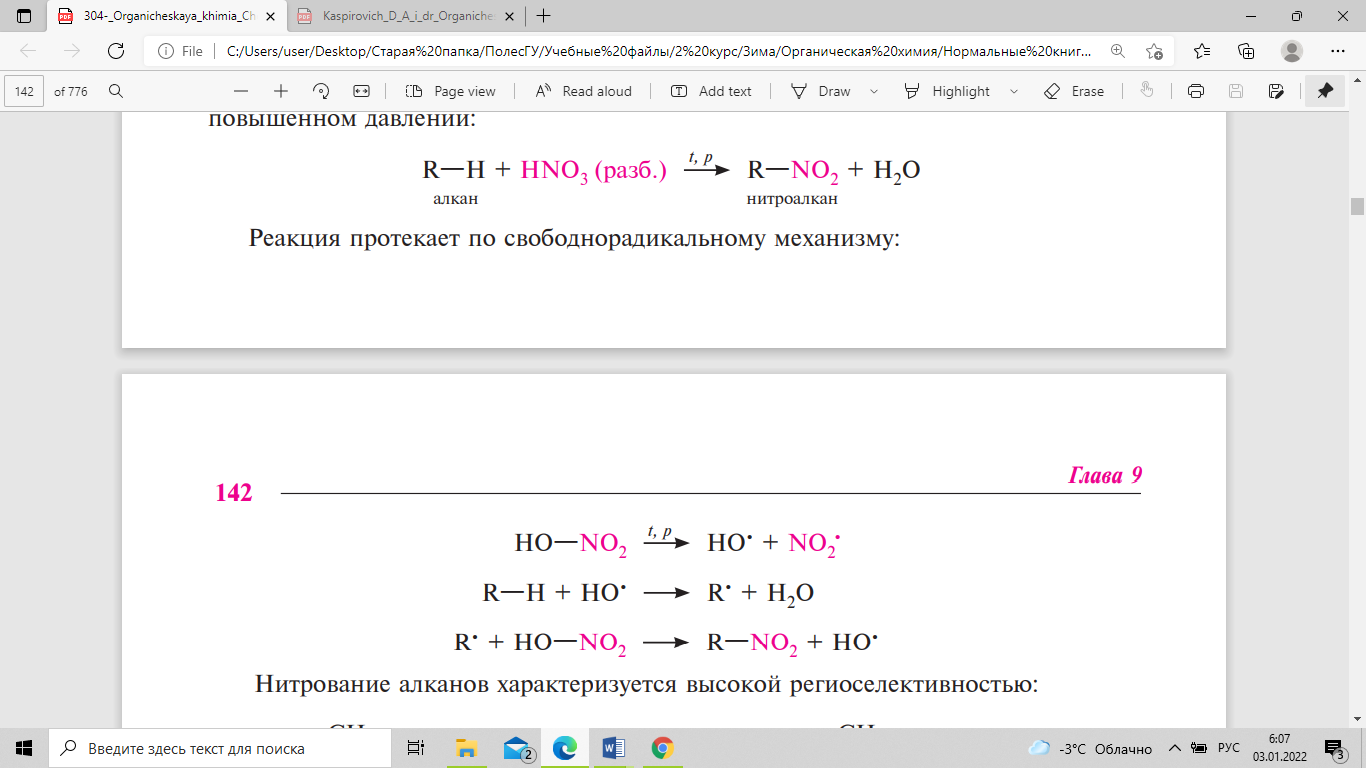
Реакция протекает по свободнорадикальному механизму. Нитрование алканов характеризуется высокой региоселективностью. Концентрированная азотная кислота в обычных условиях не взаимодействует с алканами; при нагревании она действует главным образом как окислитель. В избытке кислорода или на воздухе алканы сгорают с образованием углерода (IV) оксида и воды с выделением большого количества теплоты: СН4 + 2О2 → СO2 + 2Н2O + 882 кДж/моль. Окисление алканов кислородом воздуха в присутствии катализатора (солей марганца, хрома, свинца и др.) при температуре 150—200 °С приводит к образованию смеси продуктов, состоящей в основном из карбоновых кислот с различной длиной углеродной цепи, альдегидов, кетонов и спиртов. Реакция протекает по радикальному механизму и сопровождается разрывом углерод-углеродных связей. В качестве промежуточных продуктов окисления образуются органические гидропероксиды.
. Реакция окисления используется в промышленности для получения метанола, формальдегида, ацетальдегида и уксусной кислоты из пропана и бутана, а также высших жирных кислот из алканов с длиной цепи более 25 углеродных атомов. Крекинг — процесс термического расщепления алканов. Под действием высоких температур алканы разлагаются с разрывом связей С—С и С—Н. Одновременно протекают процессы дегидрирования, изомеризации и циклизации. Начальная температура распада алканов зависит от их строения и молекулярной массы. Чем больше молекулярная масса углеводорода, тем легче он расщепляется при нагревании. Различают термический крекинг и каталитический крекинг. Термический крекинг проводят при температуре 800 °С и выше, каталитический — при температуре 450—550 °С в присутствии алюмосиликатных катализаторов (алюминия оксид Аl2О3 на силикагеле SiO2). Наиболее устойчив к термическому разложению метан. В интервале температур 1400—1500 °С он подвергается распаду с образованием ацетилена: 2СН4 1400—1500 °С НC———СН + 3Н2. Этан разлагается при более низких температурах: CH3—CH3 600—800 °С H2C——CH2 + Н2. Высшие алканы в условиях термического крекинга разлагаются с образованием сложной смеси низших алканов и алкенов. Разрыв углеродной цепи молекулы может произойти в любом положении. Термический крекинг протекает по радикальному механизму. При каталитическом крекинге расщепление углерод-углеродной связи сопровождается преимущественно изомеризацией н-алканов в алканы с разветвленной цепью. В присутствии катализатора высшие алканы способны к циклизации с образованием ароматических углеводородов. Каталитический крекинг протекает по ионному механизму. Крекинг-процесс имеет важное промышленное значение и широко используется для получения высокооктановых бензинов, непредельных и ароматических углеводородов.
Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
Алкенами называют алифатические углеводороды, содержащие двойную углеродуглеродную связь. Общая формула алкенов CnH2n. Родоначальником гомологического ряда алкенов является этилен, что обусловило еще одно их название «этиленовые углеводороды». Сохранилось также исторически сложившееся название «олефины» (маслообразующие), поскольку низшие гомологи этой группы соединений при взаимодействии с хлором или бромом образуют маслянистые жидкости. Атомы углерода, связанные двойной связью, находятся в состоянии sp2-гибридизации. Двойная связь представляет собой сочетание ковалентных σ-связи и π-связи, из которых π-связь менее прочная. Электронная плотность π-связи расположена симметрично выше и ниже плоскости, в которой лежат σ-связи sp2-гибридизованных атомов углерода. Благодаря такому расположению электроны π-связи легче поляризуются по сравнению с электронами σ-связи. Вследствие высокой поляризуемости и низкой энергии образования π-связи алкены довольно легко вступают в реакции присоединения, протекающие с разрывом π-связи. В большинстве случаев такие реакции идут по ионному механизму и начинаются с атаки электрофильным реагентом (электрофильной частицей) электронов π-связи, а поэтому их называют реакциями электрофильного присоединения (АЕ). Кроме того, двойная связь влияет на реакционную способность связей С—Н у соседнего с ней sp3-гибридизованного атома углерода. Благодаря сверхсопряжению (σ,π-сопряжение) атомы водорода, расположенные у α-углеродного атома по отношению к двойной связи, приобретают подвижность и способность вступать в реакции замещения (SR), которые протекают значительно легче, чем у алканов. Согласно правилам IUPAС названия алкенов образуют от названий соответствующих алканов, заменяя суффикс -ан на -ен с указанием положения двойной связи в цепи углеродных атомов. При построении названий алкенов по заместительной номенклатуре IUPAС используют следующие правила:
1. Выбирают самую длинную углеродную цепь, включающую двойную связь (главная углеродная цепь).
2. Углеродные атомы главной цепи нумеруют, начиная с того конца цепи, к которому ближе расположена двойная связь.
3. Составляют название алкена, перечисляя вначале в алфавитном порядке углеводородные заместители с указанием их положения в главной цепи, затем называют углеводород, которому соответствует главная углеродная цепь. Перед названием углеводорода через дефис ставят цифру (локант), указывающую положение двойной связи (номер первого из двух углеродных атомов, образующих двойную связь).
Для низших членов гомологического ряда алкенов применяют также тривиальные названия — этилен, пропилен, бутилен и так далее, причем название первого представителя — этилен — принято правилами IUPAС как более предпочтительное, чем этен. Название одновалентных углеводородных радикалов, образованных из алкенов, составляют путем добавления к названию алкена суффикса –ил. Некоторые радикалы имеют также тривиальные названия: винил, изопропенил, аллил. Для алкенов характерна структурная и геометрическая изомерия. Структурная изомерия алкенов обусловлена различной последовательностью связывания атомов углерода в молекуле (изомерия цепи) и различным положением двойной связи при одном и том же углеродном скелете (изомерия положения). Такой вид изомерии возможен, начиная с бутена С4Н8, который может существовать в виде трех структурных изомеров. Кроме того, в ряду алкенов имеет место геометрическая, или так называемая цис-транс-изомерия, что обусловлено различным расположением атомов или групп в пространстве относительно плоскости двойной связи. Так, 2-бутен может существовать в виде двух пространственных изомеров — цис- (два одинаковых заместителя при атомах углерода двойной связи расположены по одну сторону от плоскости π-связи) и транс- (два одинаковых заместителя расположены по разные стороны относительно плоскости π-связи). Если у атомов углерода, связанных двойной связью, имеется три или четыре разных заместителя, используют Е,Z-систему обозначений конфигурации геометрических изомеров. Например, 3-метил-4-этил-3-гептен может иметь Z-конфигурацию (старшие заместители при атомах углерода с двойной связью расположены по одну сторону относительно плоскости π-связи) и Е-конфигурацию (старшие заместители расположены по разные стороны относительно плоскости π-связи). E,Z-Система является более универсальной и используется для обозначения геометрических изомеров с различным набором заместителей. Первых четыре представителя гомологического ряда алкенов подобно алканам при нормальных условиях — газы, далее следуют жидкости (С5—С17), затем — твердые вещества. Все алкены практически нерастворимы в воде, хорошо растворяются в органических растворителях. Температуры кипения алкенов неразветвленного строения, как правило, выше, чем их изомеров с разветвленной цепью углеродных атомов. Цис-изомеры по сравнению с транс-изомерами имеют обычно более высокие температуры кипения и более низкие температуры плавления.
Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
Главной структурной особенностью, определяющей реакционную способность алкенов, является наличие в их молекуле двойной углерод-углеродной связи. За счет наличия в своей структуре π-связи алкены проявляют нуклеофильные (электронодонорные) свойства и вступают в реакции с электрофильными реагентами, такими, как галогены, галогеноводороды, серная кислота, вода в присутствии минеральных кислот и др. Эти реакции протекают по механизму электрофильного присоединения (АЕ). Механизм включает две последовательные стадии:

На стадии I электрофильная частица или молекула электрофильного реагента Хδ+→Yδ– в результате электростатического взаимодействия с электронным облаком π-связи образует с молекулой алкена так называемый π-комплекс. Затем образуется ковалентная связь между электрофильной частицей X+ и одним из атомов углерода двойной связи, при этом π-комплекс превращается в карбокатион. На стадии II карбокатион взаимодействует с освободившейся из электрофильного реагента нуклеофильной частицей Y– и образуется конечный продукт присоединения. Алкены довольно легко присоединяют по двойной связи хлор и бром, труднее — йод. В результате взаимодействия образуются дигалогенопроизводные алканов, содержащие атомы галогена у соседних атомов углерода (вицинальные дигалогенопроизводные углеводородов). Механизм этой реакции включает электрофильную атаку молекулы галогена на π-электроны двойной связи. Под влиянием π-электронного облака двойной связи молекула галогена поляризуется и приобретает способность выступать в качестве электрофильного реагента. На стадии I реакции атом галогена, несущий частичный положительный заряд, вступает во взаимодействие с π-электронами двойной связи, в результате чего образуется π-комплекс. Затем в π-комплексе постепенно происходит гетероциклический разрыв связи между атомами галогена с образованием продукта присоединения, строение которого может быть представлено равновесием между ионом карбония и циклическим ионом галогенония. Положение равновесия в большинстве случаев смещено в сторону циклического иона галогенония. Но если двойная связь алкена сопряжена с бензольным ядром, способным делокализовать положительный заряд, продукт присоединения существует преимущественно в виде иона карбония. На стадии II реакции циклический ион галогенония подвергается атаке отрицательным ионом галогена по атому углерода со стороны, противоположной расположению уже имеющегося галогена, с образованием продукта транс-присоединения. Следовательно, присоединение галогенов к алкенам происходит, как правило, стереоселективно, то есть пространственно избирательно. Эта реакция широко используется в фармацевтическом анализе для качественного и количественного определения соединений, содержащих двойную углерод-углеродную связь. Алкены в присутствии катализаторов присоединяют по месту разрыва двойной связи водород, образуя алканы. Каталитическое гидрирование в присутствии палладия и платины протекает в большинстве случаев уже при комнатной температуре, применение никеля требует нагревания. Учитывая большую стоимость платины и палладия, восстановление алкенов в промышленности обычно проводят в присутствии тонкоизмельченного никеля при температуре 150—300°С.
Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
Присоединение галогеноводородов (гидрогалогенирование). Алкены присоединяют по месту разрыва двойной связи галогеноводороды, образуя галогеналканы. Реакция с НI, НВг, НF протекает при комнатной температуре, взаимодействие с НСl требует нагревания. Присоединение галогеноводородов к алкенам, как и присоединение галогенов, происходит по гетеролитическому электрофильному механизму. Вначале электронодефицитный атом водорода молекулы галогеноводорода атакует π-электроны двойной связи алкена с образованием карбокатиона, который затем реагирует с отрицательно заряженным ионом галогена, образуя конечный продукт присоединения. Реакционная способность галогеноводородов с алкенами возрастает в ряду: HF < HCl < HBr < HI. Присоединение галогеноводородов к несимметричным алкенам проходит региоселективно, то есть образуется преимущественно один из двух возможных продуктов реакции. Так, в результате присоединения НВr к пропену образуется преимущественно 2-бромпропан, но не 1-бромпропан. В 1869 году русский химик Марковников установил закономерность, определяющую направление присоединения галогеноводородов и родственных им соединений (серной кислоты, воды в присутствии минеральных кислот) по месту двойной связи алкенов, которая получила название «правила Марковникова». Сущность этого правила может быть сформулирована следующим образом. При взаимодействии галогеноводородов и родственных им соединений с несимметричными алкенами атом водорода присоединяется по месту разрыва двойной связи к более гидрогенизованному атому углерода, то есть атому углерода, содержащему большее число атомов водорода. Такая направленность присоединения определяется поляризацией молекулы несимметричного алкена в нереагирующем состоянии (статический фактор) и относительной устойчивостью образующихся на первой стадии реакции карбокатионов (динамический фактор). Влияние статического фактора состоит в том, что в нереагирующей молекуле несимметричного алкена вследствие +I-эффекта и σ,π-сопряжения со стороны алкильных групп π-электронная плотность двойной связи смещена к более гидрогенизованному ненасыщенному атому углерода. Это определяет наиболее вероятное место присоединения протона. Влияние динамического фактора обусловлено тем, что из двух возможных вариантов присоединения протона к несимметричному алкену преимущественно реализуется тот, при котором в качестве промежуточного продукта присоединения образуется более устойчивый карбокатион. Более устойчивому карбокатиону отвечает переходное состояние с меньшей энергией, а это обеспечивает бóльшую скорость реакции. Делокализация положительного заряда, а следовательно, и устойчивость карбокатиона возрастают с увеличением числа алкильных групп, поэтому третичные карбокатионы устойчивее вторичных, а те, в свою очередь, устойчивее первичных. Следует отметить, что правило Марковникова соблюдается не всегда. Так, в присутствии пероксидов присоединение бромоводорода к несимметричным алкенам происходит по свободнорадикальному механизму с ориентацией против правила Марковникова. Возникший на первой стадии реакции радикал брома присоединяется по месту двойной связи алкена к более гидрогенизованному атому углерода (направление а), так как при этом образуется более устойчивый радикал. Последний атакует новую молекулу НВr с образованием конечного продукта присоединения. В присутствии минеральных кислот — серной, азотной, хлорной и других — алкены присоединяют по месту разрыва двойной связи воду. Реакция протекает в соответствии с правилом Марковникова и приводит к образованию спиртов. Аналогично присоединению галогеноводородов гидратация алкенов протекает по ионному электрофильному механизму с первоначальной атакой протона. Реакция используется в промышленном синтезе спиртов.
Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
Алкены реагируют с бромом и хлором с образованием продуктов присоединения по двойной связи одной молекулы галогена с выходом близким к количественному. Фтор слишком активен и вызывает деструкцию алкенов. Присоединение йода к алкенам в большинстве случаев представляет собой обратимую реакцию, равновесие которой смещено в сторону исходных реагентов.

Присоединение брома и хлора к алкенам происходит по ионному, а не по радикальному механизму. Этот вывод следует из того, что скорость присоединения галогена не зависит от облучения, присутствия кислорода и других реагентов, инициирующих или ингибирующих радикальные процессы. На основании большого числа экспериментальных данных для этой реакции был предложен механизм, включающий несколько последовательных стадий. На первой стадии происходит поляризация молекулы галогена под действием электронов π-связи. Атом галогена, приобретающий некоторый дробный положительный заряд, образует с электронами π-связи нестабильный интермедиат, называемый -комплексом или комплексом с переносом заряда. Следует отметить, что в π-комплексе галоген не образует направленной связи с каким-нибудь конкретным атомом углерода; в этом комплексе просто реализуется донорно-акцепторное взаимодействие электронной пары π-связи как донора и галогена как акцептора. Далее π-комплекс превращается в циклический бромониевый ион. В процессе образования этого циклического катиона происходит гетеролитический разрыв связи Br-Br и пустая р-орбиталь sp2-гибридизованного атома углерода перекрывается с р-орбиталью "неподеленной пары" электронов атома галогена, образуя циклический ион бромония. Присоединение галогенов к двойной связи алкенов представляет собой одну из формально простых модельных реакций, на примере которой можно рассмотреть влияние основных факторов, позволяющих сделать аргументированные выводы о детальном механизме процесса. Для обоснованных выводов о механизме любой реакции следует располагать данными по: 1) кинетике реакции; 2) стереохимии (стереохимический результат реакции); 3) наличию или отсутствию сопряженного, конкурирующего процесса; 4) влиянию заместителей в исходном субстрате на скорость реакции; 5) использованию меченых субстратов и (или) реагентов; 6) возможности перегруппировок в ходе реакции; 7) влиянию растворителя на скорость реакции. Наиболее ценную информацию о механизме этой реакции представляют данные по стереохимии присоединения. Присоединение галогена к двойной связи представляет собой стереоспецифический процесс (процесс, в котором образуется только один из возможных стереоизомеров; в стереоселективном процессе наблюдается преимущественное образование одного стереомера) анти-присоединения для алкенов и циклоалкенов, у которых двойная связь не сопряжена с бензольным кольцом. Для цис- и транс-изомеров бутена-2, пентена-2, гексена-3, циклогексена, циклопентена и других алкенов присоединение брома происходит исключительно как анти-присоединение. При этом в случае циклогексена образуется исключительно транс-1,2-дибромциклогексан (смесь энантиомеров). При присоединении брома к циклогексену первоначально образуется транс-1,2-дибромциклогексан в а,а-конформации, которая затем сразу же переходит в энергетически более выгодную е,е-конформацию. Анти-присоединение галогенов к двойной связи позволяет отвергнуть механизм одностадийного синхронного присоединения одной молекулы галогена к двойной связи, которое может осуществляться только как син-присоединение. Анти-присоединение галогена не согласуется также и с образованием открытого карбкатиона RCH+-CH2Hal в качестве интермедиата. В открытом карбокатионе возможно свободное вращение вокруг С-С-связи, что должно приводить после атаки аниона Br- к образованию смеси продуктов как анти-, так и син-присоединения. Стереоспецифическое анти-присоединение галогенов явилось главной причиной создания концепции бромониевого или хлорониевого ионов в качестве дискретных промежуточных частиц. Эта концепция идеально удовлетворяет правилу анти-присоединения, поскольку нуклеофильная атака галогенид-иона возможна с анти-стороны по любому из двух атомов углерода галогенониевого иона по SN2 механизму. В некоторых случаях присоединение хлора к алкенам, содержащим электронодонорные заместители, сопровождается отщеплением протона из промежуточного соединения вместо присоединения хлорид-иона. Отщепление протона приводит к образованию хлорзамещенного алкена, которое формально можно рассматривать как прямое замещение с миграцией двойной связи. Однако опыты с изотопной меткой указывают на более сложный характер происходящих здесь превращений. При хлорировании изобутилена при 0°С образуется 2-метил-3-хлорпропен (металлилхлорид) вместо ожидаемого дихлорида - продукта присоединения по двойной связи. Скелетные перегруппировки подобного типа наиболее характерны для процессов с участием открытых карбокатионов в качестве промежуточных частиц. Не исключено, что присоединение хлора в этих случаях идет не через хлорониевый ион, а через катионную частицу, близкую к открытому карбокатиону. Вместе с тем следует отметить, что скелетные перегруппировки явление достаточно редкое в процессах присоединения галогенов и смешанных галогенов по двойной связи: они чаще наблюдаются при присоединении хлора и гораздо реже при присоединении брома. Вероятность таких перегруппировок увеличивается при переходе от неполярных растворителей (ССl4) к полярным (нитрометан, ацетонитрил).

Присоединение галогенов к алкенам можно легко осуществить в газовой фазе и по радикальному типу при освещении УФ-светом. Наряду с галогенами по радикальному типу удается присоединить к алкенам и галогеноводороды. Как показал Хараш, в присутствии перекисей присоединение бромистого водорода к алкенам идет против правила Марковникова. Механизм реакции радикального присоединения бромистого водорода к алкенам по Харашу следующий:

Из двух возможных радикалов А и Б в основном образуется первый, как более устойчивый. Таким образом, по аналогии с электрофильным радикальное присоединение к алкенам протекает через стадию образования наиболее стабильного радикала. Реакция Хараша характерна для НВr, идет с трудом с НCl и неизвестна для HF и HI . Если для HF присоединение термодинамически неблагоприятно, то для HI — наоборот. Тем не менее реакцию присоединения HI не удается осуществить, поскольку легко идет обратный процесс восстановления йодистым водородом алкилиодида.
Реакции Окисления алкенов по С=С связи: цис- дигидроксилирование (перманганатом калия по Вагнеру, тетраоксидом осмия), эпоксидирование (по Прилежаеву).
Алкены окисляются довольно легко. Направление окисления зависит от природы окислителя и условий проведения реакции. Разбавленный раствор калия перманганата в нейтральной или слабощелочной среде окисляет алкены до двухатомных спиртов (гликолей). При этом обесцвечивается розово-фиолетовая окраска раствора калия перманганата и выпадает коричневый осадок марганца (IV) оксида. Данная реакция была открыта в 1888 году русским химиком Вагнером. Реакция Вагнера используется в фармацевтическом анализе для обнаружения двойной углерод-углеродной связи. Концентрированные растворы калия перманганата окисляют алкены с разрывом двойной связи. В зависимости от структуры алкена в качестве продуктов окисления образуются кетоны и альдегиды, причем последние окисляются далее до карбоновых кислот.
Другой метод гидроксилирования алкенов под действием оксида осмия (VIII) OsO4 был предложен Р. Криге в 1936 году. Тетраоксид осмия представляет собой бесцветное, летучее, кристаллическое вещество, хорошо растворимое в органических растворителях. При взаимодействии тетраоксида осмия с алкенами образуется черный осадок циклического эфира осмиевой кислоты - осмат, который легко может быть изолирован в индивидуальном виде. Присоединение OsO4 к двойной связи заметно ускоряется в растворе в пиридине. Разложение осматов до вицинальных гликолей достигается действием водного раствора гидросульфита натрия или сероводородом

Выходы продуктов в этом методе значительно выше, чем при использовании перманганата в качестве окислителя. Важным достоинством метода Криге является отсутствие продуктов окислительного расщепления алкенов, характерного для перманганатного окисления. Тетраоксид осмия очень дорогой и труднодоступный реагент, к тому же он токсичен. Кислород воздуха в присутствии серебряного катализатора окисляет алкены при нагревании с образованием эпоксидов. Реакция применяется в промышленности для получения этиленоксида (оксирана). Аналогично алкены окисляются пероксикислотами (реакция Прилежаева). Так, при обработке алкенов пероксибензойной кислотой образуются эпоксиды. Реакция изучена в 1909 году российским химиком-органиком Н. А. Прилежаевым.
Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
Алкены легко окисляются озоном. Реакция озонирования протекает по сложному механизму с образованием продуктов присоединения озона по месту разрыва двойной связи, называемых озонидами. Многие озониды взрывоопасны. При обработке цинком в уксусной кислоте озониды разлагаются, образуя карбонильные соединения (2 моль альдегида или 2 моль кетона или же 1 моль альдегида и 1 моль кетона в зависимости от структуры алкена). Полученные карбонильные соединения могут быть идентифицированы, что позволяет использовать реакцию озонирования для определения положения двойной связи. Поскольку озон реагирует с алкенами количественно (1 моль озона расходуется на 1 моль алкена), эта реакция может также применяться для установления числа двойных углерод-углеродных связей в молекуле. Более важное значение имеет восстановительное расщепление озонидов. В качестве восстановителей наиболее часто используются цинк и уксусная кислота, трифенилфосфин или диметилсульфид. В этом случае конечными продуктами озонолиза оказываются альдегиды или кетоны в зависимости от строения исходного алкена. Тетразамещенный при двойной связи алкен при озонолизе и последующем восстановительном разложении озонида образует два кетона, тогда как тризамещенный алкен дает кетон и альдегид. Дизамещенный симметричный алкен при озонолизе образует два альдегида, а алкены с концевой связью - альдегид и формальдегид. Интересной модификацией озонолиза является метод, где в качестве восстановителя озонида используется боргидрид натрия, В этом случае конечными продуктами реакции оказываются первичные или вторичные спирты, образующиеся при восстановлении соответственно альдегидов и кетонов.


Озонолиз алкенов - это сложный, трудоемкий и взрывоопасный процесс, требующий применения специальной аппаратуры. По этой причине были разработаны другие методы окислительного расщепления алкенов до карбонильных соединений и карбоновых кислот, которые с успехом заменяют реакцию озонолиза в синтетической практике. Гидроборирование алкенов представляет собой присоединение гидридов бора по двойной связи. Простейший гидрид бора, боран BH3, неизвестен. Это соединение является крайне нестабильной кислотой Льюиса с секстетом электронов у атома бора. Боран самопроизвольно димеризуется в более стабильный диборан. Диборан имеет необычную мостиковую структуру, характерную для электронодефицитных молекул. Мостиковая структура B2H6 является классическим примером двухэлектронной трехцентровой связи B – H …B. Гидроборирование включает три стадии. На первой стадии боран присоединяется к алкену с образованием моноалкилборана:
![]()
Моноалкилборан содержит две связи B – H, поэтому последовательно присоединяет еще две молекулы алкена:
![]()
Присоединение борана к двойной связи происходит против правила Марковникова таким образом, что атома бора оказывается связанным с наименее замещенным атомом углерода при двойной связи. При обработке триалкилборанов щелочным раствором перекиси водорода происходит расщепление связи C – B с образованием спиртов. Таким образом, последовательность этих двух стадий гидрборирования алкенов представляет собой метод гидратации алкенов:
![]() .
.
Для циклических монозамещенных и дизамещенных алкенов гидроборирование – окисление дает уникальную возможность синтеза первичных спиртов с суммарным выходом 80 – 95%:
Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
Полимеризацией называют процесс соединения друг с другом молекул низкомолекулярных веществ (мономеров) с образованием высокомолекулярных соединений (полимеров). В реакцию полимеризации могут вступать молекулы одного и того же мономера, а также молекулы двух и более разных мономеров. Полимер, состоящий из одинаковых мономеров, называется гомополимером, а полимер, в состав которого входят два и более разных мономеров,— сополимером. Реакция получения сополимеров называется реакцией сополимеризации. Полимеризация алкенов представляет собой последовательное соединение молекул алкена друг с другом вследствие разрыва двойной связи. В общем виде полимеризацию алкенов можно представить следующей схемой:

Число повторяющихся мономерных звеньев п называют степенью полимеризации.
В зависимости от степени полимеризации из одного и того же мономера можно получить вещества с разными свойствами. Процесс полимеризации осуществляется в присутствии катализаторов (инициаторов) и включает три основные стадии: зарождение цепи (инициирование), рост цепи, обрыв цепи. В зависимости от структуры исходного мономера, природы инициатора и условий реакции (температура, давление) полимеризация алкенов может происходить по радикальному и ионному (катионному) механизмам. Особым типом полимеризации является полимеризация в присутствии металлорганических соединений, получившая название «координационная полимеризация». По радикальному механизму алкены полимеризуются в присутствии пероксидных соединений, таких, как ацетила пероксид, бензоила пероксид и других, способных при высоком давлении и температуре распадаться на свободные радикалы. Эти свободные радикалы затем присоединяются к алкену с образованием новых радикалов. Далее происходит последовательное присоединение других молекул алкена. Растущая активированная цепь при радикальной полимеризации представляет собой свободный радикал. Обрыв цепи осуществляется чаще всего путем димеризации свободных радикалов. Механизм радикальной полимеризации этилена в присутствии ацетила пероксида можно представить следующим образом:

Таким
способом в промышленности получают
полиэтилен и полипропилен высокого
давления. Катионная полимеризация
алкенов инициируется протонными
кислотами или кислотами Льюиса (АlС13,
BF3 и др.). Реакционным центром растущей
полимерной цепи является карбокатион.
По ионному катионному механизму наиболее
легко полимеризуются несимметрично
построенные алкены общей формулы
![]() , из которых образуются относительно
стабильные промежуточные карбокатионы.
В промышленности этот метод применяют
для полимеризации изобутилена.
Координационная полимеризация алкенов
представляет собой довольно сложный
процесс, протекающий в присутствии
комплексных металлорганических
катализаторов Циглера—Натты. Наиболее
распространенным из них является
комплекс триэтилалюминия с титана
хлоридом Аl(С2Н5)3 · ТiСl4. Механизм
координационной полимеризации пока
точно не известен, однако установлено,
что образование полимера происходит
путем внедрения молекул алкена по связи
металл-углерод растущей полимерной
цепи. Полимеризация алкенов в присутствии
катализаторов Циглера—Натты позволяет
получать высокомолекулярные полимеры
при относительно низких давлении и
температуре. Этот метод широко используют
в промышленности для производства
полиэтилена и полипропилена низкого
давления. При свободнорадикальной и
катионной полимеризации образуется
полимер нерегулярного строения, то есть
с произвольной стереохимической
конфигурацией. Такой полимер называют
атактическим. Полимеризация алкенов с
использованием катализатора Циглера—Натты
приводит к образованию стереорегулярного полимера,
получившего название «изотактический».
Пространственное строение атактического
и изотактического полипропиленов:  Изотактическим
полимерам по сравнению с атактическими
свойственны большая прочность и более
высокие температуры
плавления. Полиэтилен представляет
собой массу белого цвета (тонкие листы
прозрачны и бесцветны). Химически стоек,
диэлектрик, не чувствителен к удару
(амортизатор), при нагревании размягчается
(80—120 °С), адгезия — чрезвычайно низкая.
Применение. Полиэтиленовая плёнка
(особенно упаковочная, например,
пузырчатая упаковка или скотч), тара
(бутылки, ящики, канистры, садовые лейки,
горшки для рассады), полимерные трубы
для канализации, дренажа, водо-,
газоснабжения, электроизоляционный
материал, полиэтиленовый порошок
используется как термоклей. Полипропилен -
материал для производства плёнок
(особенно упаковочных), мешков, тары,
труб, деталей технической аппаратуры,
пластиковых стаканчиков, предметов
домашнего обихода, нетканых материалов,
электроизоляционный материал, в
строительстве для вибро- и шумоизоляции
межэтажных перекрытий в системах
«плавающий пол». При сополимеризации
пропилена с этиленом получают
некристаллизующиеся сополимеры, которые
проявляют свойства каучука, отличающиеся
повышенной химической стойкостью и
сопротивлением старению. Таким способом
в промышленности получают полиэтилен
и полипропилен высокого давления.
Катионная полимеризация алкенов
инициируется протонными кислотами или
кислотами Льюиса (АlС13, BF3 и др.). Реакционным
центром растущей полимерной цепи
является карбокатион. По ионному
катионному механизму наиболее легко
полимеризуются несимметрично построенные
алкены общей формулы.
, из которых образуются относительно
стабильные промежуточные карбокатионы.
В промышленности этот метод применяют
для полимеризации изобутилена.
Координационная полимеризация алкенов
представляет собой довольно сложный
процесс, протекающий в присутствии
комплексных металлорганических
катализаторов Циглера—Натты. Наиболее
распространенным из них является
комплекс триэтилалюминия с титана
хлоридом Аl(С2Н5)3 · ТiСl4. Механизм
координационной полимеризации пока
точно не известен, однако установлено,
что образование полимера происходит
путем внедрения молекул алкена по связи
металл-углерод растущей полимерной
цепи. Полимеризация алкенов в присутствии
катализаторов Циглера—Натты позволяет
получать высокомолекулярные полимеры
при относительно низких давлении и
температуре. Этот метод широко используют
в промышленности для производства
полиэтилена и полипропилена низкого
давления. При свободнорадикальной и
катионной полимеризации образуется
полимер нерегулярного строения, то есть
с произвольной стереохимической
конфигурацией. Такой полимер называют
атактическим. Полимеризация алкенов с
использованием катализатора Циглера—Натты
приводит к образованию стереорегулярного полимера,
получившего название «изотактический».
Пространственное строение атактического
и изотактического полипропиленов:  Изотактическим
полимерам по сравнению с атактическими
свойственны большая прочность и более
высокие температуры
плавления. Полиэтилен представляет
собой массу белого цвета (тонкие листы
прозрачны и бесцветны). Химически стоек,
диэлектрик, не чувствителен к удару
(амортизатор), при нагревании размягчается
(80—120 °С), адгезия — чрезвычайно низкая.
Применение. Полиэтиленовая плёнка
(особенно упаковочная, например,
пузырчатая упаковка или скотч), тара
(бутылки, ящики, канистры, садовые лейки,
горшки для рассады), полимерные трубы
для канализации, дренажа, водо-,
газоснабжения, электроизоляционный
материал, полиэтиленовый порошок
используется как термоклей. Полипропилен -
материал для производства плёнок
(особенно упаковочных), мешков, тары,
труб, деталей технической аппаратуры,
пластиковых стаканчиков, предметов
домашнего обихода, нетканых материалов,
электроизоляционный материал, в
строительстве для вибро- и шумоизоляции
межэтажных перекрытий в системах
«плавающий пол». При сополимеризации
пропилена с этиленом получают
некристаллизующиеся сополимеры, которые
проявляют свойства каучука, отличающиеся
повышенной химической стойкостью и
сопротивлением старению. Таким способом
в промышленности получают полиэтилен
и полипропилен высокого давления.
Катионная полимеризация алкенов
инициируется протонными кислотами или
кислотами Льюиса (АlС13, BF3 и др.). Реакционным
центром растущей полимерной цепи
является карбокатион. По ионному
катионному механизму наиболее легко
полимеризуются несимметрично построенные
алкены общей формулы.
Стереорегуля́рные полиме́ры, высокомолекулярные соединения, макромолекулы которых состоят из звеньев, имеющих одинаковые или различные конфигурации, чередующиеся в соответствии с определённой закономерностью. Полимер, в котором каждое звено содержит один центр стереоизомерии (тетраэдрический атом С, двойная связь, цикл) и конфигурации этих центров одинаковы, называется изотактическим.
Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
При действии на алкены галогенирующих реагентов (Cl2, N-бромсукцинимид и др.) в присутствии инициаторов процесса образования свободных радикалов (пероксиды, температура, УФ-свет) происходит не присоединение галогена по месту разрыва двойной связи, а свободнорадикальное замещение на галоген атома водорода, находящегося при атоме углерода в α-положении к двойной связи (аллильное положение). Так, при температуре 500—600 °С пропен реагирует с хлором, образуя аллилхлорид:
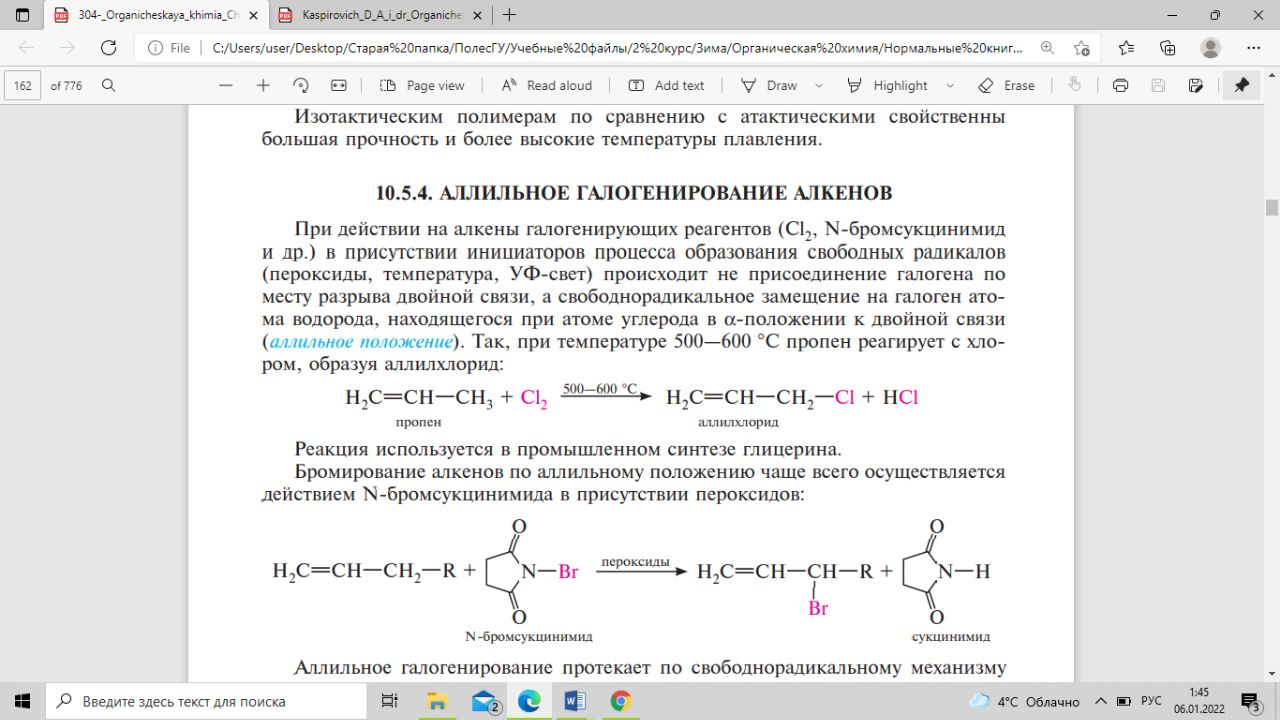
Реакция используется в промышленном синтезе глицерина. Аллильное галогенирование протекает по свободнорадикальному механизму и включает стадию образования аллильного радикала. В цепном процессе выделяют три стадии: инициирование, рост цепи, обрыв цепи. Инициирование. Под действием энергии квантов света (hn) или нагревания молекула хлора активируется и претерпевает гомолитический разрыв связи с образованием двух свободных радикалов: Cl· ·Cl hn 2Cl·. Рост цепи. Свободные радикалы хлора атакуют связь С—Н в молекуле, отрывая при этом атом водорода с образованием хлороводорода HCl и свободного радикала, он, в свою очередь, атакует молекулу хлора, отрывает атом галогена. Образовавшийся радикал хлора повторяет цикл указанных превращений, то есть происходит цепной процесс, в котором атом хлора, прореагировавший на предыдущей стадии роста цепи, способствует высвобождению нового радикала хлора на последующей стадии. Цепной процесс прекращается только после исчезновения всех свободных радикалов, образующихся в ходе реакции. Обрыв цепи. В результате рекомбинации (димеризации) свободных радикалов происходит обрыв цепи. В результате сопряжения неспаренного электрона с π-электронами двойной связи аллильные радикалы являются более устойчивыми, чем обычные алкильные радикалы:
![]() Поэтому
замещение атома водорода на атом галогена
в аллильном положении алкенов происходит
легче, чем в алканах. Аллил —
углеводородный радикал, производное
пропилена, у которого удален атом
водорода от третьего атома углерода.
Аллильная группа — органический
заместитель, часть химического соединения,
которое имеет вид CH2=CH-CH2-R. Соединения с
аллильной группой часто встречаются в
природе в растениях. Своё название аллил
получил от латинского названия чеснока
— Allium sativum.
Поэтому
замещение атома водорода на атом галогена
в аллильном положении алкенов происходит
легче, чем в алканах. Аллил —
углеводородный радикал, производное
пропилена, у которого удален атом
водорода от третьего атома углерода.
Аллильная группа — органический
заместитель, часть химического соединения,
которое имеет вид CH2=CH-CH2-R. Соединения с
аллильной группой часто встречаются в
природе в растениях. Своё название аллил
получил от латинского названия чеснока
— Allium sativum.
Пероксидное окисление алкенов кислородом воздуха
Механизм реакции:
Реакция происходит в два этапа:
Инициирование: Радикалы образуются при разрыве связи O-O в молекуле кислорода под действием света или тепла.
Распространение цепи:
Радикальный кислород присоединяется к алкену, образуя перекисный радикал.
Перекисный радикал реагирует с другой молекулой кислорода, образуя алкоксирадикальный и гидропероксидный радикал.
Гидропероксидный радикал отрывает атом водорода от другой молекулы алкена, продолжая цепь.
Условия реакции:
Реакция происходит при комнатной температуре или при нагревании.
Требуется присутствие кислорода воздуха.
Ускоряется наличием света, переходных металлов и свободных радикалов.
Продукты реакции:
Алкоксирадикалы: претерпевают дальнейшие превращения, образуя спирты, альдегиды или кетоны.
Гидропероксиды: могут разлагаться с образованием спиртов, альдегидов или кетонов, или реагировать с другими соединениями.
Изомеры: незначительное количество образующихся продуктов могут быть изомерами по сравнению с исходными алкенами.
Особенности реакции:
Реакция может быть селективной или неселективной в зависимости от условий.
Реакция может протекать по цепному механизму с быстрым накоплением продуктов.
Побочными продуктами могут быть оксираны и внутримолекулярные перекиси.
Применение:
Пероксидное окисление используется в синтезе органических соединений, таких как эпоксиды, спирты и альдегиды.
Оно применяется в процессах окисления топлива в двигателях внутреннего сгорания.
Реакция может вызывать деградацию пластмасс и других материалов, содержащих алкены.
Номенклатура, классификация, изомерия диеновых углеводородов.
Номенклатура диеновых углеводородов
Ациклические диены: Название составляется из названия алкана с добавлением суффикса “-диен”. Положение двойных связей указывается цифрами.
Циклические диены: Название составляется из названия циклоалкана с добавлением суффикса “-диен”. Положение двойных связей не указывается.
Классификация диеновых углеводородов
По положению двойных связей:
Сопряженные (кумулированные) диены: двойные связи расположены рядом.
Изолированные диены: двойные связи разделены хотя бы одной одинарной связью.
Кумулированные диены: двойные связи разделены тройной связью.
По типу гибридизации атомов углерода у двойных связей:
sp²-sp² (аллены): обе двойные связи между атомами углерода с sp²-гибридизацией.
sp²-sp³ (диены): одна двойная связь между атомами углерода с sp²-гибридизацией, другая - между атомами углерода с sp³-гибридизацией.
Изомерия диеновых углеводородов
Структурная изомерия:
Изомерия положения двойных связей: изомеры имеют одинаковую молекулярную формулу, но разное расположение двойных связей.
Изомерия углеродного скелета: изомеры имеют одинаковую молекулярную формулу, но разное строение углеродного скелета.
Геометрическая изомерия:
Изомеры цис-транс: изомеры имеют одинаковую молекулярную формулу и одинаковое расположение двойных связей, но отличаются пространственным расположением заместителей у двойных связей.
Примеры:
Cистемное название 1,3-бутадиена: бута-1,3-диен
Геометрические изомеры 2-бутена: цис-2-бутен и транс-2-бутен
Структурные изомеры пентена-1: 4-метил-1-бутен, 2-метил-2-бутен и 2-метил-1-бутен
Особенности изомерии диенов:
Для сопряженных диенов характерна геометрическая изомерия.
Для изолированных диенов характерна структурная изомерия.
Кумулированные диены не имеют изомеров.
Сопряженные диены (1,3-бутадиен и изопрен), сопряжение Двойных связей (,-сопряжение) И реакции электрофильного присоединения. Диеновый синтез (реакция Дильса-Альдера), представление о механизме реакции.
Сопряжённые алкадиены — непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряжённую систему.
К наиболее известным представителям сопряжённых диенов относятся:
бутадиен-1,3 (дивинил);
2-метилбутадиен-1,3 (изопрен).
Эти соединения используются в качестве мономеров для промышленного получения различных полимерных материалов, главным образом каучуков.
Сопряжение π-связей возможно благодаря тому, что p-орбитали, которые эти связи образуют, расположены не на линии между ядрами, а в перпендикулярной плоскости, что допускает их перекрывание во всех направлениях.
Реакции присоединения к сопряжённым диенам протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвётся только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
Диеновый синтез (реакция Дильса-Альдера) — реакция присоединения к сопряжённым диенам соединений, содержащих кратные связи (так называемых диенофилов). Реакция идёт как 1,4-присоединение и приводит к образованию циклического продукта.
Реакция Дильса-Альдера является классическим примером диенового синтеза, который часто используется для формирования шести- и более замещенных циклических соединений. В этой реакции алифатический диен (обычно 1,3-диен) и алкен (диенофил) реагируют, обычно при тепловом или ультразвуковом воздействии, для образования циклического соединения (циклопентен, циклогексен и т.д.).
Механизм реакции Дильса-Альдера включает в себя циклическое расщепление диеновой системы диенового компонента и последующее образование новых связей между атомами углерода диенового компонента и диенофила.
Общий механизм может быть представлен как следующий:
1. Инициация: Диен и диенофил первоначально образуют комплекс, который может быть представлен в виде эндо- и экзо- конформаций.
2. Циклическое сложение: Следом за этим происходит циклическое сложение, которое приводит к образованию нового шестичленика.
3. Формирование циклического продукта: После циклического сложения образуется циклический продукт, удерживающий оба диеновые остатки и диенофильный остаток.
Это упрощенное представление механизма, который описывает общие этапы реакции. На практике могут проявляться и дополнительные химические детали, особенно при работе с конкретными реагентами и условиями реакции.
Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
Изопреноиды — большая группа природных соединений, в основе химической структуры которых лежит 1,3-бутадиен (изопрен).
В молекулах изопреноидов разветвлённые насыщенные или ненасыщенные изопреновые фрагменты связаны обычно в определённом порядке: «голова» к «хвосту» (т. н. изопреновое правило, установленное Л. Ружичкой).
К изопреноидам относят углеводороды терпены и их кислородсодержащие производные — терпеноиды (терпеновые спирты, альдегиды, кетоны, кислоты, простые и сложные эфиры и др.).
Число изопреновых звеньев варьируется от двух (например, в молекулах лимонена, гераниола) до нескольких тысяч (натуральный каучук, гуттаперча).
Изопреноиды широко представлены в растительном, животном и микробном мире.
Изопреноиды — большая группа природных соединений, в основе химической структуры которых лежит 1,3-бутадиен (изопрен).
В молекулах изопреноидов разветвлённые насыщенные или ненасыщенные изопреновые фрагменты связаны обычно в определённом порядке: «голова к хвосту» (т. н. изопреновое правило, установленное Л. Ружичкой).
К изопреноидам относят углеводороды терпены и их кислородсодержащие производные — терпеноиды (терпеновые спирты, альдегиды, кетоны, кислоты, простые и сложные эфиры и др.).
Число изопреновых звеньев варьируется от двух (например, в молекулах лимонена, гераниола) до нескольких тысяч (натуральный каучук, гуттаперча).
Многие природные вещества имеют структуру изопреноидов (смоляные кислоты, зоо- и фитостерины, стероиды, полиизопреноиды, каротиноиды, ксантофиллы, витамины группы А, некоторые аттрактанты, феромоны, ювенильные гормоны и пр.).
Изопреноиды (индивидуально и в составе скипидара, эфирных масел, бальзамов и пр.) используются как душистые вещества и лекарственные средства.
Каучуки — натуральные или синтетические эластомеры, характеризующиеся эластичностью, водонепроницаемостью и электроизоляционными свойствами. Из каучуков путём вулканизации получают резины и эбониты.
Синтетический каучук — это материал, изготовленный из нефтепродуктов и других химических соединений. Он имеет широкое применение в производстве шин, ремней, покрышек и других изделий.
Основные типы синтетических каучуков:
изопреновый;
бутадиеновый;
бутадиен-метилстирольный;
бутилкаучук;
этилен-пропиленовый;
бутадиен-нитрильный;
хлоропреновый.
Свойства синтетических каучуков:
устойчивость к высоким и низким температурам;
химическая устойчивость;
водонепроницаемость;
износостойкость;
эластичность.
Применение синтетических каучуков:
производство шин и резиновых изделий;
медицина (медицинские перчатки, шприцы, маски и другие изделия);
текстильная промышленность (эластичные ткани);
промышленность строительных материалов (гидроизоляционные материалы, клеи и герметики);
производство пластмасс и искусственного камня;
производство спортивного инвентаря;
косметическая промышленность (губные блески и туши для ресниц).
Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
Алкинами называют алифатические углеводороды, содержащие тройную углеродуглеродную связь. Общая формула алкинов СnН2n–2. Простейшим представителем этого ряда соединений является ацетилен С2Н2, поэтому часто алкины называют ацетиленовыми углеводородами. Ацетилен открыт Э. Деви (1836). Впервые синтезирован М. Бертло из угля и водорода (1862). По номенклатуре IUPAC названия алкинов образуют от названий соответствующих алканов, заменяя суффикс -ан на -ин с указанием положения тройной связи в цепи углеродных атомов. Нумерацию главной углеродной цепи начинают с того конца, к которому ближе расположена тройная связь. Наряду с номенклатурой IUPAС для простейших углеводородов часто применяют рациональные названия. Согласно рациональной номенклатуре, ацетиленовые углеводороды рассматривают как производные ацетилена, в молекуле которого атомы водорода замещены на углеводородные радикалы: метилацетилен, этилацетилен, диметилацетилен. Для первого представителя гомологического ряда алкинов сохранилось тривиальное название «ацетилен». Названия углеводородных остатков (радикалов) алкинов образуют путем добавления к названию углеводорода суффикса –ил. В молекуле ацетилена атомы углерода образуют σ-связи в результате осевого перекрывания sp-гибридных орбиталей (величина валентного угла равна 180°). Две π-связи образуются при боковом перекрывании двух пар АО — 2р2 и 2ру, расположенных во взаимно перпендикулярных плоскостях. Таким образом, характерный фрагмент алкинов -С=С- имеет линейное строение. По физическим свойствам три первых представителя гомологического ряда алкинов при нормальных условиях представляют собой газы, далее следуют жидкости (С5—C15), а начиная с углеводорода состава С16Н30 алкины являются твердыми веществами. Изменения температур плавления и кипения в гомологическом ряду алкинов подчиняются основным закономерностям, характерным для алканов и алкенов.
Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (Z)- и (E)-алкенов.
Алкины - это углеводороды с тройной углерод-углеродной связью. Они обладают характерными химическими свойствами, которые делают их полезными в органическом синтезе.

