
Презентации / ФХОТ Все Презентации
.pdf
Установим связь между Гi и σ
d (F A) = d (σA) + d |
|
μ A = σ dA + Adσ + |
|
|
μ |
d ( A) + |
|
A dμ |
. |
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
s |
|
|
|
i i |
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
i |
i |
i |
|
|
|
1 |
|
|||||||||
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
i |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dF = − S dT + (−PdV ) + |
|
μ |
i |
i |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
dn , |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
d (F A) = − S dT + σdA + |
|
μ |
d ( A) |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
|
|
i |
|
i |
|
|
2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
Приравнивание выражений (1) и (2) дает равенство |
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S dT + Adσ + A |
|
|
dμ |
|
|
= 0 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
при |
T = const , |
|
|
dσ = − |
i |
dμ |
|
, |
|
|
|
адсорбционная формула Гиббса |
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
= − |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
μi T = const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||

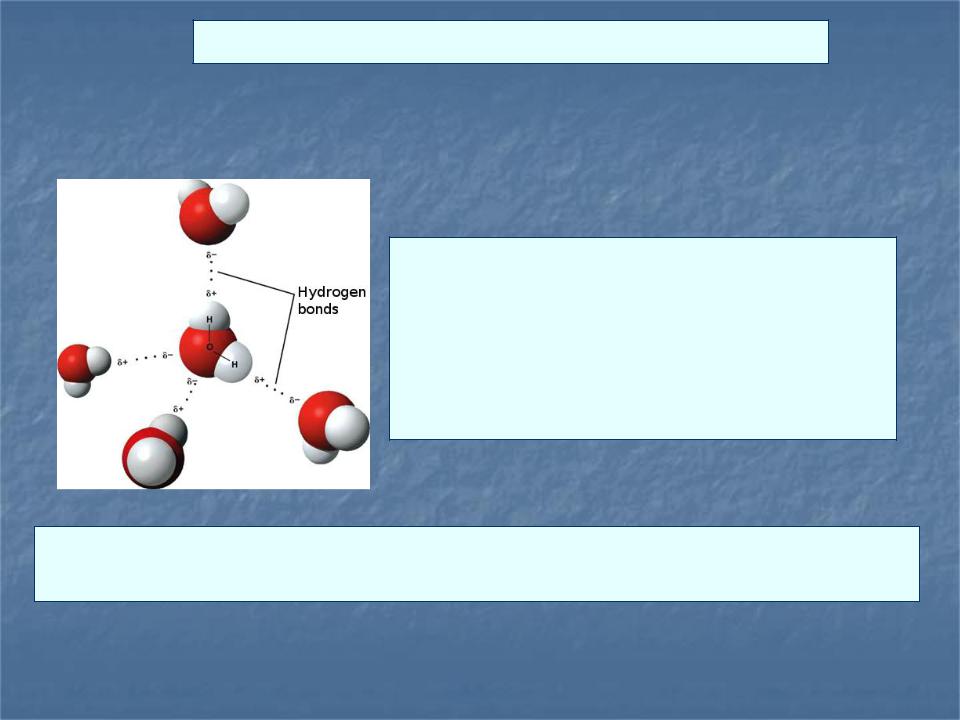
Причины возникновения физической адсорбции
Силы межмолекулярного |
|
|
|
Водородная связь |
|
|
|
|
взаимодействия (силы Ван-дер-Ваальса) |
|
|
|
|
|
|
|
|
Водородная связь, вид химического взаимодействия атомов в молекулах, участие в котором принимает атом водорода (Н), уже связанный ковалентной связью с другим атомом
(А).
Водородная связь обеспечивает адсорбцию полярных молекул на поверхности адсорбентов с гидроксильными группами ОН
Адсорбаты |
|
Адсорбенты |
молекулы Н2О, СО2, NН3 и др |
|
стекла, силикагели и цеолиты. |


Процесс физадсорбции всегда идет с выделением |
|
|
|
Qф = Uф NА |
|
энергии в виде теплоты физической адсорбции |
|
|
|
|
|
|
|
|
τа - среднее время жизни молекулы в адсорбированном состоянии основной параметр, определяющий постоянную времени процесса физадсорбции
|
|
|
|
U |
Ф |
|
|
|
Q |
Ф |
|
||
τ |
|
= τ |
|
exp |
|
|
τ |
|
exp |
|
|
||
a |
0 |
|
|
0 |
|
|
|||||||
|
|
|
κT |
|
|
|
RT |
|
|||||
|
|
|
|
|
|
|
|
|
|
||||
0 10 –13 сек (близка к периоду колебаний молекулы в потенциальной яме),
Qф ≤ 10 ккал/моль, τа ≈ 10-6 сек, (τа↓при Т↑)
Кинетической характеристикой процесса служит степень заполнения адсорбционных центров
θ(t) =N |
(t) /N |
, |
а |
ц |
|
где, Nа(t) — концентрация занятых адсорбционных центров (т. е.
адсорбированных молекул) в момент времени t, а Nц — общее число
адсорбционных центров на единице площади.

Физической адсорбцией начинается и заканчивается сорбционный процесс только для инертных газов, молекулы которых, имея полностью застроенную электронную конфигурацию, способны удерживаться у поверхности лишь межмолекулярными силами Ван- дер-Ваальса.
Молекулы других газов и паров металлов, пройдя этап физадсорбции, способны к дальнейшему более сильному взаимодействию с поверхностью за счет сил химической природы типа гомеополярной и гетерополярной связи.
Такая связь возможна лишь на атомарном уровне поэтому физически адсорбированная молекула предварительно диссоциирует на атомы, которые и обеспечивают межатомное взаимодействие, лежащее в основе процесса хемосорбции.
Хемосорбцию нельзя считать химической реакцией, так как при этом не образуется каких-либо новых веществ.
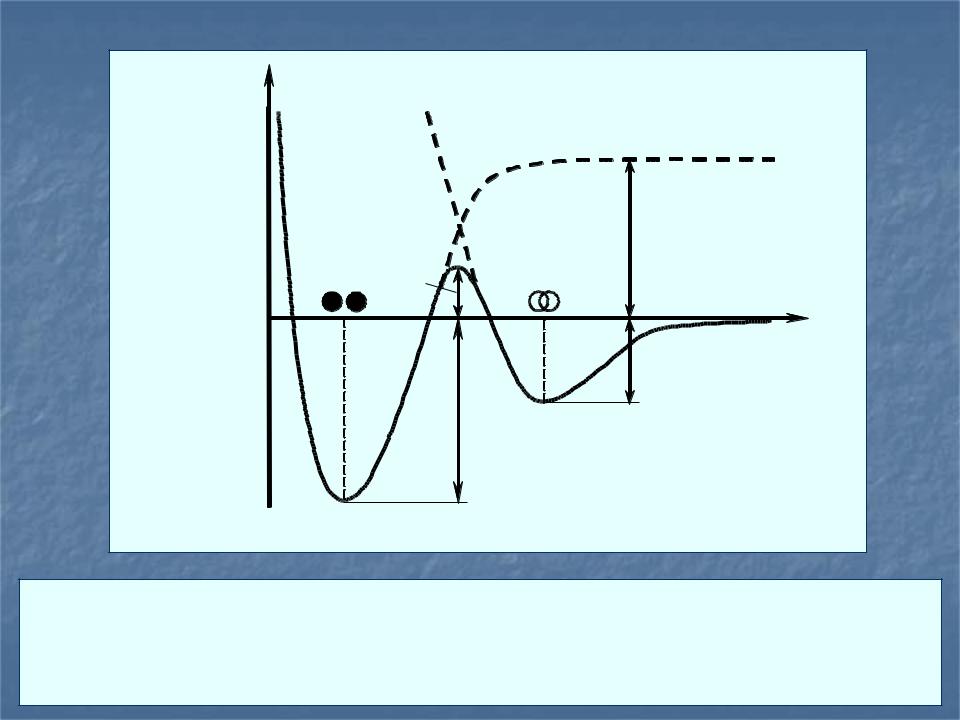
U (x)
3 |
1 |
два атома |
|
|
2
|
|
E |
|
|
|
x |
молекула |
|
|
|
|
0 |
x |
х |
x |
x |
Ф |
||
|
|
|
U |
|
|
I |
ф |
|
|
|
|
|
|
U |
|
|
|
x |
|
|
II |
|
|
межатомные силы в 5-10 раз превышают силы Ван-дер-Ваальса, => теплота химической адсорбции Qх = Uх NА достигает 50-100 ккал/моль. Это обеспечивает времена жизни частицы в адсорбированном состоянии, измеряемые часами, сутками и даже годами в зависимости от температуры.
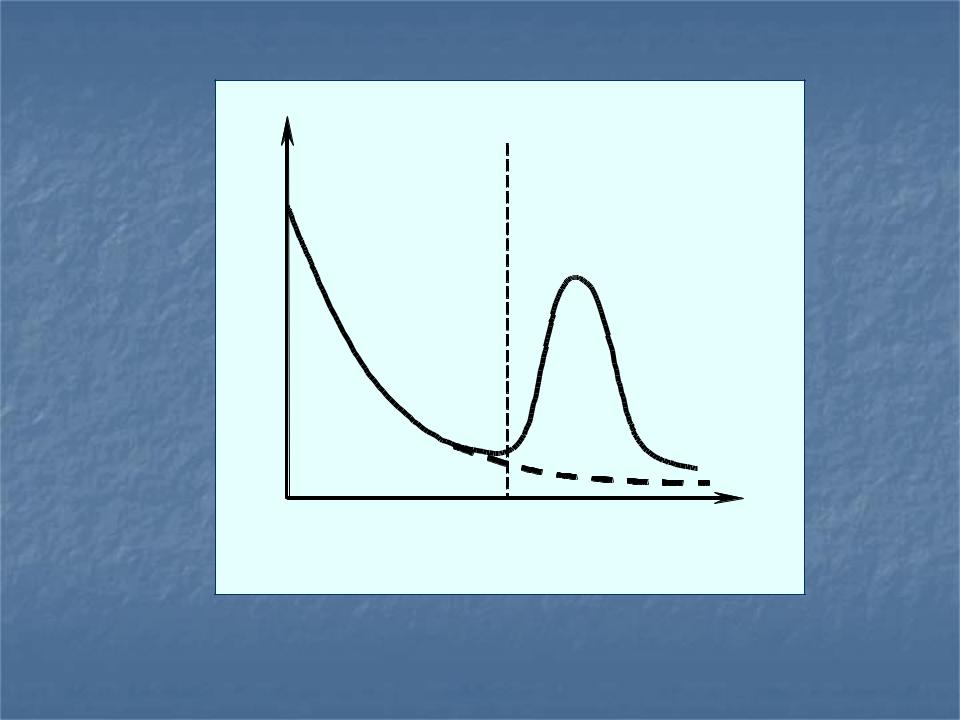
0 |
|
|
|
физадсорбция |
хемосорбция |
1 |
|
|
0 |
T0 |
T |

6.5 Роль адсорбции, растворения и диффузии в газопоглощении материалов
Газопоглощение - проникновение газовых молекул внутрь твердого тела с образованием в объёме твердых растворов или химических соединений.
Молекулы газа, пройдя предварительные этапы физической и химической адсорбции на поверхности твердого тела, растворяются в его поверхностных слоях путем вхождения в кристаллическую решетку с последующим диффузионным распределением по всему объему.
процесс поглощения газа твердым телом проходит в 4 последовательных стадии
Физадсорбция 

 Хемосорбция
Хемосорбция 

 Растворение
Растворение 

 Диффузия
Диффузия
Исключение одной из стадий в этой последовательности делает невозможным газопоглощение в целом. Газы, нехемосорбируемые поверхностью металлов, не растворяются в них: все благородные газы и азот не хемосорбируются такими металлами, как Cu, Ni, Al, Ag, Au

|
|
U (x) |
|
|
|
эндотермическое |
|
3 |
|
|
|
|
|
|
|
||
|
растворение |
|
|
|
|
|
4 |
|
|
|
|
|
E |
|
E |
|
|
|
д |
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
2 |
|
4 |
'' |
|
|
|
|
|
U |
|
|
|
|
|
р |
|
|
E |
1 |
|
|
|
|
||
|
|
|
|
|
|
|
E |
|
|
x |
|
|
|
|
|
|
|
|
д |
0 |
|
|
x |
|
' |
|
|
||
|
U |
|
|
U |
|
|
р |
|
U |
|
|
|
|
|
ф |
|
|
|
|
|
x |
|
|
экзотермическое |
|
|
|
|
|
|
растворение |
|
|
|
|
Энергетическая диаграмма поглощения газов твердым телом, |
|||||
включающая последовательные этапы физической адсорбции (1), |
|||||
хемосорбции (2), растворения (3) и диффузии (4).

 адсорбента
адсорбента