
Презентации / ФХОТ Все Презентации
.pdf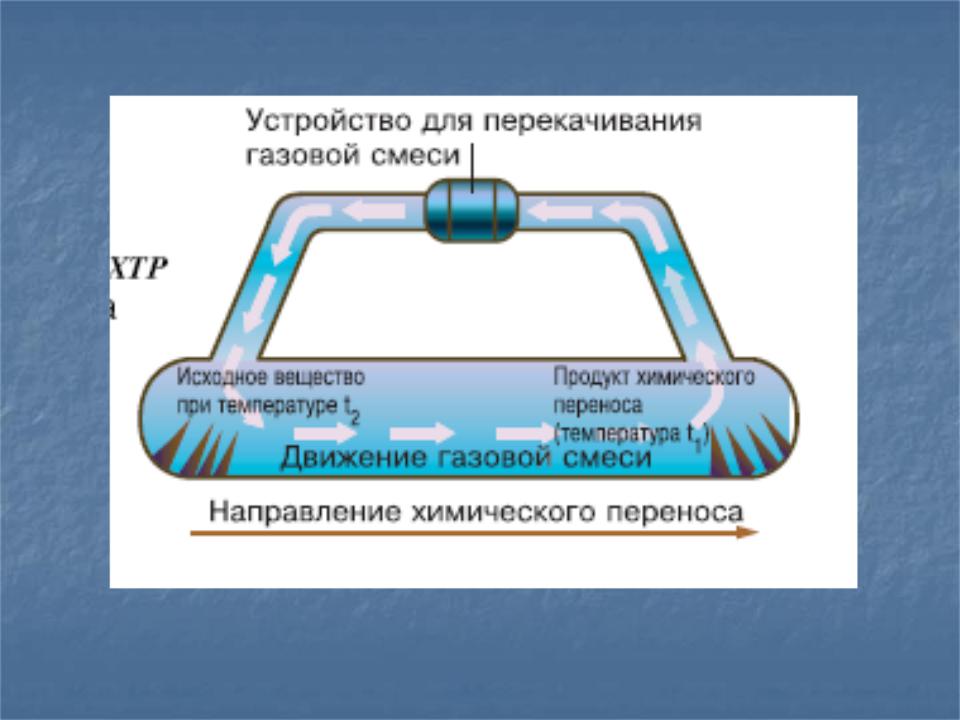
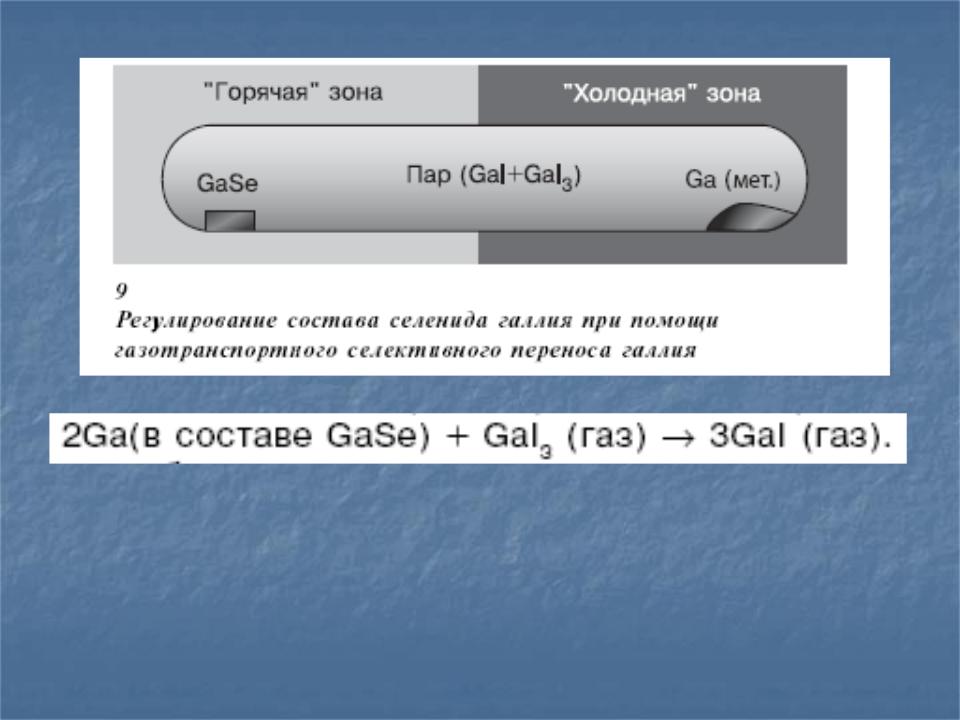


4.1 Химические связи в твердых телах
|
|
|
Твердые вещества |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
монокристаллы - |
|
|
поликристаллы - |
|
аморфные вещества |
|
распространение |
|
сохранение дальнего порядка |
|
- (неупорядоченные |
||
дальнего порядка на |
|
в ограниченных объемах |
|
структуры) |
||
весь объем вещества |
|
(кристаллитах с размерами в |
|
сохранение только |
||
|
|
десятки и сотни тысяч |
|
ближнего порядка в |
||
|
|
|
||||
|
|
|
периодов решетки). |
|
расположении |
|
|
|
Поликристаллы -это |
|
частиц |
||
|
|
совокупность беспорядочно |
|
|
||
|
|
|
|
|||
|
|
|
ориентированных |
|
|
|
|
|
|
кристаллитов |
|
|
|
|
|
|
|
|
|
|

Классификация кристаллических тел
по химическому признаку |
|
по геометрическому признаку |
(тип химической связи между |
|
( характеру симметрии |
частицами) |
|
кристаллической решетки) |
|
|
|
Классификация кристаллов по типу химической связи между частицами
Молекулярные кристаллы
Металлические кристаллы
Ионные кристаллы
Ковалентные кристаллы

Молекулярный кристалл (МК) — кристалл, образованный из молекул.
Молекулы связаны между собой слабыми силами Ван-дер-Вальса, внутри молекул между атомами действует более прочная ковалентная связь.
МК — кристаллы органических соединений (нафталин).
Молекулярная связь
простые вещества |
|
бинарные соединения |
|
металлоорганические |
(О2, N2) |
|
CO2, N2O4 |
|
соединения |
К молекулярным кристаллам относятся и кристаллы полимеров, а также кристаллы белков, нуклеиновых кислот.
|
|
|
Свойства МК |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
большие коэффициенты |
|
низкие температуры |
|
высокая |
|
малая |
||
теплового расширения |
|
плавления |
|
сжимаемость |
|
твердость |
||
|
|
|
|
|
|
|
|
|
В обычных условиях большинство МК — диэлектрики
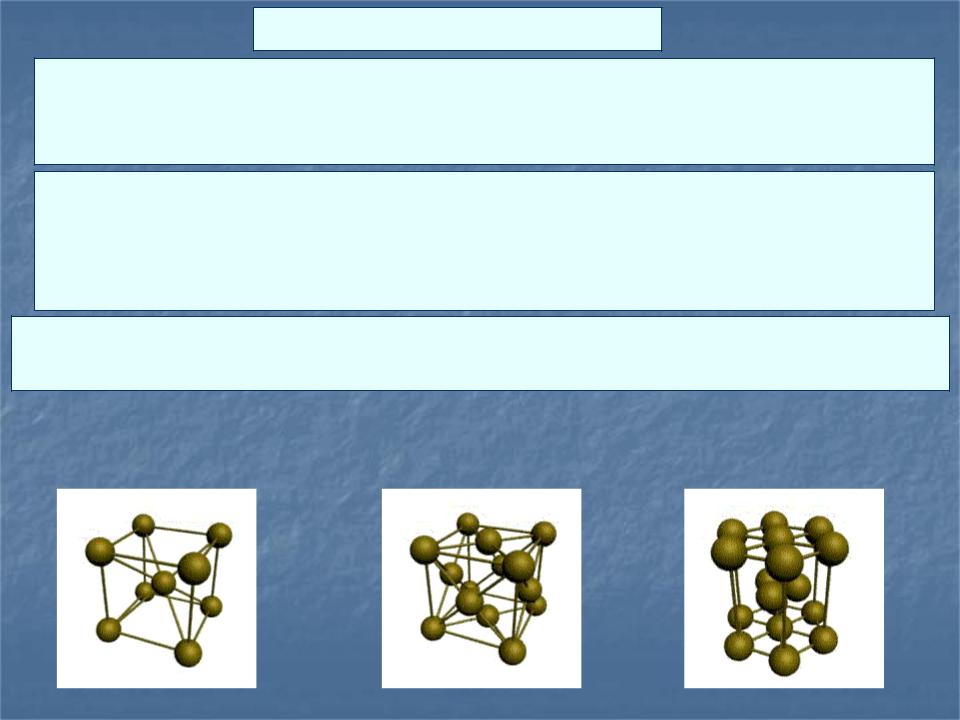
Металлический кристалл.
В узлах кристаллической решётки расположены Me+. Между ними беспорядочно движутся валентные электроны (e-), отщепившиеся от атомов при образовании ионов.
e удерживают вместе Me+ - иначе решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть.
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов:
кубическую объемно |
|
кубическую |
|
|
|
|
гексагональную. |
||
центрированную |
|
гранецентрированную |
|
|
|
|
|
||
|
|
|
||
|
|
|
|
|

Металлические кристаллы
Металлы |
|
Металлиды TiNi2 |
Свойства металлических кристаллов
высокая |
|
высокая |
|
высокая |
|
высокая |
теплопроводность |
|
электропроводность |
|
прочность |
|
пластичность |
|
|
|
|
|
|
|
наличие свободно |
|
отсутствие разрыва |
движущихся электронов |
|
связей при смещении |
|
|
атомов друг относительно |
|
|
|
|
|
друга |
|
|
|
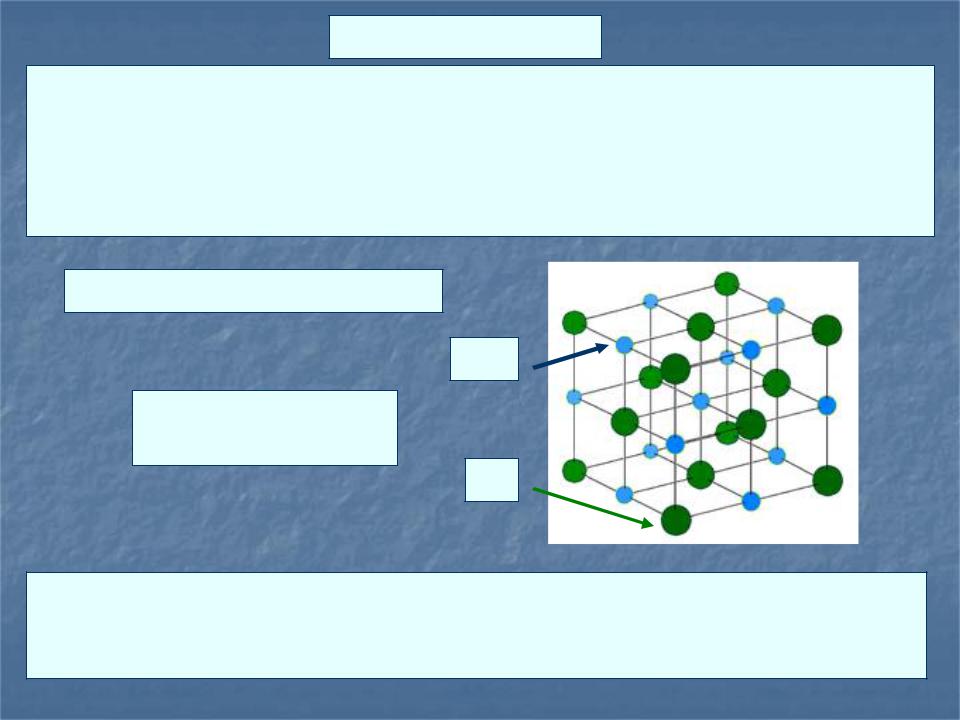
Ионный кристалл.
В узлах кристаллической решётки помещаются положительно и отрицательно заряженные ионы. Наиболее прочная химическая связь, образуется между атомами с большой разностью электроотрицательностей (>1,7 по шкале Полинга), при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.
NaCl, NaF, KBr, KI и др.
Na+
Хорошо поглощают ИК излучение
Cl-
Кристаллы с ионной связью при низких температурах являются диэлектриками. При температурах близких к температуре плавления они становятся проводниками электричества.

Ковалентный кристалл — кристалл образованный за счёт химической связи, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Кристаллы с ковалентной связью д/э или п/п - (С (алмаз), Ge, Si).
Простая ковалентная связь. Каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными. пример - атомы в молекулах простых газов (Н2, Cl2 и др.) и соединений (Н2О, NH3, CH4,
СО2, HCl и др.).
Донорно-акцепторная связь. Оба электрона предоставляет один из атомов - донор. Второй атом - акцептор. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу. Пример – ZnS.
