
Презентации / ФХОТ Все Презентации
.pdf
Состав газовой фазы
Состав газовой фазы изменяется путем введения (или удаления) химически активного компонента, что изменяет его парциальное давление рi и отражается на величине П ( pi)
G RT ln П( pi ) ln K p (T )
pк к
П( pi ) к pн н
н
Увеличение p конечных хим. реагентов при Т = const обеспечивает неравенство П (pi) > Kp (Т), что смещает реакцию влево ( G > 0), а дополнительное введение начальных химических реагентов смещает ее вправо ( G < 0).

Общее давление в системе
G RT ln П( pi ) ln K p (T )
рi = хi Р
|
|
|
|
|
|
|
|
|
|
|
|
|
xкк |
|
|
|
|
pк к |
|
|
|
|
г |
|
|
||||
|
|
|
|
к |
|
|
|
|
|
|
к |
|||
П( pi ) |
|
|
|
П ( pi ) П (xi )P |
,где П (xi ) |
|
|
|||||||
|
pн н |
|
|
xнн |
||||||||||
|
|
|
|
н |
|
|
|
|
|
|
|
н |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
г |
|
|
г |
г |
|
|
|
|
|
|
||
|
|
|
|
|
V |
г RT |
|
|
|
|||||
|
|
|
к |
н |
|
P |
|
|
|
|||||
|
|
|
|
к |
|
|
н |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

при постоянном составе системы ( хi = const) давление Р поразному влияет на величину П ( pi) (знак G) в зависимости от величины и знака г :
при г = 0 изменение Р не влияет на величину П ( pi) и не
нарушает равновесия реакции;
при г > 0 возрастание Р увеличивает величину П (pi), при этом соответственно G > 0, т. е. реакция смещается влево;
при г < 0 возрастание Р уменьшает величину П (pi), при этом соответственно G < 0 т. е. реакция смещается вправо
Сжатие системы, происходящее при повышении давления смещает хим. равновесие в том направлении, которое обеспечивает уменьшение числа молей в газовой фазе (и наоборот).

Разбавление газовой смеси
Разбавление газовой смеси путем введения в систему инертного газа (при этом Р = const) всегда уменьшает мольную долю хi (или парциальное давление рi = хi Р) каждого i-го химического реагента в газовой фазе.
|
|
|
|
|
до введения инертного газа |
|
рi = хi Р |
|
xi ni / n |
|
|
|
|
|
после введения инертного газа n
xi ni / n n ni / n 1
n / n — степень разбавления
pi xi P |
|
xi |
P |
|
|
||
1 |
|
||

П( p ) П(x )P г |
|
|
xкк |
|
|
, |
где П(x ) |
к |
|
||
xнн |
|
||||
i |
i |
|
i |
|
|
н
Химические реакции с г = 0 нечувствительны к введению
инертного газа.
Для реакций, сопровождающихся увеличением объема газа ( V > 0 при г > 0), введение инертного газа уменьшает
П (pi), что дает G < 0, т. е. реакция сдвигается вправо.
Реакции сопровождающиеся уменьшением объёма ( г < 0 )
смещаются влево при разбавлении газовой смеси инертным газом.

принцип Ле Шателье: внешнее воздействие, выводящее систему из состояния термодинамического равновесия, стимулирует в ней протекание процессов, противодействующих этому воздействию
Смещение равновесия гетерогенной химической системы, осуществляемое путем изменения одного (нескольких) параметров, необходимо осуществлять в соответствии с правилом фаз Гиббса: число изменяемых параметров не должно превышать числа термодинамических степеней свободы системы.
В противном случае будет исчезать, по крайней мере, одна из взаимодействующих фаз, и состояние системы изменится.

|
|
G G0 |
RT ln П( pi ) |
|
||
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
Реакция протекает справа налево |
||
GT |
10ккал / моль |
|
|
|
|
|
|
|
|
|
|||
GT0 10ккал / моль 
 Реакция протекает слева направо
Реакция протекает слева направо
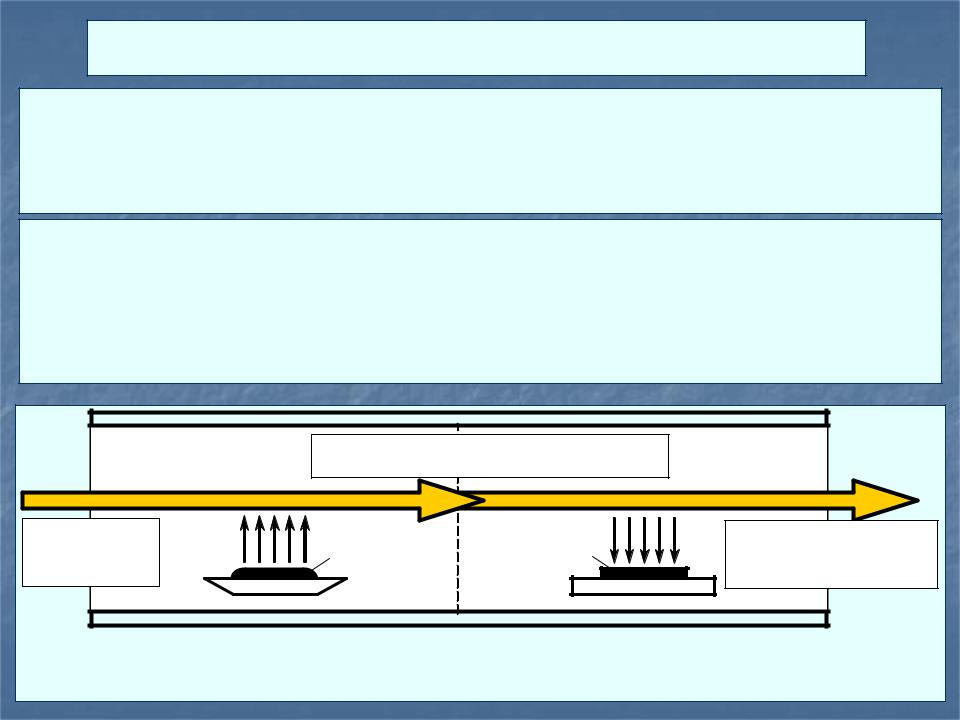
3.4 Газотранспортные химические реакции |
||||
Газотранспортной химической реакцией (ГХР) называется |
||||
обратимая гетерогенная реакция, протекающая в двух |
||||
температурных зонах (травления и осаждения). |
|
|||
В зоне травления труднолетучее твердое вещество |
||||
переводится из твердой фазы в газовую в виде продуктов |
||||
реакции, после транспорта которых в зону осаждения |
||||
происходит их обратное превращение в твердый продукт. |
||||
|
газовый поток (транспорт) |
|
||
входные |
источник |
подложка |
отработанные |
|
газы |
газы |
|||
|
|
|||

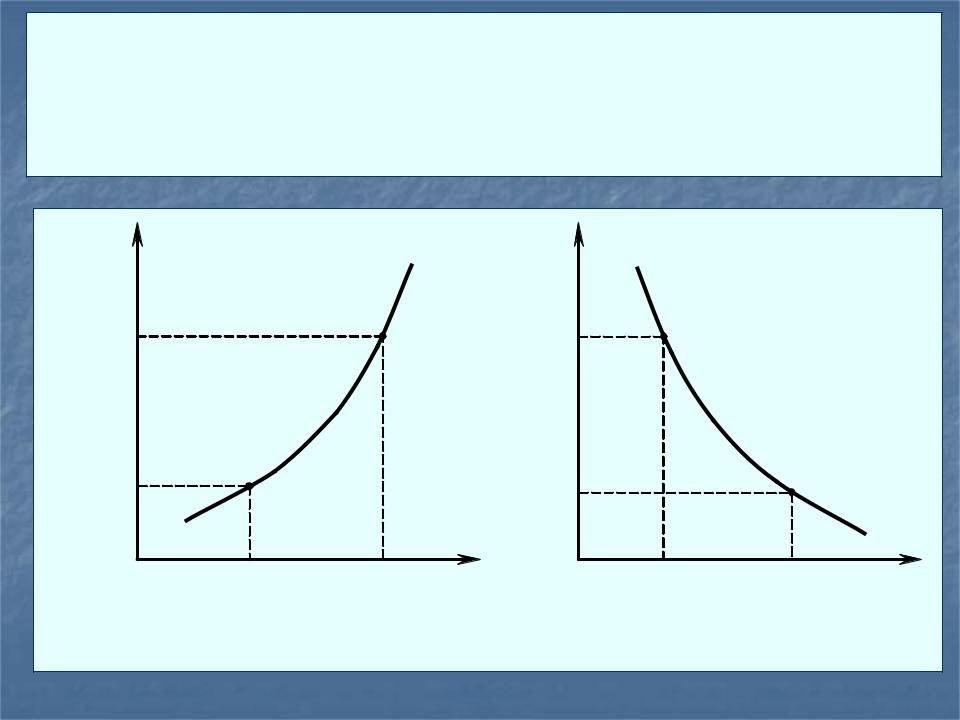
химический перенос веществ с помощью ГХР возможен не только из горячей зоны в холодную, но и в обратном направлении; при этом направление транспорта определяется знаком теплоты химической реакции.
Kр (Т ) |
|
|
|
Kр (Т ) |
|
|
|
||
|
H > 0 |
|
|
|
|
|
|
H < 0 |
|
Kр (Ти) |
|
|
|
K |
р |
(Т ) |
|
|
|
|
|
|
|
|
и |
|
|
|
|
Kр (Тп) |
|
|
|
Kр (Тп) |
|
|
|
||
0 |
Т1 = Tп |
Т2 = Tи |
T |
|
|
0 |
Т1 = Tи |
Т2 = Tп |
T |
