
972
.pdf
7.3. Флокулянты
Процесс коагуляции можно ускорить добавлением к воде веществ, называемых флокулянтами. Метод флокуляции основан на использоK вании высокомолекулярных веществ для ускорения процесса хлопьеK образования и увеличения скорости осаждения хлопьев. Часто флоK кулянты применяют в сочетании с минеральными коагулянтами. ВперK вые для очистки природных и сточных вод их начали применять в 30Kе годы прошлого столетия.
Флокуляция основана на адсорбции макромолекул на поверхности сразу нескольких твердых частиц (с образованием "мостиков" между частицами). Механизм взаимодействия флокулянта с коллоидной частицей складывается из двух фаз (по Г. Зонтхамеру). Сначала полимер адсорбируется на коллоидной частице. При этом фиксируется только один конец флокулянта, а другой остается в растворе. Затем две частицы с адсорбированными молекулами флокулянта объединяются вместе. Полимер становится мостиком между двумя частицами. Такое взаимодействие частиц протекает быстро по всему объему.
Частицы различного происхождения имеют различное распредеK ление зарядов, гидрофильных и гидрофобных областей на поверхноK сти. Вследствие этого не представляется возможным применение неK коего универсального полимерного флокулянта. Для решения задач по очистке воды (особенно сточных вод) необходим выбор флокулянтов.
Большинство флокулянтов представляют собой линейные полимеK ры с длиной цепочки до 1 мк и молекулярной массой 106 и более. Все их можно разделить на: 1) неионогенные, содержащие функциональные
группы –ОН; С = О (крахмал, ПВС, полиакрилонитрил); 2) аниK онные, содержащие диссоциированные группы –СООН, –SO3H, –OSO3H (кремниевая кислота, полиакрилат натрия, лигносульфонаты и т.д.); 3) катионные, содержащие протонированные группы –NH2, =NH (полиэтиленамин, сополимеры винилпиридина и др.); 4) амфоK терные, содержащие одновременно анионные и катионные группы (белки, гидролизованный полиакриламид и др.).
Характеристика некоторых полимерных флокулянтов приведена в табл. 7.1.
81

|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т а б л и ц а 7 . 1 |
|
Химическое строение и молекулярная масса |
|||||||||||||||
|
|
полимерных флокулянтов |
|
|
|
||||||||||
Название |
|
Химическая формула |
|
|
МолекулярK |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ная масса |
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
Полиакриламид |
|
– СН2 – СН – |
|
|
|
|
106–107 |
||||||||
(ПАА) |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
С = О |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2– |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Поливиниловый |
|
– СН2 – |
СН – |
|
|
|
|
106–107 |
|||||||
спирт (ПВС) |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ОН |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||
Сополимеры акриK |
СН2 СН |
|
СН2 СН |
|
105–106 |
||||||||||
|
|
||||||||||||||
ламида и акриK |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|||||||||||
ловой кислоты |
|
|
|
|
|
|
|
|
|
|
|
||||
|
С О |
|
ОH |
|
|
|
|||||||||
(АА – АК) |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
y |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
NH2 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
x |
|
|
|
|
|
|
|
|
||
|
(х = 20K90%) |
|
|
|
|
|
|
|
|
||||||
ПолиKN,NKдиметилK |
|
– СН2 – СН – СН – СН2 – |
|
|
5 104–2 105 |
||||||||||
N,NKдиамиламмоK |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
ний хлорид |
|
|
СН2 |
|
|
|
|
|
|
|
|
||||
|
|
СН2 |
|
|
|
|
|
||||||||
(ПДМДА) |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН – N+Cl– |
|
|
|
|
|
||||||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПолиKNKвинилK |
|
– СН2 – |
|
СН – |
|
|
|
|
5 103–1,5 106 |
||||||
капролактам |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(ПВК) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН2 |
|
С = О |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН2 |
|
|
СН2 |
|
|
|
|
|
||
|
|
|
|
СН2 |
|
|
|
СН2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
82
Полиакриламид (ПАА) применяют в виде добавки к воде, обраK ботанной минеральным коагулянтом, причем при очистке мутных вод, содержащих грубодисперсные вещества, его применяют без минеральK ного коагулянта или вводят перед коагулянтом. Силы взаимодействия ПАА с глинистыми частицами и гидроксидами металлов обусловлены не только вандерваальсовым притяжением, но и образованием водоK родных связей между амидными группами полимера (–NH2) и кислоK родом алюмосиликатов (Al2O3 2SiO2 2H2O). Этим объясняется прочK ность образующихся хлопьев.
Эффективные дозы ПАА зависят от способа его применения, качества обрабатываемой воды, типов и параметров очистных сооруK жений. При введении ПАА перед сооружениями первой ступени (отстойники, осветлители) дозы его устанавливают пробным флокулиK рованием – по эффекту осветления воды. ПАА не изменяет вкусовых свойств воды и рН. Использование ПАА приводит: а) к ускорению хлопьеобразования и осаждению взвешенных частиц; б) к понижению остаточной концентрации коагулянта в очищаемой воде.
Технический полиакриламид представляет собой прозрачный, вязкий, желтоKзеленый гель, содержащий от 4 до 9 % активного продукта – полимера. В нем содержатся в качестве примесей гипс или сульфат аммония и некоторое количество мономера. Водные растворы ПАА не проявляют заметной коррозионной активности и могут сохраняться в течение 20 дней.
83

8.АДСОРБЦИЯ
8.1.Адсорбция на границе раствор – газ
Молекулы поверхностных слоев обладают избыточной энергией. Работа образования единицы поверхности называется поверхностным натяжением ( ) (дин/см или н/м).
Адсорбция – это изменение концентрации компонента в поверхностном слое по сравнению с объемной фазой, отнесенное к единице площади поверхности. Адсорбцию выражают в моль/см2 или моль/м2. Адсорбционные явления рассмотрим на границе раздела жидкость – твердое тело.
Если раствор близок к идеальному и коэффициент активности может быть принят равным единице, то зависимость адсорбции от концентрации поверхностного натяжения выражается уравнением Гиббса*:
Г = |
C d |
, |
(1) |
|||
|
|
|
||||
RT dC |
||||||
|
|
|
||||
где С – равновесная концентрация растворенного вещества в растворе; Т – абсолютная температура, К;
R – универсальная газовая постоянная;– поверхностное натяжение.
Экспериментальные исследования влияния различных веществ на поверхностное натяжение растворов показали, что в зависимости от природы растворенного вещества и растворителя возможно как падение, так и повышение поверхностного натяжения с концентрацией растворов.
Вещества, введение которых в систему приводит к понижению поK dCd < 0 ), называют поверхностноKактивными
веществами (ПАВ). В соответствии с уравнением Гиббса адсорбция для таких веществ положительна, то есть их концентрация в поверхK ностном слое выше объемной концентрации.
Уравнение Гиббса позволяет построить кривую зависимости Г(С) на основании измерения поверхностного натяжения растворов различK ной концентрации. Кривые Г(С) называются изотермами адсорбции и имеют характерный вид, изображенный на рис.8.1. По мере увеличения концентрации адсорбция возрастает сначала резко, а затем медленнее,
*Уравнение записано в предположении, что адсорбция растворителя равна 0.
84

асимптотически приближаясь к некоторому предельному значению Г , называемому предельной адсорбцией.
Г
Г
 пропионовая
пропионовая
 масляная
масляная  капроновая кислота
капроновая кислота
С
Рис. 8.1. Изотермы адсорбции
Существование этого предельного значения объясняется тем, что тонкий поверхностный слой при высоких концентрациях ПАВ в растворе насыщен молекулами ПАВ. Постоянство Г для всех членов ряда (см. рис. 8.1) означает, что на единице площади поверхностного слоя в пределе помещается одно и то же число адсорбированных молекул, независимо от их длины.
Этот факт, установленный экспериментально, позволил Лэнгмюру (1915 г.) выдвинуть представление об ориентации адсорбированных молекул в поверхностном слое. Лэнгмюр исходил из того, что моK лекулы ПАВ состоят из двух частей: полярной группы (–СООН;
–СН2ОН; –NH3OH) и неполярного радикала. Схематически такую "дифильную" молекулу изображают в виде:
 О
О
С
О
а |
б |
в |
При адсорбции полярная группа втягивается в воду, в то время как неполярный радикал выталкивается в неполярную фазу. При малых концентрациях углеводородные цепи, вытолкнутые из воды, "плавают" на поверхности воды, тогда как полярная группа погружена в воду.
С ростом концентрации число молекул в поверхностном слое увеличивается, "цепи" приобретают вертикальное положение.
85
В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой углеводородными цепями; значение при этом уменьшается. Это свойство ПАВ обусловливает их применение в качестве эмульгаторов, пенообразователей, диспергаторов, моющих средств (классификацию ПАВ смотри в разд. 11 "Состав сточных вод").
Изотерма адсорбции Лэнгмюра. Теоретический вывод уравнения Лэнгмюра, подробно излагаемый в курсе физической химии, основан на том, что поверхность твердой фазы рассматривается как своеобразK ная шахматная доска, на каждой клеткеKячейке которой с равной веK роятностью могут находиться адсорбированные молекулы. При этом учитывается только обмен молекулами между объемом газовой фазы и ячейками на поверхности и не принимается во внимание переход молеK кул от ячейки к ячейке. Скорости процессов адсорбции и десорбции зависят от доли заполненных молекулами ячеек а=Г/Гmax.
Если молекулы не взаимодействуют друг с другом в адсорбционном слое, то скорость адсорбции va пропорциональна доле свободных мест (1– а) и давлению пара: va=ka(1– а)P, а скорость десорбции vд зависит только от доли заполненных ячеек vд=kд а, где kа, kд – константы скоростей адсорбции и десорбции. В состоянии динамического равновесия va= vд или
a |
|
|
|
|
|
(ka / kд )P |
|
KP |
||
|
|
|
|
|
|
|
. |
|||
|
max |
1 |
(k |
/ k )P |
1 KP |
|||||
|
|
|
|
|
a |
д |
|
|
|
|
Уравнение Лэнгмюра применимо только к обратимым равноK весным процессам и не может быть приложено к описанию процессов хемосорбции с образованием сильных химических связей. Переход от газа с давлением Р к раствору концентрации С, граничащему с твердой поверхностью адсорбента, существенно не изменяет логических предK посылок изложенного вывода, так что уравнение Лэнгмюра может быть применено к описанию локализованной адсорбции из раствора на тверK дой поверхности и к границе раздела раствор ПАВ – воздух в виде:
|
|
|
KC |
, |
(8.2) |
|
1 |
KC |
|||||
|
|
|
||||
где К – константа равновесия адсорбционного процесса, выраженная через отношение констант скоростей адсорбции и десорбции;
Г – предельная адсорбция.
Уравнение изотермы адсорбции Лэнгмюр вывел в 1917 г. для границы раздела твердое тело – газ, однако общность кинетических представлений, положенных в его основу, справедлива в основном для границы раздела жидкость – газ.
86

Уравнение (8.2) хорошо описывает кривую адсорбции, изображенK ную на рис. 8.1. Для малых С произведение КС << 1, Г = Г КС (зависимость адсорбции от концентрации линейна). При условии КС >> 1 уравнение сводится к Г = Г , то есть второй асимптотой является горизонтальная прямая, отвечающая предельной адсорбции. Для нахождения констант уравнение (8.2) приводят к линейному виду:
|
|
С |
= |
1 |
|
+ |
1 |
|
С. |
||
|
|
Г |
|
|
|
|
|||||
|
|
|
КГ |
Г |
|||||||
Изображая |
экспериментальные |
значения Г и С в координатах |
|||||||||
С/Г–С, легко найти обе константы графически. |
|||||||||||
Величину |
Г определяют |
|
по углу |
наклона прямой С/Г от С |
|||||||
(рис. 8.2): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
ctg |
|||||
|
|
|
|
|
|
||||||
|
|
(C / ) |
|
|
|
|
|||||
С/Г |
|
|
|
|
|
|
C |
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
С
1/Г К
С
.
Рис.8.2. Уравнение Лэнгмюра в линейной форме
По отрезку 1/Г К, отсекаемому на оси ординат, можно, определив Г , найти константу К.
Пользуясь представлением о плотнейшей упаковке молекул в монослое при предельной адсорбции, можно вычислить площадь, занимаемую одной молекулой: А=1/Г N, где N – число Авогадро, и толщину поверхностного слоя = Г М/d, где М – молярная масса адсорбируемого вещества, d – его плотность.
Вопрос об адсорбции из растворов на твердых адсорбентах является достаточно сложным, так как в этом случае необходимо учитывать адсорбцию растворителя и взаимодействие растворенного вещества не только с твердой поверхностью, но и молекулами растворителя. В отсутствие химического взаимодействия адсорбата с
87
адсорбентом и его диссоциации на начальном участке, изотермы адсорбции выражают уравнение Лэнгмюра.
В области средних концентраций (А –С ) (см. рис.8.1) количество адсорбированного вещества возрастает пропорционально дробной степени концентрации. Для этого участка изотермы применимо эмпирическое уравнение Фрейндлиха: Г = С1/n, где Г – количество адсорбированного вещества, отнесенное к единице массы адсорбента; С – равновесная концентрация (после адсорбции); и n – эмпириK ческие константы.
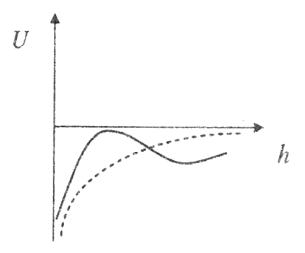
Рис. 8.3. Кривые потенциальной энергии в зависимости от расстояния между частицами
Определение констант уравнения Фрейндлиха дает возможность характеризовать количественно процесс адсорбции, а также сравнивать адсорбционную активность различных адсорбентов по отношению к растворенным веществам.
Вычисление количества вещества адсорбированного из раствора (Г ) обычно производится по уравнению
' |
(C0 C)v |
, |
(8.3) |
|
m |
||||
|
|
|
||
где С0 и С – начальная и равновесная |
концентрации |
адсорбтива, |
||
моль/л; |
|
|
|
|
v – объем раствора, л; m – масса адсорбента, г.
Построением изотермы поверхностного натяжения до адсорбции на твердом адсорбенте и после нее определяют разность (С0–С) графиK чески и рассчитывают величину адсорбции (Г ). По экспериментальK ным данным находят константы в уравнении Фрейндлиха.
88

8.2.Теория полимолекулярной адсорбции
итеория БЭТ
Развитие экспериментальной техники позволило исследовать различные по своей природе адсорбенты и получить изотермы адсорбK ции в широком диапазоне давлений, включая область очень малых значений Р ( 0,01 Р0). При этом оказалось, что для небольшого числа адсорбентов изотермы адсорбции имели "классическую" форму, отвеK чающую уравнению Лэнгмюра. Анализ экспериментального материала позволил выделить 5 основных типов изотерм, изображенных на рис. 8.4, а именно I – кривую лэнгмюровского типа; II – SKобразную кривую
слинейным участком в области средних Р; III – кривую без перегибов
смонотонным ростом; IV и V – кривые типов II и III, осложненные капиллярной конденсацией. На некоторых изотермах обнаружены также ступенчатые участки. Полученные данные осложнили теореK тическую интерпретацию полученного экспериментального материала.
ГI II II I V
Р
Рис. 8.4. Пять основных типов экспериментальных изотерм адсорбции газов и паров
В 1915 г. Поляни предложил теорию полимолекулярной адсорбции, называемую также потенциальной. Исходные положения этой теории:
1.Адсорбция обусловливается чисто физическими силами.
2.На поверхности адсорбента нет активных центров, а адсорбK ционные силы образуют около этой поверхности непрерывное силовое поле.
3.Адсорбционные силы действуют на сравнительно большие расстояния (больше размеров отдельных молекул адсорбата), поэтому можно говорить о существовании у поверхности адсорбента адсорбK ционного объема, который может заполняться молекулами адсорбента.
89

4.Действие адсорбционных сил по мере удаления от поверхности уменьшается и на некотором расстоянии становится равным нулю.
5.Притяжение данной молекулы поверхностью не зависит от наличия в адсорбционном пространстве других молекул, вследствие чего возможна полимолекулярная адсорбция.
6.Адсорбционные силы не зависят от температуры и, следоK вательно, с изменением температуры адсорбционный объем не измеK няется. Уменьшение адсорбции при повышении температуры обусловK лено не понижением адсорбционных сил, а увеличением интенK сивности теплового движения молекул, что приводит к увеличению адсорбции.
Поле, возникающее у поверхности адсорбента, можно представить в
виде эквипотенциальных поверхностей, то есть поверхностей с одинаковым адсорбционным потенциалом , который представляет собой изотермическую работу сжатия пара при переводе его от
равновесного давления Р (вдали от поверхности) в область поверхK ностного слоя с давлением насыщенного пара Р0 =RTln(P0/P). В данной теории адсорбционный потенциал является функцией адсорбK ционного объема ( ), который можно легко определить, если работа ведется при достаточно низких температурах. В этом случае адсорбат находится в основном адсорбционном пространстве в виде жидкости, адсорбционный объем которой выражается уравнением:
V,
i i
где – весовое количество адсорбата, адсорбированное всем адсорK бентом;
i – плотность вещества в жидком состоянии.
Толщина жидкости в адсорбционном объеме можно найти, пользуясь уравнением:
l , S
где S – площадь поверхности адсорбента;
– работа, совершаемая адсорбционными силами при перемеK щении 1 моль адсорбата (газа) из газовой фазы в данную точку поля.
Определив и для ряда значений Р, можно построить график зависимости =f( ). В целом, теория Поляни, несмотря на свою ограниченность (отсутствие аналитического выражения для изотермы)
90
