
2220
.pdfних, а также от температуры и кинетики взаимодействия. Наибольшей адсорбционной активностью обладают минеральные материалы из основных горных пород, содержащих карбонаты кальция и магния и оксиды железа. Адсорбция битумов на поверхности минералов кислых пород, содержащих кремнезём, происходит в меньшей степени. Структура минерального материала представляет собой атомную кристаллическую решетку, в которой каждый атом связан с другими атомами ковалентноионными химическими связями. Частицы расколотого камня имеют на своей поверхности атомы с разорванными связями. Эти атомы стремятся образовать новые связи. Формирование этих связей может происходить двумя путями. Если образующиеся связи направлены наружу от поверхности и проявляют тенденцию повернуться вокруг и соединиться с внутренними атомами горной породы, то это сопровождается искривлением кристаллической решётки, так как атомы поверхности притягиваются сильнее атомами, находящимися в объёме структуры. Если все химические связи направлены внутрь, то минеральный компонент асфальтобетонной смеси не будет иметь сродства с битумным связующим. Все вновь образованные свежие поверхности минерального наполнителя адсорбируют в разной степени слои и плёнки покрывающего их вещества.
Наиболее распространённой адсорбционной плёнкой является вода, так как водяной пар всегда присутствует в воздухе на расколотой поверхности скальных пород. В обычных условиях на поверхности кварца присутствует несколько адсорбционных слоев воды. Дробленый кварц с поверхностью 22 м2/г имеет насыщенный адсорбционный слой воды при 25 С и влажности, равной 80%. Адсорбированная вода находится в порах и трещинах и удерживается в них капиллярными силами. Наиболее удаленный от поверхности слой пленки воды находится в равновесии с водяным паром окружающего воздуха и приблизительно имеет свойства обычной воды при 250С в нормально влажном воздухе. Поверхностное натяжение адсорбированной пленки воды равно 7,4 10–6...7,8 10–6 Дж, что сравнимо с 7,2 10–6 Дж обычной свободной воды при 25 С. Таким образом, битумное связующее на частицах минерального материала распределяется по тончайшему слою воды, а скорость распространения пленки углеводородов в значительной степени зависит от вязкости битума.
3.4.4. Адсорбция электролитов на однородной твердой поверхности
Адсорбция сильных электролитов или ионная адсорбция из водных растворов на твердых адсорбентах – более сложное явление, чем молекулярная адсорбция. В большинстве случаев ионная адсорбция необратима: разбавление раствора не вызывает десорбции. При повышении температуры адсорбция ионов возрастает. Это говорит о том, что между ионами и поверхностью твердого адсорбента действуют не только
91
молекулярные силы сцепления, но и химические силы. Ионная адсорбция часто представляет собой не адсорбцию в полном смысле слова, а химическую реакцию между ионами растворенного вещества и твердой поверхностью. Образующееся соединение обычно находится в поверхностном слое, а состав внутренних слоев твердой фазы не изменяется. При ионной адсорбции на угле также образуются поверхностные химические соединения. Согласно Шилову, активированный уголь покрыт оксидами, вследствие чего в растворах сильных электролитов он становится способным к поверхностным химическим реакциям.
На минеральных полярных адсорбентах при ионной адсорбции большую роль играет химическая природа адсорбента. Ионы адсорбируются в разной степени, и почти всегда преимущественно адсорбируется один из ионов. Это так называемая избирательная адсорбция. Песковым и Фаянсом были сформулированы правила избирательной адсорбции ионов. Согласно первому правилу, на всякой твердой поверхности преимущественно будут адсорбироваться ионы, имеющие с данной поверхностью общую атомную группировку или изоморфную с ней. Поливалентные ионы адсорбируются лучше одновалентных независимо от состава адсорбента. Ионы одинаковой валентности адсорбируются различно, что связано с их размерами и различной степенью их гидратации. Ионы с самым большим радиусом проявляют наибольшую адсорбционную способность. Это объясняется тем, что такие ионы больше поляризуются и больше притягиваются полярной поверхностью твердого адсорбента. Кроме того, чем больше радиус иона, тем меньше степень его гидратации. Это также усиливает адсорбцию крупного иона, потому что гидратная оболочка ослабляет электростатическое притяжение. Ионы одинаковой валентности располагаются в так называемые лиотропные ряды, в которых каждый последующий ион адсорбируется меньше, чем предыдущий:
Cs Rb K Na Li (для катионов)
CNS J Br Cl (для анионов)
Для электролитов характерно неравенство адсорбции катиона и аниона. Твердая поверхность минеральных адсорбентов в водных растворах сильных электролитов имеет на себе электрический заряд, который возникает как в результате диссоциации собственных ионогенных групп, так и в результате избирательной адсорбции ионов одного знака заряда.
Влияние заряда твердой поверхности адсорбента на ионную адсорбцию отражено во втором правиле Пескова – Фаянса: данный ион будет адсорбироваться твердой поверхностью, если заряд поверхности противоположен по знаку заряду иона, и если образующееся поверхностное соединение труднорастворимо.
На твердой поверхности минеральных адсорбентов наблюдается очень интересное явление – ионный обмен или обменная адсорбция ионов.
92
Обменная адсорбция заключается в том, что твердое вещество, нерастворимое в воде, поглощает из раствора катионы или анионы, выделяя в раствор эквивалентное количество собственных катионов или анионов. Обменная адсорбция – явление специфическое, в ней большую роль играет химическая природа твердого адсорбента и адсорбируемого иона.
3.4.5. Теплота адсорбции
При повышении температуры равновесное значение адсорбции всегда уменьшается, так как повышается интенсивность теплового молекулярного движения, которое затрудняет фиксацию молекул на поверхности раздела фаз и способствует равномерному распределению вещества в объеме фазы.
При повышении температуры адсорбционное равновесие смещается в сторону десорбции. Отсюда, согласно принципу Ле-Шателье, следует, что адсорбция должна сопровождаться выделением тепла. Выделяющееся при адсорбции тепло Q называется теплотой адсорбции. Теплота адсорбции есть энергетический эквивалент работы, совершаемой адсорбционными силами. Его относят к единице массы адсорбента:
q Q |
, Дж/г, |
(57) |
m |
|
|
где q – интегральная теплота адсорбции.
3.5. Размеры и форма макромолекул в растворах полимеров
Термодинамические характеристики растворов полимеров тесно связано с цепным строением, размерами и гибкостью макромолекул, а также с энергией их взаимодействия с растворителем. Эти основные параметры определяют также многие другие свойства растворов полимеров, по которым можно судить о строении и свойствах макромолекул. Например, гибкость макроцепей отражается не только на высоких значениях энтропии смешивания, но и на условиях передвижения молекул в растворах при диффузии, течении и др. Влияние гибкости цепей в полной мере проявляется только при достаточной длине цепей. Слишком короткие цепи слегка изгибаются, но вследствие ограничения изгибов валентными углами, они все же не отклоняются сильно от формы вытянутых полочек. По мере удлинения цепей. То есть увеличения молекулярной массы, изгибы цепей все более приближают молекулы к свернутой форме, вначале довольно рыхлой, со многими просветами, через которые может протекать растворитель. Затем изгибы цепей все более экранируют внутренние участки молекулы, и в конце концов, образуется модель беспорядочно свернутого клубка, через который растворитель уже не может протекать,
93

он лишь обтекает такую молекулу, подобно тому, как он обтекает (Дебай и Кирквуд).
Размеры клубка характеризуются квадратом гидродинамического радиуса r 2 , который приблизительно равен 16 h 2 , где h 2 – средний квадрат
расстояния между концами цепи; для вытянутых частиц h 2 и r 2 больше, чем для свернутых молекул. Гибкие цепи образуют непроницаемые для растворителя клубки меньшей длине цепи и меньше молекулярной массе, чем жесткие цепи.
Цветков показал, что многие гибкие макромолекулы уже при молекулярной массе ниже 500000 образуют непроницаемые клубки. Размеры и форма клубка могут изменяться в зависимости от состава среды, так как взаимодействие с растворителем (гидратация или сольватация) изменяет гибкость цепи. От гибкости цепей, размеров и формы молекулярного клубка в растворе зависит осмотическое давление растворов полимеров.
Изменение энергии Гиббса G растворов полимеров |
связано с |
||||||||||||||||
осмотическим давлением и с активностью компонентов раствора: |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
G1 RT ln a1 , |
|
|
|
|
|
|
|
(58) |
|||||
отсюда следует, что осмотическое давление равно |
|
|
|
|
|
||||||||||||
|
|
|
|
RT ln a . |
|
|
|
|
|
|
|
(59) |
|||||
|
|
|
|
|
|
|
v1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Из статической теории растворов полимеров ln a1 |
можно определить по |
||||||||||||||||
уравнению |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT C2 |
RT |
|
RT |
|
1 |
|
|
C |
|
|
|
|||
|
|
|
|
1 2 |
|
|
1 |
|
|
|
|
2 |
, |
(60) |
|||
|
|
2 |
|
2 |
|
||||||||||||
|
C |
|
3 |
|
|
M3 |
|
2 |
1 |
|
|
|
|||||
|
|
|
3M1 2 |
|
M1 1 |
|
|
|
|
|
|
|
|||||
где C – концентрация, г/см3; 1 и 2 – плотности; M1 и M2 – молекуляр-
ные массы, а индексы 1 и 2 относятся соответственно к растворителю и полимеру. При небольших концентрациях последнее уравнение приобретает вид:
|
|
|
|
RT |
|
|
|
RT |
|
1 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
1 |
C2 . |
(61) |
|
C |
2 |
M2 |
|
|
|
2 |
2 |
|||||||||
|
|
|
|
|
|
M1 1 |
|
|
|
|
|||||||
Данное уравнение является основным уравнением, характеризующим |
|||||||||||||||||
осмотическое давление растворов полимеров. |
|
|
|||||||||||||||
Строят зависимость |
|
|
|
|
|
RT 1 |
C2 |
C,% . Полученную прямую |
|||||||||
|
|
C2 |
|
||||||||||||||
|
|
|
|
|
3M |
|
3 |
2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
|
|
экстраполируют до бесконечного разбавления C 0 |
и по отрезку, отсе- |
||||||||||||||||
94
каемому прямой на оси ординат определяют молекулярную массу. По на-
|
RT |
|
1 |
|
|
|
|
клону кривой к оси абсцисс определяют, |
|
1 |
|
|
1 |
, |
откуда легко |
M1 |
2 |
2 |
|||||
|
2 |
|
|
|
|
||
найти константу 1 . Величина 1 для полимеров одного гомологического
ряда или фракций его мало зависит от молекулярной массы, но заметно изменяется с природой растворителя. Величина 1 отражает не только
энергию, но и энтропию взаимодействия с растворителем, то есть включает влияние гибкости.
Если 2 известно, и определено по осмотическим данным, то можно
рассчитать величину ln a1 , а, |
зная ln a1 можно рассчитать и G RT ln a1 . |
||||
|
|
|
P1 |
можно рассчитать и относительную |
|
По уравнению G |
RT ln |
||||
P0 |
|||||
1 |
|
||||
|
|
|
1 |
|
|
упругость пара растворов полимеров. Расслоение раствора полимера или выпадение его из раствора при добавлении не растворяющей жидкости (что изменяет 1 ) происходит только при некотором критическом
значении 1 критич :
|
|
|
|
v1 |
1/ 2 |
2 |
|
|
критич |
1 |
|
|
|
|
, |
(62) |
|
|
|
|
||||||
2 |
1 |
|
|
|||||
|
|
v2 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
где (v1 , v2 ) – отношение парциальных объемов компонентов раствора.
В табл. 3.4.1 приведены значения констант взаимодействия полимера с растворителем.
Таблица 3.4.1 Значения констант взаимодействия полимера с растворителем 1
Полимер |
Растворитель |
1 |
Натуральный каучук |
Бензол |
0,43 |
Натуральный каучук |
Хлороформ |
0,37 |
Натуральный каучук |
CCl4 |
0,28 |
Гуттаперча |
Толуол |
0,36 |
Полистирол |
Толуол |
0,44 |
Этилцеллюлоза |
Этилацетат |
0,35 |
Бензилцеллюлоза |
Анилин |
0,40 |
По Флору и Кригбауму, зависимость / C от концентрации раствора дается уравнением
|
|
RT |
1 A2C A3C |
3 |
... , |
(63) |
C |
M |
|
где A2 и A3 – коэффициенты расположения в ряд по С.
95
Коэффициент A2 включает в себя величину 1 и является параметром,
зависящим от взаимодействия между полимером и растворителем. Для макромолекул, имеющих форму непроницаемого для растворителя клубка, A3 5/8 A22 . В плохих растворителях значение A3C3 мало. Приведенное
выше уравнение Флора и Кригбаум сопоставляют с уравнением концентрационной зависимости светорассеяния:
Hc |
|
1 |
1 2A3C 3A3C |
2 |
... , |
(64) |
|
M |
|
где H – константа, включающая члены, постоянные для данной серии измерений и данной комбинации полимера и растворителя; – мутность раствора.
Зависимость / C от концентрации также подобна зависимости диффузии от концентрации по Флору и Манделькерну:
D |
D0 |
1 2A2C ... |
. |
(65) |
|
|
|
||||
|
|
1 |
K C |
|
|
|
|
|
1 |
|
|
Последние два уравнения позволяют установить общие коэффициенты зависимости от концентрации раствора полимера различных их свойств, и все они показывают отсутствие линейной зависимости от концентрации. Величину гидродинамического радиуса клубка определяют путем сопо-
ставления |
коэффициентов поступательной Dt |
и вращательной D2 |
|||
диффузии |
|
|
|
|
|
|
|
r 2 |
Dt |
. |
(66) |
|
|
|
|||
|
|
|
D |
|
|
|
|
|
r |
|
|
Для проницаемости клубка, через который растворитель протекает, |
|||||
трение |
f |
пропорционально числу звеньев в клубке, то есть молекулярной |
|||
массе, |
в этом случае коэффициент диффузии Dt обратно пропорционален |
||||
молекулярной массе. Для непроницаемого клубка, обтекаемого растворителем, трение зависит от внешних размеров клубка в целом; в этом
случае величина Dt обратно пропорциональна  M . Для ряда линейных полимеров Цветковым было предложено соотношение
M . Для ряда линейных полимеров Цветковым было предложено соотношение
1 |
10,6 10 18 |
|
T |
|
|
|
(r 2 )2 |
|
, |
(67) |
|||
|
|
D |
||||
|
|
0 |
|
|
|
|
где 0 – вязкость растворителя.
Это уравнение позволяет определить гидродинамический радиус макромолекул на основании измерения коэффициента диффузии Dt .
96

В растворителях с более высокой растворяющей способностью молекулярные клубки обладают более вытянутой формой, чем в плохих растворителях.
Много исследований, касающихся, размеров и формы макромолекул, было произведено методом измерений вязкости. Результаты измерений выражают рядом условно принятых характеристик: относительной вязкостью, то есть отношение вязкости раствора к вязкости растворителя
|
|
|
|
|
|
|
|
0 |
отн |
|
; удельной вязкостью, то есть величиной, равной |
1 уд , |
|||
|
|
||||||
|
|
|
|
|
|||
|
0 |
|
0 |
|
приведенной вязкостью или числом вязкости Суд .
Приведенную вязкость часто измеряют при нескольких концентрациях, причем измерения производят в разбавленных растворах, и затем экстраполируют результаты к C 0 ; таким путем получают величину
lim |
|
|
уд |
|
, которая называется предельной приведенной вязкостью |
|
|
|
|
||||
С |
||||||
C 0 |
|
|
|
|||
или характеристической вязкостью.
Штаудингер показал, что удельная вязкость уд разбавленных раство-
ров полимеров пропорциональна молекулярной массе М и концентрации С выраженной в молях мономера цепи Н 1 дм3 раствора:
уд К М С |
|
(68) |
||
или |
|
|
||
|
уд |
К М |
, |
(69) |
|
|
|||
|
С |
|
|
|
где К – константа, характерная для данного гомологического ряда полимеров в данном растворителе.
Например, ряда парафинов вCCl4 K 1,07 10 4 ; для ряда полистиролов в CCl4 K 1,8 10 4 ; для ряда полиоксиметиленов в хлороформе K 1,4 10 4 .
Уравнение Штаудингера позволяет просто определить молекулярную массу полимеров, но это уравнение справедливо только для сравнительно коротких цепей или более длинных, но жестких цепей, которые сохраняют форму вытянутых или слегка изогнутых полочек. В широком диапазоне молекулярных масс и при изменении растворителя константа K изменяется.
При удлинении цепи свертывание молекулы в клубок уменьшает ее сопротивление течению, вследствие чего зависимость вязкости от молекулярной массы отклоняется от прямой пропорциональности
[ ]=K M ,
где – величина, характеризующая свертывание макромолекул в растворе, то есть гибкость цепей.
97
Для жестких молекул, близких к палочкообразной форме, 1, для
гибких молекул, близких к сферической форме =0,5; у сильно заряженных молекул полиэлектролитов 2.
Константы K и определяются для данного ряда полимергомологов в данном растворителе на основании точных измерений величины [ ] и молекулярной массы при помощи методов осмотического давления, светорассеяния и др. нескольких высокоочищенных фракций данного полимера; затем, при известных K и определяют молекулярную массу
Mнепосредственно из измерений вязкости по формуле KM .
Втабл.3.4.2 приведены значения [ ] для некоторых полимеров.
Таблица 3.4.2 Зависимость [ ] от молекулярной массы для некоторых растворов
полимеров
Полимер |
Растворитель |
Темпе- |
[ ] |
Область |
|
|
ратура, |
|
молярных |
|
|
С |
|
масс |
|
|
|
|
M 105 |
Полиизобутилен |
Диизобутилен |
20 |
3,6 104 M 0,64 |
0,05-13,0 |
Натуральный |
Толуол |
- |
5,02 104 M 0,67 |
0,4-15,0 |
каучук |
|
|
|
|
Полистирол |
Толуол |
- |
1,28 104 M 0,70 |
5,5-20,5 |
Поливиниловый |
Вода |
50 |
5,9 104 M 0,67 |
0,44-1,1 |
спирт |
|
|
|
|
Поливинилацетат |
Ацетон |
50 |
2,8 104 M 0,67 |
0,77-8,5 |
Поливинилацетат |
Бутанол |
25 |
4,2 104 M 0,62 |
0,17-12,0 |
Ацетилцеллюлоза |
Ацетон |
25 |
1,49 104 M 0,82 |
0,33-3,9 |
Целлюлоза |
Моноаммиачный |
25 |
0,85 104 M 0,81 |
0,33- |
|
раствор |
|
|
|
Из табл.3.4.2 следует, что для гибких каучуков 0,64, а для жестких молекул целлюлозы и ее производных 0,81. Найдено, что для растворов нитроцеллюлозы в ацетоне 1,0 . Для более низких
молекулярных масс, чем указано в табл.3.4.2, значения приближаются к 1,0. Флору и Фокс указали, что если производить измерения вблизи критической температуры смешивания , когда молекулы полимера находятся на грани выпадения в предельно «плохом» растворителе и поэтому наиболее свернуты, то
K M 0,5 ,
98

|
K 2,1 1021 |
|
r |
3/ 2 |
, а r – гидродинамический радиус молекулярного |
где |
|
|
|
||
|
|||||
|
|
|
|
||
|
|
|
M |
|
|
клубка при температуре .
В этом случае величина r уже не зависит от природы растворителя,
поскольку растворы исследуются в соответственном состоянии. Если подставить в уравнение для значение K , получаем:
|
[ ] |
|
2 / 3 |
|
r |
|
|
. |
(70) |
2,1 10 |
21 |
|||
|
|
|
|
Отношение r , измеренного по последнему уравнению, к теоретическому радиусу r0 сферической свернутой молекулы с данной молекулярной
массой характеризует асимметрию клубка, обусловленную неполной гибкостью молекулярной цепи и природой растворителя. Гибкая цепь в
«плохом» растворителе должна давать r 1,0 ; фактически для полиизо- r0
бутилена в хорошем растворителе – циклогексане было получено
отношение, |
r |
1,5 , для большинства виниловых полимеров |
r |
2,1...2,3; |
|
|
|||
|
r |
r |
||
|
0 |
|
0 |
|
для жестких молекул трибутиратцеллюлозы в метилэтилкетоне отношение r
r0
Значения молекулярной массы, определенные по вязкости и светорассеянию, дают усредненную по массе частиц средневесовую молекулярную массу MG , а значения молекулярной массы, определенные
по осмотическому давлению дают усредненную среднечисловую молекулярную массу Mn . Для высокоочищенных фракционированных препара-
тов полимеров MG Mn ; для неоднородных полимеров MG > Mn .
3.6.Реология растворов полимеров
3.6.1.Ньютоновское и неньютоновское течение разбавленных растворов полимеров
Вязкость разбавленных растворов полимеров зависит от приложенного напряжения сдвига или градиента скорости. Это значит, что разбавленные растворы полимеров могут вести себя как ньютоновские жидкости. Под влиянием приложенного напряжения длинные макромолекулы выпрямляются и ориентируются в потоке. Но тепловое движение нарушает ориентацию макромолекулы, вследствие чего степень ориентации зависит от
99
соотношения интенсивности теплового движения и величины приложенного напряжения сдвига или величины градиента скорости. Чем больше градиент скорости, тем меньше роль теплового движения, тем больше влияние ориентации и тем меньше вязкость. При постоянной температуре интенсивность теплового движения тем больше, чем разбавленье раствор. Поэтому эффект понижения вязкости с увеличением напряжения сдвига нагляднее выражен в более концентрированных растворах полимеров, в которых степень ориентации молекул больше. Коэффициент вязкости с увеличением градиента скорости уменьшается до определенного значения, соответствующего предельной ориентации цепей.
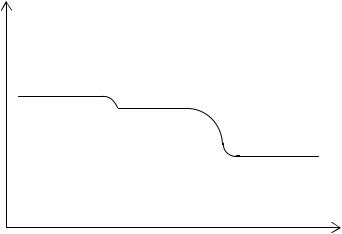
На рис. 3.8 представлена зависимость логарифма вязкости о напряжения сдвига для разбавленных растворов полимеров.
lg
lgGТ
Рис.3.8. Зависимость логарифма вязкости от логарифма напряжения сдвига lgGТ
Начальный участок на полной кривой течения отвечает наибольшей ньютоновской вязкости, а конечный – наименьшей ньютоновской вязкости при определенной ориентации макромолекул. Средний участок соответствует структурной вязкости. При определении характеристической вязкости необходимо проводить измерения в ньютоновских режимах течения.
Это достигается проведением опытов при очень малых |
напряжениях и |
|
скоростях |
сдвига или экстраполяцией полученных |
зависимостей |
lg f |
или lg f GТ к нулевой скорости или к нулевому напря- |
|
жению сдвига.
100
