
1408
.pdfпредложил внести изменения в планетарную модель атома. Эти изменения он сформулировал в виде двух постулатов и правила квантования орбит.
Первый постулат Бора: в атоме существует определённый набор устойчивых, стационарных орбит, двигаясь по которым, электрон не излучает электромагнитную энергию.
Правило квантования орбит: на стационарной орбите момент импульса электрона квантуется (кратен постоянной Планка)
me nrn nh n , 2
где n – номер орбиты электрона (целое число, отличное от нуля); rn – радиус т-й орбиты; n – скорость электрона на этой орбите; me – масса электрона; me nrn – момент импульса электрона на этой орбите; h – по-
стоянная Планка; |
h |
1,05 10 34 Дж с – приведённая постоянная |
|
2 |
|||
Планка. |
|
||
|
|
Второй постулат Бора: атом излучает или поглощает квант электромагнитной энергии при переходе электрона с одной стационарной орбиты на другую.
Находясь на некоторой из таких орбит с номером n , электрон имеет определённую энергию En. Он может перейти на орбиту, имеющую номер m, с большей энергией Em если атомом будет поглощён фотон с энергией, равной Em–En. И наоборот, атом излучает световой квант (фотон) с такой же энергией, если электрон переходит с более удалённой орбиты на орбиту, расположенную ближе к ядру.
Энергия излучённого фотона равна разности энергий стационарных состояний:
hν Em En.
Эти постулаты легли в основу боровской модели атома.
Модель Бора не была квантовой в чистом виде. Наряду с неклассическими, квантовыми представлениями в ней использовались и типично классические (понятие траектории частицы, второй закон Ньютона). Это и ограничило возможность применения модели Бора только простейшей системой – атомом водорода. Тем не менее, успех модели Бора стал ещё одним свидетельством правильности предположения о дискретном, квантовом характере процессов, в которых участвуют микрочастицы. В 1922 г. Бор получил Нобелевскую премию по физике «За заслуги в изучении строения атома», а предложенная им модель атома получила название модели Резерфорда – Бора.
В новых взглядах на процессы в микромире принципиально важной стала идея о возможности изменений физических величин, характеризую-
71
щих микрообъект, лишь в рамках определённого набора «разрешённых» значений этих величин. Постоянную Планка стали рассматривать как величину, определяющую масштаб изменения квантующихся характеристик микрообъектов, как своеобразную порцию воздействия в микромире. Через неё выражаются все характеристики, которыми обмениваются взаимодействующие объекты, если хотя бы один из них относится к микромиру. Поэтому часто постоянную Планка называют ещё квантом действия.
Таким образом, непрерывное изменение физических величин, воспринимавшееся в классической физике как само собой разумеющееся, оказалось неприемлемым при описании микрообъектов.
В классической физике нет принципиального различия между малыми объектами и большими – отсутствует критерий такого различия. С развитием концепции квантования этот критерий появился. Он связан с квантом действия: малые воздействия – это те, которые по порядку величины сравнимы с квантом действия h. Соответственно, к малым объектам относят те, которые реагируют на малые воздействия.
2.2. Спектр атома водорода
Внутреннее состояние атома изучать непосредственно невозможно из-за малости его размеров. Структура атома проявляется только косвенно
вявлениях, связанных с его внутренним строением. К числу этих явлений относится излучение.
При изучении излучения элементов ученым удалось установить общие закономерности в характере спектров и найти ряд эмпирических законов, которым они подчиняются. Было установлено, что спектральные линии всех элементов можно разбить на ряд серий. Структуры соответствующих серий, относящихся к различным химическим элементам, схожи между собой. В пределах одной серии расположение спектральных линий имеет определенный порядок.
Наиболее простым атомом является атом водорода. Он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен модулю заряда электрона, а масса
в1836 раз превышает массу электрона. В начале XIX века были открыты дискретные спектральные линии в видимой части спектра испускания атома водорода. Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра атома водорода, были изучены количественно. В 1885 г. швейцарский физик И. Бальмер пред-
72

ложил эмпирическую формулу, описывающую спектральные линии в видимой части спектра атома водорода:
R 212 n12 ,
где частота; R постоянная Ридберга ( R 3,29 1015 с-1); n 3, 4, 5…
Совокупность спектральных линий атома водорода в видимой части спектра, соответствующих разным значениям n , называется серией Баль-
мера.
Вначале XX века аналогичные серии спектральных линий были открыты в других частях спектра водорода.
Вультрафиолетовой части обнаружена серия Лаймана
|
1 |
|
|
|
|
1 |
|
|
|
|
|
||||||
R |
|
|
|
|
|
|
|
|
|
|
|
|
, где n 2, 3, 4… |
||||
|
|
2 |
n |
2 |
|
||||||||||||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
В инфракрасной части: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
серия Пашена |
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, где n 4, 5, 6… |
||
|
|
|
2 |
|
n |
2 |
|
|
|||||||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
||||
серия Брэкета |
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, где n 5, 6, 7… |
||
4 |
2 |
|
|
n |
2 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
серия Пфунда |
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, где n 6, 7, 8… |
|
|
5 |
2 |
|
|
n |
2 |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
серия Хемфри |
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, где n 7, 8, 9… |
|
|
6 |
2 |
|
|
n |
2 |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Для всех линий спектра атома водорода записывают обобщенную
формулу Бальмера
R m12 n12 ,
где m номер серии ( m 1, 2, 3, 4…); n номер отдельной линии данной серии ( n m 1, m 2 ….).
Сериальные формулы свидетельствуют о существовании физических закономерностей в спектре атома водорода, объяснить которые с помощью классической физики невозможно.
73
2.3. Комбинационный принцип Ритца
Аналогичные спектральные линии имеются не только у атома водорода, а, например, и у щелочных металлов. Расположение спектральных линий у них определяется формулой, аналогичной формуле Бальмера. Частота, соответствующая какой-либо спектральной линии этой серии, является разностью двух величин, одна из которых зависит от номера m серии и постоянная для всех линий данной серии, а другая определяется номером n линии в этой серии. Такая закономерность объясняет, что
частота некоторой спектральной линии часто оказывается равной сумме частот, соответствующих двум другим линиям спектра.
Эта закономерность была установлена экспериментально Ритцем и названа комбинационным принципом, который является основой всей современной спектроскопии.
Комбинационный принцип Ритца: Для каждого атома возможно найти последовательность чисел, называемых спектральными термами, таких, что частоты всех спектральных линий этого атома будут выражаться в виде двух каких-либо спектральных термов:
T1 m T2 n .
Справедливость этого принципа подтверждается многочисленными экспериментальными данными. Обоснование этого принципа связано со строением атома, с процессами, происходящими внутри атома при излучении волн с частотой, соответствующей какой-либо спектральной линии. И только теория Бора, выдвинутая им в 1913 г., выявила значение спектральных законов и показала, что эти законы отражают квантовый характер внутриатомной структуры.
2.4. Энергетический спектр атома водорода
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем, состоящих из ядра с зарядом Ze и одного электрона (например, ионы He+, Li2+).
Следуя Бору, рассмотрим движение электрона в водородоподобной системе, ограничиваясь круговыми стационарными орбитами. Решая совместно уравнение
m |
2 |
|
1 |
|
Ze2 |
|
|
e |
|
|
|
|
r2 |
, |
(2.1) |
|
4 |
|
|||||
r |
|
0 |
|
|
|||
n |
|
|
n |
|
|
||
предложенное Резерфордом, и уравнение me nrn n ,
74

получим выражение для радиуса n-й стационарной орбиты |
|
||
r |
n2 2 4 0 |
, |
(2.2) |
n |
m Ze2 |
|
|
|
e |
|
|
где n 1, 2, 3, ... .
Из формулы (2.2) следует, что радиусы орбит растут пропорционально квадратам целых чисел.
Для атома водорода ( Z 1) радиус первой орбиты электрона (при n 1), называемый первым боровским радиусом, равен
r1 2 4 2 0 0,528 10 10 м mee
Радиус n-й стационарной орбиты
rn r1n2 .
Так как радиусы стационарных орбит измерить невозможно, то для проверки теории необходимо обратиться к таким величинам, которые могут быть измерены экспериментально. Одной из таких величин является энергия, излучаемая и поглощаемая атомом.
Полная энергия электрона E в водородоподобной системе складывается из его кинетической энергии
Eк me2 2
и потенциальной энергии в электростатическом поле ядра
E |
|
1 |
|
|
Ze2 |
. |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
п |
|
|
4 0 rn |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
m 2 |
|
|
|
|
|
|
1 |
|
Ze2 |
|
|
|
|||||
E |
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
4 |
|
r |
|
|
|||||||||||
|
|
2 |
|
|
|
|
0 |
|
|
|
||||||||
Из формулы (2.1) следует, что |
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
m 2 |
|
1 |
|
|
|
|
Ze2 |
|
|
|
|
|
||||||
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
2 4 |
r |
|
|
|
|
||||||||||||
|
2 |
|
|
|
|
|
|
|
|
|||||||||
тогда |
|
|
|
|
|
|
|
|
|
|
|
0 n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
Ze2 |
|
|
|
|
|
Z 2m e4 |
|
|
||||||
E 2 |
|
|
|
|
|
|
|
|
|
|
|
e |
, |
(2.3) |
||||
4 |
0 |
r |
8n2h2 2 |
|||||||||||||||
|
|
|
|
|
|
|
n |
|
|
|
|
0 |
|
|
||||
где n 1, 2, 3, ... .
Полная энергия электрона в атоме отрицательна, так как отрицательна потенциальная энергия электростатического взаимодействия электрона с ядром (электрон в атоме находится в связанном состоянии). С ростом номера орбиты полная энергия электрона в атоме возрастает, причем
75
величина ее может принимать только дозволенные дискретные значения, удовлетворяющие (2.3).
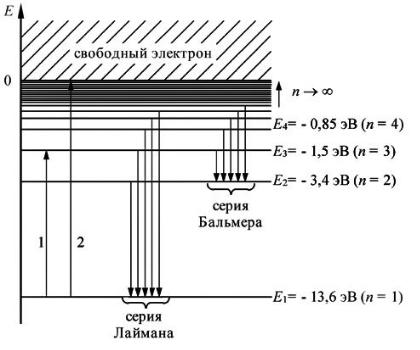
Из формулы (2.3) следует, что энергетические состояния атома водорода образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n . Целое число n в выражении (2.3), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n 1 является основным (нормальным) состоянием; состояния с n >1 являются возбужденными. Для каждого значения n формуле (2.3), можно рассчитать энергетические уровни, схематически представленные на рис. 2.1.
Рис. 2.1. Энергетический спектр электрона в атоме водорода
При n 1 энергия атома водорода минимальна ( E1 13,55 эВ). При n энергия становится максимальной ( E 0 ). Следовательно, значение E 0 соответствует ионизации атома (отрыву от него электрона).
Переход электрона с одного уровня на другой на рис. 2.1 изображен соответствующей стрелкой, начало и конец которой указывают энергетические уровни, между которыми происходит переход.
Примеры решения задач
Пример 1. Вычислите длину волны света, излучаемого атомом водорода при переходе электрона с пятого энергетического уровня на третий. Определите энергию, массу и количество движения испускаемого фотона.
76

Дано: |
|
|
Решение |
|
|
|
||||
n 3 |
Длину волны испускаемого излучения можно |
|||||||||
m 5 |
найти, воспользовавшись сериальной формулой для |
|||||||||
? ; ?; |
водорода ( Z 1) |
|
|
|
|
|
|
|
|
|
m ?; p ? |
1 |
1 |
1 |
|
|
|||||
|
|
|
R |
|
|
|
|
|
, |
(1) |
|
|
|
|
2 |
m |
2 |
||||
|
|
n |
|
|
|
|
|
|||
где R постоянная Ридберга ( R 1,1 107 м); m номер
уровня, на который переходит электрон; n номер уровня, с которого переходит электрон.
Из формулы (1) выразим длину волны
|
|
|
n2m2 |
||
|
|
|
|
. |
|
|
|
R m2 n2 |
|||
|
32 52 |
||||
|
|
|
1,28 мкм. |
||
1,10 107 |
52 32 |
||||
Энергия фотона |
|
|
|
|
|
|
|
|
|
h v h |
c |
, |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
где h – постоянная Планка (h = 6,63 10–34 |
Дж с); |
|||||
волны; длина волны. |
|
|
|
|
||
6,63 10 34 |
3 108 |
1,55 |
10 19 Дж. |
|
|
|
1,28 10 6 |
|
|
||||
|
|
|
|
|
|
|
Масса фотона
m c2 .
m1,55 10 19 1,72 10 35 кг.
3 108 2
Количество движения (импульс) фотона p mc.
p 1,72 10 35 3 108 5,15 10 27 кг м/с.
Ответ: 1,28 мкм; 1,55 10 19
частота световой
Дж; m 1,72 10 35 кг; p 5,15 10 27 кг м/с.
77

Пример 2. Найдите значение кинетической, потенциальной и полной энергии электрона на первой боровской орбите в атоме водорода.
Дано: |
|
|
Решение |
|
e 1,6 10 19 Кл |
Рассмотрим движение электрона по круговым |
|||
m 9,1 10 31 |
кг |
орбитам в атоме |
водорода, состоящем из |
ядра с |
e |
|
зарядом e и электрона с зарядом e . |
|
|
0 8,85 10 12 Ф/м |
|
|||
Стационарная |
электронная орбита представляет |
|||
h 6,62 10 34 Дж·с |
собой устойчивое состояние и определяется условием |
|||
n 1 |
|
квантования Бора |
nh |
|
К ? |
|
|
|
|
|
|
m r 2 , |
(1) |
|
П ? |
|
|
||
Е?
атакже тем, что центростремительная сила равна силе электростатического притяжения между электроном и ядром
m 2 |
|
e2 |
|
|
|
e |
|
|
. |
(2) |
|
4 0r2 |
|||||
r |
|
|
|
Выражая r из формулы (1) и подставляя это выражение в формулу (2), получаем:
|
e2 |
. |
(3) |
|
2n 0h |
||||
|
|
|
Чтобы определить радиусы допустимых орбит, подставим выражение
(3) в (2), тогда
r |
nh |
|
nh2 |
h |
|
h2 |
n2 |
|
|
|
|
0 |
|
|
0 |
|
. |
(4) |
|
2 m |
|
|
|||||||
|
|
2 me2 |
|
m e2 |
|
|
|||
|
|
|
|
|
|
e |
|
|
|
Зная зависимости и r от квантового числа n , получим выражения для кинетической, потенциальной и полной энергии электрона в атоме водорода
K m 2 2
|
m e4 |
|
e2 |
|
|
e2 m e2 |
||
|
e |
; П |
|
|
|
|
|
e |
8n2 02h2 |
4 0r |
|
4 0h2 0n2 |
|||||
|
|
|
|
|||||
|
|
|
|
|
m e4 |
|
||
|
|
Е П K |
|
e |
. |
|||
|
|
8n2 02h2 |
||||||
|
|
|
|
|
|
|||
mee4 ;
4n2 02h2
Знак «–» означает, что электрон находится в связанном состоянии.
K |
|
1,64 10 76 9,1 10 31 |
2,17 10 |
18 |
Дж 13,6 эВ, |
8 |
1 8,852 10 24 6,622 10 68 |
|
|||
|
|
|
|
78

П |
|
9,1 10 31 1,64 10 76 |
4,34 10 |
18 |
Дж 27,2 эВ, |
|
4 |
8,852 10 24 6,622 10 68 |
|
||||
|
|
|
|
|
||
|
|
Е К П 2,17 10 18 Дж 13,6 эВ. |
||||
|
|
Ответ: K 13,6 |
эВ; П 27,2 эВ; Е 13,6 эВ. |
|||
Пример 3. Определите период обращения электрона на первой боровской орбите в атоме водорода и его угловую скорость.
Дано: |
|
|
Решение |
|
r орбиты и |
||||
e 1,6 10 19 Кл |
Используя зависимости |
радиуса |
|||||||
m 9,1 10 31 |
кг |
скорости электрона от главного квантового числа n , |
|||||||
e |
|
|
полученные в предыдущей задаче, |
|
|
||||
0 8,85 10 12 Ф/м |
|
|
|||||||
|
e |
2 |
|
2 |
|
2 |
|||
h 6,62 10 |
34 |
Дж·с |
|
|
, |
r h |
0n |
|
|
2n 0h |
|
||||||||
|
|
|
mee2 |
||||||
n 1 |
|
|
и связь между , и r |
|
|
|
|
|
|
T ? |
|
|
, |
|
|
||||
|
|
|
|
|
|||||
? |
|
|
|
|
|
||||
|
|
|
|
|
|
|
r |
|
|
найдем зависимость периода T обращения электрона и его угловой скорости от главного квантового числа n :
|
|
|
|
e2 m e2 |
|
|
|
|
m e4 |
|
|
|
|||||
|
|
|
|
|
|
e |
|
|
|
|
|
|
e |
|
; |
|
|
|
|
|
|
|
2 |
2 |
|
|
|
3 |
2 |
3 |
|
||||
|
|
|
2n 0hh |
n |
0 |
|
2n |
0h |
|
|
|
||||||
|
T 2 |
2 2n3 02h3 |
|
|
4n3 02h3 . |
|
|||||||||||
|
|
|
|||||||||||||||
|
|
|
|
|
mee4 |
|
|
mee4 |
|
|
|||||||
|
3,14 9,1 10 31 1,64 |
10 76 |
|
|
|
|
16 |
|
-1 |
|
|
|
|
|
|||
|
|
|
4,12 10 |
с |
. |
|
|
|
|
||||||||
2 8,852 10 24 6,623 |
10 102 |
|
|
|
|
||||||||||||
Т |
4 (8,852 ) 10 24 (6,62)3 10 102 |
1,52 10 16 с. |
|
|
|
||||||||||||
|
9,1 10 31 (1,6)4 |
10 76 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ответ: 4,12 1016 |
с-1; Т 1,52 10 16 с. |
||||||||||
Пример 4. Электрон в атоме водорода находится в основном стационарном состоянии. Сравните энергию ионизации атома водорода с кинетической энергией электрона, вращающегося вокруг ядра (учесть, что электрон движется по круговой орбите).
79

n 1 |
Дано: |
|
|
Решение |
|
|
||||
|
|
Сила кулоновского притяжения электрона к ядру |
||||||||
|
K |
? |
|
удерживает электрон на круговой орбите. |
|
|||||
|
|
me n2 |
1 Ze2 |
|
||||||
|
W |
|
(1) |
|||||||
|
ион |
|
|
r |
|
4 |
|
r2 , |
||
|
|
|
|
n |
|
|
0 |
|
n |
|
где |
n линейная |
|
скорость электрона; rn |
радиус |
n-ой орбиты; |
Z |
||||
зарядовое число; e элементарный заряд ( e 1,6 10 19 Кл); 0 электриче-
ская постоянная ( 0 8,85 10 12 Ф/м).
С другой стороны, согласно первому постулату Бора
m r n |
h |
, |
(2) |
e n n |
2 |
|
где n главное квантовое число.
Из уравнений (1) и (2) следует, что n Ze2 . 2 0nh
Кинетическая энергия электрона равна
|
|
|
|
m 2 |
|
|
m e4 |
|
|
|
|
|
|
|
K |
|
|
|
|
e |
. |
|
|
|
|
2 |
8n2 02h2 |
|
|
||||||
|
|
|
|
|
|
|
|
||||
W |
1 |
|
9,1 10 31 12 1,6 10 19 4 |
Дж 2,18 10 18 |
Дж. |
||||||
8 8,85 10 12 2 |
|
|
|
||||||||
к |
|
12 6,62 10 34 2 |
|
|
|
||||||
Энергия ионизации равна энергии поглощаемого кванта |
|
||||||||||
|
|
|
|
W |
h |
c |
, |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
ион |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где h – постоянная Планка; c – скорость света в вакууме; |
1 |
– волновое |
|||||||||
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||
число, которое согласно сериальной формуле для водорода Z 1 равно: |
|||||||||||
1 |
|
1 |
|
1 |
|
|
|
||||
|
|
R |
|
|
|
|
|
, |
|
|
|
|
|
|
2 |
m |
2 |
|
|
||||
|
n |
|
|
|
|
|
|
||||
где R – постоянная Ридберга; n и m – главные квантовые числа, соответствующие энергетическим уровням, между которыми осуществляется переход.
Поэтому
Wион hcR n12 m12 ,
80
