
1287
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
_______________________
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Пензенский государственный университет
архитектуры и строительства» (ПГУАС)
В.Н. Вернигорова, К.Н. Махамбетова
ХИМИЯ В СТРОИТЕЛЬСТВЕ
ЧАСТЬ III
Химия процессов схватывания и твердения портландцемента Химия гидросиликатов кальция
Пенза 2014
УДК 54:69(035.3) ББК 24:38
В35
Рецензенты: проректор по непрерывному образованию Пензенского технологического университета, кандидат технических наук, профессор В.А. Худяков; доктор химических наук, профессор
кафедры «Информационно-вычислитель- ные системы» А.Н. Кошев (ПГУАС)
Вернигорова В.Н.
В35 Химия в строительстве: моногр. / В.Н. Вернигорова, К.Н. Махамбетова. – Пенза: ПГУАС, 2014. – Ч.3. – 131 с.
ISBN 978-5-9282-1116-5 (Ч.3) ISBN 978-5-9282-1091-5
В третьей части монографии рассмотрена химия процессов, приводящих к формированию структуры основного строительного материала – бетона. Подробно изложена химия основного связующего вещества в бетонах – гидросиликатов кальция (ГСК). Приводится классификация ГСК, плотность дислокаций, в них и нанометрический характер их структуры, их переменный состав и нестехиометрия.
Монография подготовлена на кафедре «Технология строительных материалов и деревообработки» и предназначена для студентов, обучающихся по направлению 08.03.01, 08.04.01 «Строительство», аспирантов, преподавателей, научных работников, занимающихся вопросами химии в строительстве.
ISBN 978-5-9282-1116-5 (Ч.3) |
Пензенский государственный университет |
ISBN 978-5-9282-1091-5 |
архитектуры и строительства, 2014 |
|
Вернигорова В.Н., Махамбетова К.Н., 2014 |
|
2 |
ОГЛАВЛЕНИЕ |
|
Глава 5. ХИМИЯ ПРОЦЕССОВ СХВАТЫВАНИЯ И ТВЕРДЕНИЯ |
|
ПОРТЛАНДЦЕМЕНТА................................................................................ |
4 |
5.1. Взаимодействие воды с компонентами бетонной смеси |
|
и процессы схватывания и твердения ................................................... |
4 |
5.2. Взаимодействие добавок ПАВ, апротонных кислот (АК), СП |
|
и ГП с кремнеземистой составляющей дисперсных |
|
строительных систем............................................................................. |
21 |
5.3. Взаимодействие оксида кремния с водой в системе |
|
CaO–SiO2–H2O, формируемой в бетонной смеси .............................. |
28 |
5.5. Скорость реакции в твёрдых фазах .................................................... |
40 |
Глава 6. ХИМИЯ ГИДРОСИЛИКАТОВ КАЛЬЦИЯ. ХИМИЧЕСКАЯ |
|
ОРГАНИЗАЦИЯ И КЛАССИФИКАЦИЯ................................................ |
42 |
6.1. Общие сведения о гидросиликатах кальция (ГСК)........................... |
42 |
6.1.1. Гидросиликаты кальция, синтезируемые в системе |
|
CaO–SiO2–H2O и цементном тесте............................................ |
43 |
6.1.2. Классификация и химическая природа гидросиликатов |
|
кальция ......................................................................................... |
48 |
6.1.3. Гранулометрический состав гидросиликатов кальция |
|
(ГСК) и влияние на него добавок поверхностно-активных |
|
веществ (ПАВ) и апротонных кислот (АК) ............................. |
73 |
6.2. Дислокации и их влияние на структуру ГСК.................................... |
83 |
6.2.1. Плотность дислокаций в структуре ГСК.................................. |
89 |
6.2.2. Роль дислокаций в процессе разрушения материалов .......... |
101 |
6.3. Гидросиликаты кальция – нанокристаллические вещества........... |
103 |
6.3.1. Структурные и фазовые превращения гидросиликатов |
|
кальция ....................................................................................... |
104 |
6.4. Граница раздела в компактируемых наноматериалах.................... |
112 |
6.5. Влияние добавок модифицированных гидросиликатов |
|
кальция на прочность цементного камня.......................................... |
121 |
3

Глава 5. ХИМИЯ ПРОЦЕССОВ СХВАТЫВАНИЯ
ИТВЕРДЕНИЯ ПОРТЛАНДЦЕМЕНТА
5.1.Взаимодействие воды с компонентами бетонной смеси
ипроцессы схватывания и твердения
В соответствии с современными представлениями схватывание и твердение неорганических вяжущих веществ на основе системы CaO SiO2 H2O, в том числе и бетонов, представляют собой сово-
купность двух последовательных процессов, связанных с образованием гидратов и возникновением структуры.
Ни одна из существующих теорий не объясняет, какова истинная роль воды в процессе схватывания и твердения вяжущих. Однако уже на первых порах становления науки о цементах было выдвинуто несколько теорий твердения, основанных на химических представлениях. Менделеев писал, что процесс затвердевания основывается на образовании химических соединений между известью, кремнезёмом, глинозёмом и водой.
Особенно мало изучена связь между структурой твердеющих систем и её прочностью. Систематически этот вопрос начал изучаться с 1956 года.
Формулы, связывающие прочность с водоцементным отношением цементного камня, устанавливаются опытным путём. Это, прежде всего, формула Беляева
|
R0 |
|
R28 |
ц |
, |
a BЦ 3 2 |
которая не содержит физического смысла прочности цементного камня. Константа «а» является чисто эмпирической. Некоторые формулы получены на основании теоретических разработок. Это формулы, предложенные Глуховским, Крыловым и Полищуком
n n0 1 e  1 R R0 1 e
1 R R0 1 e  1
1
R0 n0 Fe const,
4
где n0 – начальное число атомов, вступающих в реакции; – их подвижность; t – время; Fe – прочность единичной связи.
Эти уравнения упрощают сложный процесс твердения бетонных смесей и не учитывают структуру вяжущих на атомном уровне.
Многочисленные экспериментальные данные убедительно показывают, что как в индивидуальной системе CaO SiO2 H2O. так и в компо-
зиционных материалах, содержащих силикаты кальция, или шлаковое вяжущее, или кремнезёмистую составляющую в виде геля SiO2 , или
кварцевого песка, при температурах до 200°С образуются сходные по структуре гидросиликаты кальция (ГСК). Как правило, это твёрдые растворы с различными областями гомогенности с выделением из них фаз с различной степенью конденсации кремнекислородного мотива и в разной степени обогащённых растворенными компонентами CaO и H2O. Области гомогенности – это области валентных насыщений. ГСК
– соединения переменного состава – бертоллиды. Это означает, что механизм образования ГСК единый. Отличие между индивидуальной системой CaO SiO2 H2O и портландцементом заключается в том, что
в системе твёрдые растворы C S H I , C S H II , CSH B образуются в ходе схватывания бертоллидов CaO, SiO2 , H2O . В портланд-
цементе твёрдые растворы алит и белит, уже получены при высоких температурах. Эти твёрдые растворы более дефектны, так как структура их насыщена атомами большого числа элементов периодической системы.
Минералы портландцемента имеют неоднородный гранулометрический состав и являются высокодисперсными материалами. Вода – это жидкость с высокой концентрацией протонов. Все атомы в молекуле воды химически активны. Кристаллические решётки минералов портландцемента содержат все перечисленные выше дефекты, в том числе нанопоры, поры и свободные объёмы. Дефекты кристаллических решёток минералов активируют молекулы воды. В состав кристаллической решётки 3CaO SiO2 входит CaO , поэтому это соединение
неустойчивое, нестехиометрическое. При замешивании минералов портландцемента с водой происходит мгновенный гидролиз C3S;
выделившийся избыточный оксид кальция CaO жадно взаимодействует с водой с выделением тепловой энергии, равной 65,2 кДж/моль, которая превращается в химическую энергию взаимодействия молекул воды с
5
минералами. Капранов полагает, что процесс взаимодействия CaO с водой обусловлен неустойчивостью двухзарядного иона кислорода. Так, сродство атома кислорода к электрону равно
O e O1 2,33 Эв, O e O2 6,76 Эв.
Как видно, сродство атома кислорода ко второму электрону является
величиной отрицательной, и процесс O e O1 сопровождается выделением энергии в количестве 9,09 Эв или 873,62 кДж/моль.
В объёме кристалла ионная пара Ca2+O2 устойчива. На поверхности для отдельно взятой ионной пары характерен электронный переход
O2 e Ca2 e Ca1+O1 6,76 Эв.
Такой электронный переход изменяет состояние ионов на поверхности и снижает энергию их связи с кристаллом ввиду снижения
величины заряда. Уменьшение заряда катиона Ca2 на единицу снижает энергию его связи с кристаллом в 2 раза. Однако энергии, выделяемой при адсорбции молекул воды, недостаточно для преодоления энергетического барьера электронного перехода (3). При адсорбции
молекул на поверхности CaO происходит её ионизация на ионы H и
OH . Образовавшиеся ионы H+ и OH адсорбируются на ионах O2 и
Ca2 . Хемосорбция протона на ионах O2 энергетически более выгодна, чем присоединение его к молекуле воды с образованием иона
гидроксония H3O+ . Сродство к протону молекулы воды равно 760,78 кДж/моль, а сродство протона H+ к электрону составляет 1308,34 кДж/моль. Поэтому при адсорбции ионов H+ на ионах O2 происходит
перенос электрона от кристалла CaO к хемосорбированному иону H+ . Это понижает отрицательный заряд на атоме кислорода, вследствие чего
энергия связи иона Ca2 с кристаллом уменьшается, и он переходит в жидкую фазу. Адсорбция ионов OH на ионах Ca2 может сопро-
вождаться переносом электрона от Ca2 , но может и не сопровождаться этим переносом. Сродство к электрону радикала OH составляет 167,2 кДж/моль и зависит от влияния окружающих ионов. Таким образом, взаимодействие CaO с H2O обуславливается неустойчивостью двухза-
рядного иона O2 и разрыхляющим действием ионов H .
6
+H O
Разложение C3S протекает по схеме Ca5SiO5 2 Ca2SiO4 +Ca OH 2 . Растворимость Ca2SiO4 и образовавшегося Ca OH 2 ничтожна.
Это соединения в воде неустойчивы, их и в природе практически нет; устойчивой является только кристаллическая модификации Ca2SiO4 .
Устойчивыми являются ортосиликаты переходных, дающих слабые основания, металлов, например, Ni2SiO4 , Co2SiO4 , Fe2SiO4 и др.
Известно, что C2S кристаллизуется в моноклинной кристал-
лической решётке с нерегулярной координацией атомов кальция и метастабилен при комнатной температуре. По Гинье и Регуру состав
C2S : Ca2B0,01Si0,99O6 , а по Сузуки – Ca2Al0,06Si0,94O4 , то есть в
действительности в портландцементе C2S представляет собой твёрдый раствор.
Структура C2S состоит из изолированных тетраэдров SiO44 ,
связанных с кальцийкислородными конфигурациями с изменяющейся координацией кальция от 6 до 9. Это очень активное химическое соединение. В момент разложения C3S, после выделения избыточного
количества CaO , триклинная, кристаллическая решётка деформируется и распадается на отдельные фрагменты, которые в момент образования отличаются чрезвычайно высокой химической активностью, особенно по отношению к воде. Минералы C2S и C3S приобретают
кластерную дисперсность. Кластеры образуют с водой межфазную границу раздела и являются высокоактивными адсорбентами. Следовательно, в процессе гидратации структура ортосиликатов C2S
и C3S переходит в слоистую структуру гидросиликатов кальция с высокой степенью конденсации тетраэдров SiO44 . Например, готовой структурной деталью тоберморита является кремнийкислородный радикал Si12O31 14 . Моноклинная и триклинная элементарные ячейки
переходят в более сжатую орторомбическую. Однако кластеры содержат атомы кальция в избытке по сравнению с атомами кремния.
Образовавшиеся в течение 10-13 с, кластеры являются неравновесными и имеют малую продолжительность жизни, поэтому внимание исследователей должно быть сосредоточено на процессах их возникновения и разрушения.
7
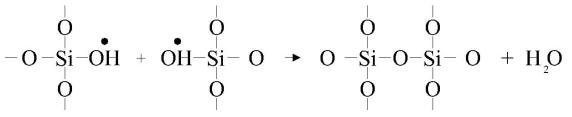
Для получения более или менее стабилизированных стационарных кластеров используют процессы образования новой фазы, которые останавливают их в зародыше, фиксируя тем или иным способом возникающие группы частиц. Именно по этому пути протекает процесс гидратации силикатов портландцемента. В первую очередь кластеры,
имея на поверхности радикальные группы OH , взаимодействуют с водой, при этом происходит ионизация молекул воды. Связывание тетраэдров, близко расположенных друг к другу происходит по схеме
Обрыв гетерогенной радикальной цепи
Образуется радикал Si2O67 , который по Белову при крупных катионах, к которым относятся катионы Ca, K, Na, Th и др. является основной силикатной структурной единицей. Однако молекулы воды не только диссоциируют на ионы H и OH , но и распадаются на
радикалы H и OH . Доказательством существования радикальных стадий являются спектры ЯМР гидросиликатов кальция, приведённые в работе [52]. Более подробно о химической поляризации ядер в химических реакциях изложено в работе [33]. Интенсивная полоса излучения в спектре ЯМР гидросиликатов кальция доказывает, что в процессе их формирования образуются отрицательно поляризованные протоны, а в системе имеется значительное сверхтонкое или контактное магнитное взаимодействие протонов с электронными спинами, принадлежащими свободным радикалам. Можно предположить, что при
диссоциации молекул воды на свободные атомы водорода H и
свободные радикалы OH спины этих радикалов будут ориентированы одинаково и будут, следовательно, складываться. Суммарный спин окажется равным единице. Такое состояние называется триплетным. Молекулы со спином, равным единице, не существуют, поэтому
триплетная радикальная пара из H и OH либо диссоциирует и радикалы расходятся навсегда, либо в радикальной паре происходит
8

изменение электронного спина от единицы до нуля, то есть радикальная пара перейдёт в устойчивое синглетное состояние. В таком состоянии радикальная пара легко рекомбинирует и образует молекулу воды.
Некоторая часть радикальных пар диссоциирует, H и OH расходятся и взаимодействуют с другими частицами системы. Триплет-синглетное
превращение |
радикальной |
пары |
и процесс образования продуктов |
|
превращения |
радикалов |
|
и |
|
H |
OH , избежавших рекомбинации, |
|||
сопровождается выделением энергии, которая передаётся в твёрдую фазу системы и последняя будет возбуждаться и расшатываться.
Самый высокий эффективный заряд имеет атом кремния. Когда молекула воды попадает в деформированный тетраэдр SiO44 , то она
одновременно образует с атомом кремния донорно-акцепторную связь и две водородные связи с атомами кислорода. Так как связь H OH ковалентная, то эти три связи разрывают молекулу воды на радикалы. Эта реакция является экзотермической, базовой, дающей возможность протекания без энергии активации процесса схватывания бетонной
смеси. Возникшие свободные атомы |
|
и свободные радикалы |
|
H |
OH |
вступают в реакции рекомбинации. При этом возможны следующие случаи
9
Здесь Si – короткоживущий центр на атоме кремния;
O – короткоживущий центр на атоме кислорода.
Возникшие радикальные центры вступают в дальнейшее взаимо-
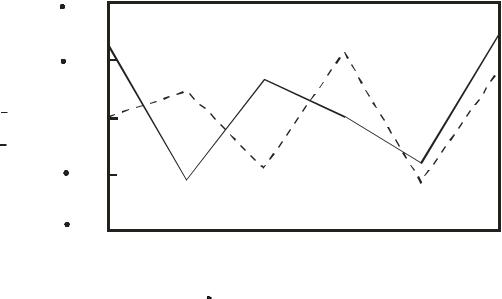
действие с молекулами воды и образование свободных атомов H и свободных радикалов идёт дальше. Возникает обратная связь. Компьютерное математическое моделирование показало, что образование
радикалов |
|
|
|
|
|
||||||||||
H |
и OH носит колебательный характер. Это представлено на |
||||||||||||||
рис. 5.1. |
|
|
|
|
|
|
|
||||||||
|
константы скоростей реакций: |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
kl 2 105 k2 106 k3 106 k4 105 |
k5 105 k6 10 2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис.5.1. Зависимость концентрации радикалов H |
и OH и короткоживущих |
|||||
|
|
Si |
|
|
|
|
радикальных центров… |
|
|
…и O от времени [20-29] |
|||
|
|
|
||||
исходные концентрации: правые части СЛДУ:
0.000025 x 0.000.00
k1 x0 d(t, x)
0 k1
0 k20 k3
(k4 k2) x |
(k5 k3) |
x |
|
|
||
|
|
1 |
|
2 |
|
j(t,d) |
k2 x0 (k4 k2) x1 |
|
|
||||
k3 x0 k5 x2 |
|
|
|
|
||
|
|
|
|
|||
k4 k2 k5 k3 |
|
|
|
|
||
k6 k4 |
0 |
|
|
|
|
|
|
|
|
|
|
||
0 |
k5 |
|
|
|
|
|
|
|
|
|
|
||
10
