
1174
.pdf
13.4. Простейшие......................................................................................... |
120 |
14. РАСЩЕПЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
В АЭРОБНЫХ И АНАЭРОБНЫХ УСЛОВИЯХ..................................... |
122 |
14.1. Окисление углеводородов ................................................................. |
122 |
14.2. Брожение ............................................................................................. |
128 |
14.3. Экосистемы искусственных аэрационных |
|
очистных сооружений........................................................................... |
132 |
ЗАКЛЮЧЕНИЕ................................................................................................ |
138 |
БИБЛИОГРАФИЧЕСКИЙ СПИСОК............................................................ |
139 |
Научное издание
Вилкова Наталья Георгиевна Мишина Светлана Ивановна
ХИМИЯ ПРИРОДНОЙ ВОДЫ. МИКРОБИОЛОГИЯ
Монография
В авторской редакции Верстка Н.А. Сазонова
_____________________________________
Подписано в печать 5.02.2016. Формат 60 84/16. Бумага офисная «Снегурочка». Печать на ризографе.
Усл.печ.л. 8,37. Уч.-изд.л. 9,0. Тираж 500 экз. 1-й завод 100 экз. Заказ № 111.
_________________________________________________________
Издательство ПГУАС. 440028, г. Пенза, ул. Германа Титова, 28
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования «Пензенский государственный университет архитектуры и строительства»
(ПГУАС)
Н.Г. Вилкова, С.И. Мишина
ХИМИЯ ПРИРОДНОЙ ВОДЫ. МИКРОБИОЛОГИЯ
Пенза 2016
144 |
1 |
УДК 543.39(076.5) ББК 44.9.я73
В44
Рецензенты: зав. кафедрой химии, доктор технических наук, профессор Ю.П. Перелыгин (ПГУ); кандидат химических наук, доцент кафедры «Физика и химия» А.В. Нуштаева (ПГУАС)
Вилкова Н.Г.
В44 Химия природной воды. Микробиология: моногр. / Н.Г. Вилкова, С.И. Мишина. – Пенза: ПГУАС, 2016. – 144 с.
ISBN 978-5-9282-1372-5
Рассмотрены свойства, состав природной и сточной воды, а также современные методы водоподготовки.
Монография подготовлена на кафедре физики и химии и предназначена для аспирантов направления подготовки 04.06.01 «Химические науки», профиль подготовки «Коллоидная химия»; 08.06.01 «Техника и технологии строительства», профиль подготовки «Водоснабжение, канализация, строительные системы охраны водных ресурсов». Материал может быть также использован студентами направления подготовки 08.03.01 «Строительство», профиль «Водоснабжение и водоотведение» при подготовке к экзаменам, практическим и самостоятельным работам по дисциплине «Химия воды и микробиология».
Пензенский государственный университет ISBN 978-5-9282-1372-5 архитектуры и строительства, 2016
© Вилкова Н.Г., Мишина С.И., 2016
|
ОГЛАВЛЕНИЕ |
|
ПРЕДИСЛОВИЕ.................................................................................................. |
3 |
|
1. |
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ.......................................... |
4 |
2. |
ФОРМИРОВАНИЕ ПРИРОДНЫХ ВОД .................................................... |
17 |
3. |
ХИМИЧЕСКИЙ СОСТАВ ПРИРОДНЫХ ВОД ........................................ |
22 |
|
3.1. Основное карбонатное равновесие природной воды.......................... |
27 |
|
3.2. Стабильность воды................................................................................. |
31 |
4. |
ЖЕСТКОСТЬ ВОДЫ И МЕТОДЫ ЕЕ УСТРАНЕНИЯ ............................ |
33 |
|
4.1. Реагентные методы умягчения воды.................................................... |
35 |
5. |
ИОНИТЫ. ИОННЫЙ ОБМЕН..................................................................... |
40 |
6. |
ОБЕЗЗАРАЖИВАНИЕ ВОДЫ..................................................................... |
48 |
|
6.1. Хлорирование воды................................................................................ |
48 |
|
6.2. Хлоропоглощаемость воды. Выбор оптимальной дозы хлора......... |
53 |
|
6.3. Озонирование воды................................................................................ |
57 |
7. |
МЕТОДЫ ОЧИСТКИ ВОДЫ....................................................................... |
61 |
|
7.1. Очистка воды коагуляцией.................................................................... |
61 |
|
7.2. Устойчивость коллоидных систем........................................................ |
69 |
|
7.3. Коагулянты, применяемые для очистки воды..................................... |
73 |
|
7.4. Флокулянты............................................................................................. |
75 |
8. |
АДСОРБЦИЯ ................................................................................................. |
78 |
|
8.1. Адсорбция на границе раствор – газ..................................................... |
78 |
|
8.2. Теория полимолекулярной адсорбции и теория БЭТ......................... |
82 |
|
8.3. Адсорбция на поверхности твердых тел.............................................. |
85 |
|
8.4. Практическое применение адсорбции. Адсорбенты........................... |
87 |
9. |
ФЛОТАЦИЯ................................................................................................... |
90 |
|
9.1. Удаление твердых веществ.................................................................... |
90 |
10.СОВРЕМЕННЫЕ МЕТОДЫ ОБРАБОТКИ ВОДЫ.................................. |
92 |
|
|
10.1. Обработка воды магнитным полем..................................................... |
92 |
|
10.2. Коагуляция под воздействием акустических колебаний................. |
93 |
|
10.3. Фильтрация при воздействии акустических колебаний.................. |
94 |
|
10.4. Разделение неоднородных систем (пеногашение) ............................ |
94 |
11. СТОЧНЫЕ ВОДЫ. ИХ СОСТАВ.............................................................. |
96 |
|
12. ХИМИЧЕСКИЕ МЕТОДЫ ОЧИСТКИ СТОЧНЫХ ВОД..................... |
102 |
|
13. МИКРООРГАНИЗМЫ ОЧИСТНЫХ СООРУЖЕНИЙ......................... |
108 |
|
|
13.1. Бактерии............................................................................................... |
108 |
|
13.2. Грибы................................................................................................... |
118 |
|
13.3. Водоросли............................................................................................ |
118 |
2 |
143 |
56.Горленко, В.М. Экология водных микроорганизмов [Текст] / В.М. Горленко, Г.А. Дубинина, С.И. Кузнецов. – М.: Наука. 1977.
57.Готтшалк, Г. Метаболизм бактерий [Текст] /Г.Готтшалк – М.: Мир, 1982.
58.Чурбанова, И.Н. Микробиология[Текст] / И.Н. Чурбанова – М.: Высшая школа, 1987.
59.Мудрецова-Висс, К.А. Микробиология, санитария и гигиена [Текст]
/К.А. Мудрецова-Висс, А.А.Кудряшова, В.П.Дедюхина. – Владивосток: Изд-во ДВГАЭУ, 1997.
60.Ассонов, Н.Р. Микробиология [Текст] / Н.Р. Ассонов. – М.: Колос,
1997.
61.Вербина, Н.М. Микробиология пищевых производств [Текст] / Н.М. Вербина, Ю.В. Каптерева. – М.: Агропромиздат, 1988.
62.Жарикова, Г.Г. Микробиология продовольственных товаров. Санитария и гигиена [Текст] / Г.Г. Жарикова. – М.: ACADEMA, 2005.
63.Никитина, Е. В. Микробиология [Текст]: учебник для вузов / Е.В. Никитина. – СПб.: ГИОРД, 2008.
64.Атлас по медицинской микробиологии, вирусологии и иммунологии [Текст]/ под ред. А.А. Воробьева, А.С. Быкова. – М.: Медицинское информационное агентство, 2003.
65.Коротяев, А.И. Медицинская микробиология, иммунология и вирусология [Текст]: учебник для медицинских вузов: Род Pseudomonas /А.И. Коротяев, С.А.Бабичев. – СПб.: СпецЛит, 2008.
66.Теппер, Е.З. Практикум по микробиологии. [Текст] / Е.З. Теппер, В.К. Шильникова. – М.: Дрофа, 2004.
67.Мишустин, Е.Н. Микробиология[Текст]/ Е.Н. Мишустин, В.Т. Емцев. – М.: Агропромиздат, 1987.
68.Красникова, Л.В. Микробиология[Текст] /Л.В. Красникова. – СПб.: Троицкий мост, 2012.
69.Воробьев, А.В. Микробиология [Текст] / А.В. Воробьев, А.С. Быков, Е.П. Пашков. –М.:Медицина:2003.
70.Нетрусов, А.И. Микробиология [Текст]: учебник для студентов вузов /А.И. Нетрусов , И.Б.Котова. – М.: Академия, 2006.
71.Нетрусов, А.И. Экология микроорганизмов [Текст] / А.И.Нетрусов, Е.А.Бонч-Осмоловская, В.М.Горленко – М.: Издательский центр «Ака-
демия», 2004.
ПРЕДИСЛОВИЕ
Монография предназначена для использования аспирантами направления подготовки 04.06.01 «Химические науки» (профиль подготовки «Коллоидная химия») и направления подготовки 08.06.01 «Техника и технологии строительства» (профиль подготовки «Водоснабжение, канализация, строительные системы охраны водных ресурсов»). Материал может быть также использован студентами второго курса направления подготовки 08.03.01 «Строительство», профиль подготовки «Водоснабжение и водоотведение» для самостоятельной работы и сдачи экзамена по дисциплине «Химия воды и микробиология», студентами второго курса направления подготовки 20.03.01 «Техносферная безопасность» при подготовке к экзаменам по дисциплинам «Коллоидная химия», «Физическая химия».
Монография содержит 14 глав, в которых рассмотрены состав и свойства природной воды и ее важнейшие характеристики: кислотность, щелочность, жесткость воды. Указаны основные анионы и катионы природной воды, растворенные газы. Выделены наиболее распространенные методы обеззараживания воды (хлорирование, озонирование), отмечены их достоинства и недостатки, перспективы дальнейшего использования. Рассмотрены современные методы водоподготовки : ионный обмен, коагуляция примесей. Дана характеристика состава некоторых сточных вод. Рассмотрены методы очистки воды от тяжелых металлов осаждением и теоретические основы обработки воды методом флотации, адсорбции. В последней главе рассмотрена биохимическая очистка воды : аэробное расщепление органических веществ, а также процессы брожения.
142 |
3 |
1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
Вода – вещество привычное и необычное. Известный советский ученый академик И.В. Петрянов свою научно-популярную книгу о воде назвал «Самое необыкновенное вещество в мире». А доктор биологических наук Б.Ф. Сергеев начал свою книгу «Занимательная физиология» с главы о воде – «Вещество, которое создало нашу планету».
Почти 3/4 поверхности планеты занято океанами и морями. Твердой водой – снегом и льдом – покрыто 20 % суши. Из общего количества воды на Земле, равного 1 млрд. 386 млн. кубических километров, 1 млрд 338 млн кубических километров приходится на долю соленых вод Мирового океана, и только 35 млн кубических километров приходится на долю пресных вод. Всего количества океанической воды хватило бы на то, чтобы покрыть ею земной шар слоем более 2,5 километров. На каждого жителя Земли приблизительно приходится 0,33 кубических километров морской воды и 0,008 кубических километров пресной воды. Но трудность в том, что подавляющая часть пресной воды на Земле находится в таком состоянии, которое делает ее труднодоступной для человека. Почти 70 % пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 30 % – в водоносных слоях под землей, а в руслах всех рек содержится одновременно всего лишь 0,006 % пресных вод.
Изотопный состав. Существует девять устойчивых изотопных разно-
видностей воды. Содержание их в пресной воде в среднем следующее:
1Н216О – 99,73 %; 1Н218О – 0,2 %; 1Н217О – 0,04 %. Остальные шесть изотопных разновидностей присутствуют в воде в ничтожно малых количествах.
Чистая вода представляет собой бесцветную прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0°С до 4°С плотность ее также увеличивается. При 4°С вода имеет максимальную плотность, и лишь при дальнейшем нагревании ее плотность уменьшается.
Если бы при понижении температуры и при переходе из жидкого состояния в твердое плотность воды изменялась бы так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались бы до 0°С и опускались на дно, освобождая место более теплым слоям, и так продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру 0°С. Далее вода начала бы замерзать, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы невозможны. Но так как наибольшей плотности вода достигает при 4°С, то перемещение ее слоев, вызываемое охлаждением,
4
36.Кухта, В.К. Биологическая химия [Текст] / В.К. Кухта, Т.С. Морозкина, Таганович. – М.: Бином. Лаборатория знаний, 2008.
37.Северин, Е.С. Биохимия [Текст] / Е.С. Северин. – М.: ГЭОТАР-
Медиа, 2004.
38.Чиркин, А.А. Биохимия [Текст]: учебное пособие для студентов и магистрантов высших учебных заведений по биологическим и медицинским специальностям / А.А.Чиркин, Е.О. Данченко. – М.: Медицинская литература, 2010.
39.Щербак, И.Г. Биологическая химия [Текст]: учебник для медицинских вузов / И.Г.Щербак – СПб.: Издательство СПбГМУ, 2005.
40.Мусил, Я., Современная биохимия в схемах[Текст] / Я. Мусил, О. Новикова, К.Кунц. – М.: Мир, 1984.
41.Страйер, Л. Биохимия [Текст] / Л. Страйер. – М.: Мир, 1984.
42.Шатаева, Л.К. Пептидная саморегуляция живых систем. Факты и гипотезы Текст] / Л.К. Шатаева, В.Х. Хавинсон, И.Ю. Ряднова. – СПб.:
Наука, 2003.
43.Тюкавкина, Н.А. Биоорганическая химия [Текст] / Н.А.Тюкавкина, Ю.И. Бауков. – 4-е изд. – М.: Дрофа, 2005.
44.Глик, Б. Молекулярная биотехнология. Принципы и применение. [Текст] / Б. Глик, Дж.Пастернак. – М.: Мир, 2002.
45.Нетрусов, А.И. Микробиология [Текст] / А.И.Нетрусов, И.Б.Котова. – 4-е изд., перераб. и доп. – М.: Издательский центр «Академия», 2012.
46.Современная микробиология / под ред. Й. Ленгелера, Г. Древса,
Г. Шлегеля. – М.: Мир, 2005. – Т. 1.
47.David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. – Fifth edition. – New York: W. H. Freeman and company, 2008.
48.David E. Metzler. Biochemistry: The Chemical Reactions of Living Cells. 2nd edition. – Academic Press, 2003. – Т. 2.
49.Шлегель, Г. Общая микробиология [Текст] / Г. Шлегель. – М.: Мир,
1987.
50.Лысак, В.В. Микробиология [Текст] / В.В. Лысак. – Минск: БГУ,
2005.
51.Ашмарин, И.П. Молекулярная биология [Текст] / И.П. Ашмарин – Л.: Изд-во ЛГУ.
52.Титова, Н.М. Биохимия и молекулярная биология [Текст] / Н.М. Титова. – Красноярск: ИПК СФУ, 2008.
53.Белясова, Н.А. Биохимия и молекулярная биология [Текст] / Н.М. Белясова. – Минск: БГТУ, 2002.
54.Воробьева, Л.И. Промышленная микробиология [Текст]: учеб. пособие / Л.И.Воробьева. – М.: Изд-во МГУ, 1989.
55.Современная микробиология. Прокариоты [Текст]: в 2-х т. пер. с англ. /под ред. Й. Ленглера, Г. Древса, Г. Шлегеля. – М.: Мир, 2005.
141
20. |
Вилкова, Н.Г. Свойства пен и методы их исследования [Текст] / |
заканчивается достижением этой температуры. При дальнейшем пониже- |
||
Н.Г. Вилкова. – Пенза: ПГУАС, 2014. |
|
нии температуры охлажденный слой, обладающий меньшей плотностью, |
||
21. |
Вилкова, Н.Г. Агрегация гидрофобизованных частиц кремнезема и |
остается на поверхности, замерзает и тем самым защищает лежащие ниже |
||
ее влияние на устойчивость образующихся дисперсных систем [Текст] / |
слои от дальнейшего охлаждения и замерзания. |
|||
Н.Г. Вилкова, О.В.Дорчина, А.А.Шумкина, М.А. Карев // Региональная |
Большое значение в жизни природы занимает и тот факт, что вода |
|||
архитектура и строительство. – 2014. – № 2(19). – С. 30-35. |
|
обладает аномальной теплоемкостью (4,18 Дж/(г·К)). Поэтому в ночное |
||
22. Вилкова, Н.Г. Влияние концентрации твердой фазы на устойчи- |
время, а также при переходе от лета к зиме вода остывает медленно, а днем |
|||
вость пен, стабилизированных твердыми частицами [Текст] / Н.Г. Вилкова, |
или при переходе от зимы к лету так же медленно нагревается, являясь, |
|||
О.В. Дорчина // Elena Gartel – Современные проблемы естествознания: |
таким образом, регулятором температуры на земном шаре. |
|||
сборник докладов научно-методической конференции с международным |
В связи с тем, что при плавлении льда объем, занимаемый водой, |
|||
участием 22-25 октября 2014 г. – Пенза: ПГУАС, 2014. – С. 11-18. |
уменьшается, давление понижает температуру плавления льда. Это выте- |
|||
23. |
Хорн, Р. Морская химия [Текст] / Р.Хорн. – М.: Мир, 1972. |
кает из принципа Ле Шателье. Действительно, пусть лед и жидкая вода |
||
24. |
Рис, Э. Введение в молекулярную биологию: От клеток к атомам |
находятся в равновесии при 0°С. При увеличении давления равновесие, |
||
[Текст] / Э.Рис, М. Стернберг. – М.: Мир, 2002. |
|
согласно принципу Ле Шателье, сместится в сторону образования той |
||
24. |
Коничев, А.С. |
Молекулярная биология [Текст] / А.С.Коничев, |
фазы, которая при той же температуре занимает меньший объем. Этой |
|
Г.А.Севастьянова. – М.: Издательский центр «Академия», 2005. |
|
фазой в данном случае является жидкость. Таким образом, возрастание |
||
25. |
Ленинджер, А. Основы биохимии [Текст] / А.Ленинджер. – М.: |
давления при 0°С вызывает превращение льда в жидкость, а это означает, |
||
Мир, 1985. |
|
|
что температура плавления льда снижается. |
|
26. |
Мецлер, Д. Биохимия. Химические реакции в клетках [Текст] / |
Структура воды. Теперь рассмотрим структуру воды. Молекулы воды |
||
Д.Мецлер. – М.: Мир, 1980. |
|
обладают значительным дипольным моментом. |
||
27. |
Березов, Т.Т. Биологическая химия [Текст] / Т.Т.Березов, Б.Ф.Ко- |
Силовое поле молекул воды резко меняется в зависимости от |
||
ровкин. – М.: Медицина, 1998. |
|
направления. Основные положения современной теории структуры воды |
||
28. |
Основы биохимии [Текст]: в 3-х томах. Т. 2: пер. с англ. / пер. |
были выдвинуты Берналом и Фаулером. |
||
В.П. Скулачева, Э.И. Будовского, Л.М. Гинодмана; под ред. Ю.А. Овчин- |
Кривая интенсивности рассеяния рентгеновских лучей в воде была |
|||
никова. – М.: Мир, 1981 |
|
|
известна из работ ряда других авторов. Бернал и Фаулер, прежде всего, |
|
29. |
Кольман, Я. Наглядная биохимия [Текст] / Я.Кольман, К.Г.Рём. – |
попытались выяснить, какую радиальную функцию распределения нужно |
||
М.: Мир, 2000. |
|
|
подставить в уравнения теории рассеяния рентгеновских лучей, чтобы |
|
30. |
Николаев, А.Я. Обмен и функции углеводов [Текст] / А.Я. Николаев |
получить кривую интенсивности, близкую к экспериментальной кривой. |
||
// Биологическая химия. – М.: Медицинское информационное агентство, |
Сравнение различных функций показало, что более всего подходит функ- |
|||
2004. |
|
|
|
ция, в которой предполагается расположение молекул по типу |
31. |
Жеребцов, Н.А. Биохимия. [Текст] / Н.А.Жеребцов, Т.Н. Попов, |
расположения молекулs SiO в кристаллах кварца. |
||
В.Г.Артюхов. – Воронеж: Изд-во Воронежского государственного универ- |
На рис.1.1 изображена «кварцевая» структура воды по Берналу и |
|||
ситета, 2002. |
|
|
Фаулеру. Каждая молекула воды приближенно может быть представлена в |
|
32. |
Солвей, Дж.Г. |
Наглядная медицинская биохимия |
[Текст] / |
виде шара, на поверхности которого имеются две области с избыточным |
Дж.Г. Солвей. – М.: ГЭОТАР-Медиа, 2011. |
|
положительным зарядом и две области с избыточным отрицательным заря- |
||
33. |
Бохински, Р. Современные воззрения в биохимии [Текст] / Р. Бо- |
дом. Валентный угол НОН равен 105°. Каждая молекула воды связана с |
||
хински. – М.: Мир, 1987. |
|
четырьмя другими молекулами при помощи водородной связи. Расстояние |
||
34. |
Уайт, А. Основы биохимии [Текст] / А.Уайт [и др.]. – |
М.: Мир, |
между центрами соседних молекул равно 2,8 А. Расстояние до следующей |
|
1981. |
|
|
|
ближайшей молекулы (например, расстояние АВ на рис.1.1) равно 4,2 А. |
35. |
Кнорре, Д.Г. Биологическая химия [Текст] / Д.Г.Кнорре, С.Д. Мы- |
Сравнение «кварцевой» структуры воды со структурой льда показы- |
||
зина. – М: Высшая школа, 2000. |
|
вает, что «кварцевая» структура должна быть несколько более плотной. |
||
|
|
|
|
Лёд имеет структуру, сходную со структурой тридимита – одной из моди- |
|
|
140 |
|
5 |
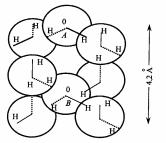
фикаций кремнезема. Молекулы воды в этой тридимитоподобной структу- |
|
|
БИБЛИОГРАФИЧЕСКИЙ СПИСОК |
|
|
||||||
ре также связаны с четырьмя соседями. Но расстояние типа АВ (см. рис. 1.1) |
1. |
Глинка, Н.Л. Общая химия [Текст] / Н.Л.Глинка – Л.: Химия, 1985. |
|
||||||||
равны не 4,2 А, как у воды, а 4,5 А. Это дает увеличение объема примерно |
|
||||||||||
на 17 %. |
2. |
Дерпгольц, В.Ф. Мир воды[Текст] / В.Ф.Дерпгольц – Л.: Недра, 1979. |
|||||||||
|
|
|
3. |
Коровин, Н.В. Курс общей химии [Текст] / Н.В. Коровин. – М.: |
|||||||
|
|
|
|||||||||
|
|
|
Высшая школа, 1990. |
|
|
|
|
|
|||
|
|
|
4. |
Кругляков, |
П.М. Физическая |
и |
коллоидная |
химия |
[Текст] |
/ |
|
|
|
|
П.М. Кругляков, Т.Н. Хаскова. – М.: Высшая школа, 2003. |
|
|
||||||
|
|
|
5. |
Таубе. П.Р. Химия и микробиология воды. химия [Текст] / П.Р.Таубе, |
|||||||
|
|
|
А.Г. Баранова А.Г. – М.: Высшая школа, 1983. |
|
|
|
|||||
|
|
|
6. |
Бондарев,Л.Г. Микроэлементы-благо и зло[Текст] / Л.Г.Бондарев. – |
|||||||
|
|
|
М.:Знание, 1984. |
|
|
|
|
|
|
||
|
|
|
7. |
Щукин, Е.А. Коллоидная химия [Текст] / Е.А. Щукин, А.В. Перцов, |
|||||||
|
|
|
Е.А. Амелина. – М.: Высшая школа, 2004. |
|
|
|
|
||||
|
|
|
|
|
|
|
|||||
Рис. 1.1. «Кварцевая» структура воды |
8. |
Фридрихсберг, Д.А. Курс коллоидной химии [Текст] / Д.А.Фридрих- |
|||||||||
Детальный анализ кривой рассеяния рентгеновских лучей привел |
сберг. – Л.: Химия, 1984. |
|
|
|
|
|
|||||
9. |
Воюцкий, С.С.Курс коллоидной химии [Текст] / С.С.Воюцкий. – М.: |
||||||||||
Бернала и Фаулера к выводу, что в воде одновременно сосуществуют три |
Химия, 1964. |
|
|
|
|
|
|
||||
основные формы расположения молекул: |
10. |
Кругляков, П.М. Физическая |
и |
коллоидная |
химия.Практикум |
||||||
вода I типа льда (тридимита), встречающаяся сравнительно редко и |
[Текст] / П.М. Кругляков, А.В.Нуштаева, Н.Г.Вилкова, Н.В.Кошева. – СПб: |
||||||||||
присутствующая в некотором количестве при температурах ниже 4 °С; |
Лань, 2013. |
|
|
|
|
|
|
||||
вода II типа кварца, преобладающая при обыкновенных температурах; |
11.Шварц, А. Поверхностноактивные вещества [Текст] /А.Шварц, |
||||||||||
вода III типа с распределением молекул, соответствующих плотной |
Дж.Перри. – М.: ИЛ, 1953. |
|
|
|
|
|
|||||
упаковке, как у жидкого аммиака, преобладающая при высоких темпе- |
12. |
Лурье,Ю.Ю. Химический анализ производственных сточных вод |
|||||||||
ратурах в интервале ниже критической точки. |
[Текст] /Ю.Ю. Лурье, А.И.Рыбникова. – М.: Химия, 1974. |
|
|
||||||||
Жидкая вода в различных температурных интервалах не обладает |
13. |
Рубин, |
А.Г. Химия промышленных сточных вод |
[Текст] |
/ |
||||||
разной структурой. При всех температурах жидкость остается однородной, |
А.Г.Рубин. – М.: Химия, 1983. |
|
|
|
|
|
|||||
и только средние взаимные расположения молекул в большей или меньшей |
14. |
Беспамятнов, Г.П. Предельно допустимые концентрации вредных |
|||||||||
степени напоминают воду I, II или III. Переход от воды I к II или III |
веществ в воздухе и воде [Текст] / Г.П. Беспамятнов [и др.]. – Л.: Химия, |
||||||||||
состояния сопровождается повышением вращательного и поступательного |
1975. |
|
|
|
|
|
|
|
|
||
движения молекул и соответствующим понижением дипольных сил сцеп- |
15. |
Доливо-Добровольский, Л.Б. Химия и микробиология воды [Текст] |
|||||||||
ления жидкости и относительным ростом дисперсионных сил. Это след- |
/ Л.Б.Доливо-Добровольский, Л.А.Кульский, В.Ф.Накорчевская. – Киев: |
||||||||||
ствие повышения текучести, но не увеличения объема. Непосредственным |
Вища школа, 1971. |
|
|
|
|
|
|||||
результатом разрушения относительно рыхлой структуры льда (воды I) |
16. |
Голубовская, Э.Г. Биологические основы очистки воды [Текст] / |
|||||||||
является уменьшение объема при переходе к воде II, сопровождаемое |
Э.Г. Голубовская. – М.: Высшая школа, 1978. |
|
|
|
|||||||
увеличением при переходе к воде III, где возрастание среднего расстояния |
17. |
Вилкова, Н.Г. Микробиология [Текст] / Н.Г. Вилкова. – Пенза: |
|||||||||
между соседними молекулами, вызванное тепловым движением, более чем |
ПГУАС, 2000. |
|
|
|
|
|
|
||||
компенсирует геометрическое сжатие при переходе от структуры кварца к |
18. |
Шлегель, Г. Общая микробиология [Текст] /Г.Шлегель – М.: Мир, |
|||||||||
плотно уложенным структурам. |
1987. |
|
|
|
|
|
|
|
|
||
Теория структуры воды была развита Берналом и Фаулером в связи с |
19. |
Возная, Н.Ф. Химия воды и микробиолгия [Текст] /Н.Ф.Возная – |
|||||||||
необходимостью объяснить аномальную подвижность иона водорода в |
М.: Высшая школа, 1979. |
|
|
|
|
|
|||||
водных растворах. С помощью этой теории оказалось возможным вычис- |
|
|
|
|
|
|
|
|
|
||
6 |
|
|
|
|
139 |
|
|
|
|
|
|
ЗАКЛЮЧЕНИЕ
Вмонографии рассмотрено формирование природных вод, предложены способы их классификации по составу и методы обеззараживания воды. Показано, что хотя применение хлора экономически и технологически предпочтительнее, чем озонирование, но экологически целесообразней применение озона в качестве окислителя.
Вмонографии рассмотрена очистка воды коагуляцией. Приведены примеры важнейших коагулянтов, которые применяются в процессе водоподготовки. Предложен модифицированный метод пробного коагулирования, который позволяет более точно определить минимальную дозу добавляемого коагулянта.
Анализ состава сточных вод и физико-химические методы удаления загрязнений является основой для разработки современных технологичных методов обработки воды.
лить полную энергию и дать объяснение ряда других свойств воды и льда. Тем самым теория Бернала и Фаулера получила большую степень достоверности.
Однако в дальнейшем неоднократно высказывалась другая точка зрения. Так, по мнению Эйкена, допущение Бернала и Фаулера о существовании в воде кварцеподобной структуры не вытекает ни из данных по рассеянию рентгеновских лучей, ни из наблюдаемых аномалий. Эйкен предложил свой вариант теории структуры воды, основанный на анализе температурного хода теплоемкости и объема. Согласно Эйкену, в воде имеются устойчивые циклические агрегаты, структура которых сходна со структурой льда, затем изогнутые цепочки молекул воды, связанных водородными «мостами», наконец, в воде присутствуют разомкнутые водородные «мосты». С помощью теории Эйкена были сделаны попытки расчета концентрации сосуществующих структур в воде. С помощью этой теории можно объяснить зависимость аномальной подвижности Н+ ионов в воде от температуры и давления. Однако при ближайшем сопоставлении обнаруживается сходство между теорией Эйкена и теорией Бернала и Фаулера. Оба эти варианта теории структуры воды делают излишними прежние допущения о существовании в воде тригидрола (Н2О)3, дигидрола (Н2О)2 и
гидрола (Н2О).
По более современным моделям атом кислорода, находящийся в центре нелинейной молекулы Н-О-Н имеет на внешних 2s, 2рx, 2ру и 1рz-орби- талях 6 электронов. Таким образом, атом кислорода имеет две орбиты, занятые спаренными электронами, и две связывающие орбиты. Взаимное расположение связывающих орбиталей может меняться, образуя углы от
90 до 180°.
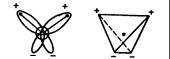
Наиболее распространенной моделью,которая позволяет объяснить многие физико-химические процессы является угловое строение молекулы: входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине – ядро атома кислорода. Межъядерные расстояния О-Н близки к 0,1нм, расстояние между ядрами атомов водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды две электронные пары образуют ковалентные связи О-Н, а остальные четыре электрона представляют собой две неподеленных электронных пары.
Атом кислорода в молекуле воды создают два отрицательных полюса.
Рис.1.2. Схема строения молекулы воды
138 |
7 |
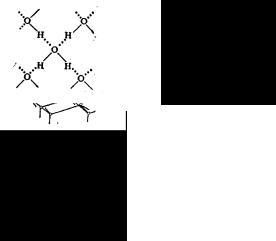
Таким образом, молекула воды полярна, что является причиной особого взаимодействия между разными ее молекулами. Атомы водорода в молекуле воды, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул. Такая химическая связь называется водородной.
В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании водородных связей с соседними молекулами воды согласно схеме, в которой водородные связи обозначены пунктиром. Схема объемной структуры льда изображена на рис.1.3.
Рис. 1.3. Схема объемной структуры льда
Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащих к тому же слою, и с одной – из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы Н2О,как было отмечено ранее.
Установлено, что в модификациях, существующих при низких давлениях, так называемый лед-I, связи Н-О-Н почти прямолинейны. При высоких давлениях обычный лед можно превратить в так называемые лед-II, лед-III так далее – более тяжелые и плотные кристаллические формы этого вещества. Самые твердые, плотные и тугоплавкие пока – лед-VII и ледVIII. ЛедVII получен при высоких давлениях и плавится при температуре +190С. В модификациях лед-VII и лед-VIII достигается самая высокая плотность упаковки: в их структуре две правильные сетки, выстроенные из тетраэдров, вставлены одна в другую, при этом сохраняется система прямолинейных водородных связей.
Вода имеет незакономерно высокие температуры плавления и кипения по сравнению с другими водородными соединениями элементов главной подгруппы VI группы таблицы Менделеева.
8
качество ила и состояние очистки можно, пользуясь упрощенным методом анализа.
Упрощенный анализ состояния активного ила основан на том, что при ухудшении качества очистки в жидкости аэротенка возрастает концентрация растворенных органических веществ. Это приводит к увеличению числа форм, питающихся растворенными веществами, то есть в основном бактерий, грибов и частично жгутиковых. Появление свободноплавающих бактерий в большом числе в свою очередь влияет на состав микрофауны. Преимущественное развитие получают формы простейших. Не имеющих специальных приспособлений для седиментации пищи такие. Как равноресничные инфузории, кругоресничные со слаборазвитым околоротовым полем, корненожки.
При хорошем качестве очистки бактерии в основном содержатся в хлопьях, свободноплаввющих бактерий мало. Простейшие весьма разнообразны, представлены в основном инфузориями, среди которых преобладают брюхоресничные и кругоресничные. Особенно показательны представители рода Vorticella. При хорошей очистке преобладают формы с хорошо развитым околоротовым полем.
При плохом качестве очистки в иловой жидкости содержится много свободноплавающих бактерий. Простейших много, но они представлены малым числом видов. Преобладают мелкие амебы, жгутиковые и мелкие инфузории, преимущественно из отряда равноресничных. Присутствующие вортицеллы имеют слаборазвитое околоротовое поле.
Частый порок развития активного ила – так называемое «вспухание». Оно заключается в том, что в иле в массовом количестве размножаются нитчатые бактерии или грибы. Их длинные пружинящие нити препятствуют осаждению активного ила во вторичном отстойнике, вследствие чего часть ила выносится с очищенной водой. При этом не только загрязняется водоем, но и снижается количество ила, возвращаемого в аэротенк, и, следовательно, концентрация его в аэротенке. Количество загрязнения, приходящегося на единицу ила, возрастает, и качество очистки ухудшается.
Причины развития нитчатых бактерий Sphaerotilus natans достоверно не установлены. Существует мнение, что оно вызывается нарушением технологического режима и, в частности, недостаточной аэрацией. Для борьбы с вспуханием активного ила рекомендуется в течение нескольких дней поддерживать рН стока на уровне 9-9,4 или не выше 5. Можно предотвратить вспухание ила его регенерацией. Причиной развития нитчатых является также нарушение соотношения солей фосфора и азота в очищаемой жидкости.
137
Повышенная концентрация загрязнений приводит к недостатку растворенного кислорода. При этом вортицеллы отрываются от стебелька и образуют особую свобоноплавающую форму с венчиком ресничек на заднем конце.
При дальнейшем снижении концентрации кислорода появляются особи вортицелл, раздувшиеся в виде шара, которые затем лопаются и исчезают, Opercularia – с замкнутым ресничным диском, мелкие, неподвижные коловратки, застывшие в вытянутом состоянии или отмирающие. В большом количестве развиваются жгутиковые; из инфузорий преобладает Paramecium caudatum, как очень выносливая к недостатку кислорода форма, способная развиваться даже в гниющем иле. В большом количестве присутствуют бактерии во взвешенном состоянии. Хлопья ила распадаются. Вода над илом мутнеет.
При низкой концентрации доступных органических веществ в сточной жидкости активный ил испытывает «голодание». При этом наблюдается постепенное мельчание простейших, которые становятся прозрачными, их пищеварительные вакуоли исчезают, а инфузории постепенно превращаются в цисты. В клетках нитчатых серобактерий исчезает сера. Зооглеи и хлопья ила становятся прозрачными, а вода над илом опалесцирует.
Если сточная жидкость содержит избыток солей аммония, в очищаемой воде может образоваться большое количество нитритов и нитратов. Процесс активной нитрификации чаще наблюдается при недостатке органических соединений, но бывает и при очистке сточных вод, богатых органикой, содержащей азот, например, сточных вод от переработки рыбы, свинооткормочного производства и т.п. В случае полной очистки в иле постоянно присутствуют в заметных количествах коловратки (Calladina, Rotaria и другие виды); количественно преобладают Peritrichia (Vorticella convallaria, Carchesium), Arcella, крупные амебы, пышно развиты Zoogloa ratmigera. Возможно присутствие в больших количествах малощетинковых червей Aelosoma. Отсутствуют Chilodon, мелкие амебы, бесцветные жгутиковые. Хлопья ила рыхлые. Характерно всплывание осевшего активного ила.
При залповом сбросе промышленных сточных вод наблюдается уменьшение числа видов. Гидробионты становятся более мелкими,
особенно Vorticella convallaria, Opercularia, Carchesium. Общее количество гидробионтов увеличивается или резко уменьшается в зависимости от степени токсичности стока. Реснички инфузорий останавливаются, ресничный диск оперкулярий закрывается. Вследствие уменьшения числа простейших иногда наблюдается вспышка развития бактерий. Хлопья ила мельчают, плохо осаждаются, в них появляются посторонние включения.
При очистке различных промышленных сточных вод картина активного ила может быть другой. Это необходимо учитывать при оценке качества очистки в аэротенке. Для биологического анализа ила требуется достаточно высокая квалификация исследователя, но приблизительно оценить
136
Таблица 1 . 1 Температуры плавления и кипения некоторых веществ
|
H2Te |
H2Se |
H2S |
H2O |
Температура плавления, С |
-51 |
-64 |
-82 |
0 |
Температура кипения, С |
-4 |
-42 |
-61 |
100 |
При плавлении льда его структура разрушается. Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты, состоящие из большего или меньшего числа молекул воды. Однако в отличие от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах «ледяных» агрегатов могут размещаться: одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает и достигает максимального значения при температуре +4 градуса.
Однако при нагревании выше 4 С преобладает влияние усиления теплового движения молекул и плотность воды уменьшается. Поэтому при 4 С вода обладает максимальной плотностью, как было отмечено ранее.
При нагревании воды часть теплоты затрачивается на разрыв водородных связей (энергия разрыва водородной связи в воде составляет примерно 25 кДж/моль). Этим объясняется высокая теплоемкость воды.
Водородные связи между молекулами воды полностью разрываются только при переходе воды в пар.
Диаграмма состояния воды Диаграмма состояния (или фазовая диаграмма) представляет собой
графическое изображение зависимости между величинами, характеризующими состояние системы, и фазовыми превращениями в системе (переход из твердого состояния в жидкое, из жидкого в газообразное и т.д.).
Примером однокомпонентной системы может служить не только какое-либо простое химическое вещество, но и химическое соединение, которое обладает строго определенным составом во всех агрегатных состояниях. На рис.1.4 схематически изображена диаграмма состояния воды.
Область АОС соответствует области существования воды в твердом агрегатном состоянии, т.е. в форме льда, область АОВ – в жидком, а область ВОС – в газообразном. Каждая точка, находящаяся в поле диаграммы, отражающая соответствующее агрегатное состояние и характеризующаяся параметрами р и t и называется фигуративной. Например, фигуративной точке 1 соответствует жидкая вода, находящаяся при температуре t1 и давлении р1.
9
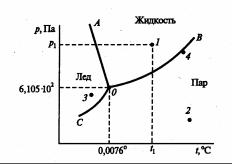
Рис.1.4. Диаграмма состояния воды в области невысоких давлений
Каждая кривая, изображенная на рис. 1.4, отвечает равновесию между соответствующими двумя фазами. Кривая 0В характеризует зависимость давления насыщенного пара жидкой воды от температуры и называется кривой испарения. Кривая ОА – зависимость температуры замерзания воды от внешнего давления и называется кривой плавления. Кривая ОС – зависимость давления насыщенного пара льда от температуры и называется кривой возгонки. Точка О соответствует одновременному существованию трех фаз: воды, пара и льда и называется тройной точкой. Для любой точки однофазной области, т.е. для точек, находящихся между кривыми ОА, ОВ и ОС, исключая сами эти кривые, например, для фигуративных точек 1, 2, 3, число степеней свободы равно 2. Это значит, что в этих областях (АОС, ВОС, ВОЛ) можно изменять независимо и температуру, и давление, при этом число и вид фаз в системе не изменится.
Влюбой точке, лежащей на кривых ОА, ОВ и ОС, например, в точке 4, кроме точки О, число степеней свободы равно 1. Это значит, что можно изменять один из параметров: либо температуру, либо давление, а вторая переменная при этом должна изменяться в соответствии с уравнением Клапейрона-Клаузиуса.
Вточке О в равновесии существуют три фазы и число степеней свободы f = 3-1= 0, т.е. система инвариантна. Это означает, что все три фазы могут находиться в равновесии только при определенных условиях: при 4,579 мм рт.ст. (610 Па) и температуре 0,00760 °С. При атмосферном давлении в присутствии воздуха лед тает при 0 °С, т.е. при более низкой температуре.
Если к этой системе, находящейся при р= 6,1 102 Па, t=0,0076 °С, подводить теплоту, то сначала эта теплота будет расходоваться на плавление льда при p = const до тех пор, пока весь лед не растает. Как только лед растает, в системе будет две фазы (жидкость-пар), она становится моновариантной и при дальнейшем нагревании процесс пойдет в соответствии с кривой испарения OВ. Если, наоборот, в тройной точке
10
Один из весьма распространенных способов изучения микробонаселения любого исследуемого образца – почвы, воды и т.д. – заключается в анализе его бактериального состава по физиологическим группам. Физиологическими группами микроорганизмов называется комплекс организмов, обладающих сходными пищевыми потребностями и растущих в одинаковых условиях. Например, при посеве на мясопептонный агар вырастают в колонии аэробных бактерий, споровых и неспоровых грибов, у которых потребности в пище удовлетворяются за счет пептона; на безазотистой питательной среде растут микроорганизмы, способные усваивать молекулярный азот из воздуха и т.д.
Физиологические группы бактерий активного ила весьма разнообразны. Такие группы, как аммонифицирующие, денитрифицирующие, использующие углеводы и органические соли, целлюлозоразлагающие, содержатся практически в любом активном иле. Для жизнедеятельности нитрифицирующих бактерий необходим ряд условий: достаточно высокая степень очистки и присутствие аммонийных солей. Наконец, специфические бактерии обнаруживаются в аэротенках, очищающих производственные сточные воды: при очистке сточных вод, содержащих фенолы, – фенолразлагающие бактерии, при очистке серосодержащих стоков – тионовые и сульфатредуцирующие, при содержании в сточных водах трудноокисляемых соединений, например, смол, в иле обнаруживаются микроорганизмы, способные к их активному использованию.
Микрофауна активного ила играет роль санитаров: она поддерживает количество микрофлоры в аэротенке на определенном уровне. Микрофауна более, чем микрофлора, чувствительна к химическим и физическим факторам среды, она более подвержена колебаниям при изменении технологического режима, и поэтому микрофауна, и особенно простейшие, служат показателями работы аэротенка. Удовлетворительно работающий активный ил характеризуется большим разнообразием простейших по видовому составу при небольшом количественном преобладании какого-либо из видов. редко встречаются Litonotus, Podophrya, Vorticella microstotma,
жгутиковые и мелкие амебы. Постоянно присутствуют брюхоресничные и кругоресничные инфузории, бактерии – преимущественно в зооглейных скоплениях. Простейшие достаточно подвижны. Хлопья ила плотные, компактные. Ил быстро оседает. Вода над илом прозрачная.
В том случае, когда активный ил не справляется с поступающим загрязнением, биоценоз ила характеризуется малым разнообразием видов при количественном преобладании двух-трех из них. Обычно наблюдается большое количество бесцветных жгутиковых, мелких амеб, Litonotus или мелких инфузорий. Иногда в заметных количествах присутствуют
Podophrya, Chilodon, Nematoda, V. microstoma, Opercularia и нитчатые бактерии. Ил содержит разнообразные включения: органические аморфные частицы, мусор. Хлопья ила темные, плотные, вода над илом опалесцирует.
135
