
2. Аминокислоты → Глутамат → а-Кетоглутарат
Превращение происходит во многих тканях под действием глутаматдегидрогеназы или ами-нотрансфераз.

Пропионил-КоА, а затем и сукцинил-КоА могут образоваться также при распаде высших жирных кислот с нечётным числом атомов углерода.
4. Аминокислоты → Фумарат
5. Аминокислоты → Оксалоацетат
Реакции 2, 3 происходят во всех тканях (кроме печени и мышц), где отсутствует пируват-карбоксилаза, а реакции 4 и 5 - в основном в печени. Реакции 1 и 3 - основные анаплеротические реакции.
2. Реакции образования и иннактивации глутамина Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы): Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3РО4
Накопление
глутамина в клетках нейроглии приводит
к повышению осмотического давления в
них, набуханию астроцитов и в больших
концентрациях может вызвать отёк
мозга.
Основной
реакцией связывания аммиака, протекающей
во всех тканях организма, является
синтез глутамина под действием
глутамин-синтетазы:
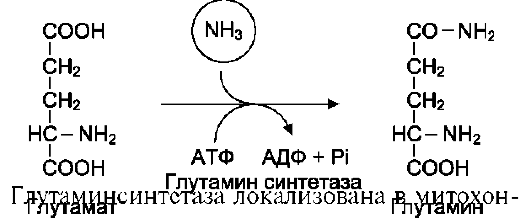
Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщиками глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки.
В
клетках кишечника под
действием фермента глутаминазы происходит
гидролитическое освобождение амидного
азота в виде аммиака:
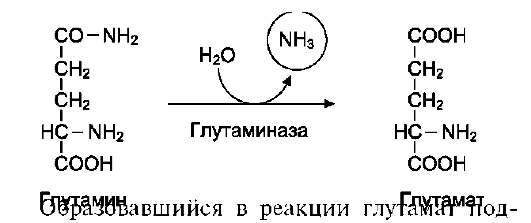 В
почках также
происходит гидролиз глутамина под
действием глутаминазы с образованием
аммиака. Этот процесс является одним
из механизмов регуляции кислотно-щелочного
равновесия в организме и сохранения
важнейших катионов для поддержания
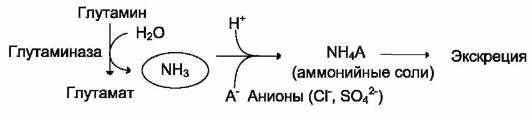
осмотического давления. Глутаминаза
почек значительно индуцируется при
ацидозе, образующийся аммиак нейтрализует
кислые продукты обмена и в виде аммонийных
солей экскретируется с мочой.
Высокий
уровень глутамина в крови и лёгкость
его поступления в клетки обусловливают
использование глутамина во многих
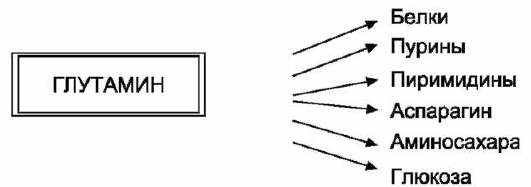
анаболических процессах. Глутамин
- основной донор азота в организме. Амидный
азот глутамина используется для синтеза
пуриновых и пиримидиновых нук-леотидов,
аспарагина, аминосахаров и других
соединений.
В
почках также
происходит гидролиз глутамина под
действием глутаминазы с образованием
аммиака. Этот процесс является одним
из механизмов регуляции кислотно-щелочного
равновесия в организме и сохранения
важнейших катионов для поддержания
осмотического давления. Глутаминаза
почек значительно индуцируется при
ацидозе, образующийся аммиак нейтрализует
кислые продукты обмена и в виде аммонийных
солей экскретируется с мочой.
Высокий
уровень глутамина в крови и лёгкость
его поступления в клетки обусловливают
использование глутамина во многих
анаболических процессах. Глутамин
- основной донор азота в организме. Амидный
азот глутамина используется для синтеза
пуриновых и пиримидиновых нук-леотидов,
аспарагина, аминосахаров и других
соединений.
 Главными
медиаторами ЦНС и головного мозга
являются :
Глутаминовая
кислота (Glu)
– главный возбуждающий медиатор (около
40% всех нейронов); проведение основных
потоков информации в ЦНС (сенсорные
сигналы, двигат. команды, память).
Гамма-аминомасляная
кислота (ГАМК)
– главный тормозный медиатор (также
около 40% всех нейронов); запрет проведения
«ненужной» информации (внимание,
двигательный контроль).
Нормальная
деятельность ЦНС обеспечивается тонким
балансом Glu и ГАМК. Нарушение этого
баланса (как правило, в сторону уменьшения
торможения) негативно влияет на многие
нервные процессы.
Главными
медиаторами ЦНС и головного мозга
являются :
Глутаминовая
кислота (Glu)
– главный возбуждающий медиатор (около
40% всех нейронов); проведение основных
потоков информации в ЦНС (сенсорные
сигналы, двигат. команды, память).
Гамма-аминомасляная
кислота (ГАМК)
– главный тормозный медиатор (также
около 40% всех нейронов); запрет проведения
«ненужной» информации (внимание,
двигательный контроль).
Нормальная
деятельность ЦНС обеспечивается тонким
балансом Glu и ГАМК. Нарушение этого
баланса (как правило, в сторону уменьшения
торможения) негативно влияет на многие
нервные процессы.
БИЛЕТ 6
1. Качественные и количественные характеристики пищевых белков.
Азотистый баланс (количественная характеристика):
В здоровом организме мужчины массой 70 кг величина скорости распада соответствует скорости синтеза и равна 500 г белка в сутки.
Если скорость синтеза белков равна скорости их распада, наступает азотистое равновесие, или, по другому, это состояние, когда количество выводимого азота равно количеству получаемого (Vпоступ= Vвывод).
Если синтез белков превышает скорость их распада, то количество выводимого азота снижается и разность между поступающим азотом и выводимым (Vпоступ > Vвывод) становится положительной. В этом случае говорят о положительном азотистом балансе. Положительный азотистый баланс наблюдается у здоровых детей, при нормальной беременности, выздоравливающих больных, спортсменов при наборе формы, т.е. в тех случаях, когда усиливается синтез структурных и функциональных белков в клетках.
При возрастании доли выводимого азота наблюдается отрицательный азотистый баланс. (Vпоступ < Vвывод) Отрицательный баланс отмечается у больных и голодающих.
Всемирная организация здравоохранения рекомендует принимать не менее 42 г полноценного белка в сутки – это физиологический минимум. Только в этом случае в организме наступает азотистое равновесие.
При приеме 23 г белка с пищей у добровольцев наблюдался отрицательный азотистый баланс, т.е. продолжали преобладать процессы распада белков. Равновесие наступало только при приеме 42 г полноценного белка в сутки, эта величина получила название физиологический минимум. Величина 23 г белка в сутки получила название коэффициент изнашивания.
Полноценность/неполноценность белка (качественная характеристика):
В реальности нормы потребления белка устанавливаются, исходя из представлений о белковом составе пищевых продуктов, о соотношении полноценных и неполноценных белков в рационе. В России нормы суточного поступления пищевого белка установлены
для взрослых на уровне 100-120 г,
для детей 1 года жизни – 2-3 г на кг веса тела,
у старших детей – около 1,5-2 г/кг веса.
Животных белков должно быть не менее 60% от общего количества.
Основной трудностью при расчете нормативов потребления белков является разнообразие их аминокислотного состава и неодинаковая потребность организма в разных аминокислотах. В связи с этим введены критерии качества белка:
соотношение заменимых и незаменимых аминокислот – в белке должно быть не менее 32% незаменимых аминокислот,
близость аминокислотного состава белка к аминокислотному составу усредненного белка тела человека,
легкость переваривания в ЖКТ.
Существует понятие оптимального по всем параметрам идеального белка, к нему наиболее близок белок куриного яйца. Растительные белки считаются неполноценными, так как в их составе мало незаменимых аминокислот, доля тех или иных аминокислот в растительном белке резко отличается от таковой животного белка.
Строение некоторых белков снижает или даже исключает их усвоение: например, плохо переваривается коллаген, белок волос и шерсти кератин вообще не гидролизуется в ЖКТ, т.к. содержит очень много дисульфидных (S-S) связей для расщепления которых у животных нет ферментов.
Указанные 32% незаменимых аминокислот должны поступать в определенном соотношении, чтобы обеспечить синтез белка:
Триптофан : Треонин : Лизин/Валин/Изолейцин : Фенилаланин/Лейцин/Метионин
1 : 2 : 3 : 4,5
Так как аминокислоты необходимы в определенном соотношении, то возникает понятие "лимитирующей аминокислоты", т.е. поступающей в минимальном и недостаточном количестве. Отсутствие этой аминокислоты препятствует использованию (включению в состав белка) других аминокислот, которых может быть достаточно.
✳ У детей при недостатке белка в пище задерживается рост, отстает физическое и умственное развитие, изменяется состав костной ткани, снижается активность иммунной системы и сопротивляемость к заболеваниям, тормозится деятельность эндокринных желез. Выраженным нарушением потребления белков является квашиоркор – нехватка белков, особенно животных, в пище. В результате возникает дисбаланс аминокислотного состава пищи и недостаток незаменимых аминокислот. Заболевание наиболее характерно для слаборазвитых стран Азии и Африки и его начало совпадает с отнятием ребенка от груди матери (1,5-3 годика), когда он лишается полноценного белка и переходит на скудное растительное питание взрослых. У больных наблюдается истощение, остановка роста, отечность, анемия, нарушение интеллекта и памяти, умственная отсталость, гипопротеинемия и аминоацидурия.
2. Химизм и роль непрямого дезаминирвания аминокислот.
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз. Этот перенос называется трансаминирование и его механизм довольно сложен.
В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2").
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О.
При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы в глюконеогенезе. В этом случае количество аминотрансфераз увеличивается под влиянием глюкокортикоидов.
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование.
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой (перейти вверх к ее реакции), которая имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая
тесную связь обоих этапов, непрямое
окислительное дезаминирование называют
трансдезаминирование.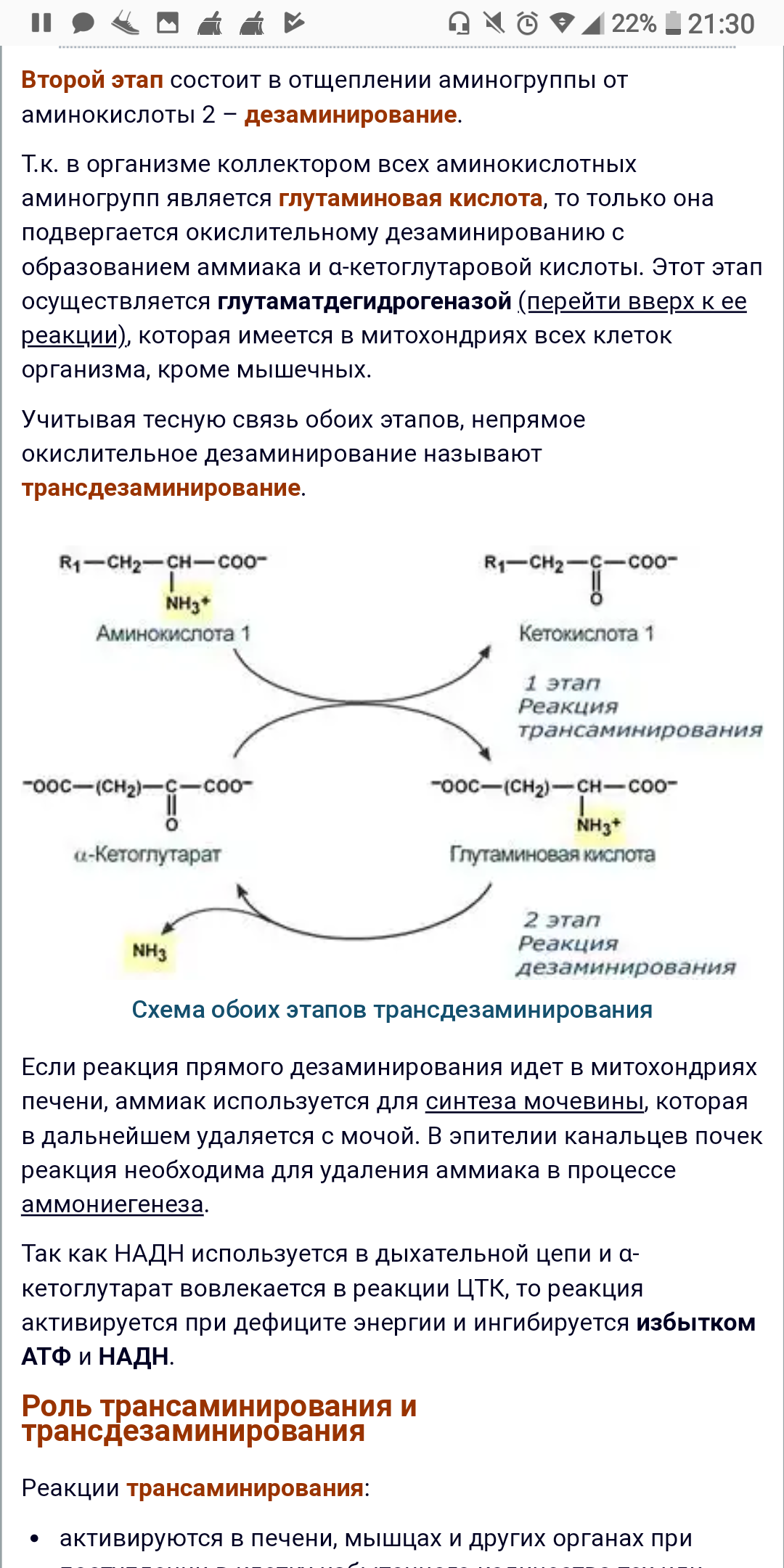
Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Роль трансаминирования и трансдезаминирования
Реакции трансаминирования:
активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
при патологиях (сахарный диабет, гиперкортицизм) обусловливают наличие субстратов для глюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
является одной из транспортных форм аминного азота в гепатоциты,
способна реагировать со свободным аммиаком, обезвреживая его.
Процесс трансдезаминирования идет в организме непрерывно, потому что:
 сопряженные
реакции трансаминирования и дезаминирования
создают поток лишнего аминного азота
из периферических клеток в печень для
синтеза мочевины и в почки для синтеза
аммонийных солей.
сопряженные
реакции трансаминирования и дезаминирования
создают поток лишнего аминного азота
из периферических клеток в печень для
синтеза мочевины и в почки для синтеза
аммонийных солей.
БИЛЕТ 7
Характеристика глутаматдегидрогеназы, ее роль в дезаминировании и аминировании
Восстановительное
аминирование – обратная реакция
кетоглутарата в глутамат, используется
при обезвреживании аммиака, применяется
редко.

Образование аммойных солей, роль процесс
 В
данной реакции нейтрализации глутамин
происходит образование аммонийных
солей. Роль процесса – связывание
аммиака с целью выведения его с мочой
( экскреция), так как обычные катионы
NH4+
практические не проникают через
мембрану).
В
данной реакции нейтрализации глутамин
происходит образование аммонийных
солей. Роль процесса – связывание
аммиака с целью выведения его с мочой
( экскреция), так как обычные катионы
NH4+
практические не проникают через
мембрану).
БИЛЕТ 9
Азотистый баланс: понятие, характеристика.
Азотистый баланс - соответствие между количеством азота поглощённого органом и выделенного из него.
Во всех клетках организма постоянно идут процессы анаболизма и катаболизма. Также как и любые другие молекулы, белковые молекулы в организме непрерывно распадаются и синтезируются, т.е. идет процесс самообновления белков.
Если скорость синтеза белков равна скорости их распада, наступает азотистое равновесие, или, по другому, это состояние, когда количество выводимого азота равно количеству получаемого.
Если синтез белков превышает скорость их распада, то количество выводимого азота снижается и разность между поступающим азотом и выводимым становится положительной. В этом случае говорят о положительном азотистом балансе. Положительный азотистый баланс наблюдается у здоровых детей, при нормальной беременности, выздоравливающих больных, т.е. в тех случаях, когда усиливается синтез структурных и функциональных белков в клетках.
При возрастании доли выводимого азота наблюдается отрицательный азотистый баланс. Отрицательный баланс отмечается у больных и голодающих.
Образование и роль серотонина
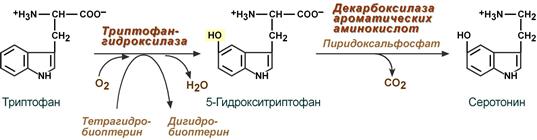
Серотонин активно синтезируется в тучных клетках кожи, легких, печени, в селезенке, ЦНС из триптофана.
Серотонин – биогенный амин, является одним из основных нейромедиаторов. Физиологические функции серотонина чрезвычайно многообразны. Серотонин «руководит» очень многими функциями в организме.
Как нейромедиатор: при активации серотонинэргических путей стимулирует выработку пролактина и некоторых других гормонов передней доли гипофиза.
Как гормон: фактор свертывания (повышает функциональную активность тромбоцитов), участвует в процессах аллергии и воспаления (повышает проницаемость сосудов, усиливает хемотаксис и миграцию лейкоцитов в очаг воспаления, увеличивает содержание эозинофилов в крови, усиливает дегрануляцию тучных клеток и высвобождение других медиаторов аллергии и воспаления), участвует в пищеварении (играет важную роль в регуляции моторики и секреции в желудочно-кишечном тракте, усиливая его перистальтику и секреторную активность + фактор роста для некоторых видов симбиотических микроорганизмов).
БИЛЕТ 11
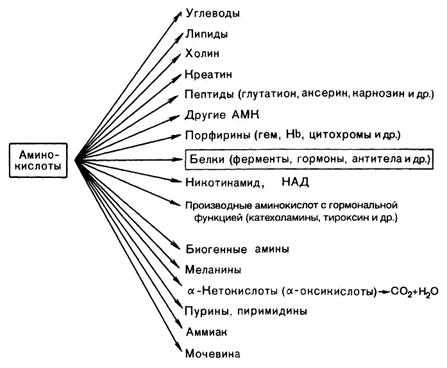
Источники и пути использования АК в организме
Источники АК в клетке - поступление с пищей, из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот, кетокислот. Основным экзогенными источником аминокислот являются белки пищи. Белки переводятся в доступную для организма форму при переваривании под действием протеолитических ферментов, входящих в состав желудочно-кишечных секретов. Свободные аминокислоты всасываются и после транспорта кровью включаются в клетках в различные пути использования. Путь дальнейшего превращения аминокислот зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк.
Пути использования:
1.Синтез собственных белков организма. Скорость синтеза и деградации белка 400 г/сутки у взрослого массой тела 70 кг» Распад катализируют протеиназы (катепсины) и пептидазы. Синтез осуществляется в соответствии с генетической программой. Период полуобновления белков организма около 3 недель.
2. Участие в образовании биологически активных веществ путем декарбоксилирования аминокислот.
3.Глюконеогенез и выработка энергии при использовании альфа-кетокислот, получаемых путем трансаминирования аминокислот.
Орнитиновый цикл: характеристика, роль, химизм реакций, идущих с затратой энергии
Большая часть свободного аммиака, а также аминного азота в составе АК (в основном глутамин, аланин) поступают в печень, где из них синтезируется нетоксичное и хорошо растворимое в воде соединение — мочевина. Мочевина является основной формой выведения азота из организма человека.
Синтез мочевины происходит в цикле, который замыкается орнитином. Цикл открыли в 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт.
Мочевина (карбамид) — полный амид угольной кислоты — содержит 2 атома азота, один из аммиака, другой – из асп.
Реакции орнитинового цикла
Предварительно в митохондриях под действием карбамоилфосфатсинтетазы I с затратой 2 АТФ аммиак связывается с СО2 с образованием карбамоилфосфата:
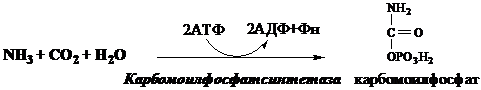
(Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе пиримидиновых нуклеотидов).
1. В митохондриях орнитинкарбамоилтрансфераза переносит карбамоильную группу карбамоилфосфата на орнитин и образуется — цитруллин:

2. В цитозоле аргининосукцинатсинтетаза с затратой 1 АТФ (двух макроэргических связей) связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарная кислота). Фермент нуждается в Mg2+. Аспартат — источник второго атома азота мочевины.

3. В цитозоле аргининосукцинатлиаза (аргининсукциназа) расщепляет аргининосукцинат на аргинин и фумарат (аминогруппа аспартата оказывается в аргинине).

4. В цитозоле аргиназа гидролизует аргинин на орнитин и мочевину. У аргиназы кофакторы ионы Са2+ или Мn2+, ингибиторы - высокие концентрации орнитина и лизина.

Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Регенерация аспартата из фумарата
Фумарат, образующийся в орнитиновом цикле, в цитозоле превращается в ЩУК, который переаминируется с аланином или глутаматом с образованием аспартата. Аланин поступает главным образом из мышц и клеток кишечника:
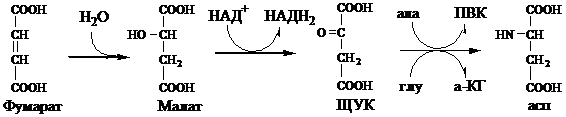
Малат может направиться в митохондрии и включиться в ЦТК.
Пируват, образующийся в этих реакциях из аланина, используется для глюконеогенеза.
Общее уравнение синтеза мочевины:
CO2 + NH3 + асп + 3 АТФ + 2 Н2О → мочевина + фумарат + 2АДФ + АМФ + 2Фн + ФФн

Энергетический баланс орнитинового цикла
На синтез 1 мочевины расходуются 4 макроэргических связи 3 АТФ. Дополнительные затраты энергии связаны с трансмембранным переносом веществ и экскрецией мочевины. Энергозатраты при этом частично компенсируются:
· при окислительном дезаминировании глутамата образуется 1 молекула НАДН2, которая обеспечивает синтез 3 АТФ;
· в ЦТК, при превращении малата в ЩУК образуется еще 1 молекула НАДН2, которая также обеспечивает синтез 3 АТФ;
Орнитиновый цикл в печени выполняет 2 функции:
1. превращение азота АК в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
2. синтез аргинина и пополнение его фонда в организме.
Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Отдельные же ферменты орнитинового цикла обнаруживаются в разных тканях. В энтероцитах, есть карбамоилфосфатсинтетаза I и орнитинкарбамоилтрансфераза, следовательно, может синтезироваться цитруллин. В почках есть аргининосукцинатсинтетаза и аргининосукцинатлиаза. Цитруллин, образовавшийся в энтероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гидролизуется аргиназой. Активность этих рассеянных по разным органам ферментов значительно ниже, чем в печени.
Выделение азота из организма
Азот выводиться из организма с мочой, калом, потом и с выдыхаемым воздухом в виде различных соединений. Основная масса азота выделяется из организма с мочой в виде мочевины (до 90%). В норме соотношение азотсодержащих веществ в моче составляет: мочевина 86%, креатинин 5%, аммиак 3%, мочевая кислота 1,5% и другие вещества 4,5%. Экскреция мочевины в норме составляет 25 г/сут, солей аммония 0,5 г/сут
БИЛЕТ 15
Прямое дезаминирование аминокислот в организме.
Дезаминирование АК — р-я отщепления α-аминогруппы от АК, в результате образуется соответствующая α-кетокислота и выделяется аммиак.
Прямое дезаминирование происходит в 1 стадию с участием одного фермента, повергаются: глу, гис, сер, тре, цис.
Существует 5 видов прямого дезаминирования АК: окислительное; неокислительное; внутримолекулярное; восстановительное; гидролитическое. В тканях человека преобладает окислительное дезаминирование.
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме человека эти ферменты присутствуют, но практически неактивны.
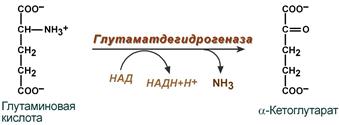
2. Анаэробное прямое окислительное дезаминирование-только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа 1. в качестве кофермента содержит НАД+ или НАДФ+;
2. обладает абсолютной специфичностью;
3. высокоактивна;
4. локализована в митохондриях.
Особенности обмена фенилаланина
Фенилаланин-незаменимая АК. В организме используется только в синтезе белков, весь неиспользованный запас АК превращается в тирозин благодаря ферменту фенилаланин-4-монооксигеназе (фенилаланингидроксилазе- обеспечивающей окисление ароматического кольца). При врожденном дефекте данного фермента развивается заболевание фенилкетонурия, при котором фенилаланин переходит в токсичные для ткани мозга соединения фенилпируват, фенилацетат. А возникающий дефицит тирозина блокирует синтез нейромедиаторов. Фенилкетонурия сопровождается развитием слабоумия (фенилпировиноградная олигофрения).
+ участвует кофермент тетрагидробиоптерин, который в реакции окисляется до дигидроформы. Восстановление кофермента осуществляет дигидробиоптерин-редуктаза с своим коферментом НАДФН.
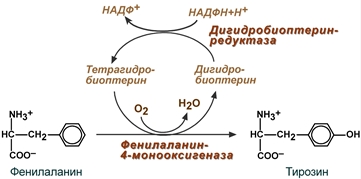
Необходимый участник - кислород. Образуется еще один продукт реакции - вода.
БИЛЕТ 16
Источники свободных аминокислот и пути их использования в организме
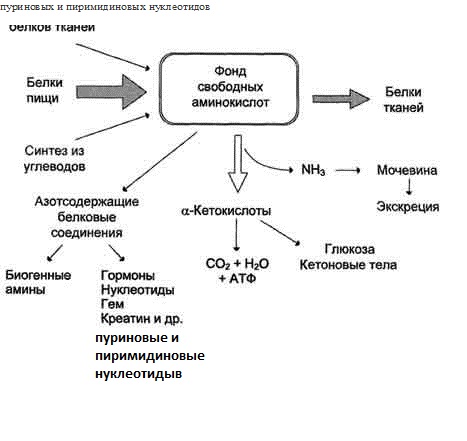
Главным путь испол-я - синтез собственных белков. АК используются для синтеза других азотсодержащих соединений, например таких, как тироксин, адреналин, гистамин, выполняющих специфические функции. Аминокислоты используются также как источники энергии, включаясь в путь катаболизма.
В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Остальные поступают с пищей
Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 3565 мг/дл.
Просто прочитать!!!!В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
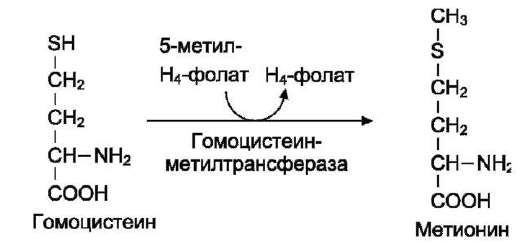
Особенности обмена метионина.
Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции.
Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение.
Активной формой метионина является S-аде-нозилметионин (SAM) - сульфониевая форма аминокислоты
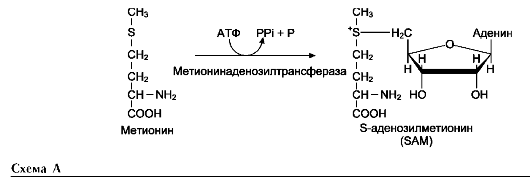
Примеры реакций трансметилирования
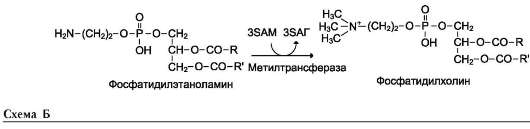
Синтез фосфатидилхолина из фосфатидилэтиноламина
Фосфатидилхолины (лецитины) - наиболее распространённая группа глицерофосфоли-пидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов
Синтез карнитина
Карнитин - переносчик жирных кислот через мембрану митохондрий
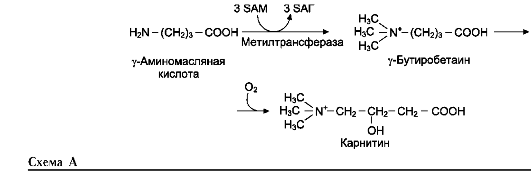
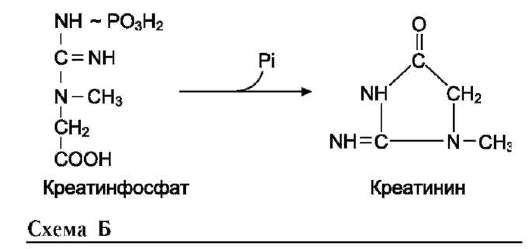
Синтез креатина
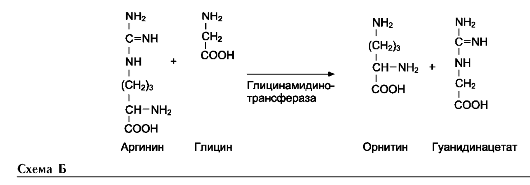
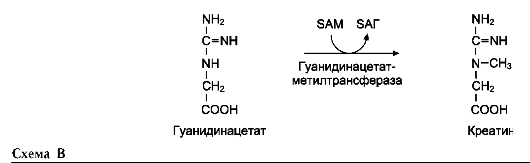
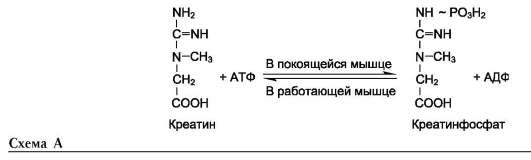
Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидин-ацетат при действии глицинамидинотрансферазы
Определение содержания креатина и креа-тинина в крови и моче используется для характеристики интенсивности работы мышц в спортивной медицине и при некоторых патологических состояниях. Определение активности фермента креатинкиназы и его изоферментных форм в крови используется в медицине для диагностики таких заболеваний, как инфаркт
 Регенерация
метионина
Регенерация
метионина
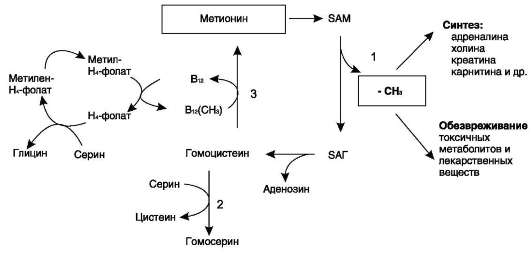 1
- реакции трансметилирования; 2 - синтез
цистеина; 3 - регенерация метионина.
1
- реакции трансметилирования; 2 - синтез
цистеина; 3 - регенерация метионина.
БИЛЕТ 17
Трансаминирование. Характеристика аминотрансфераз, клинико-диагностическое определение, значение определения их активности.
Трансаминирование аминокислот. Реакция заключается в том, что аминокислота и кетокислота обмениваются друг с другом своими функциональными группами при альфа-углеродном атоме. В результате вступившая в реакцию аминокислота превращается в соответствующую альфа-кетокислоту, а кетокислота становится аминокислотой.
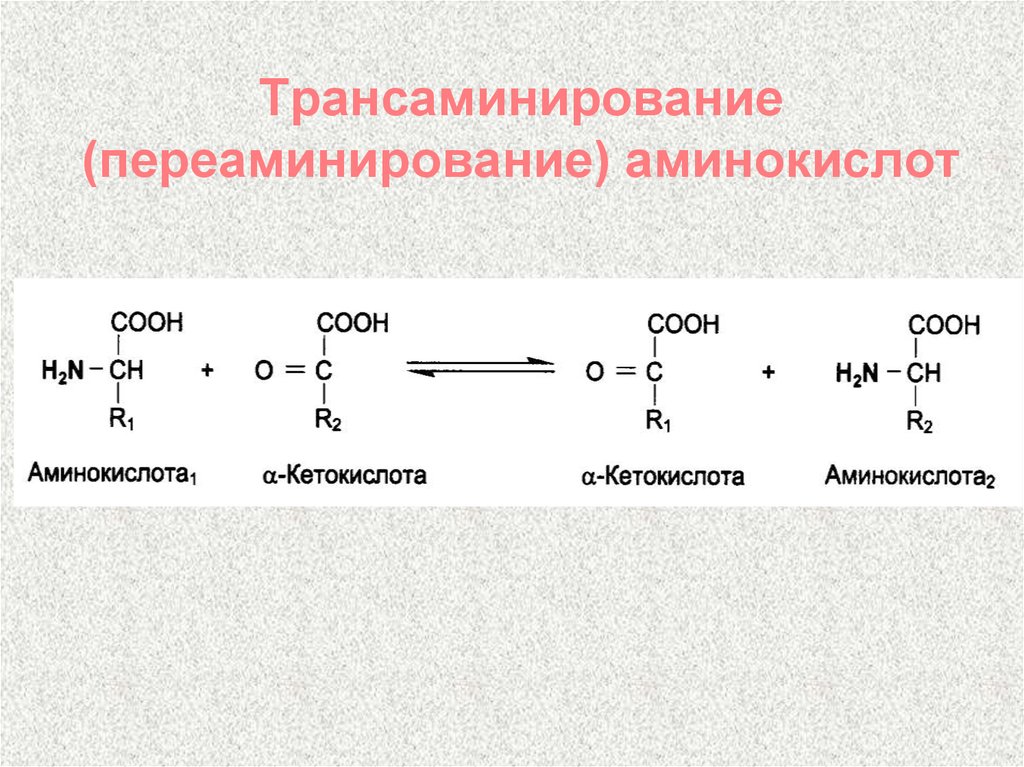
Эту реакцию катализируют ферменты под названием ТРАНСАМИНАЗЫ (АМИНОТРАНСФЕРАЗЫ). Коферментом всех трансаминаз является активная форма витамина В6 - пиридоксальфосфат (фосфопиридоксаль).

В клетках сердечной мышцы (миокарда) содержится гораздо больше АсТ, чем АлТ, а в клетках печени - наоборот: АлТ намного больше, чем АсТ. Поэтому ПРИ ИНФАРКТЕ МИОКАРДА АКТИВНОСТЬ АСТ в крови БУДЕТ ЗНАЧИТЕЛЬНО ВЫШЕ, ЧЕМ АЛТ, А ПРИ ВИРУСНОМ ГЕПАТИТЕ АКТИВНОСТЬ АЛТ БУДЕТ ВЫШЕ, ЧЕМ АСТ.
Поэтому определение активности этих ферментов в крови помогает врачам в постановке правильного диагноза.
Транспорт аминокислот с помощью гамма-глутамильного цикла.
γ-глутамильный цикл переносит некоторые нейтральные аминокислоты (фенилаланин, лейцин) и аминокислоты с катионными радикалами (лизин) в кишечнике, почках и, по-видимому, мозге.
В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные — в цитозоле. Мембранно-связанный фермент γ-глутамилтрансфераза (гликопротеин) катализирует перенос γ-глутамильной группы от глутатиона на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Амнокислота отщепляется от у-глутамильного остатка под действием фермента у-глутамилциклотрансферазы.
Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты — цистеин и глицин. В результате этих 3 реакций происходит перенос одной молекулы аминокислоты в клетку (или внутриклеточную структуру). Следующие 3 реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной молекулы аминокислоты с участием у-глутамильного цикла затрачиваются 3 молекулы АТФ.

Поступление аминокислот в организм осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30—50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Аминокислоты при всасывании конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина
