
БИЛЕТ 1(21)
Проферменты пептидаз ЖКТ,механизмы перевода их в активное состояние.
Активация пепсина: под действием гастринов в главных кл.желудочных желез стимулируется синтез и секреция пепсиногена. Под действием НСl пепсиноген прерващается в пепсин(оптимум pH 1,0-2,5). В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляется 42 АК-остатка,которые содержат в основном положительно-заряженные АК,следовательно в пепсине преобладают отрицат.заряж.АК. Активные молекулы пепсина активируют остальные молекулы пепсиногена(аутокатализ).
Пепсин-гидролизует пептидные связи в белках,образованные ароматич.АК(фен,три,тир). Пепсин-эндопептидаза,в рез-те его действия в желудке образуются более короткие пептиды,но не свобод.АК.
Гастриксин-синтезируется главными кл.желудка в виде профермента и активируется НС|,оптимум рН 3,2-3,5,значение имеет при питании молочно-растительной пищей.является эндопептидазой,гидролизует связи,образованные карбоксильными гр.дикарбоновых АК.
Активация панкреатических ферм.: в поджелудочной железе синтезируются проферменты ряда протеаз:трипсиноген,химотрипсиноген,проэластаза,прокарбоксипептидазы А и В.
Трипсиноген под действием энтеропептидазы,которая отщепляет с N-конца гексопептид вал-(асп)4-лиз,превращ-ся в трипсин. Трипсин путем активации превращается в химотрипсин и путем частичного протеолиза в эластазу и карбоксипептидазу А и В.
Образование, биологическая роль и инактивация гистамина.
Реакция образования гистамина активно идет в тучных клетках легких,кожи,печени,базо- и эозинофилах. В них гистамин синтезируется и накапливается в секретор.гранулах.

В кровь гистамин выделяется при повреждении ткани, при ударе, при электрич.раздражении, при аллергич.реакции
Физиологич.роль-медиатор воспаления, аллергич.реакций, пищ.гормон.
Функции:стимулирует секрецию желудочного сока и слюны,повышает проницаемость капилляров,вызывает отеки,снижает АД,сокращает гладкую мускулатуру легких,вызывает удушье,является медиатором боли.
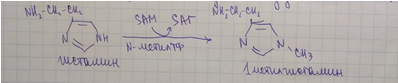
Инактивация: происходит метилированием с участием SAM под действием метилтрансферазы
БИЛЕТ 2(22)
Прямое дезаминирование аминокислот в организме. Химизм процесса, биологическая роль.
ДЕЗАМИНИРОВАНИЕ — один из основных этапов обмена азотистых соединений; представляет собой процесс отщепления аминогруппы (NH2-группы) от органических соединений и замещения на какую-либо другую функциональную группу.
Прямому дезаминированию повергаются глу, гис, сер, тре, цис.
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное).
1. Анаэробное окислительное дезаминирование - самый активный вид прямого дезаминирования АК. Наиболее активно таким образом дезаминируется глутамат.
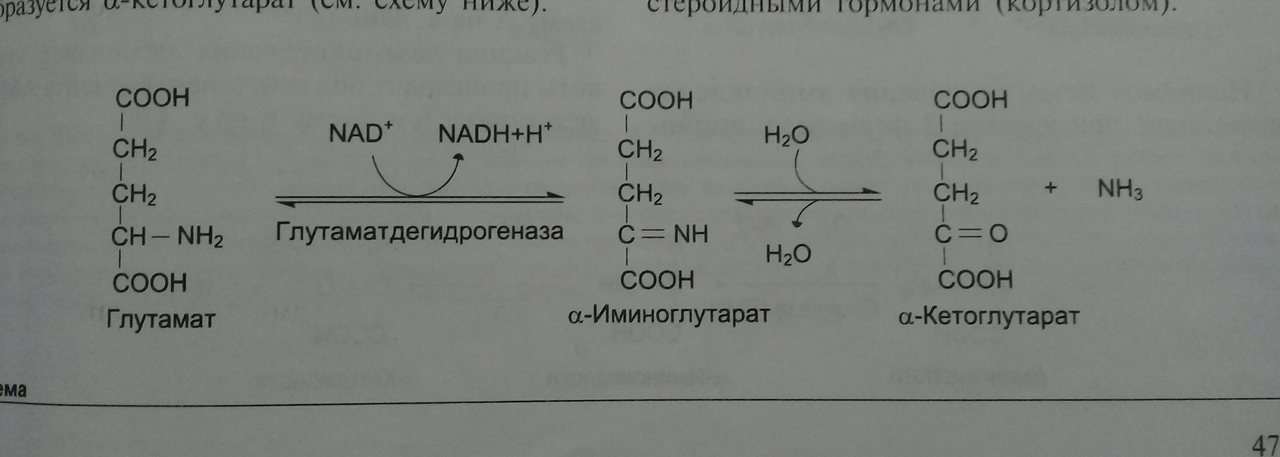
ГлутаматДГ – очень важный фермент, т.к. является регулятором аминокислотного обмена. АТФ, ГТФ, NADH – его аллостерические ингибиторы, диссоциируют фермент и угнетают его активность. АДФ – наоборот, активатор. ТАКИМ ОБРАЗОМ, низкий энергетический баланс (много АДФ) стимулирует разрушение АК и образование a-кетоглутарата, который идет в ЦТК в качестве энергетического субстрата.
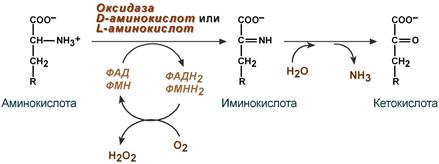
2. Аэробное окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме человека эти ферменты присутствуют, но практически неактивны. ПЕРЕКИСЬ ПОД ДЕЙСТВИЕМ КАТАЛАЗЫ ПРЕВРАЩАЕТСЯ В ВОДУ И КИСЛОРОД. ВОДА ИДЕТ В СЛЕДУЮЩУЮ РЕАКЦИЮ!
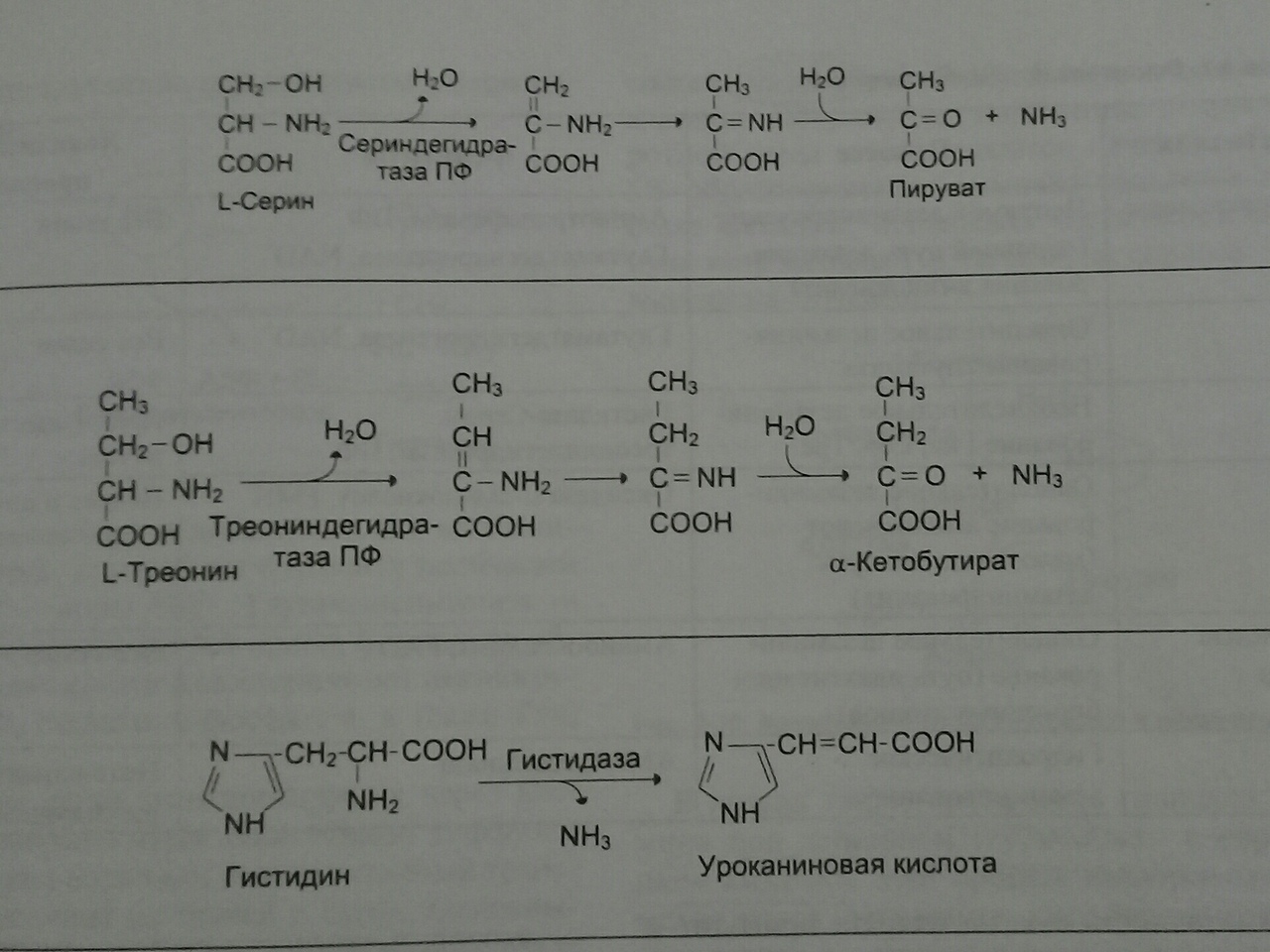
Неокислительное дезаминирование. В печени человека присутствуют специфические пиридоксальфосфатзависимые (ВИТАМИН В6) ферменты сериндегидратаза, треониндегидратаза, катализирующие реакции неокислительного дезаминирования аминокислот серина и треонина
Биологическая роль: Все образующиеся альфа-кетокислоты легко расщепляются дальше до СО2 и Н2О (например, аланин превращается в ПВК (путем дезаминирования; аспартат - в ЩУК; глутаминовая кислота - в альфа-кетоглутаровую). Большинство альфа-кетокислот тем или иным путем превращаются в кислоты, которые являются промежуточными метаболитами ЦТК: в альфа-кетоглутаровую, янтарную, фумаровую, щавелево-уксусную. Все эти метаболиты могут в организме трансформироваться в углеводы, перед этим превращаясь в ПВК. Поэтому большинство аминокислот относится к группе, которая называется ГЛИКОГЕННЫМИ АМИНОКИСЛОТАМИ (их 17). Только 3 аминокислоты не могут превращаться в ПВК, но превращаются в Ац-КоА - КЕТОГЕННЫЕ АМИНОКИСЛОТЫ: лейцин, лизин, триптофан). Они могут прямо трансформироваться в жирные кислоты или в кетоновые тела.

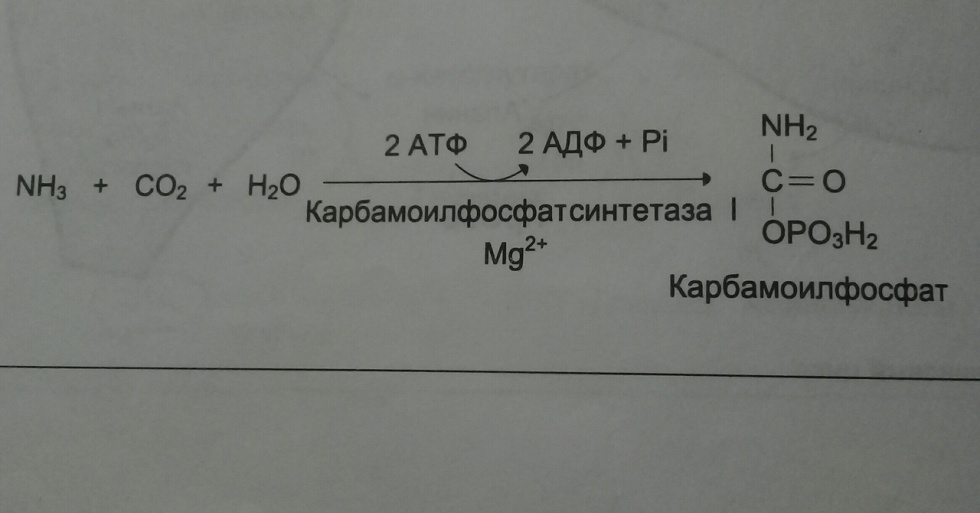
Строение мочевины, источники атомов азота и углерода. Диагностическое значение определения мочевины в биологических жидкостях.
Мочевина – основной конечный продукт азотистого обмена. Синтезируется в печени.
Синтез мочевины наз «Орнитиновый цикл» или «малый цикл Кребса».
Источником
1 атома азота в мочевине является аммиак,
который в печени связывается с СО2 с
образованием карбамоилфосфата.
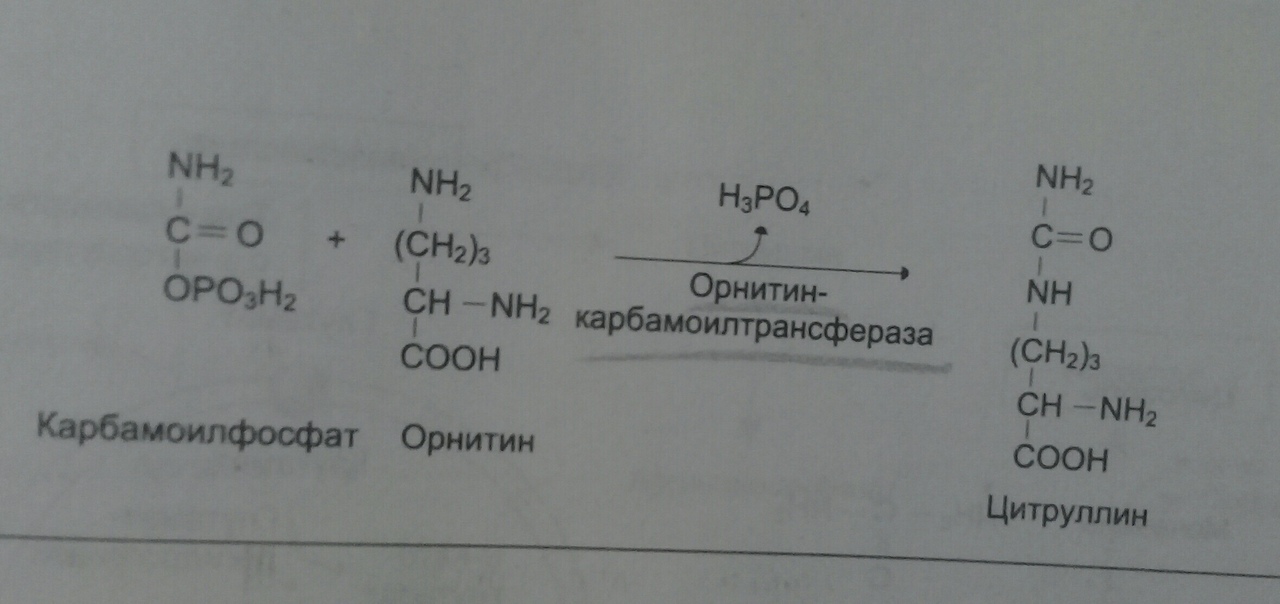
Аспартат – источник 2 атома азота в мочевине


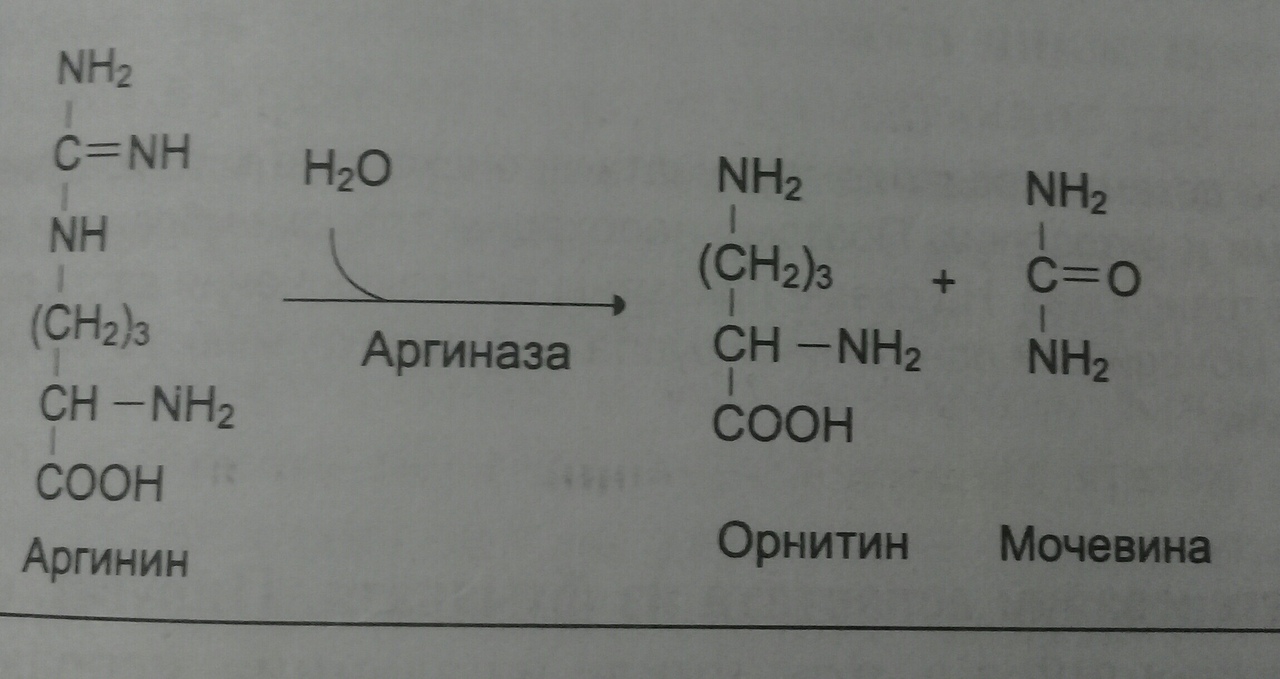
Образовавшийся орнитин взаимодействует с карбамоилфосфатом, цикл замыкается. Первые 2 реакции идут в митохондриях гепатоцитов. Потом цитруллин транспортируется в цитозоль, где идут оставшиеся.
Диагностическое значение: орнитиновый цикл превращается азот АК в мочевину, тем самым нейтрализуя токсины (аммиак), а так же синтезирует аргинин и накопление его резерва. Увеличение скорости синтеза мочевины происходит при длительном голодании и физической работе, которые сопровождаются распадом тканевых белков. Некоторые патологии (сахарный диабет), которые характеризуются интенсивным распадом белковых тканей, также сопровождаются активацией цикла.
БИЛЕТ 3
1. Источники образования аммиака в орг-ме.
Содержание аммиака в крови в норме составляет всего 0,4-0,7 мг/л (25-40 мкмоль/л).
Аммиак постоянно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основными источниками аммиака являются следующие реакции:
внутримолекулярное дезаминирование гистидина, катаболизм некоторых аминокислот (серина, треонина, глицина) – в печени,
окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках,
катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани,
жизнедеятельность бактерий толстого кишечника,
распад пуриновых и пиримидиновых оснований – во всех тканях.
Аммиак является одним из конечных продуктов азотистого обмена. Основной путь, приводящий к образованию аммиака в тканях - это непрямое окислительное дезаминирование аминокислот, т.е. трансдезаминирование.
2.Непрямое дезаминирование аминокислот: химизм, биологическое значение.
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение - мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования, в процессах глюконеогенеза, кето-генеза, в реакциях окисления до СО2 и Н2О.
У человека основным способом дезаминирования является окислительное дезаминирование. Выделяют два варианта окислительного дезаминирования: прямое и непрямое.
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз. Этот перенос называется трансаминирование и его механизм довольно сложен.
В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2").
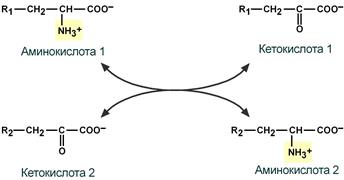
Схема реакции трансаминирования
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О.
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование.
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой, которая имеется в митохондриях всех клеток организма, кроме мышечных.
Окислительное дезаминирование глутамата - обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное шинирование α-кетоглутарата. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДф активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образованиеα-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование.

Схема обоих этапов трансдезаминирования.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Продукт трансаминирования глутаминовая кислота:
является одной из транспортных форм аминного азота в гепатоциты,
способна реагировать со свободным аммиаком, обезвреживая его.
Процесс трансдезаминирования идет в организме непрерывно, потому что:
сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
БИЛЕТ 4
1.Механизм декарбоксилирование глутамата, биологическое значение.

!!синтез ГАМК происходит исключительно в центральной нервной системе в подкорковых образованиях головного мозга.
Биологическое значение ГАМК - медиатор ЦНС
(В большом количестве содержится в сером веществе мозга, в то время как в белом веществе мозга и периферической нервной системе ее почти нет) Является тормозным фактором в нервных клетках. В опытах с изолированной петлей кишечника показано, что ГАМК вызывает прекращение перистальтики даже в присутствии ацетилхолина, стимулирующего перистальтику. Используется в клинике при лечении заболеваний центральной нервной системы, связанных с резким возбуждением коры головного мозга (эпилепсия).
2. Транспортные формы аммиака в организме, их строение и характеристика.
Транспортными формами аммиака из тканей в печень являются глутамин и аланин, в меньшей степени аспарагин и глутамат, некоторое количество аммиака находится в крови в свободном виде. Глутамин и аланин являются наиболее представленными, их доля среди всех аминокислот крови составляет до 50%. Большая часть глутамина поступает от мышц и нервной ткани, аланин переносит аминный азот от мышц и стенки кишечника.
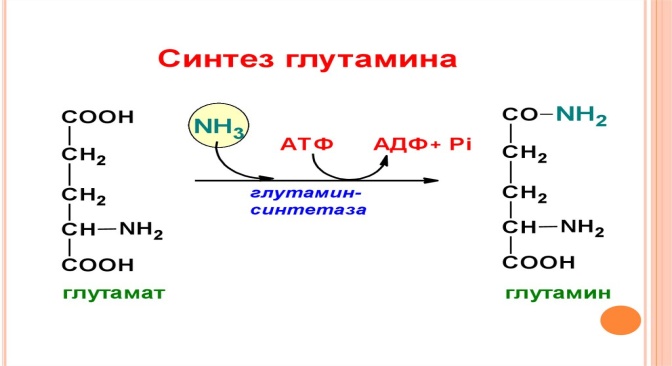
Глутамин – амид глутаминовой кислоты, обр при прямом аминировании. нейтральное нетоксичное соединение, способное легко проходить через клеточные мембраны. В виде этой аминокислоты аммиак транспортируется в крови. Содержится в раст белках, входит в состав фолиевой кислоты, использ при синтезе пурина
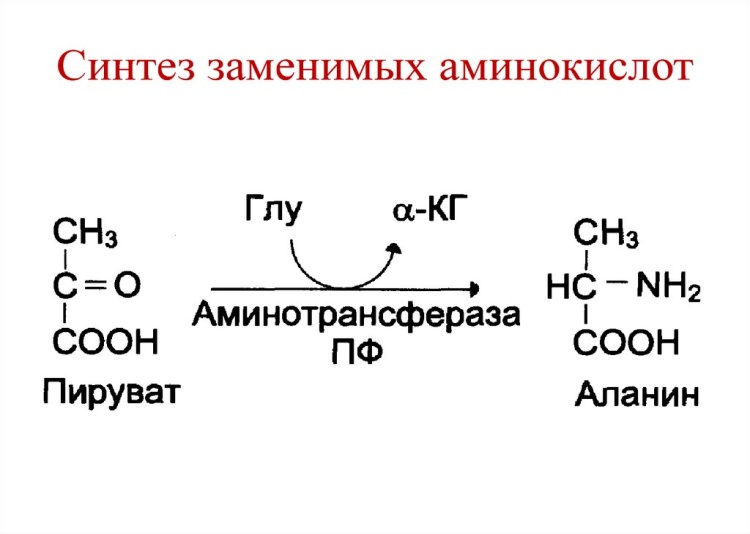
Аланин – образуется преимущественно в мышцах. протеиногенная заменимая аминокислота, напоминает глицин
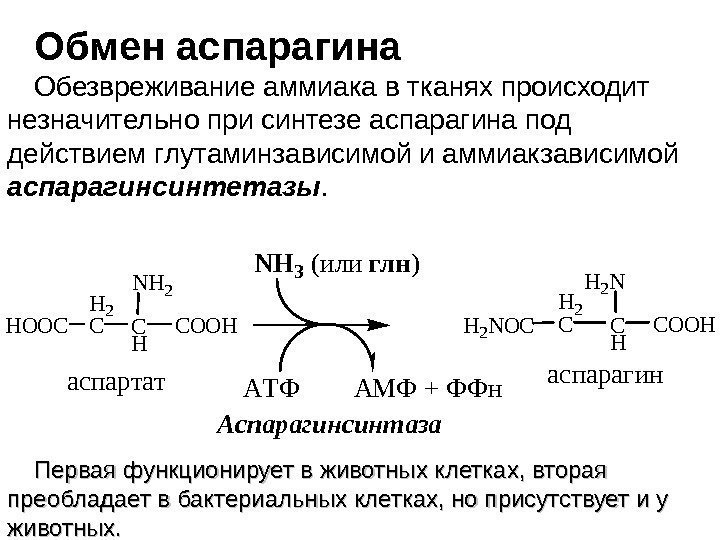
Аспарагин – амид аспарагиновой кислоты , заменимое глюкогенное соединение
Глутамат – заменимая, моноаминодикарбоновая аминокислота, ее содержание до 25% от всех ак. является нейромедиаторной аминокислотой
БИЛЕТ 5
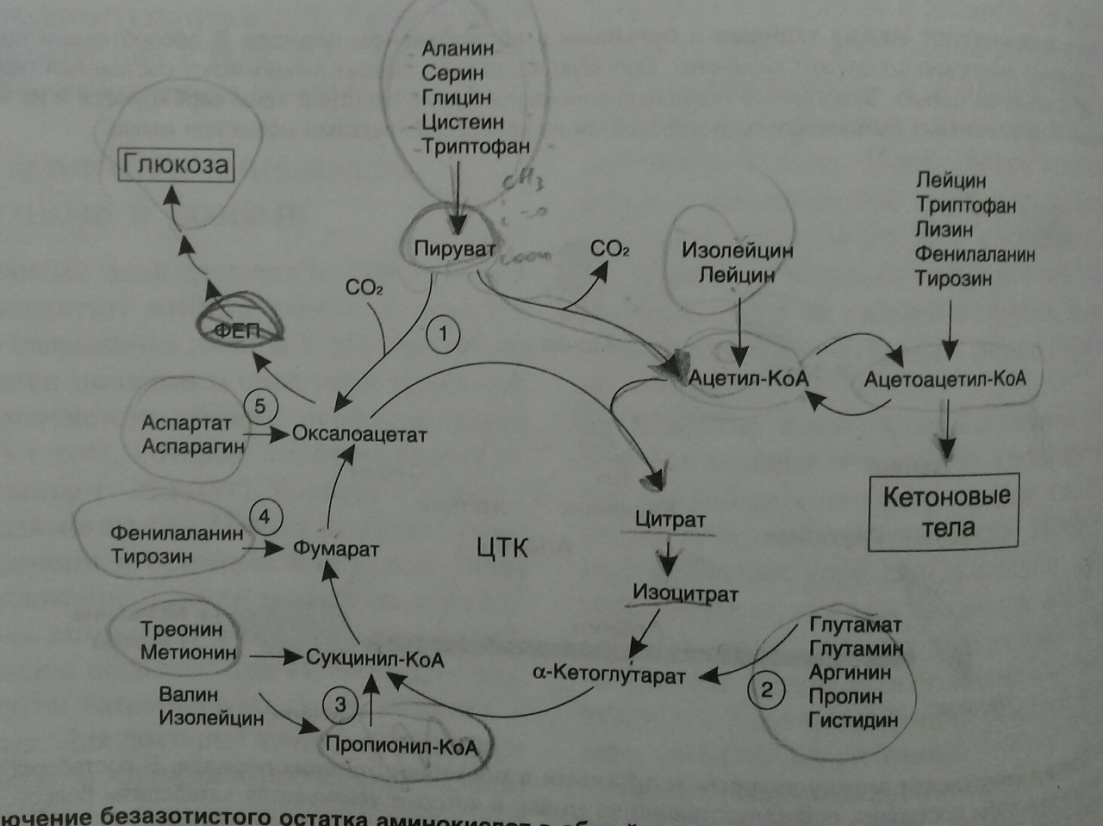
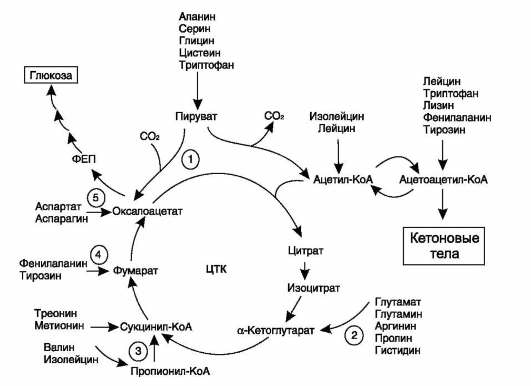
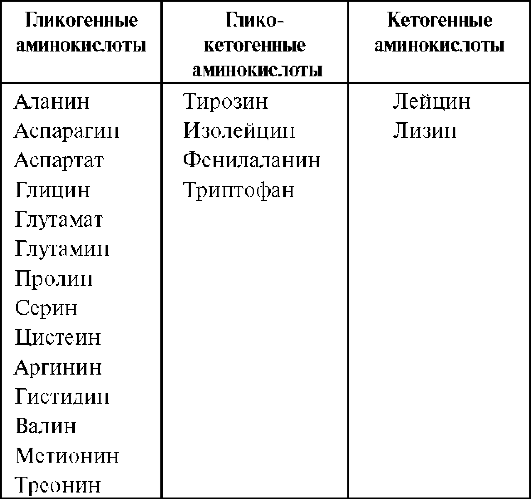
1.Гликогенные и кетогенные аминокислоты. Судьба безазотистых аминокислот. Всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кето-глутарат, сукцинил-КоА, фумарат, оксалоацетат. Аминокислоты, которые превращаются в пи-руват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот.
Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными.
Ряд
аминокислот используется и для синтеза
глюкозы, и для синтеза кетоновых тел,
так как в процессе их катаболизма
образуются 2 продукта - определённый
метаболит цитратного цикла и ацетоацетат
(Три, Фен, Тир) или ацетил-КоА (Иле). Такие
аминокислоты называют смешанными,
или глико-кетогенными.
 В
ходе катаболизма аминокислот происходит
отщепление аминогруппы и выделение
аммиака. Другим продуктом дезаминирования
аминокислот служит их безазотистый
остаток в виде α-кетокислот. Катаболизм
аминокислот происходит практически
постоянно. За сутки в норме в организме
человека распадается примерно 100
г аминокислот,
и такое же количество должно поступать
в составе белков пищи.
В
ходе катаболизма аминокислот происходит
отщепление аминогруппы и выделение
аммиака. Другим продуктом дезаминирования
аминокислот служит их безазотистый
остаток в виде α-кетокислот. Катаболизм
аминокислот происходит практически
постоянно. За сутки в норме в организме
человека распадается примерно 100
г аминокислот,
и такое же количество должно поступать
в составе белков пищи.
Большая
часть безазотистых остатков аминокислот
превращается в пируват либо непосредственно
(Ала, Сер), либо в результате более
сложного пути, превращаясь вначале в
один из метаболитов ЦТК. Затем в реакциях
цитратного цикла происходит образование
оксалоацетата, который превращается в
фосфоенолпируват. Из фосфоенолпирувата
под действием пируватки-назы образуется
пируват. Пируват подвергается
окислительному декарбоксилированию и
превращается в ацетил-КоА, который
окисляется в ЦТК до СО2 и
Н2О
с выделением энергии. Такой путь проходят
преимущественно аминокислоты
пищи.
Безазотистые
остатки аминокислот используются для
восполнения того количества метаболитов
общего пути катаболизма, которое
затрачивается на синтез биологически
активных веществ.
Такие реакции называют анаплеротическими.
5
анаплеротических реакций:
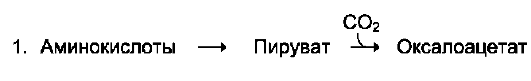
Фермент пируваткарбоксилаза (кофермент - биотин), катализирующий эту реакцию, обнаружен в печени и мышцах.
