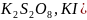лб19
.docxМинистерство науки и высшего образования РФ
Федеральное государственное бюджетное образовательное
Учреждение высшего образования
«Владимирский государственный университет им. А.Г. и Н.Г. Столетовых»
Кафедра химии
Лабораторная работа №19
«Определение порядка реакции по времени полураспада»
Выполнил:
студент группы Б-122
Мартин М.Р.
Проверил:
Пикалов Е.С.
Владимир, 2024
Теоретическая часть
Время полураспада для реакции n-гo порядка и определяется уравнением:
![]() где
С
–концентрации исходных веществ,
где
С
–концентрации исходных веществ,
![]() k
– константа скорости реакции, она
связана со временем полураспада
соотношениями для реакции первого,
второго, третьего порядка соответственно:
k
– константа скорости реакции, она
связана со временем полураспада
соотношениями для реакции первого,
второго, третьего порядка соответственно:
![]()
![]()
Время полураспада для указанных концентраций реагирующих веществ определяется при 5 – 6 температурах (в диапазоне от 29 до 60C).
Порядок реакции можно определить по уравнению:

В работе определяется порядок реакции и константы скорости реакции на примере реакции взаимодействия персульфата калия с йодистым калием:

Раствор тиосульфата натрия используют для связывания половины выделившегося свободного йода по реакции:

Крахмал используется в качестве индикатора выделившегося йода и дистиллированная вода при необходимости для изменения концентрации раствора.
Таблица 1. Количество реагентов, необходимых для реакции
Концентрация
|
Крахмал, число капель |
Количество раствора, мл |
|||
|
|
|
|
||
0,0375 |
7 |
5 |
5 |
- |
10 |
0,0300 |
7 |
4 |
4 |
4 |
8 |
0,0225 |
7 |
3 |
3 |
8 |
6 |
Цель: освоить метод определения порядка реакции - по периоду полураспада. Оценить основные кинетические константы по времени полураспада одного из реагирующих веществ. Оценить влияние катализатора и его концентрации на скорость реакции.
Выполнение работы
1)
Проводим реакции и определяем их время
полураспада

первой реакции = 23 мин 42 сек = 1422 сек
второй реакции = 29 мин 28 сек = 1768 сек
третьей реакции = 1 ч 12 мин 17 сек = 4337 сек
2) Рассчитываем время полураспада
Для
1 и 2 реакции

Для
2 и 3 реакции

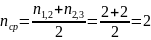
3) Рассчитываем константу скорости реакции для реакции 2 порядка
Для
1 реакции

Для
2 реакции

Для
3 реакции

Средняя
 =
=
 0,016
0,016
4)
Таблица 2. Экспериментальные и расчетные данные
№ |
С
( |
t, C |
T, K |
|
|
|
|
n |
|
1 |
0,0300 |
26 |
299 |
3,3444 |
1422 |
1410 |
1422 |
2 |
2 |
2 |
0,0375 |
26 |
299 |
3,3444 |
1768 |
1705 |
1768 |
||
3 |
0,0225 |
26 |
299 |
3,3444 |
4337 |
4292 |
4337 |
2 |
Вывод:
Мы определили порядок реакции по времени полураспада. Проведенная реакция соответствует 2 порядку реакции. Средняя константа скорости реакции для реакции 2 порядка равна 0,016. Время полураспада веществ реакции 2 порядка обратно пропорционально концентрации раствора. При увеличении концентрации в растворе наблюдается уменьшение времени полураспада.