
Кишкун А.А
.pdf
312 ■ Глава 5
Тромбоцитарный компонент гемостаза
Показатели, характеризующие тромбоцитарный компонент гемостаза:
■Определение длительности кровотечения по Дуке.
■Подсчёт количества тромбоцитов в крови.
■Определение агрегации тромбоцитов с АДФ.
■Определение агрегации тромбоцитов с коллагеном.
■Определение агрегации тромбоцитов с адреналином.
■Определение агрегации тромбоцитов с ристоцетином (определение активности фактора фон Виллебранда).
Клиническое значение исследования первых двух перечисленных показателей в рассмотрено в главе 2 «Гематологические исследования». Ниже подробно рассмотрены клиническая оценка и значение исследования агрегационных функций тромбоцитов.
АГРЕГАЦИЯ ТРОМБОЦИТОВ С АДФ
Процессы агрегации изучают с помощью агрегометра, отражающего ход агрегации графически в виде кривой; в качестве стимулятора агрегации служит АДФ [Меньшиков В.В., 1987].
До добавления проагреганта (АДФ) возможны случайные осцилляции кривой оптической плотности. После добавления агреганта на кривой появляются осцилляции за счёт изменения формы тромбоцитов. Осцилляции уменьшаются по амплитуде, уменьшается оптическая плотность. Тромбоциты соединяются в агрегаты и кривая отклоняется вверх (первичная волна). Когда подъём переходит в «плато», то происходит реакция высвобождения, и кривая ещё больше поднимается вверх (вторичная волна).
При воздействии малых доз АДФ на агрегатограмме регистрируют двойную волну агрегации. Первая фаза (первичная волна) зависит от добавленного экзогенного АДФ, а вторая фаза (вторичная волна агрегации) — за счёт реакции высвобождения собственных агонистов, содержащихся
вгранулах тромбоцитов. Вводимые извне большие дозы АДФ (обычно 1×10−5 моль) приводят к слиянию первой и второй волн агрегации. Для
достижения двухволновой агрегации обычно используется АДФ в концентрации 1×10−7 моль.
При анализе агрегатограмм обращают внимание на общий характер агрегации (одноволновая, двухволновая; полная, неполная; обратимая, необратимая), разницу между оптической плотностью плазмы до начала агрегации и после достижения максимальной агрегации (характеризует интенсивность агрегации), а также уменьшение оптической плотности плазмы за первую минуту агрегации или угол наклона кривой на этапе бурной агрегации (характеризует скорость агрегации). Важно отметить, что появление двухволновой агрегации при стимуляции АДФ и адреналином
вконцентрациях, вызывающих в норме обратимую агрегацию (обычно 1−5 мкмоль), указывает на повышение чувствительности тромбоцитов к этим индукторам, а развитие одноволновой неполной (а часто и обратимой) агрегации при стимуляции ими в концентрациях 10 мкмоль и больше — на нарушение реакции высвобождения тромбоцитов. В клинических иссле-
дованиях общепринятым считают использование АДФ в концентрациях 1×10-5 моль (для достижения одноволновой агрегации) и 1×10-7 моль (для достижения двухволновой агрегации).

Исследование системы гемостаза ■ 313
Результаты исследования агрегационной способности тромбоцитов могут выражаться в процентах (табл. 5-2).
Таблица 5-2. Агрегации по Вайсу для АДФ
АДФ, мкмоль |
Агрегации в норме,% |
|
|
10 |
77,7 |
5 |
66,1 |
2 |
47,5 |
1 |
30,7 |
Определение агрегации тромбоцитов с различными индукторами агрегации играет важнейшую роль в дифференциальной диагностике тромбоцитопатий (табл. 5-3).
Таблица 5-3. Нарушения агрегации тромбоцитов при различных заболеваниях
Вид |
Стимулятор агрегации и нарушения агрегации |
|||||
АДФ |
|
|
|
|||
тромбоцитопа- |
|
|
|
|||
первичная |
вторичная |
Коллаген |
Адреналин |
Ристоцетин |
||
тии |
||||||
|
волна |
волна |
|
|
|
|
Тромбастения |
Патология |
Патология |
Патология |
Патология |
Норма |
|
Эссенциальная |
Патология |
Патология |
Патология |
Патология |
Норма |
|
атромбия |
||||||
|
|
|
|
|
||
Аспиринопо- |
Норма |
Патология |
Патология |
Патология |
Норма |
|
добный дефект |
|
|
|
|
|
|
Синдром |
Норма |
Норма |
(+,−) |
(+,−) |
Норма |
|
Бернара−Сулье |
|
|
|
|
|
|
Синдром Вис- |
Патология |
Патология |
Патология |
Патология |
Норма |
|
кота−Олдрича |
|
|
|
|
|
|
Болезнь фон |
Норма |
Норма |
Норма |
Норма |
Сниженная |
|
Виллебранда |
|
|
|
|
(патологи- |
|
|
|
|
|
|
ческая) |
|
(+,−) — диагностического значения не имеет.
В зависимости от функционально-морфологических характеристик тромбоцитов выделяют следующие группы тромбоцитопатий.
■Наследственные дизагрегационные тромбоцитопатии без нарушения реакции высвобождения (вторичная волна). В эту группу входят:
тромбастения Глянцманна, для которой характерно нарушение АДФзависимой агрегации, при нормальной ристоцетин-агрегации;
эссенциальная атромбия — при воздействии малых количеств АДФ агрегация не индуцируется, а при удвоении количества АДФ приближается к нормальной;
аномалия Мая−Хегглина — нарушается коллаген-зависимая агрегация, реакция освобождения при стимуляции АДФ и ристоцетином сохранена.

314 ■ Глава 5
■Парциальные дизагрегационные тромбоцитопатии. В эту группу входят заболевания с врождённым дефектом агрегации с тем или иным агрегантом, или угнетением реакции высвобождения.
■Нарушение реакции высвобождения. Для этой группы заболеваний характерно отсутствие второй волны агрегации при стимуляции малым количеством АДФ и адреналина. В тяжёлых случаях отсутствует АДФ- и адреналин-зависимая агрегация. Коллаген-зависимая агрегация не выявляется.
■Болезни и синдромы с недостаточным пулом накопления и хранения медиаторов агрегации. К этой группе относятся заболевания, характеризующиеся нарушением способности тромбоцитов накапливать и выделять серотонин, адреналин, АДФ и другие факторы кровяных плас-
тинок. Лабораторно для этой группы характерно снижение всех видов агрегации и отсутствие второй волны агрегации.
Снижение агрегации в ответ на введение АДФ наблюдают при пернициозной анемии, остром и хроническом лейкозе, миеломной болезни. У больных с уремией при стимуляции коллагеном, адреналином, АДФ агрегация снижена. Для гипотиреоза характерно снижение агрегации при стимуляции АДФ. Ацетилсалициловая кислота, пенициллин, индометацин, хлорохин, диуретики (в частности, фуросемид при применении в высоких дозах) способствуют снижению агрегации тромбоцитов, что нужно учитывать при лечении этими препаратами.
При хирургических операциях, осложнённых кровотечениями, нарушения в системе сосудисто-тромбоцитарного гемостаза в большинстве случаев обусловлены не нарушением агрегационных и других функциональных свойств тромбоцитов, а наличием тромбоцитопении той или иной степени.
АГРЕГАЦИЯ ТРОМБОЦИТОВ С КОЛЛАГЕНОМ
Коллаген-индуцированная агрегация тромбоцитов имеет достаточно выраженную латентную фазу, во время которой происходит активация фосфолипазы С. В зависимости от используемого реагента продолжительность этой фазы может составлять 5−7 мин. После завершения этого периода
втромбоцитах происходят процессы, приводящие к образованию вторичных посредников, вследствие чего развивается секреция тромбоцитарных
гранул и синтез тромбоксана А2, что сопровождается резким усилением межтромбоцитарного взаимодействия.
Влабораторно-клинической практике коллаген чаще всего используют
вконечной концентрации 50 мкг/мл, однако коллагены разных фирм могут обладать различной активностью, что необходимо учитывать при их применении. Результаты исследования агрегационной способности тромбоцитов могут выражаться в процентах (табл. 5-4).
Диагностическое значение и оценку результатов исследования — см. раздел «Агрегация тромбоцитов с АДФ». Отдельно это исследование не применяют, а проводят в комплексе с определением агрегации тромбоцитов с АДФ и адреналином.

Исследование системы гемостаза ■ 315
Таблица 5-4. Референтные значения агрегации тромбоцитов по Вайсу для коллагена
Концентрация коллагена, мкг/мл |
Агрегация в норме,% |
|
|
10 |
93,1 |
5 |
75,0 |
2 |
69,4 |
1 |
46,4 |
АГРЕГАЦИЯ ТРОМБОЦИТОВ С АДРЕНАЛИНОМ
Кривая, регистрируемая при записи адреналин-индуцированной агрегации, имеет две волны. Адреналин при контакте с тромбоцитами взаимодействует с α2-адренорецепторами, что вызывает ингибирование аденилатциклазы. Не исключено, что механизм, лежащий в основе реализации эффекта адреналина и развития первой волны агрегации, не зависит от образования тромбоксана А2, реакции высвобождения или синтеза фактора агрегации тромбоцитов, а связан со способностью этого проагреганта прямо изменять проницаемость клеточной мембраны для ионов Са2+. Вторичная агрегация при индукции процесса адреналином возникает как результат реакции высвобождения и продукции тромбоксана А2. Результаты исследования агрегационной способности тромбоцитов могут выражаться
впроцентах (табл. 5-5).
Диагностическое значение и оценка результатов исследования — см. в раз-
деле «Агрегация тромбоцитов с АДФ».
Отдельно исследование не применяют, а проводят в комплексе с определением агрегации тромбоцитов с АДФ и коллагеном.
Таблица 5-5. Референтные значения агрегации тромбоцитов по Вайсу для адреналина
Адреналин, мкмоль |
Агрегация в норме, % |
|
|
300 |
92,5 |
150 |
46,0 |
60 |
42,5 |
30 |
35,0 |
АГРЕГАЦИЯ ТРОМБОЦИТОВ С АРАХИДОНОВОЙ КИСЛОТОЙ
Арахидоновая кислота — природный агонист агрегации, причём её действие опосредовано эффектами простагландинов G2 и H2 и тромбоксана А2 и включает активацию как фосфолипазы C с последующим образованием вторичных посредников, мобилизацией внутриклеточного кальция и расширением процесса активации клеток, так и фосфолипазы А2, что непосредственно приводит к освобождению эндогенной арахидоновой кислоты.
Активация тромбоцитов под действием арахидоновой кислоты происходит достаточно быстро, поэтому кривая, характеризующая этот процесс, чаще носит одноволновый характер.
Для индукции агрегации тромбоцитов арахидоновую кислоту используют в концентрациях 1×10-3−1×10-4 моль. При работе с арахидоновой кислотой следует учитывать, что на воздухе это вещество очень быстро окисляется.

316 ■ Глава 5
Пробу на агрегацию с арахидоновой кислотой рекомендуют проводить в случаях использования ЛС, влияющих на реакцию агрегации (например, ацетилсалициловая кислота, пенициллин, индометацин, делагил, диуретики), что нужно учитывать при оценке результатов исследований.
АГРЕГАЦИЯ ТРОМБОЦИТОВ С РИСТОЦЕТИНОМ
Референтные величины активности фактора фон Виллебранда — 58−166%. Фактор фон Виллебранда синтезируют эндотелиальные клетки и мегакариоциты. Он необходим для нормальной адгезии тромбоцитов и обладает способностью удлинять период полувыведения фактора VIII. Фактор VIII свёртывания плазмы — антигемофильный глобулин А — циркулирует в крови в виде комплекса из трёх субъединиц, обозначаемых VIII-к (коагулирующая единица), VIII-Аг (основной антигенный маркёр) и VIII-фВ (фактор фон Виллебранда, связанный с VIII-Аг). Считают, что фактор фон Виллебранда регулирует синтез коагуляционной части антигемофильного глобулина А (VIII-к) и участвует в сосудисто-тромбоцитарном гемостазе. Болезнь фон Виллебранда — наследственное заболевание, для которого характерны увеличение длительности кровотечения, уменьшение ристоцетиновой кофакторной активности и снижение (в разной степени) коагулянтной активности фактора VIII. Клинические проявления заболевания сходны с таковыми при тромбоцитопатиях. Вместе с тем у пациентов со значительным снижением активности фактора VIII могут наблюдаться гематомы и гемартрозы. На основе лабораторных исследований, позволяющих определить структуру и активность фактора фон Виллебранда, различают следующие формы болезни.
■Тип I (70% всех случаев) характеризуется незначительным снижением ристоцетин-кофакторной (фактора фон Виллебранда) и коагулянтной активности (VIII-к) при нормальной макромолекулярной структуре фактора фон Виллебранда.
■Тип II: в основе лежит избирательный дефицит высокомолекулярных полимеров фактора Виллебранда вследствие нарушений в структуре этого белка.
Тип IIВ обусловлен усиленным взаимодействием между фактором фон Виллебранда и тромбоцитами, а повышенный клиренс агрегатов тромбоцитов приводит к тромбоцитопении.
■Тип III характеризуется тяжёлым количественным дефицитом фактора фон Виллебранда, что приводит к клинически значимому снижению активности фактора VIII (VIII-к).
Содержание фактора фон Виллебранда определяют в тех случаях, когда увеличено время кровотечения, количество тромбоцитов находится в пределах референтных величин и нет явных причин дисфункции тромбоцитов. Для оценки фактора фон Виллебранда определяют количественное содержание фактора фон Виллебранда (исследование ристоцетин-кофакторной активности), исследуют индуцированную ристоцетином агглютинацию тромбоцитов и антигенную структуру фактора Виллебранда, связанного
сфактором VIII (VIII-фВ).
Определение агрегации тромбоцитов с ристоцетином в плазме применя-
ют для количественной оценки фактора фон Виллебранда. Установлена линейная зависимость между степенью ристоцетиновой агрегации и количеством фактора фон Виллебранда. В основе метода лежит способность этого
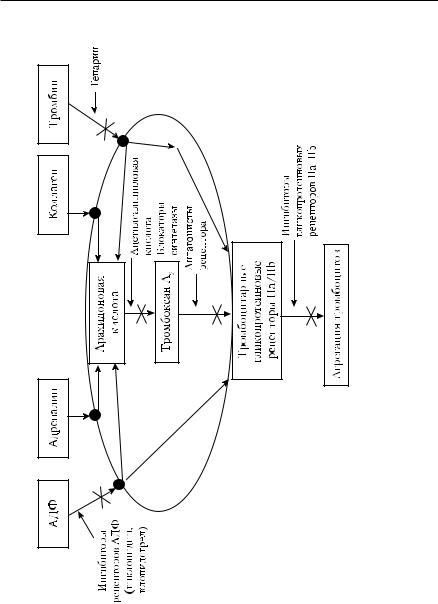
Исследование системы гемостаза ■ 317
Рис. 5-5. Пути агрегации тромбоцитов и точки приложения антиагрегантов

318 ■ Глава 5
антибиотика (ристоцетина) стимулировать in vitro взаимодействие фактора фон Виллебранда с тромбоцитарным гликопротеином Ib. В большинстве случаев болезни фон Виллебранда отмечается нарушение ристоцетин-аг- регации при нормальном ответе на воздействие АДФ, коллагена и адреналина. Нарушение ристоцетин-агрегации выявляют и при макроцитарной тромбодистрофии Бернара−Сулье (отсутствие на мембране тромбоцитов рецепторов ристоцетиновой агрегации). Для дифференциации применяют тест с добавлением нормальной плазмы: при болезни фон Виллебранда после добавления нормальной плазмы ристоцетин-агрегация нормализуется, в то время как при синдроме Бернара−Сулье этого не происходит.
Исследование также можно использовать в дифференциальной диагностике гемофилии А (недостаток фактора VIII) и болезнью фон Виллебранда. При гемофилии резко снижено содержание VIII-к, а содержание VIII-фВ находится в пределах нормы. Клинически это различие проявляется тем, что при гемофилии возникает гематомный тип повышенной кровоточивости, а при болезни фон Виллебранда — петехиально-гематомный [Ogston D., Bennett B., 1977].
Индуцированная ристоцетином агглютинация тромбоцитов снижена при большинстве случаев болезни фон Виллебранда, кроме типа IIВ.
Антигенную структуру фактора Виллебранда, связанного с фактором VIII (VIII-фВ), выявляют различными иммунологическими методами, а распределение фактора Виллебранда по размерам молекул определяют путём электрофореза в агарозном геле. Эти тесты применяют для установления типа болезни фон Виллебранда.
Исследование агрегации тромбоцитов с различными индукторами проводят не только для выявления нарушений агрегационных функций тромбоцитов. Это исследование позволяет оценить эффективность терапии антиагрегантами, подобрать индивидуальные дозы ЛС и проводить лекарственный мониторинг. На рис. 5-5 приведены основные ЛС, обладающие антиагрегантным действием, и точки их приложения.
Плазменный (коагуляционный) гемостаз
I фаза плазменного гемостаза (образования протромбиназы)
Показатели, характеризующие I фазу плазменного гемостаза включают:
■время свёртывания крови по Сухареву;
■активированное частичное тромбопластиновое время (АЧТВ).
■активность XII фактора;
■активность XI фактора;
■активность IX фактора;
■активность VIII фактора;
■активность X фактора.
АКТИВИРОВАННОЕ ЧАСТИЧНОЕ ТРОМБОПЛАСТИНОВОЕ ВРЕМЯ
Референтные величины АЧТВ — 25−35 с.
АЧТВ — один из наиболее ценных общих тестов для получения представления о системе свёртывания крови. АЧТВ — тест, выявляющий исклю-

Исследование системы гемостаза ■ 319
чительно плазменные дефекты внутренней системы активации Х фактора в I фазе (образование протромбиназы) свёртывания крови. Удлинение АЧТВ отражает дефицит плазменных факторов (кроме VII и XIII) и наблюдается при их значительном (ниже 25−10%) снижении [Баркаган З.С., 1988]. Удлинение АЧТВ указывает на преобладание гипокоагуляции.
Причины, приводящие к удлинению АЧТВ
■ Нарушение показателей АЧТВ при нормальном протромбиновом и тромбиновом времени наблюдают только при дефиците или ингибировании факторов VIII, IX, XI, XII, а также прекалликреина и высокомолекулярного кининогена. Из этих форм патологии наиболее часто наблюдают дефицит и/или ингибирование факторов VIII и IX, что характерно для гемофилии А и В, а также дефицит фактора фон Виллебранда. Более редко в крови ранее здоровых лиц появляются иммунные ингибиторы фактора VIII.
■Замедление свёртывания при определении как АЧТВ, так и протромбинового времени при нормальных тромбиновом времени и концен-
трации фибриногена наблюдают при дефиците факторов X, V, II,
а также при воздействии непрямых антикоагулянтов.
■Удлинение протромбинового времени при нормальных показаниях АЧТВ и тромбинового времени характерно только для дефицита фактора VII.
■Удлинение АЧТВ, протромбинового и тромбинового времени наблюдают при глубокой гипофибриногенемии, лечении активаторами фибринолиза. Удлинение времени свёртывания только в тромбиновом тесте характерно для дисфибриногенемии и нарушений полимеризации фибрин-мономеров.
■Афибриногенемия и гипофибриногенемия, как врождённые, так и связанные с тяжёлыми поражениями печени, сопровождаются удлинением АЧТВ.
■При проведении гепаринотерапии удлиняются АЧТВ, протромбиновое и тромбиновое время. Важное значение придают определению АЧТВ. Известно, что больные могут обладать повышенной и пониженной чувствительностью к гепарину. Окончательно вопрос толерантности к гепарину может быть уточнён путём повторного определения АЧТВ за 1 ч до очередного введения гепарина. Если АЧТВ в это время окажется удлинённым более чем в 2,5 раза по сравнению с нормой, то констатируют повышенную чувствительность к гепарину и снижают его дозу или увеличивают интервал между введениями.
■Удлинение АЧТВ может свидетельствовать о наличии у пациента волчаночного антикоагулянта (ВА), при отсутствии нарушений других показателей коагулограммы.
В табл. 5-6 приведены данные о том, в каких сочетаниях нарушаются показания базисных коагуляционных тестов при дефиците различных факторов свёртывания и действии антикоагулянтов. Укорочение АЧТВ свидетельствует о преобладании гиперкоагуляции и отмечается в первой (гиперкоагуляционной) фазе острого ДВС-синдрома.

320 ■ Глава 5
Таблица 5-6. Результаты основных коагуляционных тестов при дефиците разных факторов свёртывания крови
Дефицитные факторы |
|
Замедление свёртывания |
||
и эффекты |
|
|
|
|
АЧТВ |
Протромбиновый тест |
Тромбиновый тест |
||
антикоагулянтов |
||||
XII |
+ |
− |
− |
|
XI |
+ |
− |
− |
|
Прекалликреин |
+ |
− |
− |
|
ВМ кининоген |
+ |
− |
− |
|
IX |
+ |
− |
− |
|
VIII |
+ |
− |
− |
|
Фактор фон Виллебранда |
Часто + |
− |
− |
|
VII |
− |
+ |
− |
|
V |
+ |
+ |
− |
|
Х |
+ |
+ |
− |
|
II |
+ |
+ |
- |
|
I |
+ |
+ |
+ |
|
ХIII |
− |
− |
− |
|
Действие гепарина |
+ |
+ |
+ |
|
Действие кумаринов |
+ |
+ |
− |
|
Обнаружение признаков гиперкоагуляции (укорочение времени свёртывания крови, протромбинового времени, АЧТВ) считают показанием для назначения препаратов среднемолекулярного (15 000−25 000 Да) или низкомолекулярного (4200−6100) гепарина. Для контроля за адекватностью проводимой терапии 2 раза в сутки необходимо определять время свёртывания крови или АЧТВ. При исследовании времени свёртывания крови инфузию гепарина (с помощью инфузионных насосов) следует подбирать таким образом, чтобы поддерживать этот показатель в пределах 15−23 мин, а АЧТВ в 2−3 раза выше нормы. Рекомендуемые схемы контроля за лечением среднемолекулярным гепарином представлены в табл. 5-7. Кроме того, при назначении высоких доз гепарина необходим ежедневный контроль за содержанием АТIII, так как его уровень резко снижается в результате потребления.
Низкомолекулярные (фракционированные) гепарины вызывают меньшее потребление АТIII, практически не активируют тромбоциты и не вызывают иммунных реакций. Они не способны связывать одновременно тромбин и АТIII, поэтому не ускоряют инактивацию АТIII, но сохраняют способность катализировать ингибирование фактора Ха АТIII. Ускорение инактивации фактора Ха не требует образования тройного комплекса и может достигаться только через связывание гепарина с АТIII (в зависимости от препарата низкомолекулярного гепарина соотношение анти-Ха/ анти IIа составляет от 2:1 до 4:1).
Для контроля за лечением низкомолекулярным гепарином используют более чувствительный тест, чем АЧТВ — определяют анти-Ха активность плазмы (количественное определение гепарина, где фактор Ха применяют

Исследование системы гемостаза ■ 321
в качестве реактива). При определении анти-Ха активности плазмы используют сульфат декстрана для вытеснения гепарина из комплекса с белками, что обеспечивает точность измерения количества комплексов Ха с АТIII. В качестве индикаторной используют реакцию с хромогенным субстратом на фактор Ха. Рекомендуемые схемы контроля за лечением низкомолекулярным гепарином приведены в табл. 5-8.
Таблица 5-7. Схема контроля при лечении среднемолекулярным гепарином
|
|
Отношение АЧТВ пациента/ |
Доза гепарина |
Способ введения |
АЧТВ контроля |
|
|
и количество определений |
|
|
|
Менее 20 000 ЕД/сут |
Подкожно (2−3 введения) |
Мониторинг не нужен |
20 000−30 000 ЕД/сут |
Подкожно (2−3 введения) |
1,2−1,5, определение перед |
|
|
очередным введением и |
|
|
через 4−6 ч |
Более 30 000 ЕД/сут |
Внутривенно (прерывистое |
1,5−4, определение перед |
|
введение 5000−7500 ЕД |
очередным введением |
|
через 4 ч или |
|
|
7500−10 000 ЕД через 6 ч) |
|
500−1000 ЕД/ч |
Внутривенно (инфузия) |
2,0−2,5 |
Таблица 5-8. Схема контроля за лечением низкомолекулярным гепарином
Доза гепарина |
Способ введения |
Анти-Ха, ЕД/мл |
|
|
|
2000−2500 ЕД |
Подкожно |
Мониторинг не нужен |
|
(1 раз в сут) |
|
4000−5000 ЕД |
Подкожно |
Перед очередным введением — |
|
(1−2 раза в сут) |
0,2−0,4 ЕД/мл |
100−120 МЕ/кг |
Подкожно |
До инъекции — свыше 0,3 ЕД/мл, |
|
(2 раза в сут) |
через 3−4 ч — менее 1,5 ЕД/мл |
30−40 МЕ/кг разово, |
Непрерывная |
0,5−1,0 ЕД/мл, коррекция |
затем по |
внутривенная |
скорости каждые 3−6 ч |
10−15 МЕ(кг.ч) |
инфузия |
|
При ИМ об эффективности антикоагулянтной терапии (гепарином) судят по степени удлинения АЧТВ, что также отражает проходимость коронарных артерий. На рис. 5-6 показана зависимость между степенью проходимости коронарных артерий (по данным ангиографии) и длительностью АЧТВ при проведении антикоагулянтной терапии гепарином у больных ИМ [Alexander R.W. et al., 1998].
ФАКТОР XII (ХАГЕМАНА)
Референтные величины активности фактора XII в плазме крови — 65−150%. Фактор XII (Хагемана) — сиалогликопротеид, активизируемый коллагеном, контактом с чужеродной поверхностью, адреналином и рядом протеолитических ферментов (в частности, плазмином). Фактор XII инициирует внутрисосудистую коагуляцию, кроме того, фактор XIIа переводит прекалликреины плазмы в калликреины. Активный фактор XII служит активато-
ром фибринолиза.
