
Кишкун А.А
.pdf
242 ■ Глава 4
ти КК в сыворотке крови наблюдают при травматических повреждениях скелетной мускулатуры и заболеваниях мышечной системы. Так, при прогрессирующей мышечной дистрофии (миопатии) активность КК может увеличиваться в 50 раз и более по сравнению с нормой, что используют в качестве диагностического теста. Следует заметить, что при неврогенных дистрофиях активность КК в крови чаще остаётся в пределах нормы. Для того чтобы дифференцировать ИМ от повреждения мышц, определяют отношение КК/АСТ. При ИМ это отношение меньше 10; если оно более 10, то можно говорить о повреждении скелетной мускулатуры.
Высокая активность КК возможна при различных нарушениях со стороны ЦНС (шизофрения, маниакально-депрессивный психоз, синдромы, вызываемые психотропными ЛС, и др.). Кроме того, активность КК возрастает после различных хирургических операций, причём метод и продолжительность анестезии сказывается на послеоперационном уровне активности КК.
Наконец, необходимо учитывать, что повышение активности КК возможно при приёме алкоголя и после назначения препаратов, активирующих фермент (например, преднизолон), а также при гипотиреозе (напротив, при тиреотоксикозе наблюдают необычайно низкие значения активности КК).
MB-фракция креатинкиназы в сыворотке крови
Референтные величины активности MB-фракции КК в сыворотке крови: 6% общей активности КК или 0−24 МЕ/л.
КК в сердечной мышце состоит из двух изоферментов: КК-ММ (60% общей активности) и КК-MB (40% общей активности). КК-MB — димер, состоит из двух субъединиц: М (мышечная) и В (мозговая). MB-фракцию нельзя считать строго специфичной для миокарда. 3% КК скелетных мышц представлены этой фракцией. Тем не менее повышение активности КК-MB считают наиболее специфичным для ИМ — на неё приходится более 6% от общей КК (до 25%). Увеличение активности КК-MB наблюдают уже через 4−8 ч после начала заболевания, максимум достигается через 12−24 ч, на 3-и сутки активность изофермента возвращается к нормальным значениям при неосложнённом течении ИМ. При расширении зоны ИМ активность КК-MB повышена дольше, что позволяет диагностировать инфаркт пролонгированного и рецидивирующего течения. Максимум активности ККMB часто достигается раньше максимума активности общей КК. Степень повышения активности повышения КК и КК-MB соответствует величине поражённой зоны миокарда. Если в первые часы ИМ больному начали проводить тромболитическую терапию, то пик активности КК и КК-MB может появиться раньше, чем обычно, что объясняется более быстрым вымыванием фермента из поражённой зоны (результат реперфузии — восстановление проходимости тромбированной коронарной артерии).
В крови карбоксипептидаза расщепляет терминальные лизины пептидного димера КК-MB с образованием 2 главных изоформ: КК-MB1 и КК-MB2. В сыворотке крови здорового человека коэффициент КК-MB2/КК-MB1 меньше или равен 1,5. После ИМ активность КК-MB2 быстро повышается и коэффициент КК-MB2/КК-MB1 становится больше 1,5. В клинической практике этот коэффициент используют для ранней диагностики ИМ и наступления реперфузии при тромболитической терапии.

Биохимические исследования ■ 243
Проведённые исследования показали, что у людей при электрофоретическом разделении КК можно выявить 2 типа макро-КК. Макро-КК типа 1 представляет КК-MB, связанную с IgG, реже с IgA. При электрофорезе макро-КК типа 1 располагается между КК-ММ и КК-MB. Её обнаруживают у 3−4% госпитализированных пациентов пожилого возраста, у женщин чаще, чем у мужчин. Этот тип КК может присутствовать в крови пациентов годами и не связан с каким-либо заболеванием. Макро-КК типа 2 — митохондриальная КК (олигомер митохондриальной КК). При электрофорезе она мигрирует к катоду как КК-MB. Макро-КК типа 2 свидетельствует о серьёзном повреждении клетки, наблюдается при тяжёлых заболеваниях (ИМ, шок, злокачественные опухоли, гепатит, цирроз печени, тяжёлая сердечная недостаточность) и является прогностически неблагоприятным признаком.
Различные опухоли могут продуцировать КК-MB или КК-ММ, на долю которых приходится 60% и более общей активности КК. В этой связи, если КК-MB составляет более 25% общей КК, необходимо заподозрить злокачественное новообразование как причину повышения активности фермента.
Присутствие в крови ВВ-фракции может симулировать увеличение MBфракции, вплоть до превышения активности MB-фракции над общей КК. КК-ВВ появляется при нарушении гематоэнцефалического барьера (после операций на мозге или при его травме). ВВ-фракция также появляется при серьёзных повреждениях кишечника и после родов (особенно при кесаревом сечении).
Повышение активности общей КК и MB-фракции выявляют после операций или диагностических манипуляций на сердце. Лучевая терапия области груди также может вызвать небольшую гиперферментемию. Тахиаритмия или сердечная недостаточность редко вызывают подъём активности КК и КК-MB.
Повышение фракции КК-MB в отдельных случаях возможно при миокардитах и миокардиодистрофиях, однако на неё обычно приходится менее 3% общей КК.
Повреждения скелетной мускулатуры сопровождают значительным повышением активности ММ-фракции, которая может «симулировать» MBфракцию. При рабдомиолизе диагностическая чувствительность исследования активности КК (повышается в 5 раз и более) выше, чем альдолазы, АСТ и ЛДГ.
Заболевания и состояния, сопровождающиеся повышением активности КК
иКК-MB в сыворотке крови
■Физический стресс и травмы мышц.
Увеличение мышечной массы в результате физических упражнений.
Физический стресс (перегрузка).
Хирургические вмешательства, прямая травма, внутримышечные инъекции.
Острый психоз, острое повреждение мозга, кома (некроз мышц при пролежнях).
Спазмы (эпилепсия, тетанус), роды.
Сильные ожоги; поражения электрическим током.
■Дегенеративные и воспалительные повреждения.
Мышечная дистрофия.

244■ Глава 4
Миозит (коллагенозы, вирусные инфекции, трихинеллёз).
Миокардит.
■Токсические поражения мышц.
Острое алкогольное отравление, белая горячка.
Экзогенная интоксикация (бромиды, барбитураты, угарный газ).
Тетания.
Медикаменты (клофибрат, бронхолитики).
Токсический рабдомиолиз (героин, амфетамины).
Злокачественная гипертермия.
■Метаболические поражения мышц.
Гипотиреоз.
Метаболический рабдомиолиз (гипокалиемия, гипофосфатемия, гиперосмолярные состояния).
Гликогеноз (тип V).
■Гипоксические поражения мышц: шок, периферическая эмболия, гипотермия.
MB-фракция креатинкиназы (КК-MB mass) в плазме крови
Референтные величины концентрации КК-MB mass в плазме крови — менее 5 мкг/л [Bakker A.J. et al., 1994].
В настоящее время широко используют иммуноингибиторный анализ активности КК-MB. Вместе с тем присутствие атипичных форм КК и активности аденилаткиназы (вследствие гемолиза эритроцитов) в сыворотке крови может приводить к ложноположительным результатам. Более того, активность КК-MB в сыворотке крови редко увеличивается в первые 4−8 ч после приступа загрудинной боли, что ведёт к снижению диагностической чувствительности данного метода исследования в ранний период ИМ. Вместо измерения активности КК-MB в последнее время активно используют двухсайтовый иммуноэнзимометрический анализ, позволяющий измерять концентрацию изофермента КК-MB mass. В основе метода определения концентрации КК-MB mass лежит связывание АТ с его М-субъединицей и других АТ — с В-субъединицей. Чувствительность метода составляет 0,2 мкг/л.
Патологическое увеличение концентрации КК-MB mass при ИМ в плазме крови происходит раньше (чаще в первые 2−4 ч), чем активности ККMB и активности КК. В среднем интервал между первым увеличением концентрации КК-MB mass и повышением активности КК и КК-MB составляет 1 ч. Пик всех маркёров наступает раньше у пациентов с ранней реперфузией в случаях ИМ с зубцом Q на ЭКГ. Значительных различий во времени пика значений КК-MB mass (через 12−14 ч после приступа острых болей) и активности КК-MB не выявлено. Уровень повышения концентрации КК-MB mass в плазме при ИМ сильнее отличается от нормы, чем увеличение активности КК-MB у тех же самых пациентов. Период увеличения концентрации КК-MB mass в плазме крови при ИМ, который позволяет поставить диагноз по биохимическим маркёрам (диагностическое окно), длиннее для КК-MB mass, чем для активности КК-MB, и составляет в среднем 69 ч [Mair J.M.D. et al., 1991]. Концентрация КК-MB mass в плазме крови возвращается к норме в среднем через 70 ч.

Биохимические исследования ■ 245
Чувствительность и специфичность метода определения концентрации КК-MB mass для диагностики ИМ в течение первых 4 ч с момента болевого приступа составляет 49% и 94% соответственно, а через 4−12 ч — 76
и79% [Bakker A.J. et al., 1994].
Определение концентрации КК-MB mass — более чувствительный тест в диаг-
ностике ИМ без зубца Q, чем активности КК-MB.
Повышение уровня КК-MB mass — в плазме крови может быть выявлено у пациентов со стенокардией (7−9,1 мкг/л), миокардитом (до 20,9 мкг/л), кардиомиопатией вследствие прямой электроимпульсной терапии при фибрилляции желудочков (до 73,2 мкг/л), что отражает наличие микроинфарктов или диссеминированных поражений миокарда [Thomas P. et al., 1996].
Ложноположительное повышение концентрации КК-MB mass может быть выявлено у пациентов с травмами скелетных мышц, после хирургических операций, гипертонического криза, с недостаточностью кровообращения.
Для повышения специфичности диагностики ИМ и уменьшения ложноположительных результатов, при оценке концентрации КК-MB mass в плазме крови, производители тест-систем рекомендуют использовать отсекающие значения, которые для КК-MB mass составляют 7 мкг/л. Значения выше 7 мкг/л с большей вероятностью свидетельствуют о поражении миокарда.
Миоглобин в сыворотке крови
Референтные величины концентрации миоглобина в сыворотке крови: мужчины — 22−66 мкг/л, женщины — 21−49 мкг/л.
Миоглобин — гемсодержащий хромопротеид; представляет собой лёгкую цепь миозина с молекулярной массой 17,6 кДа. Является белком, транспортирующим кислород в скелетных мышцах и миокарде. Миоглобин слабо связывается с белками крови; при повреждении миокарда и скелетных мышц легко и быстро попадает в кровь и затем быстро экскретируется с мочой. Повышение концентрации в крови преходящее, возникает уже через 2−3 ч после появления боли при ИМ и сохраняется 2−3 сут. Повышение концентрации миоглобина в крови в первые 2 ч выявляют у 50%, к 3-му часу — у 92%, к 5-му часу — у 100% больных с ИМ. Концентрация миоглобина при ИМ может повышаться в 4−10 раз и более. Степень её повышения зависит от величины повреждения миокарда. Нормализация концентрации миоглобина при ИМ происходит на 2−3-и сутки. При развитии осложнений (сердечная недостаточность) концентрация миоглобина сохраняется повышенной более 3 сут. Повторные повышения концентрации миоглобина в крови на фоне уже начавшейся нормализации могут свидетельствовать о расширении зоны ИМ или образовании новых некротических очагов. При ишемии миокарда, возникающей во время приступов стенокардии, без развития очаговых некротических изменений, повышение концентрации миоглобина в крови также возможно, но оно незначительно. При ИМ наряду с миоглобинемией выявляют миоглобинурию (повышение содержания миоглобина в моче), чего не наблюдают при приступах стенокардии. Определение концентрации миоглобина в крови наиболее важно для ранней диагностики ИМ.

246 ■ Глава 4
Определение миоглобина в крови имеет важное значение и у больных
ссиндромом длительного сдавления, при обширных травмах мышц, которые часто осложняются ОПН вследствие массивного отложения миоглобина в почечных клубочках.
Концентрация миоглобина в крови увеличивается при тяжёлом электрошоке, термических ожогах, вторичной токсической миоглобинурии (болезнь Хаффа), повреждении скелетных мышц, артериальной окклюзии
сишемией мышц.
Тропонин Т в сыворотке крови
Референтные величины концентрации тропонина Т в сыворотке крови — 0−0,1 нг/мл.
Комплекс тропонина входит в состав сократительной системы мышц. Он образован тремя белками: тропонином Т, образующим связь с тропомиозином (молекулярная масса 3700), тропонином I (молекулярная масса 26 500), который может ингибировать АТФазную активность, и тропонином С (молекулярная масса 18 000), обладающим значительным сродством к Са2+. Приблизительно 93% тропонина Т содержится в сократительном аппарате миоцитов; эта фракция может быть предшественником для синтеза тропонинового комплекса, 7% — в цитозоле (что объясняет двухфазность пика повышения концентрации тропонина при ИМ). Тропонин Т из сердечной мышцы по аминокислотному составу и иммунным свойствам отличается от тропонина Т скелетных мышц. В крови здоровых людей даже после чрезмерной физической нагрузки концентрация тропонина Т не превышает 0,2−0,5 нг/мл, поэтому обнаружение его уровня выше указанного предела свидетельствует о поражении сердечной мышцы.
Кинетика тропонина Т по сравнению с другими маркёрами ИМ представлена в табл. 4-30 и на рис. 4-6. Миоглобин растворён в цитозоле, поэтому он повышается в крови первым. Далее появляются КК и КК-MB, но они довольно быстро исчезают из крови (в первые 1−2 дня). ЛДГ и ЛДГ1 появляются позднее и сохраняются дольше.
Таблица 4-30. Динамика изменений маркёров ИМ
|
|
Начало |
Максимум |
Возвращение |
Кратность |
|
Параметр |
|
увеличения |
увеличения |
|||
|
к норме, сут |
увеличения, раз |
||||
|
|
активности, ч |
активности, ч |
|||
|
|
|
|
|
||
КК |
|
2−4 |
24−36 |
|
3−6 |
3−30 |
КК-MB |
|
2−4 |
12−18 |
|
2−3 |
До 8 |
ЛДГ |
|
8−10 |
48−72 |
|
6−15 |
До 8 |
ЛДГ1 |
|
8−10 |
30−72 |
|
7−20 |
До 8 |
Миоглобин |
|
0,5−2 |
6−12 |
|
0,5−1 |
До 20 |
Тропонин Т |
|
3,5−10 |
12−18 |
|
7−20 |
До 400 |
|
|
|
(и 3−5-й день) |
|
|
|
Кинетика |
тропонина Т |
при ИМ отличается |
от таковой ферментов. |
|||
В первый день повышение тропонина Т зависит от кровотока в зоне инфаркта. При ИМ тропонин Т повышается в крови уже через 3−4 ч после начала болевого приступа, пик его концентрации приходится на 3−4-е сутки,
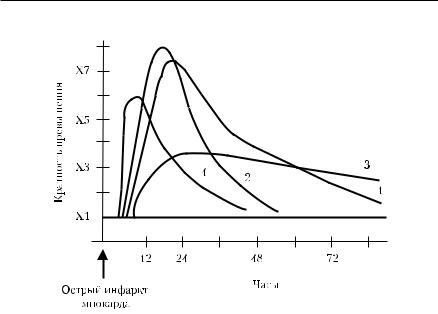
Биохимические исследования ■ 247
Рис. 4-6. Динамика изменений концентрации маркёров ИМ
втечение 5−7 дней наблюдается «плато», затем уровень тропонина Т постепенно снижается, однако остаётся повышенным до 10−20-го дня.
При неосложнённом течении ИМ концентрация тропонина Т снижается уже к 5−6-му дню, а к 7-му дню повышенные значения тропонина Т выявляют у 60% больных.
Специфичность определения тропонина Т в крови при ИМ составляет 90−100%. В первые 2 ч от начала болевого приступа чувствительность определения тропонина Т составляет 33%, через 4 ч — 50%, после 10 ч — 100%, на 7-й день — 84%.
Концентрация тропонина Т увеличивается после начала ИМ значительно в большей степени, чем активность КК и ЛДГ. У некоторых пациентов с успешной реканализацией концентрация тропонина Т может увеличиваться более чем в 300 раз. Концентрация тропонина Т в крови зависит от размера ИМ. Так, при крупноочаговом или трансмуральном ИМ после тромболизиса концентрация тропонина Т может повышаться до 400 раз, а у больных с ИМ без зубца Q — только в 37 раз. Время сохранения высокой концентрации тропонина Т в сыворотке крови также значительно дольше, чем КК и ЛДГ. Длительный период выхода тропонина Т в кровь увеличивает вероятность того, что положительный результат его определения был правильным, особенно в подострой фазе ИМ. «Диагностическое окно» (время, в течение которого выявляют изменённые значения исследуемого показателя при патологических состояниях) для тропонина Т больше
в4 раза по сравнению с КК и в 2 раза по сравнению с ЛДГ. Интервал абсо-

248 ■ Глава 4
лютной диагностической чувствительности при остром ИМ для тропонина Т составляет 125−129 ч, для КК и ЛДГ — 22 и 70 ч соответственно.
Концентрация тропонина Т в сыворотке повышается у больных после операций на сердце. При пересадке сердца концентрация тропонин Т увеличивается до 3−5 нг/мл и сохраняется на повышенном уровне 70−90 дней.
Некоронарогенные заболевания и поражения сердечной мышцы (миокардиты, травма сердца, кардиоверсия) также могут сопровождаться повышением концентрации тропонина Т в крови, однако динамика её изменения, характерная для ИМ, отсутствует.
Содержание тропонина Т в сыворотке крови может повышаться при септическом шоке и проведении химиотерапии вследствие токсического повреждения миокарда.
Ложноположительные результаты при определении тропонина Т в сыворотке крови могут быть получены при наличии гемолиза (интерференция), у больных со значительным увеличением концентрации Ig в крови, ОПН
иособенно ХПН, а также при хронической патологии мышц. Повышение концентрации тропонина Т возможно при острой алкоголь-
ной интоксикации, но при хронической интоксикации этого не наблюдают. Слегка повышенное содержание тропонина Т в сыворотке крови обнаруживают у 15% пациентов с выраженным повреждением скелетных мышц (активность КК-MB повышается у 50% таких больных), поэтому тропонин Т можно рассматривать как высокоспецифичный маркёр ИМ даже на фоне
повреждения скелетной мускулатуры.
В отличие от кардиального, в скелетных мышцах экспрессируется мышечный тропонин Т. Несмотря на то что для определения кардиального тропонина Т используют специфические к нему моноклональные АТ, при поступлении большого количества тропонина Т из скелетной мускулатуры возникают перекрёстные реакции.
У пациентов с концентрацией тропонина Т 0,1−0,2 нг/мл риск ранних осложнений особенно высок, поэтому в таких случаях необходима активная терапия и тщательное наблюдение в динамике. Поскольку только количественный метод определения тропонина Т позволяет измерять концентрацию в пределах 0,1−0,2 нг/мл, то это исследование имеет преимущество перед быстрым качественным методом, порог чувствительности которого 0,2 нг/мл.
Тропонин I в сыворотке крови
Референтные величины содержания тропонина I в сыворотке крови — 0−1 нг/мл. Тропонин I — структурный белок тропонинового комплекса мышц с молекулярной массой 26 500 Да. Тропонины I, как и тропонины Т, сердечной и скелетных мышц значительно отличаются по своей аминокислотной последовательности. Это позволило создать диагностические наборы для кардиальных изоформ указанных тропонинов. Для тропонина I различия в последовательности аминокислот между сердечной и скелетной изоформами составляет приблизительно 40%. Тропонин I и тропонин Т — компоненты сократительного аппарата, то есть структурно связанные белки кардиомиоцитов; в то время как растворённые в цитозоле белки (миоглобин) относительно быстро вымываются из зоны некроза, деструкция

Биохимические исследования ■ 249
сократительного аппарата кардиомиоцитов более продолжительна по времени, поэтому увеличение концентрации тропонинов сохраняется до 8−10 дней после начала ИМ. Тропонин I — высокоспецифичный маркёр ИМ. Повышение концентрации тропонина I в крови происходит через 4−6 ч после начала ИМ (у 50% больных), достигает максимума на 2-й день
иприходит к норме между 6-ми и 8-ми сутками. Средние значения концентрации тропонина I в крови на 2-й день ИМ составляют 80−100 нг/мл. При оценке результатов исследования тропонина I необходимо помнить, что отсекающие значения его концентрации (ИМ и не ИМ) составляют 2,5 нг/мл. Содержание тропонина I повышается у больных с нестабильной стенокардией при развитии микронекрозов. При стабильной стенокардии повышения содержания тропонина I не отмечают.
Вотличие от тропонина Т концентрация тропонина I не повышается у больных с почечной недостаточностью, при массивных повреждениях
изаболеваниях мышц.
Изофермент 1 лактат дегидрогеназы в сыворотке крови
Референтные величины активности ЛДГ1 составляют 15−25% общей активности ЛДГ в сыворотке крови.
Изоферменты ЛДГ содержатся в тканях в строго определённом соотношении, то есть каждая ткань, в том числе и кровь, имеет характерный, только ей свойственный спектр изоферментов ЛДГ. При ряде патологических состояний, когда в том или ином органе увеличивается проницаемость клеточных мембран и происходит повреждение тканей, изоферменты ЛДГ в избыточном количестве поступают в кровь. Поскольку активность изоферментов в тканях в несколько сот раз превышает активность их в сыворотке крови, спектр изоферментов ЛДГ в ней становится похожим на спектр изоферментов ЛДГ в поражённом органе. В норме в сыворотке крови соотношение активности изоферментов ЛДГ следующее: ЛДГ1 — 15−25% общей активности, ЛДГ2 — 30−40%, ЛДГ3 — 20−25%, ЛДГ4 — 10−15%, ЛДГ5 — 5−15%.
Определение активности ЛДГ1 используют в клинической практике главным образом для диагностики ИМ.
Убольных с ИМ в сыворотке крови резко повышается активность ЛДГ1
иотчасти ЛДГ2. Начало подъёма активности ЛДГ1 совпадает с таковой для общей ЛДГ, однако его продолжительность для ЛДГ1 выше — 10−12 сут.
При стенокардии активность ЛДГ1 не изменяется, поэтому при неясной клинической симптоматике и нормальной общей активности ЛДГ повышение активности ЛДГ1 указывает на мелкие некротические очаги в миокарде.
При заболеваниях печени возрастает активность ЛДГ5 и ЛДГ4 и уменьшается активность ЛДГ1 и ЛДГ2.
У больных с прогрессирующей мышечной дистрофией (миопатией) в крови повышается активность изоферментов ЛДГ1, ЛДГ2, ЛДГ3, снижается — ЛДГ4, ЛДГ5. Степень снижения активности ЛДГ4 и ЛДГ5 при миопатии коррелирует с тяжестью заболевания.
У больных острыми лейкозами отмечают отчётливое повышение активности изоферментов ЛДГ2 и ЛДГ3. При опухолевых заболеваниях отноше-

250 ■ Глава 4
ние ЛДГ5/ЛДГ1 всегда превышает 1. Опухолевые ткани отличаются значительной активностью изоферментов ЛДГ3, ЛДГ4, ЛДГ5.
Маркёры недостаточности питания
Нарушение питания — состояния, обусловленные изменением потребления пищи или нарушением её утилизации организмом, что приводит к нарушению функций на субклеточном, клеточном и органном уровнях. Синдром недостаточности питания может развиваться при дефиците в организме любого из незаменимых питательных веществ (белков, источников энергии, витаминов, макро- и микроэлементов). Однако в клинической практике чаще всего наблюдают белковую или белково-энергетическую недостаточность питания. Как правило, при выраженной белково-энер- гетической недостаточности отмечают признаки дефицита тех или иных витаминов, макро- и микроэлементов. Недостаточность питания с нарушением трофического статуса во всём многообразии её видов (белковая, энергетическая, витаминная и др.) наблюдают у 20−50% больных хирургического и терапевтического профиля [Костюченко А.Л. и др., 1996; Луфт В.М., Хорошилов И.Е., 1997; Хорошилов И.Е., 2000].
Оценка питания в настоящее время — обязательный компонент медицинской помощи госпитализированным больным в ведущих клиниках наиболее развитых стран мира. Объединённая комиссия по аккредитации организаций здравоохранения (JCAHO) требует соответствия питания больных определённым стандартам, которые включают [Davies B.G. et al., 1999]:
■оценку состояния питания пациента;
■регистрацию клинических проявлений нарушения питания;
■мониторинг изменений в статусе питания и ответной реакции пациента на внесённые коррективы.
Процесс оценки питания включает различные методы, которые можно условно разделить на 4 группы:
■методы оценки пищи;
■антропометрические (соматометрические);
■клинические;
■лабораторные.
Эти методы можно использовать для оценки питания раздельно, но наиболее целесообразно их сочетание.
Антропометрические методы оценки питания являются наиболее доступными и включают измерение:
■роста (длины тела);
■массы тела;
■окружностей живота, шеи, плеча и др.;
■толщины кожно-жировых складок в стандартных точках;
■расчёт индекса массы тела [отношение массы тела (кг) к росту (м), возведённому в квадрат].
Антропометрические методы имеют большие преимущества: они просты, безвредны, неинвазивны, могут быть проведены у постели больного, не требуют дорогого оборудования. Вместе с тем они имеют свои недостатки, к которым относятся:

Биохимические исследования ■ 251
■низкая чувствительность (не позволяют выявить кратковременные нарушения трофического статуса и не идентифицируют специфические дефициты);
■невозможность отличить нарушения, вызванные дефицитом какоголибо питательного вещества, от нарушений, обусловленных дисбалансом между потреблением белка и энергии;
■некоторые состояния больного (отёк, ожирение, потеря эластичности кожи, нарушение тургора) не позволяют провести точные измерения.
Клинические методы оценки питания включают изучение анамнеза и физикальное обследование для обнаружения признаков и симптомов, связанных с нарушением трофического статуса. В большинстве случаев эти признаки удаётся обнаружить только в прогрессирующей стадии истощения. Поэтому клинические оценки не позволяют выявлять нарушения питания в раннюю клиническую или доклиническую стадии.
Впоследнее время в клинической практике всё большее предпочтение отдают лабораторным методам оценки питания. При первичных и вторичных дефицитах питания тканевые депо постепенно истощаются, в результате чего снижается уровень этих веществ или их метаболитов в определённых средах организма, что можно обнаружить лабораторными методами. Использование лабораторных методов предпочтительно и с экономической стороны, так как позволяет обнаружить начальные признаки дефицита до развития клинического синдрома (следовательно, на лечение будет затрачено меньше средств), а также выявлять дефицит специфических питательных веществ.
Все лабораторные тесты для оценки питания можно разделить на 2 категории:
■ определение концентрации веществ в сыворотке крови больного; ■ определение скорости экскреции веществ с мочой.
Всыворотке крови присутствуют вновь абсорбированные, поступившие
спищей вещества. Поэтому концентрация вещества в сыворотке крови
отражает настоящее (по времени) потребление (поступление) вещества с пищей, то есть оценивает статус питания одномоментно, а не в течение длительного периода, что имеет очень важное значение при лечении неотложных состояний. Если функция почек у пациента не нарушена, то исследование мочи позволяет оценить метаболизм минералов, витаминов и белков. Экскреция этих веществ с мочой также отражает одномоментный статус питания, а не статус за длительный период времени.
Сывороточные маркёры
Биохимическая оценка белкового компонента трофического статуса питания включает определение концентрации различных белков в сыворотке крови больного. Главным органом синтеза сывороточных белковых маркёров служит печень, она же является первым из органов, которые поражаются при синдроме недостаточности питания. В табл. 4-31 приведён спектр белков сыворотки крови, используемых в качестве индикаторов при оценке статуса питания. Все эти белки выполняют транспортные функции.
Идеальный маркёр для оценки коротких по времени изменений белкового статуса должен обладать небольшим пулом в сыворотке крови, высокой скоростью синтеза, коротким периодом полужизни, специфичным
