
6 курс / Эндокринология / Персонализированная_эндокринология_в_клинических_примерах_Дедов
.pdfесть возможность пожизненного мониторинга прооперированных пациентов в установленные сроки наблюдения с обязательным контролем назначенной заместительной терапии.
Список литературы
1.Ершова Е.В. Обмен глюкозы, липидов и продукция инкретинов у пациентов с ожирением и сахарным диабетом 2 типа после билиопанкреатического шунтирования: дис. ... канд. мед.
наук. М., 2016.
2.Огнева Н.А. Изменение продукции инкретинов и обмена кальция у пациентов с морбидным ожирением, перенесших билиопанкреатическое шунтирование: дис. . канд. мед. наук. Москва, 2014.
3.Heber D., Greenway F., Kaplan L. et al. Endocrine and Nutritional Management of the PostBariatric Surgery Patient: An Endocrine Society Clinical Practice Guideline // J. Clin. Endocrinol. Metab. 2010. Vol. 95, N 11. P. 4823-4843.
4.The Diabetes Surgery Summit Consensus Conference: Recommendations for the evaluation and use of gastrointestinal surgery to treat type 2 diabetes // Ann. Surg. 2010. Vol. 251, N 3. P. 399-405.
Развитие гипогликемических состояний после билиопанкреатического шунтирования по поводу морбидного ожирения. Клинический случай
Н.В. Мазурина, Н.А. Огнева, Ю.И. Яшков, Е.А. Трошина, Г.А. Мельниченко Гипогликемии, развивающиеся после бариатрических вмешательств, в ряде случаев нельзя объяснить только развитием демпинг-синдрома. Описаны многочисленные случаи развития незидиобластоза у пациентов,
перенесших гастрошунтирование. Установление характера гипогликемии (в первую очередь, исключение органических причин) - одна из главных задач клинициста. В данной статье приводится описание постпрандиаль-ных гипогликемических состояний функционального характера у пациента, перенесшего БПШ по поводу морбидного ожирения.
Описание клинического случая
В мае 2012 г. в ФГБУ «НМИЦ эндокринологии» обратился пациент З. (рис. 3.12), 31 год, с жалобами на эпизоды резкой слабости после приема пищи, сопровождающиеся дрожью в руках, учащением ЧСС, профузным потоотделением.
Из анамнеза: с детства страдал ожирением. В 18 лет масса тела составляла 110 кг. Неоднократно предпринимал попытки снизить массу тела с помощью диеты, увеличения физической активности с положительным эффектом, однако длительно удерживать достигнутый резуль-

Рис. 3.12. Пациент до билиопанкреатического шунтирования и через 2 года после операции
тат не удавалось. Масса тела прогрессивно увеличивалась и к 2006 г. (25 лет) составляла 147 кг, ИМТ - 44,3 кг/м2 (см. рис. 3.12), стали беспокоить боли в суставах, одышка. В октябре 2006 г. было проведено БПШ, на фоне чего за 8 мес пациент похудел до 80 кг и удерживает эту массу тела по настоящее время.
С момента проведения БПШ пациент регулярно принимал препараты кальция и витамина D и осуществлял контроль за биохимическими показателями. Режим питания нерегулярный (от 2 до 8 приемов пищи в день), рацион с недостаточным потреблением белка, чрезмерным употреблением легкоусвояемых углеводов при почти полном отсутствии продуктов, богатых клетчаткой. Алкоголь употребляет умеренно, страдает никотиновой зависимостью. Образ жизни в целом малоподвижный, однако за последние 2 мес в связи с изменением характера работы физическая активность значительно возросла.
В течение последнего года на фоне смены работы (хронический стресс, нерегулярное питание, нарушение режима сна) стали беспокоить эпизоды слабости, возникающие после еды, сопровождающиеся дрожью в руках, учащением ЧСС, профузным потоотделением. Для купирования подобных состояний стал использовать сок, кока-колу, конфеты, на фоне приема которых состояние улучшалось, однако далее симптомы возобновлялись, что побуждало пациента вновь употреблять легкоусвояемые углеводы. В течение последних 2 мес стал
испытывать страх потери сознания при вождении автомобиля, что стало причиной обращения к врачу.
В апреле 2012 г. обратился в поликлинику по месту жительства, где было выявлено снижение гликемии натощак до 2,9 ммоль/л. Была проведена МРТ головного мозга - патологии не выявлено.
При осмотре: состояние удовлетворительное, рост - 182 см, масса тела - 82 кг, ИМТ - 24,7 кг/м2, окружность талии - 94 см, окружность бедер - 92 см. ПЖК развита умеренно, распределена равномерно. Кожный покров обычной окраски, множественные тонкие бледные стрии на коже живота, бедер, внутренней поверхности плеч. На передней брюшной стенке - значительный кожно-жировой «фартук». Опорно-двигательный аппарат - без видимых изменений. Неврологических симптомов нет.
При обследовании: биохимический и клинический анализы крови - без особенностей. При проведении трехчасового орального глю-козотолерантного теста с 75 г глюкозы (табл. 3.6) отмечалось повышение (пик - на 30-й минуте) уровня инсулина (ИРИ), ГПП-1, а также подавление уровня глюкагона, что способствовало снижению уровня
гликемии к 120-й минуте проведения теста до 2,7 ммоль/л. Снижение уровня глюкозы в крови сопровождалось характерной, преимущественно адренергической клинической симптоматикой.
Таблица 3.6
Результаты перорального глюкозотолерантного теста с 75 г глюкозы
Время, мин |
Глюкоза, ммоль/л |
ИРИ, ЕД/л |
ГПП-1, нг/мл |
Глюкозозависимый |
Глюкагон, нг/мл |
|
|
|
|
инсулинотропный |
|
|
|
|
|
полипептид, нг/мл |
|
0 |
3,1 |
2,8 |
0,12 |
2,83 |
0,53 |
30 |
6,4 |
97,7 |
0,61 |
3,0 |
0,41 |
60 |
4,7 |
56,2 |
0,4 |
2,95 |
0,44 |
120 |
2,7 |
40,9 |
0,28 |
2,91 |
0,49 |
180 |
3,0 |
20,1 |
0,13 |
2,85 |
0,52 |
У пациентов, подвергшихся ГШ, определяется значительно более высокий постпрандиальный уровень ГПП-1 по сравнению с контрольной группой здоровых лиц. В ряде исследований у больных с нейроглю-копеническими симптомами уровень ГПП-1, инсулина и С-пептида был значительно выше.
Однако исследование Sun H. Kim не выявило взаимосвязи выраженности гипогликемических симптомов с уровнем инсулина. В данной работе были исследованы плазменные уровни глюкозы и инсулина в ходе орального глюкозотолерантного теста в двух группах пациентов, перенесших ГШ - с симптомами гипогликемии в анамнезе и без таковых, и в трех контрольных группах больных с избыточной массой тела и ожирением, различающихся по степени чувствительности к инсулину. Пиковые значения инсулина в хирургических группах действительно были выше, нежели в группах контроля, однако максимальные и минимальные показатели глюкозы и инсулина не различались в обеих группах перенесших ГШ, при этом у трети фиксировалась гликемия <2,7 ммоль/л без каких-либо клинических проявлений.
Бессимптомные гипогликемии также были диагностированы и другими исследователями. A. Goldfine и соавт. выявили бессимптомные постпрандиальные гипогликемии (глюкоза - ниже 3,3 ммоль/л) в 33% случаев после ГШ, а Vidal и соавт. - в 12,5% случаев (за гипогликемию в этом исследовании принимали значения менее 2,7 ммоль/л). Интересно, что бессимптомные гипогликемии (менее 3,0 ммоль/л) в ходе орального глюкозотолерантного теста также были отмечены примерно

у 3-4% пациентов, подвергшихся бандажированию желудка, процедуре, не меняющей анатомию желудочно-кишечного тракта.
Таким образом, помимо гиперсекреции ГПП-1 и ИРИ, в генезе тяжелых гипогликемических состояний, вероятно, играют роль и другие причины: изменение секреции глюкагона, а также ряд внепанкреатиче-ских факторов, таких как грелин, лептин, пептид YY, висфатин и т.д. Возможно, увеличение в послеоперационном периоде уровня пептида YY потенцирует действие ГПП-1, усиливая инкретиновый эффект, а наличие отрицательной обратной связи между уровнем инсулина и грелина и снижение последнего после шунтирующих процедур (из-за удаления грелинпродуцирующего дна желудка) могут также способствовать формированию гипогликемий.
Учитывая уровень гликемии натощак (3,1 ммоль/л при обследовании в стационаре и 2,9 ммоль/л по месту жительства), была проведена проба с голоданием (табл. 3.7) для исключения органического гиперин-сулинизма.
Таблица 3.7
Гликемия в ходе 72-часовой пробы с голоданием
Дата |
8:30 |
13:30 |
17:30 |
21:00 |
23:00 |
3:00 |
6:00 |
1-е сутки |
- |
3,3 |
3,7 |
3,7 |
3,8 |
3,9 |
3,8 |
2-е сутки |
3,9 |
3,2 |
3,5 |
3,7 |
3,6 |
3,6 |
3,4 |
3-и сутки |
2,9 |
3,1 |
3,3 |
2,8 |
3,8 |
3,3 |
3,3 |
1-е сутки: С-пептид - 1,3 нг/мл (норма - 1,1-4,4 нг/мл), ИРИ - 3,3 ЕД/л (норма - 2,3-26,4 ЕД/л).
3-и сутки: С-пептид - 0,4 нг/мл, ИРИ - 0,5 ЕД/л.
Первое сообщение о развитии органического гиперинсулинизма у бариа-трических пациентов было опубликовано в 2005 г. и принадлежало исследователям из клиники Мэйо. Группа ученых, возглавляемая G. Service, описала развитие постпрандиальных нейроглюкопенических симптомов (нарушение сознания, обмороки, судороги) у шести пациентов с ГШ в анамнезе. После дообследования всем шести пациентам потребовалось хирургическое лечение - резекция поджелудочной железы. Гистологическое исследование выявило островковоклеточную гипертрофию и гиперплазию, характерную для незидиобластоза, у пяти больных, у одного пациента была верифицирована инсулинома (впрочем, у данного пациента гипогликемии дебютировали до бариатрического лечения).
Спустя несколько месяцев M. Patti и коллеги также описали трех пациентов с похожей клинической симптоматикой, манифестировавшей
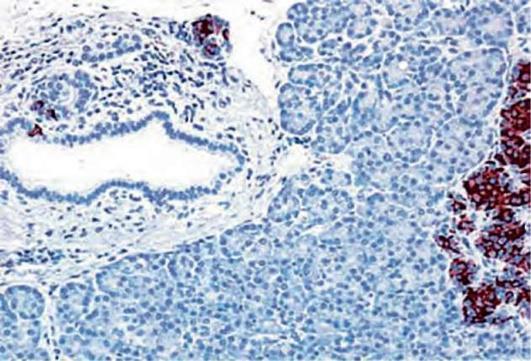
Рис. 3.13. Гистологическая картина незидиобластоза у пациента с органическим гиперинсулинизмом, развившимся после гастрошунтирования (Service G. et al. N Engl J Med 2005;
353 (3): 249-254)
после ГШ, резистентных к медикаментозной терапии. Одному из больных была выполнена реоперация (восстановление нормального пассажа по желудочно-кишечному тракту) с положительным эффектом, остальные подвергнуты резекции поджелудочной железы с последующей гистологической верификацией незидиобластоза.
Уже через 2 года после первого сообщения о серьезных гипогликемиях после бариатрических процедур число лиц с аналогичной патологией достигло 37 и продолжало расти, причем большинству больных потребовалось проведение хирургических вмешательств на поджелудочной железе.
Воснове явлений, приводящих к развитию тяжелых постбариатриче-ских гипогликемий, резистентных к дието- и фармакотерапии, предполагают дисбаланс между гиперсекрецией ГПП-1, ИРИ и улучшенной чувствительностью к инсулину.
Входе пробы не отмечалось снижения гликемии менее 2,5 ммоль/л, также не возникало клинических проявлений гипогликемии. Уровень ИРИ и С-пептида после голодания снизился по сравнению с исходным, что позволило исключить органический гиперинсулинизм как причину гипогликемических явлений.
Проведенное УЗИ органов брюшной полости не выявило патологических объемных образований. Учитывая перенесенное БПШ, был исследован фосфорно-кальциевый обмен, патологических отклонений выявлено не было, рекомендовано продолжить лекарственную терапию в прежнем объеме.
Таким образом, клиническая картина пациента З. была представлена функциональной постпрандиальной гипогликемией, обусловленной шунтирующим вмешательством на желудочно-кишечном тракте. Гиперинсулинемия и, как следствие, снижение уровня постпрандиаль-ного уровня глюкозы - результат повышения уровня инкретинов (в первую очередь ГПП-1) из-за быстрого и массивного поступления в подвздошную кишку простых углеводов, стимулирующих L-клетки тонкой кишки, а также снижения уровня глюкагона. Ситуация усугублялась приемом легкоусвояемых углеводов.

Имеющиеся жалобы, а также данные проведенного обследования были расценены как функциональная гипогликемия в рамках позднего демпинг-синдрома, манифестировавшая в отдаленном периоде после шунтирующей операции на фоне регулярного потребления большого количества простых углеводов. Клинический диагноз: «Функциональная гипогликемия (демпинг-синдром) после БПШ по поводу морбид-ного ожирения в 2006 г.».
Пациенту было рекомендовано рациональное дробное питание не менее 5-6 раз в сутки, снижение потребления сладких и молочных блюд, а также увеличение потребления белка и клетчатки. На фоне изменения питания была отмечена выраженная положительная динамика: улучшение самочувствия, исчезновение гипогликемических состояний.
В представленном клиническом случае у пациента З. гипогликемиче-ские состояния носили функциональный характер, обусловленный изменением рациона питания в сторону преобладания потребления легкоусвояемых углеводов, и были успешно купированы с помощью диетических ограничений. Именно поэтому всем больным, подвергшимся бариатрическим операциям, необходим тщательный мониторинг состояния углеводного обмена для предупреждения и своевременной диагностики гипогликемических явлений, значительно снижающих качество жизни больных, а в ряде случаев представляющих серьезную угрозу.
Список литературы
1.Akimov V. et al. A new view on pathogenesis of dumping-syndrome // Vestn. Khir. Im I.I. Grek. 2008. Vol. 167. P. 22-25.
2.Anlauf M. et al. Persistent hyperinsulinemic hypoglycemia in 15 adults with diffuse nesidioblastosis: diagnostic criteria, incidence, and characterization of beta-cell changes // Am. J. Surg. Pathol. 2005. Vol. 29. P. 524-533.
3.Bantle J. et al. Hyperinsulinemic hypoglycemia developing late after gastric bypass // Obes. Surg. 2007. Vol. 17. P. 592-594.
4.Beckman L. et al. Changes in gastrointestinal hormones and leptin after Roux-en-Y gastric bypass surgery // J. Parenter. Enteral Nutr. 2011. Vol. 35. P. 169-180.
5.Bernard B. et al. Hypoglycaemia following upper gastrointestinal surgery: case report and review of the literature // BMC Gastroenterol. 2010. Vol. 10. P. 77.
6.Brechner R. et al. A graded evidence-based summary of evidence for bariatric surgery // Surg. Obes. Relat. Dis. 2005. Vol. 1. P. 430-441.
7.Buchwald H. et al. Metabolic bariatric surgery Worldwide 2008 // Obes. Surg. 2009. Vol. 19. P. 1605-1611.
8.Bult M. et al. Surgical treatment of obesity // Eur. J. Endocrinol. 2008. Vol. 158, N 2. P. 135-145.
9.Clancy T. et al. Post-gastric bypass hyperinsulinism with nesidioblastosis: subtotal or total pancreatectomy may be needed to prevent recurrent hypoglycemia // J. Gastrointest. Surg. 2006. Vol.
10.P. 1116-1119.
10.Clifton P. Bariatric surgery: results in obesity and effects on metabolic parameters // Curr. Opin. Lipidol. 2011. Vol. 22. P. 1-5.
11.Cui Y. et al. Advances in the etiology and management of hyperinsulinemic hypoglycemia after Roux-en-Y gastric bypass // J. Gastrointest. Surg. 2011. Vol. 15. P. 1879-1888.
12.Deitel M. The change in the dumping syndrome concept // Obes. Surg. 2008. Vol. 18. P. 16221624.
13.Dirksen C. et al. Mechanisms ofimproved glycaemic control after Roux-en-Ygastric bypass // Diabetologia. 2012. Vol. 55. P. 1890-1901.
14.Edholm T. et al. Differential incretin effects of GIP and GLP-1 on gastric emptying, appetite, and insulin-glucose homeostasis // Neurogastroenterol. Motil. 2010. Vol. 22. P. 1191-1200. e315.
15.Goldfine A. et al. Patients with neuroglycopenia after gastric bypass surgery have exaggerated incretin and insulin responses to a mixed meal // J. Clin. Endocrinol. Metab. 2007. Vol. 92. P. 46784685.
16.Heber D. et al. Endocrine and nutritional management of the post-bariatric surgery patient: An Endocrine Society Clinical Practice Guideline // J. Clin. Endocrinol. Metab. 2010. Vol. 95, N 11. P. 4823-4843.
17.Heinlein C. Dumping syndrome in Roux-en-Y bariatric surgery patients: are they prepared? // Bariatric Nurs. Surg. Patient Care. 2009. Vol. 4, N 1. P. 39-47.
18.Holst J. The physiology of glucagon-like peptide 1 // Physiol. Rev. 2007. Vol. 87. P. 1409-1439.
19.Kim S. et al. Plasma glucose and insulin regulation is abnormal following gastric bypass surgery with or without neuroglycopenia // Obes. Surg. 2009. Vol. 19. P. 1550-1556.
20.Lamounier R. et al. Incretins: clinical physiology and bariatric surgery-correlating the enteroendocrine system and a potentially anti-dysmetabolic procedure //
Obes. Surg. 2007. Vol. 17. P. 569-576.
21.le Roux C. et al. Gut hormone profiles following bariatric surgery favor an anorectic state, facilitate weight loss, and improve metabolic parameters // Ann. Surg. 2006. Vol. 243. P. 108-114.
22.Marsk R. et al. Nationwide cohort study of post-gastric bypass hypoglycemia including 5,040 patients undergoing surgery for obesity in 1986-2006 in Sweden // Diabetologia. 2010. Vol. 53. P. 2307-2311.
23.McLaughlin T. et al. Reversible hyperinsulinemic hypoglycemia after gastric bypass: a consequence of altered nutrient delivery // J. Clin. Endocrinol. Metab. 2010. Vol. 95. P. 1851-1855.
24.Mechanick J. et al. AACE/TOS/ASMBS Guidelines // Surg. Obes. Relat. Dis. 2008. Vol. 4. P. S109-S184.
25.Neary M. et al. Gut hormones: implications for the treatment of obesity // Pharmacol. Ther. 2009. Vol. 124. P. 44-56.
26.Patti M. et al. Hypoglycaemia following gastric bypass surgery: diabetes remission in the extreme? // Diabetologia. 2010. Vol. 53. P. 2276-2279.
27.Patti M. et al. Severe hypoglycaemia postgastric bypass requiring partial pancreatectomy: evidence for inappropriate insulin secretion and pancreatic islet hyperplasia // Diabetologia. 2005. Vol. 48. P. 2236-2240.
28.Rabiee A. et al. Hyperinsulinemic hypoglycemia after Roux-en-Y gastric bypass: unraveling the roles of gut hormonal and pancreatic endocrine dysfunction // J. Surg. Res. 2011. Vol. 167. P. 199-
29.Rubino F. et al. The early effect of Roux-en-Y gastric bypass on hormones is involved in body weight regulation and glucose metabolism // Ann. Surg. 2004. Vol. 240. P. 236-242.
30.Scavini M. et al. Asymptomatic hyperinsulinemic hypoglycemia after gastric banding // N. Engl. J. Med. 2005. Vol. 353. P. 2822-2823.

31.Service G. et al. Hyperinsulinemic hypoglycemia with nesidioblastosis after gastric bypass surgery // N. Engl. J. Med. 2005. Vol. 353. P. 249-254.
32.Thaler J. et al. Hormonal and metabolic mechanisms of diabetes remission after gastrointestinal surgery // Endocrinology. 2009. Vol. 150. P. 2518-2525.
33.Ukleja A. Dumping syndrome: pathophysiology and treatment // Nutr. Clin. Pract. 2005. Vol. 20. P. 517-525.
34.Vella A. et al. Incretin hypersecretion in postgastric bypass hypoglycemia: primary problem or red herring? // J. Clin. Endocrinol. Metab. 2007. Vol. 92. P. 45634565.
Глава 4. НЕЙРОЭНДОКРИННЫЕ ЗАБОЛЕВАНИЯ
4.1. ПРЕДИСЛОВИЕ
Л.Я. Рожинская, Е.И. Марова, Е.О. Мамедова
Клиническая нейроэндокринология - раздел эндокринологии, изучающий, с одной стороны, заболевания гипоталамо-гипофизарной системы и, прежде всего, гормонально-активные опухоли гипофиза, с другой - НЭО других органов и систем, вырабатывающие различные гормоны, как свойственные тем или иным органам, так и вследствие эктопической продукции.
Опухоли гипофиза составляют до 25% всех опухолей головного мозга. Наиболее часто встречаются аденомы - доброкачественные опухоли из клеток аденогипофиза. Однако нередко аденомы гипофиза имеют местный инвазивный рост и могут инфильтрировать соседние структуры, а также приводить к серьезным осложнениям из-за метаболических эффектов избыточной продукции гормонов этими опухолями. К гормонально-активным аденомам гипофиза относятся пролактиномы, кортикотропиномы, соматотропиномы, тиреотропиномы и др.
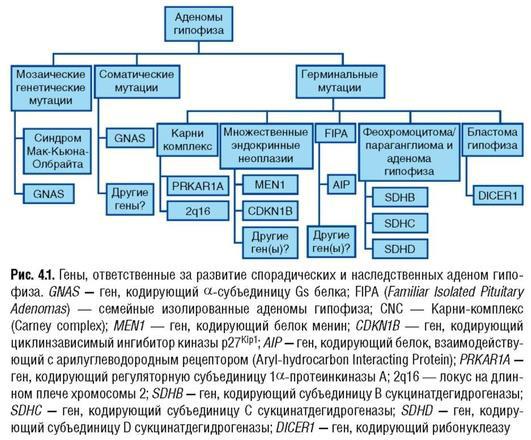
Также выделяют спорадические и семейные формы аденом гипофиза. Последние составляют около 5% всех случаев аденом гипофиза. Стремительное развитие молекулярной биологии, расширение спектра генетических исследований в ряде случаев позволяют своевременно выявить ряд малосимптомных компонентов наследственных синдромов, выбрать правильную тактику лечения и предсказать развитие заболевания у родственников пациентов. На рис. 4.1 представлены варианты наследственных синдромов, компонентом которых, в частности, являются аденомы гипофиза.
НЭО - гетерогенная группа различных по локализации, характеру роста и клинической симптоматике опухолей, происходящих из нейроэн-докринных клеток и, соответственно, имеющих сходные цитологические характеристики. С современных позиций, в организме существует

диффузная нейроэндокринная система, клетки которой должны отвечать следующим критериям: могут продуцировать нейротрансмиттеры, нейро-модуляторы или нейропептиды; имеют большое количество секреторных гранул, из которых экзоцитозом выделяются гормоны в ответ на внешние стимулы; не имеют аксонов и синапсов. Эти опухоли могут происходить из островковых клеток поджелудочной железы, нейроэндокринных клеток, диффузно локализующихся по всему дыхательному и желудочно-кишечному тракту. Указанные новообразования, прежде всего, попадают в поле зрения онкологов и частично эндокринологов. Опухоли мозговой ткани надпочечников, гипофиза, из парафолликулярных клеток щитовидной железы и ОЩЖ имеют сходные морфофункциональные характеристики, однако рассматриваются отдельно и являются предметом изучения преимущественно эндокринологами. В табл. 4.1 представлена классификация НЭО в зависимости от эмбриогенеза.
Как гормонально-активные аденомы гипофиза, так и НЭО относят к группе редких заболеваний, они поздно диагностируются, значитель-
Таблица 4.1
Группы нейроэндокринных опухолей в зависимости от эмбриогенеза
Отдел эмбриональной |
Группа опухолей |
Характеристика |
кишечной трубки |
|
|
Верхний (foregut) |
Опухоли тимуса, легких, |
Низкое содержание серотонина, высокое содержание |
|
желудка, двенадцатиперстной |
предшественника серо-тонина - 5- |
|
кишки и поджелудочной железы |
гидрокситриптофана, усиленная секреция гистамина, |
|
|
атипичное течение карциноидного синдрома. |
|
|
Высокий риск метастазирования в кости |
Средний (midgut) |
Опухоли тонкой кишки, |
Редкая гормональная секреция. Усиленная секреция |
|
аппендикса, правых отделов |
серотонина и вазоактив-ных субстанций. Высокий |
|
толстой кишки |
риск метаста-зирования в печень |
Концевой (hindgut) |
Опухоли левых отделов |
- |
|
||
|
ободочной кишки, прямой |
|
|
кишки |
|
но сокращают продолжительность жизни без адекватного и своевременного лечения. Почти каждый случай указанных новообразований является примером трудной диагностики, персонифицированного выбора лечения и тактики ведения пациента.
В настоящей главе представлены трудные для диагностики и лечения случаи аденом гипофиза и АКТГ-продуцирующих опухолей легких, аппендикса и надпочечника, а также примеры эндокринных опухолей в рамках наследственных синдромов.
4.2. БЛОК КЛИНИЧЕСКИХ ПРИМЕРОВ
АДРЕНОКОРТИКОТРОПНЫЙ ГОРМОНЗАВИСИМЫЙ ЭНДОГЕННЫЙ ГИПЕРКОРТИЦИЗМ
Ж.Е. Белая
Ниже представлены клинические примеры, иллюстрирующие сложности дифференциальной диагностики АКТГ-зависимого эндогенного гиперкортицизма.
Пациенты З., 18 лет, и П., 21 год, поступили в отделение нейроэндо-кринологии и остеопатий ФГБУ «НМИЦ эндокринологии» одновре-
