
6 курс / Эндокринология / Stroev_Endokrinologia_podrostkov
.pdf
тивности их действия. Такая резистентность часто связана с рецепторными механизмами. Это может подразумевать:
S наследственный дефект внутриклеточных рецепторов потипу одиночных аминокислотных замен или отсутствия их экспрессии (как это наблюдается в отношении рецепторов ан-дрогенов при тестикулярной феминизации— синдроме Морриса, псевдогипоалъдосте-ронизме, наследственной резистентности к кортизолу); S
наследственный дефект мембранных поверхностных рецепторов {почечный питрессин-резистентный несахарный диабет, синдром карликовости Ларона,
некоторые формы тяжелого наследственного
инсулинорезис-тентного сахарного диабета); S
блокадурецепторов аутоантителами (как этоотмечено при myasthenia gravis — в отношении Н-
холинергических, а при acantosis nigricans—в отношении инсулиновых рецепторов); Sподавление экспрессии генов рецепторов эпигенетическими воздействиями (считается, что подобным образом переедание и ожирение могут способствовать развитию гиперин-сулинемических форм сахарного диабета). Не менее важен пострецепторный
механизм гор-монорезистентности. При
псевдогипопаратирозе имеет местодефект сопряжения рецептора паратгор-мона и рецепторов ряда других регуляторов с адени-латциклазами за счет наследственного дефекта гуа-нилнуклеотид- связывающего регуляторного белка. Многие формы
инсулиннезависимого сахарного диабета зависят от наличия пострецепторных дефектов в опосредовании действия инсулина на его мишени.
Иногда рецепторная нечувствительность к гормону связана с неспособностью ткани выработать под его влиянием тканевой белковый гормон-посредник. Так,
при карликовости Ларона продукция СТГ адекватна, но ткани из-за дефекта рецептора СТГне образуют под действием гормона роста нужного количества одного из соматомединов — инсулиноподобного фактора ро-
ста I (соматомедина С). Важно подчеркнуть, что тканевая резистентность бывает не только к пептидным
или тирозиновым гормонам, но и к стероидам. Так,
А. Вингерхёдс с соавт. (1976) описали пациента с выраженым гиперкортицизмом, но без признаков синд-
рома Иценко-Кушинга.
•Наконец, если сами клетки-мишени атрофиро-
ваны или повреждены, они могут не отвечать
даже на сильный гормональный сигнал. Так, глюкагон перестает вызывать гипергликемию при тяжелой печёночной недостаточности. В условиях истощения адипоциты прекращают отвечать вы-
работкой лептина на инсулин и глюкагоноподоб-ный пептид — и перестает тормозиться аппетит. Вазопрессин, например, не эффективен при выраженном нефросклерозе. Избыточное действие гормона также может иметь несколько типовых причин.
•Недостаточность физиологического серво-
механизма, контролирующего продукцию гормона по типу обратной связи (например, снижение чувствительности В-клеток островков Лангерганса к глюкозе при некоторых формах ин-
сулиннезависимого сахарного диабета или
клеток гипоталамуса, вырабатывающих корти-
колиберин, к глюкокортикоидам и АКТГ— при болезни Иценко-Кушинга).
•Обход физиологического механизма обратной связи из-за появления избытка стимуляторов гормонообразующих клеток, не включённых в сервомеханизм. Данная группа гиперфункциональных эндокринопатий имеет почти исключительно аутоиммунную природу и вызвана имму- ноглобулинами-агонистами рецепторов тропных гормонов. Типичным примером служит базедова болезнь, при которой гиперплазия и гиперфункция щитовидной железы вызываются, в обход гипоталамо-гипофизарной регуляции, аутоантителами к ганглиозидной и белковой частям рецепторов ТТГ. Подобные аутоантитела могут вызвать изолированную гиперфункцию железы, но чаще обусловливают ее гиперплазию и гиперфункцию. Хронические неэндокринные заболевания могут создавать неиммунологические сигналы, стимулирующие продукцию того или иного гормона с развитием вторичной гиперпродукции последнего. Примером служит вторичный гипералъдостеронизм, закрепляющий механизм системных отёков при сердечной недостаточности. В роли сигнала, побуждающего в конечном итоге к гиперфункции «ренин-ангиотензин-алъ- достероновой системы», выступает снижение
объема сердечного выброса.
•Утечка гормона из железы вследствие ее дест-
рукции (примером служат эпизоды гипертироза при развитии аутоиммунного подострого тироиди-
та Де Кервена).
•Нерегулируемая гиперпродукция гормона отно-
сительно высокодифференцированной доброкачественной эндокринной опухолью в пределах той
31

железы, которая служит его основным источником (таков гипертироз при токсической аденоме щитовидной железы, персистирующая галакто- рея-аменорея при пролактиноме аденогипофиза). Изредка гормонообразующими являются злокачественные опухоли эндокринных желез.
• Метаболический блок во взаимопревращени ях гормонов может вызвать не только недоста ток гормона, являющегося конечным звеном цепи превращений, но и избыток промежуточного гор монально-активного продукта. Характерным при мером служит врождённая гиперплазия коры надпочечников, вызванная дефицитом 21-гидро- ксилазы. При дефиците этого фермента страдает биосинтез минералокортикоидов, а избыток предшественников превращается в андрогены.
Поэтому гипоалъдостеронизм и солътеряющий синдром может сочетаться с гиперандрогенизмом и вирилизацией девочек, либо с макрогенитосомией и с преждевременным половым со зреванием мальчиков.
Синдром избыточной эффективности действия гормона может иметь также внежелезистое проис-
хождение. Основныеформыэтогоявленияследующие.
•Эктопическая, автономная от сервоконтроля,
продукция избытка гормонов вне основных эндокринных желез. Этот вариант эндокринной гиперфункции связан, как правило, с образованием гормонов, кодируемых одним-двумя генами, в опухолевых, чаще злокачественных, клетках апудоцитарной природы (синтез АКТГ и паратгормона овсяноклеточными карциномами бронхов, а также серото-
нина и энтериновых пептидов — карциноидами желудочно-кишечного тракта, гормонообразование в тимомах). Изредка опухоли неапудоцитарной природы могут осуществлять подобный эктопический синтез (продукция тироидных гормонов в опухолях яичника).
•Продукция избытка активного гормона из прогормонов в неопухолевых периферических тканях. Примером служат гиперэстрогенизм при ожирении и при печеночной патологии из-за избы-
точной конверсии андростендиона в эстрогены
адипоцитами или гепатоцитами, а также эндогенный гипервитаминоз D при саркоидозе из-за образования макрофагами гранулём избытка высокоак-
тивной формы кальциферола.
•Ятрогенный избыток гормона или его аналога может быть результатом лечения или самолечения. Часто это относится к избыточному приему
адреномиметиков, тироидных гормонов, анд-
рогенов и кортикостероидов. Интересно, что некоторые растительные пищевые продукты содержат действенные аналоги животных гормонов. Такова солодка, имеющая в своём составе аналоги алъдостерона (глицерризиниевую кислоту). Злоупотребление лакричными конфетами и усиленное траволечение солодкой вызывает картину,
сходную с первичным гиперальдостеронизмом,
провоцируя артериальную гипертензию.
•Аутоантитела к гормональным рецепторам
периферических тканей-мишеней могут имитировать избыточное действие соответствующих гормонов. Как правило, они образуются по иди-
отип-антиидиотипическому механизму в ответ на антитела к гормону. Инсулиномиметичес-кие аутоантитела обнаружены у подростков,
больных «криптогенной» гипогликемией и лабильным инсулинзависимым сахарным ди-
абетом, а также получены экспериментально, Связываясь с инсулиновым рецептором, они временно воспроизводят часть эффектов гормона, нарушая соотношение между уровнем глюкозы и активностью В-клеток (Ди Марио В. с соавт. 1977; Шехтер Й. с соавт., 1982).
•Тканевая гиперчувствительность к гормонам встречается реже, чем резистентность. Однако описаны почечная гиперчувствительность к мине-
ралокортикоидам {псевдогиперальдостеро-
низм с низким уровнем ренина и альдостерона и задержкой натрия), а также глюкокортикоидная глаукома у больных, которые особенно чувствительны к влиянию кортикостероидов на внутриглазное давление. Широко известна индукция ти роидными гормонами экспрессии рецепторов катехоламинов в сердце и сосудах, участвующая в патогенезе артериальной гипертензии и миокар диодистрофии при гипертирозе.
•Изолированные понижение связывания гормона в крови и ускорение его деградации, как пра вило, недостаточны для индукции его избыточного действия в силу нивелирующего эффекта нормаль-ных механизмов обратного контроля. Но эндокри нологи традиционно не оставляют без внимания возможность появления стабильного внежелези стого избытка гормона, связанного с особеннос тями его транспорта и катаболизма. Дело в том что при нарушениях нормальных взаимоотноше ний тропных и периферических гормонов или в со четании с действием других факторов данный механизм приобретает известное значение. Так приголодании,печёночнойнедостаточностиине-
32

фротическом синдроме дефицит альдостеронсвязывающих белков плазмы и недостаточный распад алъдостерона в печени вносят свой вклад в развитие вторичного гипералъдостеронизма и
отёков, которые обусловлены прежде всего другим фактором — понижением онкотического давления плазмы. Эндокринопатии бывают моногланду лярными, то естьпоражающимиоднуэндокринную железу.Новстречаютсяиплюригландулярные поражения. В случаевовлечениявдисфункциюмногих железнеобходимоучестьвозможностьсистемных причинтакогопоражения.Плюригландулярные синдромы бывают гипоталамо-гипо-физарными, аутоиммунными,рецепторнымиинаследственными. При центральной этиологии плюригландулярное поражение является вторичным по отношению к панги-
попитуитаризму (тироидная, надпочечниковая недостаточность и гипогонадизм).
При аутоиммунном плюригландулярном синдроме
аутоантитела поражают несколько желёз внутренней секреции, имеющих общие или сходные антигены. Из-
вестен аутоиммунный синдром Шмидта {инсулинзависимый сахарный диабет, аутоиммунный тироидит, гипопаратироз и гонадо-надпочечниковая недостаточность).
При наличии аутоантител к 17-а-гидроксилазе аутоаллергия поражает стероидопродуцирующие клетки в коре надпочечника и в гонадах. Аутоиммунные плю-
ригландулярные синдромы часто сопровождаются неэндокринными аутоиммунными расстройствами {ар-
трит, бронхиальная астма, витилиго, атрофический гастрит с В1-дефицитной анемией), а также другими признаками нарушенного иммунитета (напри-
мер, кандидоз).
Рецепторная плюригландулярная аномалия развивается при дефекте гуанидин-связывающей части гормональных рецепторов семейства G-белков. Наблюдается неэффективность действия многих гормонов на их мишени {псеедогипопаратироз, гипергонадотропный гипогонадизм, первичный гипотироз).
Описаны три различных плюригландулярных наследственных синдрома, характеризующихся аномалией экспресии онкогенов и неопластическими процессами в разных гормонообразующих клетках {MEN-I, 11а, 11в — от англ. Multiple Endocrine Neoplasiae).
Это аутосомно-доминантные растройства с варьирующей пенетрантностью. Носитель синдрома MEN наследует один из двух аллельных генов дефектным, а во втором на протяжении онтогенеза имеет место соматическая мутация. Если она предоставляет клеткам-
мутантам селективные преимущества, формируется доброкачественная или злокачественная опухоль.
При синдроме MEN I имеется дефект гена под аналогичным названием из 11 -й хромосомы, который служит антионкогеном. При других типах MEN-синдро- ма генетический дефект, вероятно, связан с протоонкогеном RET из 10-й хромосомы, онкобелок которого является мембранной тирозин-протеинкиназой со свойствами ростового рецептора (Зайчик А.Ш.,
Чурилов Л.П., 2002).
Синдром MEN-1 (он же множественный эндокринный аденоматоз или синдром Вермера) включает доброкачественную аденому паращитовидной железы, а также доброкачественную либо злокачественную гормонообразующую опухоль островковых клеток поджелудочной железы (это, в порядке убывания частоты, может быть гастринома, инсулино-
ма, значительно реже — глюкагонома или ВИПома).
Гастриномы обусловливают у таких больных тяжё-
лые язвы желудка {синдром Цоллингера-Эллисона).
Для синдрома MEN I характерны также гипофизар-
ные аденомы (соматотропинома, пролактинома, реже— кортикотропинома). Бывают карциноиды из диффузных эндокриноцитов желудочно-кишечного тракта, липомы и аденомы коры надпочечников.
Клиника некоторых гормонально-активных опухолей у подростков подробно описывается ниже.
Синдром MEN II отличается присутствием медул-
лярной карциномы С-клеток щитовидной железы и
доброкачественной либо злокачественной феохромо-
цитомы.
Он имеет две разновидности. При синдроме MEN 11а (синдроме Сиппла) добавляется гиперпаратироз,
а при синдроме MEN 11в (он же —MEN III) — гиперпаратироз не типичен, зато бывают невриномы кожи и слизистых, ганглионевромы, а внешний вид пациентов может напоминать синдром Марфана (арахнодактилия, высокий рост, длинные конечности).
Подростковый возраст — сенситивно-критический период онтогенеза эндокринной системы
Завершив рассмотрение типовых нарушений эндокринной регуляции, мы должныприсоединиться кмнению
А.Т. Камерона (1948), что «взаимодействие различных эндокринных желёз является примером изумительной корреляции функций животного организма».
Однако эта, восхитившая классика эндокринологии корреляция, не дана природой в готовом, неизменном виде. Сложность в том, что она создается на ходу, по
33

мере развёртывания онтогенетических программ организма и в динамике самого его формирования, которое, в свою очередь, подконтрольно гормонам.
Онтогенез — процесс временного развертывания генетических программ, поэтому тот факт, что индивиды разного возраста обладают различной реактивностью, является производным от наследственной детерминации реактивности. Реактивность индивидов различных возрастов неодинакова прежде всего из-за асинхронии в экспрессии и репрессии различных генетических программ. Таким образом, кажущаяся зависимость реактивности от времени есть, по сути, ее зависимость от генов.
В связи с этим индивид в определенном возрасте может иметь более высокую резистентность по отношению к одним факторам и меньшую устойчивость — по отношению к другим (Зайчик А.Ш., Чурилов JI.IL, 1999). Эндокринная система и ее резистентность к эндокринопатиям также не является исключением. Можно, например, говорить о большей толерантности инсулярного аппарата подростков к глюкозной нагрузке, но устойчивость гипоталамо-ги- пофизарного нейросекреторного комплекса и надпочечников к хроническому стрессу у подростков ниже, чем у зрелых индивидов.
Развитие желез внутренней секреции идет не-
равномерно (Потапова И.Н., 1971). По образному вы-
ражению В.Н. Никитина (1975), «каждая из них имеет свой «почерк» возрастного развития».
Эпифиз, тимус, глюкокортикоидная зона коры надпочечников, инсулярный аппарат достигают высшего развития уже в раннем возрасте, а половые железы и щитовидная железа наиболее развиты в пубертатном периоде и в поздней молодости.
В раннем детском возрасте имеются существенные отличия в строении и функции многих эндокринных желёз, по сравнению с взрослыми. Так, при рождении в коре надпочечников доминирует особая фетальная зона, мозговое их вещество секретирует в основном не адреналин, а норадреналин. В гипофизе до 5-6 лет имеется промежуточная доля и т.д. Но к 15-16 годам строение подавляющего большинства эндокринных органов практически становится идентичным таковому в зрелом воз-.
расте. Следовательно, до подросткового периода формообразовательные процессы в эндокринных органах нельзя считать завершенными, ведь именно на подростковый период приходится ряд ключевых изменений.
В онтогенезе снижение функции одних желез усиливает работу других. Еще Н. Пенде (1937) систематизировал данные о «растормаживании» гонад и надпочечников по мере снижения функций тимуса и
шишковидной железы. В пубертате происходит своеобразная проверка слаженности взаимодействия нейрогормональных механизмов регуляции и зрелости их таргетных тканевых структур (Старкова Н.Т., 1989).
По аналогии с представлениями Ц. Стоккарда (1921), П.Г. Светлова (1969) и других авторов о критических сенситивных и терминационных тератогенных периодах, связанных с ранним онтогенезом, мы
считаем возможным расценивать подростковый возраст как постнатальный критический сенситивный «надерганный» период в формировании эндокринной системы.
Подростковый период с его социопсихологической адаптацией предъявляет к эндокринным железам, особенно —к гипоталамо-гипофизарному нейросекреторному комплексу (ГГНСК) и надпочечникам резко повышенные требования.
Согласно Р. Рахе, И. Флостаду с соавт. (1974), интенсивность и патогенная значимость хронического стресса находится в зависимости от скорости и характера жизненных изменений, отклоняющих существование индивида от повседневной стереотипии и установки. По выработанной ими шкале жизнеизменяющих единиц (ЖИЕ), многие события, обязательные для подросткового возраста (смена рода занятий и места жительства, связанная с устройством на работу, учёбой, отделением от родителей, появление и смена половых партнеров, конфликты, связанные с встраиванием в иерархию подростковых групп) — расцениваются как весьма стрессогенные. Так, на- пример, поступление на учёбу или переезд в другой город приравниваются к смене работы и по шкале Р. Рахе с соавт. соответствует 36 ЖИЕ (для сравнения
— смерть супруга или родителя соответствует 100 ЖИЕ). А между тем при превышении предела в 75 ЖИЕ за полгода вероятность болезней нарушенной адаптации существенно возрастает!
Состояние центрального звена нейроэндокринной регуляции — ГГНСК — уподростков может быть охарактеризованокакперестройканаходу. Вподростковом возрасте в деятельности гипоталамуса происходят выраженные функциональные изменения. По данным Л.И. Ставицкой с соавт. (1972), полученным у крыс периода пубертата, в этой фазеонтогенеза резко нарас-
тают кортиколибериновая и люлибериновая актив-
ность гипоталамуса. В то же время фоллибериновая активность остаётся существеннониже, нежели увзрослых животных, а продукция соматостатина понижается. Вазопрессиногенез, максимальный в раннем детстве, несколько уменьшается, а производство окситоцина, напротив, растет (Никитин В.Н. с соавт., 1960).
34

Эпифиз человека, достигающий максимума активности в 5-7 лет, в подростковом периоде снижает продукцию мелатонина и начинает инволюцировать (Пархон К., 1959; Салийчук Л.И., 1964). В подростковом возрасте происходит бурное развитие аденогипофиза, растет его масса — в 15 раз на протяжении 10 лет (Скебельская Ю.В., 1966). Возрастает количество и активность гонадотропоцитов, почти в 3 раза увеличивается удельная адренокортикотропная активность питуитарной ткани, в то же время вазопрессиновая активность нейрогипофиза на протяжении подросткового периода несколько снижается (Никитин В.Н., 1975).
По данным О.В. Волковой (1983), в подростковом возрасте развитию гипофиза присуща стадийность. Если в позднем детстве и начале подросткового периода, в 7-12 лет, происходит значительное увеличение количества и активности ацидофилов и прогрессирование соматомаммотрофной функции, то позже у подростков формируются гипертрофия и гиперплазия базофильных элементов гипофиза, отражающия активацию гонадотропоцитов и кортиколипотропоцитов. Только у подростков отмечается выраженная стимуляция секреции гонадотропинов по ночам, не присущая аденогипофизарной функции других возрастных периодов (Арки Р.А., Кеттайл В.М., 2001).
СТГ секретируется аденогипофизом с нарастающей силой на протяжении детства, егопродукция резко усилена у подростков, снижается после 20 лет, остается стабильной до 40, а затем еще более уменьшается.
В надпочечниках подростков происходят перемены, диктуемые онтогенетической программой. Нарастает выраженность сетчатой зоны, увеличивается клубочковая зона, достигает максимума своего развития мозговое вещество (Волкова О.В., 1983), окончательно перешедшее к адреналовому типу секреции, полностью исчезает к началу подросткового периода (11 годам) фетальная зона. В подобных напряженных условиях сложные регуляторные взаимоотношения подбугорья, нижнего мозгового придатка и надпочечных желез зачастую могут обратимо нарушаться. Это ведет к расстройствам регуляции балансовых констант организма.
При отсутствии надлежащей коррекции и профилактики обратимые стадии гипоталамо-гипофизарно-над- почечниковых нарушений прогрессируют, приводя к формированию необратимой нейроэндокринной патологии. В практике подростковой кардиологии эта закономерность иллюстрируется, например, существованием нейроциркуляторной дистонии, пограничной гипертензии с возможным последующим развитием явной артериальной гипертензии соответственно у
детей, подростков и молодых взрослых (Левина Л.И.
ссоавт., 1999).
Вотношенииэндокринныхзаболеваний,втомчисле— расстройств регуляции массы тела (Строев Ю. И. с соавт., 2003), подобную важнейшую переходную роль играет такое специфическое для подростковой эндокринологии нейроэндокринное нарушение, как гипота-
ламический синдром пубертатного периода, осве-
щаемый ниже.
Не остаются в стороне от кардинальных изменений периода пубертата и другие эндокринные железы.
Инкреция йодсодержащих гормонов щитовидной железы с началом подросткового периода увеличивается вплоть до 20-21 года. В паращитовидных железах, напротив, именно в начале подросткового периода выявляются первые признаки регресса, а способность тка-
ней к инактивации паратгормона (паратирокрини-
на) на протяжении всего постнатального онтогенеза медленно, но неуклонно снижается (Никитин В.Н., 1975).
Для вилочковой железы подростковый период расценивался классиком тимологии Й. Гаммаром (1905) как раннеинволютивный. Но вопрос о возрастной инволюции тимуса не так прост, как казалось 100 лет назад. Тимус при рождении весит 15 г, а к пубертатному периоду достигает максимальной массы порядка 50 г (Кемилева З., 1984). Однако, если измерять массу паренхимы без учёта жировой ткани, то максимум в 38 г достигается уже в раннем детстве (1-5 лет), а далее идет прогрессивное уменьшение ее веса (Кендалл М., 1981).
Внастоящее время известно, что атрофия тимуса идет наиболее быстро после достижения половой зрелости — в период 25-40 лет (убывает до 5% чистой паренхиматозной массы в год). В старости инволюция замедляется, но расчеты показывают, что экстраполированный возраст предполагаемой полной атрофии с заменой тимуса на соединительную и жировую ткани приходится на 120 лет. Механизмы возрастной атрофии тимуса генетически запрограммированы, опосредованы апоптозом и управляются паракринными цитокинами, оказывая возможное влияние на развитие старческого иммунодефицита (Новиков B.C. с соавт., 1995; Сри Рам Дж., 1967; Зайратьянц О.В., Бер-
щанская A.M., 1998).
Тот же Й. Гаммар (1923) открыл, что инволюция тимуса ускоряется в эксперименте экстрактами надпочечников. При болезни Аддисона инволюция тимуса сильно тормозится. Тироидные гормоны, вероятно, снижая биодоступность свободных глюкокортикоидов, тормозят инволюцию тимуса.
35

Затем оказалось, что самые разные воздействия достаточной силы провоцируют инволютивные изменения в тимусе. Й. Гаммар назвал это явление «акциден-
талъной инволюцией тимуса», имея в виду не случайный характер феномена, а случайность разнообразных стимулов, вызывающих закономерный инволютивный ответ вилочковои железы. Так как открытие произошло до создания концепции стресса (Селье Г., 1936), феномен не был увязан с действием гормонов надпочечников на лимфоидные органы.
По современным данным, акцидентальная инволюция — это нарастающий по времени, динамический процесс гипофункции и атрофии лимфоидных элементов тимуса сначала в корковой, а затем — и в медуллярной его зонах. Вместе с тем эпителиальные и макрофагальные клетки микроокружения тимоцитов по ходу акциденталъной инволюции не апоптозируют, а могут даже активизироваться.
Не случайно данные количественного определения гормона тимуса тимозина свидетельствуют, что его удельное содержание в ткани вилочковои железы с возрастом не снижается, а растет (Голдстайн А.Л. с соавт., 1970). Акцидентальную инволюцию расценивают как явление, зависящее не только от апоптоза, но и от эмиграции лимфоцитов и связанное с кумулируемым действием стрессов, опосредованным прежде всего глюкокортикоидами (Харченко В.П. с соавт., 1998). В любом случае в течение всего подросткового периода тимус активно функционирует, а дебютные инволютивные изменения зависят от стрессогенности данного периода, возрастной активации надпочечников и щитовидной железы и касаются, по-видимому, только лимфоид-ной части вилочковои железы.
Классические данные К. Клотцбюхера (1944) доказали удивительновысокую толерантность к глюкозе у детей и подростков, по сравнению со всеми более старшими возрастными группами. В детстве и юности наблюдаются максимальный функциональный резерв В-клеток поджелудочной железы и оптимальная чувствительность тканей-мишеней к инсулину (Никитин В.Н., 1975). Так как В-клетки не обладают существенным регенераторным потенциалом, их количество в течение последующей жизни может только понижаться. Способность к столь выраженной продукции инсулина у здоровых подростков не случайна. Этот гормон — важнейший ростовой и анаболический фактор, один из посредников соматотропных эффектов, столь важных для юного организма.
Наиболее заметные изменения в предподростковом
иподростковом периодах происходят в инкреторной активности гонад. Продукция половых стероидов резко возрастает, что во многом определяет в организме формообразовательные процессы, а также метаболические и поведенческие особенности подростков, в частности, приоритет анаболических процессов обмена
иконкурентно-окрашенные поведенческие стереотипы. Подробное изложение физиологии и патологии гонад у подростков можнонайти в работах Ю.А. Гуркина с соавт. (1988, 1993).
Итак, генетические и внешние факторы — в частности, идущие в организме бурные формообразовательные процессы и социальное встраивание нового активного индивида во взрослый мир — представляют в ювенильном периоде серьезное испытание для нейроэндокринной системы. Это может считаться дополнительным фактором риска многих эндокринопатий.
36
Часть 2
ЗАБОЛЕВАНИЯ ЭНДОКРИННОЙ СИСТЕМЫ У ПОДРОСТКОВ
В подростковый период на формирующуюся |
низмов. Все это следует учитывать в диагностике |
эндокринную систему влияют многие факторы рис- |
эндокринных заболеваний подростков, а также при |
ка. |
их лечении и профилактике (Балаболкин М.И., |
Эндокринная патология может развиться в резуль- |
1993,1998; Дильман В.М., 1983; Старкова Н.Т., |
татекакповышенной, таки пониженной продукции ка- |
1989; Шрайбер В., 1987, Шабалов Н.П. с соавт., |
кого-либо гормона, а также при нарушениях транспор- |
2003). |
та гормона к тканям-мишеням, инактивации гормона, |
Следующие разделы книги посвящены обсуждению |
при несовершенном взаимодействии гормона с рецеп- |
заболеваний желез внутренней секреции в подростко- |
торами клеток, при дефектах пострецепторных меха- |
вом периоде. |
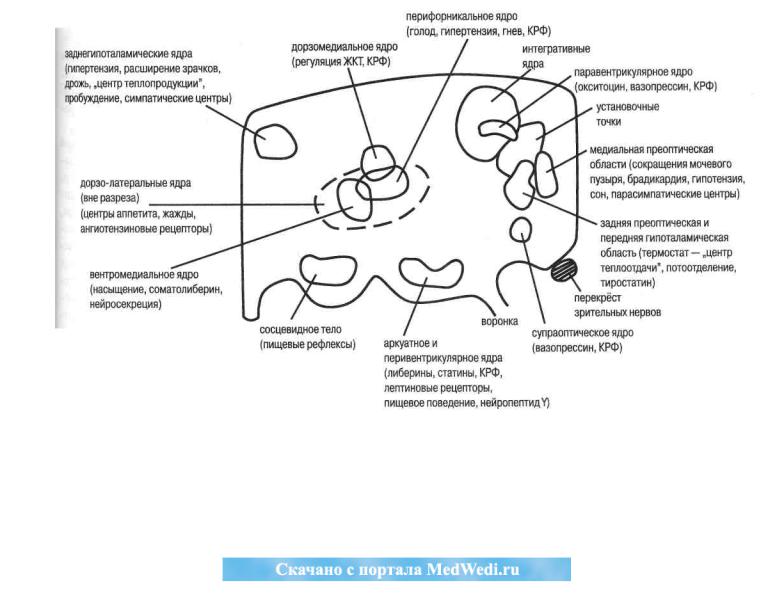
Рис. 13.Блок-схемафункциональныхзон и ядергипоталамуса (поА. Гайтону. 1989).КРФ— кортиколиберип,ЖКТ—желудочно-ки- шечный тракт
37
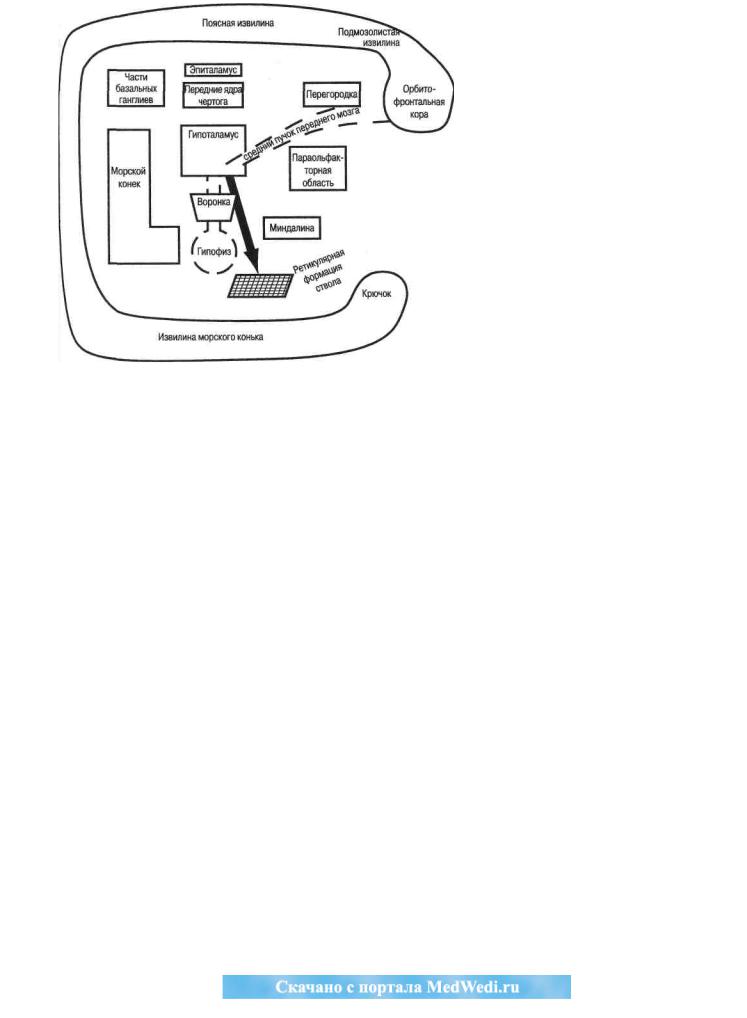
Гипоталамо-гипофизарный |
кая система включает древнейшую часть коры — па- |
||||
нейросекреторныи комплекс |
леокортекс (фронтоорбитальная кора, подмозолистая из- |
||||
в норме и патологии |
вилина, поясная извилина, парагиппокампальная извили- |
||||
Гипоталамо-гипофизарный |
нейросекреторныи |
на и крючок). Связанный двусторонней коммуникацией |
|||
с неокортексом, палеокортекс поясом охватывает суб- |
|||||
комплекс (ГГНСК) представляет собой высший |
|||||
кортикальные лимбические структуры — перегородку, |
|||||
нейроэндокринный трансмиттер организма, координи- |
|||||
параольфакторную область, эпиталамус, передние ядра |
|||||
рующий эндокринную регуляцию обмена веществ с ра- |
чертога, часть базальных ганглиев, морской конёк, мин- |
||||
ботой вегетативной нервной системы и интегральными |
далину. В сердцевине этого лимба и находится гипота- |
||||
эмоционально-поведенческими реакциями лимбической |
|||||
ламус—главный выходной информационный канал лим- |
|||||
системы (Ледерис К., Вил У., 1978). |
|||||
бической системы. Он связан |
с чертогом, куда |
||||
Он состоит из нескольких важных отделов: |
|||||
стекается и где переключается сенсорная информация, |
|||||
• гипоталамуса, рассматриваемого как отдел про- |
|||||
касающаяся всех видов чувствительности. Медиальный |
|||||
межуточного мозга и центральное звено лимби- |
пучок переднего мозга, пронизывающий его от палеокор- |
||||
ческой системы (рис. 13, 15); |
|
текса через подбугорье к ретикулярной формации, позво- |
|||
• нейрогипофиза: передняя часть — срединное воз- |
ляет гипоталамусу иметь двустороннюю нервную связь |
||||
вышение, задняя часть — собственно задняя доля |
с центрами вегетативной нервной системы в стволе |
||||
гипофиза (рис. 14); |
|
мозга. Книзу гипоталамус переходит в воронку и соеди- |
|||
• аденогипофиза (передняя доля, существующая у |
няется ножкой с гипофизом через нервные проводники |
||||
всех индивидов, и промежуточная доля, слива- |
и портальную систему сосудов. |
|
|||
ющаяся у человека с передней, и как обособлен- |
Гипофиз служит главным «интерфейсом» гипо- |
||||
ное образование представленная только у плода, |
таламуса во взаимодействии с периферическими же- |
||||
детей в возрасте до 1 года и при беременности). |
лезами внутренней секреции. В области подбугорья ге- |
||||
Архетипы поведения человека, связанные с пищевы- |
матоэнцефалический барьер разрешает (через |
||||
ми, половыми, непроизвольными двигательными форма- |
сосудистый орган концевой пластинки) доступ регуля- |
||||
ми активности, эмоциями, положительным и отрицатель- |
торов и метаболитов к центральной нервной системе |
||||
ным подкреплением действий и поддержанием |
чтобы обеспечить канал обратной связи между мозгом |
||||
температурного и метаболического гомеостаза контро- |
и метаболизмом тела. Хотя гипоталамус обменивается |
||||
лируются лимбической системой (рис. 15). Лимбичес- |
сигналами с вышележащими отделами центрально» |
||||
|
|
нервной системы, его регуляторные образования продол- |
|||
|
|
жаютфункционироватьдажепослеотделения отних, что |
|||
|
|
говорит о решающей роли гуморальных сигналов, пере |
|||
|
|
носимых кровью, для работы его сервомеханизмов. |
|||
|
|
Гипоталамус вовлекается в реакции лимбической |
|||
|
|
системой головного мозга и обеспечивает эмоциональ- |
|||
|
|
ный и поведенческий ответ лимбических структур |
|||
|
|
адекватный рефлекторной и эндокринной гомеостази |
|||
|
|
рующей реакции. Поэтому его можно считать центром |
|||
|
|
обеспечивающим вегетативную основу эмоционально |
|||
|
|
поведенческих реакций, что крайне важно для обуче |
|||
|
|
ния и даже для специфически человеческих социальны |
|||
|
|
форм адаптации. Гипоталамус может быть охаракте |
|||
|
|
ризован как орган биосоциальной интеграции или аф |
|||
|
|
фективный дирижёр поведения. Гипоталамус находит |
|||
|
|
ся под контролем не только лимбической системы, |
|||
|
|
но и эпифиза, вносящего в деятельность ГГНСК |
|||
|
|
биорит мологические программы. На уровне |
|||
|
|
гипоталамус |
фактически |
взаимодействуют |
|
|
|
внутренний и внешни миры, реализуются |
|||
|
|
механизмы главнейших болезни и естественной |
|||
|
|
смерти (Дильман В.М., 1983). |
|
||
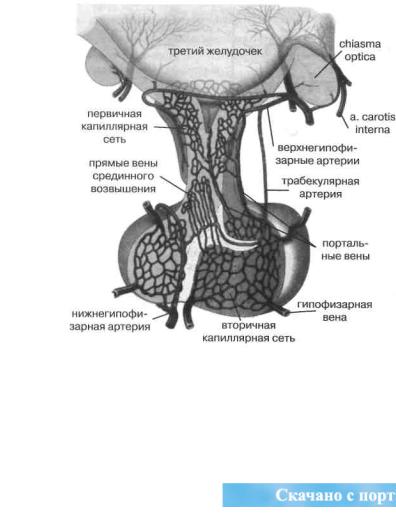
Рис. 14. Гипоталамо-гипофизарный нейросекреторный аппарат, |
Немаловажно, что именно гипоталамус — это oт |
||||
его портальная система кровообращения (по В. Лингаппе с соавт., 1997) |
дел промежуточногомозга, занятый контролем уста |
||||
|
|
новочных точек гомеостаза. Здесь имеются вегета |
|||
38
тивные нервные центры, задающие термостатную установочную точку, массостатную установочную точку (Строев Ю.И. с соавт., 2003), осмостатную установочную точку, а также баростатические и другие центры поддержания балансовых констант организма. Физиологически это выражается в регуляции теплоотдачи и теплопродукции, аппетита и насыщения, жажды
идиуреза, индукции противоположных изменений кровяного давления.
Управляющие воздействия гипоталамуса на обмен веществ осуществляются по принципу компенсации отклонений метаболических констант от установочных точек за счёт координированного ответа эндокринной
иавтономной нервной систем.
Таким образом, уникальное положение гипоталамуса и неиросекреторные потенции его нейронов делают этот небольшой отдел мозга, составляющий всего 0,8 % его объема, главным нейроэндокринным регулятором
(рис. 13).
Центральная нервная система при посредстве ГГНСК участвует в регуляции метаболизма и подвержена, в свою очередь, регуляторному влиянию гормонов и метаболитов. Для влияния на метаболизм мозг располагает несколькими каналами.
Парагипофизарная нервная регуляция осуществляется по пути «гипоталамус —> медиальный пучок
переднего мозга —> ретикулярная формация —> вегетативные симпатические и парасимпатические нервные центры —> черепно-мозговые и спинномозговые нервы —
» эффекторные органы». Прямую иннервацию, влияющую на метаболические процессы, получают печень, жировая ткань, желудочно-кишечный тракт, поджелудочная железа и островки Лангерганса, щитовидная железа, паращитовидные железы и мозговое
вещество надпочечников.
Парагипофизарная гуморальная регу-
ляция использует ток цереброспинальной жидкости и осуществляется по пути «гипо-
таламус —> цереброспинальная жидкость —> венулы сосудистого органа концевой пластинки —> системный кровоток». Це-
реброспинальный путь передачи центральных гормональных влияний изучен мало, но привлекает растущее внимание исследователей в связи с возможностью вмешательства в его деятельность при процедуре ликворо-сорбции (МихайловаН. Г. с
соавт., 1998).
Гормоны гипоталамуса и гипофиза могут цереброспинальным путем достигать не только системного кровотока, но и спинномоз-
гового канала. С участием системы цереброспинальноголикворноготранспорта провоцируются их системные эффекты, например, усиление двигательной и подавление пищевой активности кортиколиберином. Часть гипоталамических продуктов может попадать в системный кровоток из портальной системы, используя ветви верхнегипофизарной артерии.
Трансгипофизарная гуморальная регуляция осу-
ществляется либеринами и статинами мелкоклеточных нейронов гипоталамуса через портальную систему в аденогипофизе, а также включает секрецию крупноклеточными нейронами гипоталамических нонапептидных гормонов — окситоцина и вазопрессина — в кровь в пределах нейрогипофиза. Этим путем регулируется деятельность коры надпочечников, гонад, щитовидной железы, молочных желез, а также координируются ростовые, анаболические процессы, функции жировой ткани, водно-солевой метаболизм и многие другие процессы. Под управлением либеринов, статинов и сигналов обратной связи аденогипофиз инкретирует в кровь свои гормоны. Адренокортикотропный гормон гипофиза (АКТГ) стимулирует синтез глюкокортикоидов, тиротропный гормон (ТТГ) — трийодтиронина (ТЗ) и тироксина (T4), лютеинизирующий гормон (ЛГ) —
овуляцию, образование желтого тела, эстрогенов и прогестинов у женщин. Он же стимулирует функцию клеток Лейдига и производствоандрогенов,
39

восновном тестостерона у мужчин. ЛГ активирует
исинтез многих простагландинов. Фолликулостимулирующий гормон (ФСГ) ускоряет рост фолликулов яичника и стимулирует сперматогенез.
Гормон роста, соматотропин или соматотроп-
ный гормон (СТГ), регулирует ростовые и анаболические процессы. СТГ стимулирует утилизацию аминокислот из крови и синтез белка, действуя через
инсулиноподобные факторы роста — ИФР-I (соматомедин С) и ИФР-П (соматомедин А), продуцирую-
щиесяв основномвпечениифункционирующиекакауто-
ипаракринные гормоны.
Вгипофизе вырабатываются и меланоцитостиму-
лирующие гормоны (интермедины или различные подвиды меланоцитостимулирующего гормона — МСГ). МСГ пигментирует кожу, действуя на меланоциты, участвует в стрессовых реакциях, влияет на возбудимость мозга, вызывает липолиз(ШрейберВ., 1987).
Гипофиз продуцирует также (из общего с АКТГ и МСГ предшественника проопиомеланокортина — ПОМК) ряд опиатных пептидов и липотропинов. Опиоидные пептиды аденогипофиза многочисленны. Это а-, в- и у-эндорфины, пептиды динорфинового семейства — динорфины А и В, а также а- и Р-неоэндорфи- ны. Мет-энкефалиновая последовательность имеется
вПОМК, но энкефалины в аденогипофизе не процессируются. Аденогипофиз продуцирует некоторые факторы роста, в частности, эритропоэтин (Зай-
чик А.Ш., Чурилов Л.П., 2000, 2002).
Патология каждого из отделов ГГНСК имеет свои особенности. Ниже они кратко рассматриваются применительнок гипоталамусуи к гипофизу. Затем даётся детальная клинико-патофизиологическая характеристика тех заболеваний гипоталамуса и гипофиза, которые наиболееважны в практике подростковоговрача.
Гипоталамус вместе с нейрогипофизом развивается из выпячивания нейроэктодермы дна промежуточного мозга. Он насыщен нейросекреторными клетками.
Гипоталамические мелкоклеточные нейроны,
имеющиеся в аркуатном ядре, перивентрикулярной зоне, вентромедиальном и частично паравентрикулярном и супраоптическом ядрах, синтезируют (частично — не рибосомальным путём) и выделяют стимуляторы сек-
реции гипофизарных тройных гормонов (либерины
или, при неидентифицированной структуре, —рилизинг-
факторы), а также ингибиторы секреторной деятельности аденогипофиза — статины (при неиден-
тифицированной структуре — ингибитинг-факторы).
Автор идеи «гипоталамической либерин-стати- новой регуляции» М. Саффран (1955) первоначально полагал, что для каждого аденогипофизарного гормона имеется пара контррегулирующих факторов, но реальная регуляция оказалась экономнее. Так как до-
минирующее влияние гипоталамуса на секрецию пролактина в гипофизе является тормозным, а на продукцию остальных аденогипофизарных регуляторов—сти- мулирующим, то пересечение ножки гипофиза вызывает пангипопитуитаризм, но растормаживает и повышает пролактиновую секрецию.
Краткая характеристика гипоталамических мелкоклеточных биорегуляторов аденогипофиза содержится в таблице 1.
Таблица1
Биорегуляторымелкоклеточныхнейросекреторных клеток гипоталамуса
Гормон |
Структура |
Примечание |
Тиролиберин |
Пироглутамилгис- |
Одновременно - слабый |
|
тидилпролин-амид |
пролактолиберин |
Кортиколиберин |
Пептид из 41 |
Ключевой либерин |
|
аминокислоты |
стресса |
Люлиберин |
Декапептид |
Одновременно - |
|
|
фоллиберин |
Соматолиберин |
Пептид из 44 |
Главный стимулятор |
(соматокринин) |
аминокислот |
продукции СТГ |
Соматостатин |
Пептид из 14 ами- |
Одновременно- |
|
нокислот, желудоч- |
тиростатин, слабый |
|
но-кишечный тракт |
кортикостатин, снижает |
|
производит прогор- |
продукцию ряда |
|
мон из 28 амино- |
гормонов желудочно- |
|
кислот |
кишечного тракта |
Пролактостатин |
Дофамин |
Переднее перивентрику- |
(основной) |
|
лярное и аркуатное ядра |
Пролактостатин- |
Пептид |
Карбокси-конец |
пептид |
из 56 аминокислот |
предшественника |
|
|
люлиберина |
Меланостатин |
Пролиллейцил- |
Карбокси-конец |
|
глицинамид |
окситоцина |
МСГ-рилизинг |
Не идентифициро- |
Стимулятор продукции |
фактор |
вана |
МСГ |
Пролактин- |
Не идентифициро- |
Предположительно, ВИП |
рилизинг |
вана |
|
фактор |
|
|
Многие гормоны этой группы синтезированы и дос-
тупны как лекарства (тиролиберин, гонадолиберин и
др.). Особенно перспективно применение длительно действующего аналога соматостатина — октреотида, который, в частности, эффективно подавляет гор- монообразование в самых различных апудомах.
Помимо этого, нейросекреторные клетки гипоталамуса вырабатывают множество нейропептидов паракринного местного действия и содержат к ним рецепторы. Эти пептиды очень важны в регуляции поведения и гомеостаза.
Так, нейропептид У в аркуатном ядре стимулирует аппетит и пищевое поведение, его продукция чум ствительна к лептину адипоцитов и к гормонам же- лудочно-кишечного тракта. Ангиотензин II -пептид жажды в латеральных гипоталамических яд-pax. Более подробную характеристику этих гипоталамических регуляторов приводят ряд авторов (Поле-
40
