
3 курс / Фармакология / Лечение_ВИЧ_инфекции,_К_Хоффман,_Дж_К_Роктрох,_Б_С_Кампс
.pdfЛечение ВИЧ-инфекции. 2005 год 45
Проблема «диагностического окна»
Одна из важнейших проблем тестирования на ВИЧ —так называемый период диагностического окна. Это срок, который проходит с момента заражения ВИЧ до появления определимого уровня антител (Busch 1997). Переход неопределимого титра антител в определимый называется сероконверсией. Современные скрининг-тесты выявляют ВИЧ-инфекцию через 6 недель после заражения примерно в 80% случаев, а через 12 недель — почти в 100% случаев. Крайне редко ВИЧ-инфекция выявляется только через 3-6 месяцев после заражения. Чтобы сократить период диагностического окна, в скрининг-тестах четвертого поколения определяются и антитела к ВИЧ, и антиген p24 (Gürtler 1998, Ly 2001). Однако у тестов такого рода есть свои сложности: они раньше становятся положительными, но в силу методологических причин (Meier 2001) они дают второй период окна, то есть спустя некоторое время их результаты становятся отрицательными.
На ранних этапах сероконверсии скрининг-тесты дают пограничный или слабоположительный результат. Используемый для подтверждения иммуноблоттинг в этот период может не дать ни одной полосы, либо показать неполный набор полос, причем полоса p24 часто проявляется первой. Результаты тестирования в подобных случаях нередко неотличимы от результатов, получаемых у неинфицированных лиц при наличии так или иначе выраженных неспецифических реакций — у них иногда тоже проявляется только полоса p24. Это ясно показывает, насколько важно сообщать в лабораторию, которая выполняет тест, все важные клинические данные (например: «подозревается недавнее заражение», «стандартный скринингтест» и так далее).
Прояснить ситуацию в подобных случаях порой не удается на протяжении некоторого времени, но контрольные исследования достаточно скоро расставляют все по местам. Если сомнительный результат получен в начале сероконверсии, уже в ближайшее время реактивность сыворотки возрастет и через несколько недель иммуноблоттинг даст полный набор полос. Целесообразность применения в начале сероконверсии прямых тестов на ВИЧ (например, ПЦР), в каждом случае зависит от обстоятельств. Важно помнить, что антиретровирусная постконтактная профилактика влияет на результаты таких тестов и может отдалить сероконверсию.
Постепенное нарастание реактивности сыворотки в ходе сероконверсии можно использовать в целях эпидемиологической диагностики. Так называемая стратегия тестирования «со снижением чувствительности» позволяет оценивать заболеваемость — то есть частоту новых случаев инфекции. Она в корне отличается от распространенности (частоты всех выявляемых случаев ВИЧ-инфекции), которую определяют стандартные тесты на антитела к ВИЧ. Продуманно комбинируя высокочувствительные тесты на антитела к ВИЧ с менее чувствительными, можно определить, какая доля положительных результатов получена у людей, недавно заразившихся ВИЧ (Parekh 2001; Constantine et al. 2003).
Прямые тесты на ВИЧ
Диагноз ВИЧ-инфекции можно поставить не только на основании косвенных признаков (наличия антител к ВИЧ), но и на основании прямых доказательств присутствия вируса. Непосредственно выявлять ВИЧ требуется лишь в некоторых случаях и только по показаниям, поскольку стоимость тестов, которые позволяют это сделать, высока.
Выделение вируса в культуре клеток — исследование, которое приберегают для особых случаев: оно требует специального оборудования и подготовки, а кроме того сопряжено с определенным риском и поэтому может проводиться только в лабораториях с повышенными мерами безопасности.
Существуют и другие прямые тесты на ВИЧ, в частности тест на антиген p24. В целом ИФА на антиген p24 сегодня вытеснили более чувствительные тесты на нуклеиновые кислоты ВИЧ, однако скринингтесты четвертого поколения помимо антител к ВИЧ выявляют и антиген p24, что позволяет сократить период диагностического окна (см. выше).
Вирусные нуклеиновые кислоты (то есть генетический материал ВИЧ) можно определить различными лабораторными методами. Одни из них выявляют провирусную кДНК в лейкоцитах (в цельной крови, обработанной ЭДТА), другие — вирусную РНК в бесклеточной фракции (в плазме или цельной крови, обработанной ЭДТА).
Качественные тесты на нуклеиновые кислоты ВИЧ позволяют судить о наличии инфекции. Они дополняют или заменяют тесты на антитела к ВИЧ при диагностике ВИЧ-инфекции в отдельных случаях — например, при подозрении на недавнее заражение (в период диагностического окна, когда антитела не
46 Тестирование на ВИЧ
определяются) или при обследовании детей, рожденных ВИЧ-инфицированными женщинами (в их крови присутствуют материнские антитела — см. ниже)
Количественные тесты на РНК ВИЧ в плазме позволяют составить прогноз, следить за результатами лечения и оценивать вирулентность (Berger 2002). Наиболее чувствительные количественные тесты определяют РНК ВИЧ в концентрации около 50 копий/мл.
Для выявления генетического материала ВИЧ существует множество коммерческих тестов и тестов «домашнего применения». В их основе лежат различные методики: полимеразная цепная реакция (ПЦР), метод разветвленной ДНК, метод амплификации, основанной на нуклеотидной последовательности, или лигазная цепная реакция. Исследование так называемой вирусной нагрузки сегодня в клинической практике незаменимо: оно позволяет как оценивать прогноз, так и следить за эффективностью лечения.
Результаты теста
Ложноположительный результат иммуноблоттинга — чрезвычайная редкость. В связи с этим положительный результат иммуноблоттинга подтверждает наличие специфических антител к ВИЧ и — следовательно —ВИЧ-инфекции.
О положительном результате тестирования говорят, когда скрининг-тест и подтверждающий тест дали положительные результаты, а вероятность ошибки при идентификации исследуемых образцов была исключена взятием другого образца. Положительный результат тестирования на ВИЧ означает, что обследованный:
инфицирован ВИЧ, то есть в его организме присутствует вирус, являющийся причиной СПИДа (исключение — маленькие дети; см. ниже);
способен передать ВИЧ другим людям, если не будут приняты меры предосторожности (см. гл. о передаче ВИЧ).
Положительный результат тестирования на ВИЧ НЕ означает, что обследованный пациент:
болен СПИДом; обязательно заболеет СПИДом.
Отрицательный результат тестирования на ВИЧ означает, что:
в крови обследованного на момент проведения исследования антитела к ВИЧ не определялись. Отрицательный результат тестирования на ВИЧ НЕ означает, что обследованный:
не инфицирован ВИЧ (тестирование могло проводиться в период диагностического окна); обладает иммунитетом или устойчивостью к ВИЧ; может вступать в половые отношения, не соблюдая правил безопасного секса.
По истечении периода диагностического окна (через 6 и более месяцев после чреватого заражением контакта) скрининг-тесты на ВИЧ редко дают ложноотрицательный результат. Следовательно, отрицательный результат тестирования на этом этапе означает, что обследуемый не инфицирован ВИЧ — при условии, конечно, что за это время риску заражения ВИЧ он более не подвергался.
«Сомнительный» результат подтверждающего теста встречается редко. Что он означает?
Тест не дал однозначного результата. Следовательно, в ближайшем будущем необходимо провести контрольное тестирование. Подозревать острую лихорадочную стадию ВИЧ-инфекции и начало сероконверсии прежде всего заставляют такие клинические проявления, как лихорадка, увеличение лимфоузлов, сыпь и неврологические нарушения. Иногда тест на антитела реакцию дает, а при иммуноблоттинге полный набор полос еще не определяется. Сероконверсия следует определенной динамике, и при иммуноблоттинге одни полосы (например, p24 или gp120) проявляются раньше, а другие — позже.
Если результат иммуноблоттинга сомнителен, но клиническая картина или данные анамнеза заставляют подозревать острую фазу ВИЧ-инфекции, следует провести прямое исследование на ВИЧ — ПЦР. Это необходимо, чтобы своевременно выявить и, возможно, начать лечить ВИЧ-инфекцию (см. также гл. «Острая лихорадочная фаза ВИЧ-инфекции»). Чем раньше, тем лучше!
Внимание! Если при подозрении на недавно приобретенную ВИЧ-инфекцию используется количественный тест на РНК ВИЧ в плазме (он часто доступнее ПЦР на провирусную кДНК в лейкоцитах), важно
Лечение ВИЧ-инфекции. 2005 год 47
помнить о вероятности ложноположительного результата (Rich 1999). В подобных случаях вирусная РНК как правило определяется в низкой концентрации (обычно не более 2000 копий/мл), что в острой фазе ВИЧ-инфекции маловероятно, поскольку для нее характерна высокая вирусная нагрузка. Как бы то ни было, ложноположительные результаты тестов на вирусную нагрузку порой вносят путаницу и приводят к ошибочному диагнозу.
Вероятность ошибки существует при использовании любого теста на вирусную нагрузку. Если упустить это из вида, не инфицированный пациент будет признан инфицированным, что чревато многочисленными пагубными последствиями. Не допустить подобной ошибки (безошибочное соблюдение методики теста и соответствующий контроль качества исследований в лаборатории мы не обсуждаем) позволяет тест на провирусную кДНК в лейкоцитах, который, однако, выполняют в относительно редкие лаборатории.
Особый случай: дети, рожденные ВИЧ-инфицированными женщинами
К счастью, риск передачи ВИЧ от матери ребенку (ПМР) (см. гл. о ВИЧ-инфекции и беременности) в развитых странах весьма сократился и, по-видимому, сегодня не превышает 1%. Тем не менее, проводить диагностику ВИЧ-инфекции необходимо всем новорожденным, чьи матери инфицированы ВИЧ!
У детей, рожденных ВИЧ-инфицированными женщинами, антитела к ВИЧ в норме определяются примерно до 12-15 мес. Это пассивно приобретенные антитела, которые проникали в кровь плода через плаценту начиная примерно с 30-й недели внутриутробного развития. Материнские IgG-антитела обеспечивают ребенку более или менее выраженный иммунитет ко многим инфекциям, однако против ВИЧ они бессильны. Таким образом, у всех детей, рожденных ВИЧ-инфицированными женщинами, в том числе и у не инфицированных (их всегда большинство), тесты на антитела к ВИЧ изначально дают положительный результат. Однако со временем реактивность сыворотки снижается и, как только материнские антитела из крови не инфицированного ВИЧ ребенка исчезнут, тесты на антитела к ВИЧ становятся отрицательными.
Раньше диагностика ВИЧ-инфекции у новорожденных занимала очень много времени и требовала регулярных повторных исследований крови. Чтобы достоверно исключить ВИЧ-инфекцию у ребенка, обычно приходилось ждать 9 или больше месяцев, пока титр антител к ВИЧ в крови ребенка не упадет (Newell 1995). Если антитела к ВИЧ сохранялись в крови рожденного ВИЧ-инфицированной женщиной ребенка после того, как ему исполнялось 15 месяцев, ему ставили диагноз ВИЧ-инфекции.
Сегодня поставить диагноз ребенку можно раньше — с помощью ПЦР. Убеждаться в присутствии или (как мы всегда надеемся) в отсутствии вируса в крови ребенка необходимо с помощью прямых тестов на ВИЧ. Пока не ясно, какой из двух методов более чувствителен: определение провирусной (внутриклеточной) кДНК в лейкоцитах или же вирусной РНК (внеклеточной) в плазме. В любом случае, каждый положительный результат теста необходимо подтверждать исследованием другого образца.
Внимание! Многие тесты на нуклеиновые кислоты ВИЧ не чувствительны, если инфекция вызвана «экзотическими» штаммами ВИЧ: ВИЧ-1 не подтипа B и ВИЧ-2. В подобных случаях они дают ложноотрицательный результат (Haas 1996). Чтобы исключить такую вероятность, при необходимости (например, если мать или лицо, от которого она заразилась ВИЧ, — не европейцы) тест проводят с кровью матери. Это позволяет установить, способен ли используемый тест определить данный штамм ВИЧ. Если ПЦР при исследовании материнской крови дала положительный результат, отрицательный результат ПЦР при исследовании крови ребенка можно считать достоверным. В противном случае кровь ребенка необходимо исследовать чувствительным к редким штаммам ВИЧ методом в специализированной лаборатории, либо прибегнуть к тестам на антитела к ВИЧ со всеми упомянутыми оговорками (см. выше).
Исключить ВИЧ-инфекцию у ребенка, рожденного ВИЧ-инфицированной женщиной, позволяют лишь два отрицательных результата ПЦР: один должен быть получен в возрасте от 1 до 4 месяцев, другой — в возрасте старше 4 месяцев. Только в таком случае можно уверенно утверждать, что у ребенка ВИЧинфекция отсутствует (Rossi 1992). Кроме того, ПЦР детям проводят раньше — до месячного возраста (но не в первые дни жизни, поскольку можно случайно определить материнский вирус). Это необходимо, поскольку ранняя диагностика ВИЧ у новорожденного позволяет начать профилактику пневмоцистной пневмонии и антиретровирусную терапию в первые месяцы жизни ребенка. Если первая же ПЦР положительна (и результат был подтвержден), ребенок был инфицирован внутриутробно (встречается реже). При передаче ВИЧ во время родов (именно так бывает чаще всего) обнаружить вирус удается только более поздним исследованиям. Внимание! При естественном вскармливании риск передачи ВИЧ от матери
48 Тестирование на ВИЧ
ребенку весьма высок, и все сказанное относится только к случаям, в которых передача ВИЧ в послеродовом периоде исключена.
Чтобы убедиться в отсутствии ВИЧ-инфекции у ребенка, рожденного ВИЧ-инфицированной женщиной, помимо отрицательных результатов ПЦР необходимо получить хотя бы один отрицательный результат теста на антитела к ВИЧ в возрасте, когда материнские антитела полностью элиминируются.
Особый случай: травма иглой и прочие контакты, чреватые заражением ВИЧ на рабочем месте
В данном случае возникают две проблемы: тестирование пациента, который может быть источником инфекции (источника или донора), и тестирование медицинского работника, подвергшегося риску заражения (пострадавшего или реципиента). Безусловно, по юридическим и прочим соображениям, решать эти проблемы необходимо в соответствии с национальными и местными нормативами.
Если источник известен, его (после соответствующего консультирования и получения согласия) необходимо обследовать. Теоретически, следует немедленно вызвать начальника пострадавшего, чтобы он отдал распоряжение о тестировании источника на антитела к ВИЧ, HBsAg (не следует забывать об иммунизации против гепатита B при необходимости) и антитела к вирусу гепатита C. Иногда (например, в выходной день) можно провести экспресс-тесты. Предварительное решение о ведении пострадавшего следует принять еще до получения результатов тестирования источника, поскольку любая проволочка сокращает вероятность успеха постконтактной профилактики ВИЧ-инфекции (ПКП) (CDC 2001). Следовательно, при малейшем риске заражения медицинский работник должен принять первые одну или две дозы по схеме ПКП (так называемый начальный набор ПКП должен быть доступен днем и ночью), если же результат тестирования источника окажется отрицательным, профилактику следует прекратить. Начинать ПКП только после получения положительного результата тестирования источника — ошибка, поскольку в этом случае медицинский работник получит первую дозу ПКП, когда время ее наибольшей профилактической эффективности уже будет упущено!
Если источник серонегативен и какие-либо симптомы острой лихорадочной фазы ВИЧ-инфекции у него отсутствуют, вероятность того, что он находится в периоде диагностического окна крайне мала. Следовательно, отказаться от прямых тестов на ВИЧ (чтобы исключить недавно приобретенную инфекцию) в такой ситуации вполне оправдано. Если источник неизвестен, следует ориентироваться на эпидемиологические данные. Внимание! Искать антитела к ВИЧ в крови с использованных инъекционных игл и прочих инструментов в целом не рекомендуется: затраты сил и денег и — прежде всего — сомнительность результатов слишком велики, учитывая крайне низкий риск передачи столь, к счастью, нестойкого во внешней среде вируса.
Если источник ВИЧ-позитивен, для выбора метода ПКП (см. соответствующую гл.) необходимо собрать и учесть все сведения о нем (в том числе вирусную нагрузку в настоящее время, результаты тестов на лекарственную устойчивость ВИЧ и так далее).
При положительных результатах тестирования на ВИЧ источника пострадавшему необходимо сразу же провести стандартный скрининг-тест на антитела к ВИЧ. Подтвердить его серонегативный статус важно с юридической точки зрения — он станет основанием для подачи заявления на компенсацию и выплату страховки в связи с заражением на рабочем месте. Контрольные тесты рекомендуется проводить через 6 недель, 3 месяца и 6 месяцев после чреватого заражением контакта (Ciesielski, 1997). Если источник инфицирован ВИЧ, еще одно контрольное обследование пострадавшего проводят через 12 месяцев после контакта, в остальных случаях это не обязательно (Ridzon 1997). Кроме того, если у источника появятся симптомы острой лихорадочной фазы ВИЧ-инфекции, тест на антитела к ВИЧ (и, возможно, прямой тест на ВИЧ) следует провести безотлагательно, независимо от срока, прошедшего после контакта.
Практические сведения
При проведении любого теста на ВИЧ необходимо принимать во внимание целый ряд факторов. Как ни печально, но легкомыслие и небрежность в данной области встречаются и поныне.
О чем важно помнить?
Несмотря на достижения в лечении ВИЧ-инфекции, положительный результат теста на ВИЧ по-прежнему чреват тяжелейшей психологической травмой для того, кто его получил. Его неблагоприятные последствия зачастую переоценивают.
Лечение ВИЧ-инфекции. 2005 год 49
В связи с этим каждому пациенту следует сообщать, что ему будет проведено тестирование на ВИЧ. Делать это необходимо заранее! Тестирование в рамках стандартного обследования перед хирургическим вмешательством, которое до сих пор иногда проводят, тем более, если оно даст положительный результат чревато не только неприятными психологическими, но порой и серьезными юридическими последствиями для персонала. Согласие на тестирование не обязательно получать в письменной форме, однако его обязательно регистрировать в истории болезни. Если речь идет о ребенке или недееспособном пациенте, информировать о предстоящем тестировании на ВИЧ следует родителей или официальных доверенных лиц.
Получить согласие на тестирование важно, но с другой стороны, при этом отнюдь не всегда следует подробно разъяснять пациенту все факторы риска, последствия и так далее. Предтестовое консультирование должно соответствовать обстоятельствам каждого конкретного случая. Пациента необходимо оберегать от неоправданных тревог и психических травм.
Сообщать результаты тестирования на ВИЧ должны только те врачи, которые сами хорошо осведомлены в вопросах ВИЧ-инфекции и СПИДа или знают, куда безотлагательно направить пациента с только что установленным диагнозом ВИЧ-инфекции. Люди, впервые столкнувшиеся с таким диагнозом, нуждаются в интенсивной поддержке, причем немедленно! Порой пациентам сообщают устаревшую информацию, и в результате выйти на необходимых специалистов им удается лишь спустя недели и даже месяцы.
Положительный результат тестирования на ВИЧ ни в коем случае нельзя сообщать по телефону. Во-первых, во время телефонного разговора невозможно провести полноценное послетестовое консультирование. Во-вторых, не видя пациента, нельзя оценить его реакцию, тогда как столь тяжелое известие способно толкнуть человека на самоубийство. Порой сообщение диагноза провоцирует серьезные психические нарушения или бурную эмоциональную реакцию, что требует послетестового консультирования в расширенном объеме. В каждом случае реакция непредсказуема. По возможности, договариваться о встрече с пациентом следует при взятии у него материала для исследования. Отрицательный результат тестирования по телефону сообщать допустимо.
По указанным причинам, использование экспресс-тестов для самостоятельного применения связано с серьезными недостатками. Так называемые «тесты на месте» и «тесты у постели больного» в определенных обстоятельствах весьма полезны (в частности в приемных отделениях), однако за ними скрываются такие проблемы, как непрофессиональное применение без должного консультирования и помощи пациенту.
Сообщать пациенту положительный (реактивный) результат скрининг-теста до того, как он будет проверен, не следует ни при каких обстоятельствах! Поскольку по многим причинам результат скрининг-теста может оказаться ложноположительным, всегда необходимо дождаться результата подтверждающего теста. Неполный набор полос при подтверждающем иммуноблоттинге может свидетельствовать как о начале сероконверсии (то есть о недавнем заражении), так и о неспецифической реакции иммунитета. Такие результаты всегда необходимо сначала обсудить с лабораторией и опытным специалистом по диагностике ВИЧ-инфекции и только затем сообщать пациентам. Мы встречали пациентов, которые по нескольку дней и даже недель пребывали в уверенности, что они ВИЧ-инфицированны, лишь потому, что медицинские работники, не дождались результата подтверждающего теста и сообщили о положительном результате ИФА, хотя он был обусловлен перекрестными реакциями.
Даже после подтверждения серопозитивного ВИЧ-статуса иммуноблоттингом и получения первого подтвержденного положительного результата тестирования следует напомнить себе: «Наличие специфических антител к ВИЧ не означает, что человек болен СПИДом. Каждый положительный результат необходимо подтвердить, исследовав второй образец крови, полученный в другое время. Только после этого результаты тестирования можно сообщить пациенту!»
Каждый раз, направляя пациента на тестирование на ВИЧ, следует выяснять, почему человек решил его пройти. Страх СПИДа — серьезная проблема и представляет собой отнюдь не редкую фобию. Встречаются люди, столь же твердо, сколь и ошибочно убежденные в том, что они ВИЧ-инфицированны, хотя для этого почти всегда нет никаких оснований. Зачастую они обращаются за тестированием раз за разом через короткие промежутки времени, меняют специалистов и порой настаивают на проведении дорогостоящей ПЦР. Нередко они к тому же охвачены бредовой идеей, будто положительный результат тестирования от них скрывают. Такие пациенты нуждаются в психологической, а возможно, и психиатрической помощи, а не в повторном тестировании на ВИЧ.
50 Тестирование на ВИЧ
Интернет-ресурсы о тестировании на ВИЧ
Всемирная организация здравоохранения (ВОЗ), Отдел основных технологий здравоохранения: http://www.who.int/bct/Main_areas_of_work/BTS/HIV_Diagnostics/HIV_Diagnostics.htm
Следующие страницы:
Обзор технологий диагностики ВИЧ-инфекции: http://www.who.int/bct/Main_areas_of_work/BTS/HIV_Diagnostics/Overview_of_HIV_Diagnostic_Tech.h tm
Исследование тест-систем на ВИЧ: http://www.who.int/bct/Main_areas_of_work/BTS/HIV_Diagnostics/HIV_Test_Kit_Evaluation.htm
С данной страницы можно загрузить отчеты с результатами исследования различных имеющихся на рынке тестов на ВИЧ и документ «Схема снабжения тест-системами на ВИЧ ВОЗ».
ЮНЭЙДС: диагностические тесты на ВИЧ http://www.unaids.org/en/in+focus/topic+areas/hiv+diagnostic+tests.asp
На сайте имеется ссылка на последнюю версию документа «Отдельные лекарственные средства и диагностические наборы для людей, живущих с ВИЧ/СПИДом: источники и цены»
Инициатива «3 к 5», Лекарственные средства и диагностика при СПИДе, Диагностика ВИЧ/СПИДа: http://www.who.int/3by5/amds/diagnostics/en/
Центры контроля и профилактики заболеваний (CDC), США, Отдел профилактики ВИЧ/СПИДа: http://www.cdc.gov/hiv/testing.htm, http://www.cdc.gov/hiv/rapid_testing/
Управление по контролю качества пищевых продуктов и лекарственных средств США, Центр биологических исследований и анализов: Лицензированные и одобренные тесты на ВИЧ,
Т-лимфотропный вирус человека и гепатит: http://www.fda.gov/cber/products/testkits.htm
Европейская комиссия, Предприятия и индустрия, Медицинские принадлежности: http://europa.eu.int/comm/enterprise/medical_devices/index.htm
Средства диагностики in vitro
Литература
1.Beckwith CG, Flanigan TP, del Rio C, Simmons E, Wing EJ, Carpenter CCJ, Bartlett JG. It is time to implement routine, not risk-based, HIV testing. Clin Infect Dis 2005; 40:1037-40.
2.Berger A, Preiser W. Viral genome quantification as a tool for improving patient management: the example of HIV, HBV, HCV and CMV. J Antimicrob Chemother 2002; 49:713-21. http://amedeo.com/lit.php?id=12003963
3.Branson BM. Patientennahe Schnelltests für den Nachweis von HIV-Antikörpern. Point-of-Care Rapid Tests for HIV Antibodies. J Lab Med 2003; 27:288-295.
4.Branson BM. Rapid Tests for HIV Antibody. AIDS Reviews 2000; 2:76-83.
5.Brust S, Duttmann H, Feldner J, Gürtler L, Thorstensson R, Simon F. Shortening of the diagnostic window with a new combined HIV p24 antigen and anti-HIV-1/2/O screening test. J Virol Meth 2000; 90:153-65. http://amedeo.com/lit.php?id=11064116
6.Busch MP, Satten GA. Time course of viremia and antibody seroconversion following human immunodeficiency virus exposure. Am J Med 1997; 102(suppl 5B): 117-24. http://amedeo.com/lit.php?id=9845513
7.Centers for Disease Control and Prevention. Interpretation and Use of the Western-Blot Assay for Serodiagnosis of Human Immunodeficiency Virus Type 1 Infections. MMWR 1989; 38: 1-7. http://amedeo.com/lit.php?id=2501638
8.Centers for Disease Control and Prevention. Protocols for Confirmation of Reactive Rapid HIV Tests. MMWR 2004; 53: 221-2. http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5310a7.htm
9.Centers for Disease Control and Prevention. Updated U.S. Public Health Service Guidelines for the Management of Occupational Exposures to HBV, HCV, and HIV and Recommendations for Postexposure Prophylaxis. MMWR 2001; 50: 1-54. http://amedeo.com/lit.php?id=11442229
10.Ciesielski CA, Metler RP. Duration of time between exposure and seroconversion in healthcare workers with occupationally acquired infection with human immunodeficiency virus. Am J Med 1997; 102 (suppl 5B):115-6. http://amedeo.com/lit.php?id=9845512
11.Connick E. Incomplete antibody evolution and seroreversion after treatment of primary HIV type 1 infection: What is the clinical significance? Clin Infect Dis 2005; 40:874-5. http://amedeo.com/lit.php?id=15736022
12.Constantine NT, Sill AM, Jack N, Kreisel K, Edwards J, Cafarella T, Smith H, Bartholomew C, Cleghorn FR, Blattner WA. Improved classification of recent HIV-1 infection by employing a two-stage sensitive/less-sensitive test strategy. J Acquir Immune Defic Syndr. 2003 Jan 1;32(1):94-103. http://amedeo.com/lit.php?id=12514420
13.Deutsches Institut für Normung e.V. (DIN). DIN-Norm 58969-41. DIN-Taschenbuch 222: Medizinische Mikrobiologie und Immunologie, Diagnostische Verfahren, 3. Auflage, Stand 2000. Berlin, Wien, Zürich: Beuth-Verlag.
14.Giles RE, Perry KR, Parry JV. Simple/rapid test devices for anti-HIV screening: Do they come up to the mark? J Med Virol 1999; 59:104-9. http://amedeo.com/lit.php?id=10440816
15.Gürtler L, Mühlbacher A, Michl U, et al. Reduction of the diagnostic window with a new combined p24 antigen and human immunodeficiency virus antibody screening assay. J Virol Meth 1998; 75:27-38. http://amedeo.com/lit.php?id=9820572
16.Gürtler L. Difficulties and strategies of HIV diagnosis. Lancet 1996; 348:176-9. http://amedeo.com/lit.php?id=8684160
Лечение ВИЧ-инфекции. 2005 год 51
17.Haas J, Geiss M, Böhler T. False-negative polymerase chain reaction-based diagnosis of human immunodeficiency virus type 1 in children infected with HIV strains of African origin. J Infect Dis 1996; 174:224-5. http://amedeo.com/lit.php?id=8656008
18.Kassutto S, Johnston MN, Rosenberg ES. Incomplete HIV type 1 antibody evolution and seroreversion in acutely infected individuals treated with early antiretroviral therapy. Clin Infect Dis 2005; 40:868-73. http://amedeo.com/lit.php?id=15736021
19.King SD, Wynter SH, Bain BC, Brown WA, Johnston JN, Delk AS. Comparison of testing saliva and serum for detection of antibody to human immunodeficiency virus in Jamaica, West Indies. J Clin Virol 2000; 19:157-61. http://amedeo.com/lit.php?id=11090751
20.Ly TD, Laperche S, Couroucé AM. Early detection of human immunodeficiency virus infection using third-and fourth-generation screening assays. Eur J Clin Microbiol Infect Dis 2001; 20:104-10. http://amedeo.com/lit.php?id=11305462
21.Manavi K, Welsby PD. HIV testing: Should no longer be accorded any special status. Brit Med J 2005; 330:492-3. http://amedeo.com/lit.php?id=15746110
22.Meier T, Knoll E, Henkes M, Enders G, Braun R. Evidence for a diagnostic window in fourth generation assays for HIV. J Clin Virol 2001;23:113-6. http://amedeo.com/lit.php?id=11595590
23.Newell ML, Loveday C, Dunn D, Kaye S, Tedder R, et al. Use of polymerase chain reaction and quantitative antibody tests in children born to HIV -1-infected mothers. J Med Virol 1995; 47:330-5. http://amedeo.com/lit.php?id=8636699
24.Parekh BS, McDougal JS . New Approaches For Detecting Recent HIV-1 Infection. AIDS Rev 2001;3:183-93.
25.Preiser W, Brink NS, Hayman A, Waite J, Balfe P, Tedder RS. False-negative HIV antibody test results. J Med Virol 2000; 60:43-7. http://amedeo.com/lit.php?id=10568762
26.Rich JD, Merriman NA, Mylonakis E, Greenough TC, Flanigan TP, Mady BJ, Carpenter CC. Misdiagnosis of HIV infection by HIV-1 plasma viral load testing: a case series. Ann Intern Med 1999; 130:37-9. http://amedeo.com/lit.php?id=9890848
27.Ridzon R, Gallagher K, Ciesielski C, et al. Simultaneous transmission of human immunodeficiency virus and hepatitis C virus from a nee- dle-stick injury. N Engl J Med 1997; 336:919-22. http://amedeo.com/lit.php?id=9070472
28.Rossi. Early diagnosis of HIV infection in infants – Report of a consensus workshop, Siena, Italy, January 17-18, 1992. JAIDS 1992; 5:1168-78. http://amedeo.com/lit.php?id=1403648
29.Tamashiro H, Constantine NT. Serological diagnosis of HIV infection using oral fluid samples. Bull World Health Organ 1994; 72:135-143. http://amedeo.com/lit.php?id=8131250
30.Tamashiro H, Maskill W, Emmanuel J, Fauquex A, Sato P, Heymann D. Reducing the cost of HIV antibody testing. Lancet 1993;342:87-90. http://amedeo.com/lit.php?id=8100916
31.UNAIDS (1997a): Blood safety and HIV. UNAIDS Technical Update (UNAIDS Best Practice Collection: Technical Update). Geneva: UNAIDS, October 1997. WC 503.3 http://hiv.net/link.php?id=232
32.UNAIDS (1997b): HIV testing methods. UNAIDS Technical Update (UNAIDS Best Practice Collection: Technical Update). Geneva: UNAIDS, November 1997. WC 503.1 http://hiv.net/link.php?id=233
33.UNAIDS (2001): Guidelines for Using HIV Testing Technologies in Surveillance: Selection, Evaluation, and Implementation. WHO/CDS/CSR/EDC/2001.16. UNAIDS/01.22E. http://hiv.net/link.php?id=234
34.UNAIDS / WHO. Recommendations for the selection and use of HIV antibody tests. Weekly Epidemiological Record 1992; 67:145-49. http://amedeo.com/lit.php?id=1599842
35.UNAIDS / WHO. Revised recommendations for the selection and use of HIV antibody tests. Weekly Epidemiological Record 1997;72:81-7. http://amedeo.com/lit.php?id=9238418
36.Voß L. HIV-Testpolitik und -Testpraxis in Deutschland – eine Bestandsaufnahme. Bundesgesundheitsbl - Gesundheitsforsch -Gesundheitsschutz 2000; 43:683-93.
37.WHO / UNAIDS. The importance of simple/rapid assays in HIV testing - WHO/UNAIDS recommendations. Weekly Epidemiological Record 1998;73:321-6.
38.WHO. Rapid HIV tests: Guidelines for use in HIV testing and counselling services in resource-constrained settings. Geneva 2004. http://www.who.int/hiv/pub/vct/rapidhivtests/en/
52 Патогенез ВИЧ-1-инфекции
4. Патогенез ВИЧ-1-инфекции
Андреа Рабберт и Марио Островски
Прошло уже почти 20 лет с тех пор как были открыты вирусы иммунодефицита человека типа 1 в 1983 г. (1, 2) и типа 2 в 1986 г. (3) и установлено, что они являются первопричиной синдрома приобретенного иммунодефицита (СПИДа). Во всем мире большинство случаев СПИДа сегодня вызвано ВИЧ-1, поэтому говоря о ВИЧ мы будем подразумевать именно вирус первого типа. Число инфицированных ВИЧ-1 на земном шаре превышает 40 млн человек, большинство из них живет в Азии, Западной, Экваториальной и Южной Африке и Южной Америке.
С введением в схемы антиретровирусной терапии в 1995 г. ингибиторов протеазы и ненуклеозидных ингибиторов обратной транскриптазы началась эра высокоактивной антиретровирусной терапии (ВААРТ). Она ознаменовалась значительным снижением смертности и числа осложнений у ВИЧ-инфицированных, включая оппортунистические инфекции и злокачественные новообразования. Однако несмотря на все успехи антиретровирусной терапии последних десяти лет, искоренение вируса у ВИЧ-инфицированных по-прежнему остается недостижимым.
Лечение ВИЧ-инфекции столкнулось и с новыми проблемами — ранней и отдаленной токсичностью препаратов и устойчивостью вируса как у отдельных больных, так и в целом. В большинстве стран Юго-Восточной Азии и Африки заболеваемость и распространенность ВИЧ-инфекции выше, чем в Европе и Северной Америке и продолжают расти. Из-за высокой стоимости лечения и слаборазвитой сети здравоохранения в развивающихся странах применение ВААРТ пока ограничено. Дальнейший ход пандемии ВИЧ-инфекции во многом зависит от того, смогут ли развивающиеся страны с высокой распространенностью ВИЧ-инфекции в полной мере воспользоваться достижениями Европы и Северной Америки и от того, появится ли в ближайшем будущем вакцина для профилактики этой инфекции.
Главное условие, без которого невозможно ни упрочить завоеванных позиций в лечении ВИЧ-инфекции, ни достичь новых — будь то иммунотерапия или получение вакцин, — это понимание иммунопатогенеза ВИЧ-инфекции. Не вызывает сомнений, что течение ВИЧ-инфекции зависит от свойств как возбудителя, так и макроорганизма.
Течение ВИЧ-инфекции отличается крайним непостоянством — у одних людей инфекция прогрессирует быстро, у других медленно — даже при заражении от одного и того же источника (4). У некоторых ВИЧинфицированных число лимфоцитов CD4 не снижается и СПИД не развивается в течение 7 и более лет — в таких случаях (их около 5%) говорят о длительном непрогрессирующем течении инфекции. В некоторых из этих случаев обнаружены дефектные вирусы с ослабленной способностью к репликации
(5). Однако у большинства ВИЧ-инфицированных вирус активно реплицируется, а различия в скорости развития иммунодефицита объясняются особенностями макроорганизма.
С выяснением этих особенностей, в том числе генетических факторов и механизмов иммунной защиты, связывают перспективы дальнейшего изучения патогенеза ВИЧ-инфекции и создания методов иммунотерапии и профилактики.
Структура ВИЧ
ВИЧ относится к семейству ретровирусов, подсемейству лентивирусов. Лентивирусы вызывают хронические инфекции с длинным латентным периодом, персистирующей репродукцией вируса и поражением ЦНС. Возбудители типичных лентивирусных инфекций — вирус висны, вызывающий заболевание у овец, вирус иммунодефицита обезьян и вирус кошачьего иммунодефицита.
С помощью электронной микроскопии показано, что ВИЧ-1 и ВИЧ-2 имеют сходную структуру. В то же время у них есть и отличия — по молекулярной массе белков и некоторым дополнительным генам. Филогенетически ВИЧ-2 ближе к вирусу иммунодефицита обезьян, обнаруженному у воротничковых мангобеев, чем к ВИЧ-1. Предполагают, что у людей инфекция, вызванная ВИЧ-2, появилась в результате заражения от обезьян. Репликация как ВИЧ-1, так и ВИЧ-2 происходит в лимфоцитах CD4; оба вируса вызывают СПИД, хотя у инфицированных ВИЧ-2 он обычно протекает легче.
Лечение ВИЧ-инфекции. 2005 год 53
Морфология ВИЧ
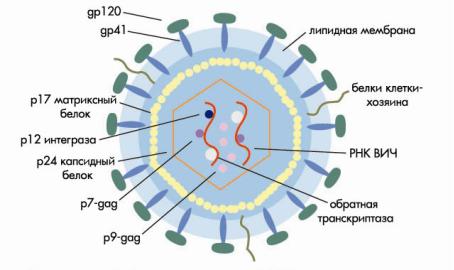
Диаметр ВИЧ-1 составляет 100 нм. Снаружи вирус окружен липидной мембраной, в которую встроены 72 гликопротеидных комплекса. Каждый из этих комплексов образован тремя молекулами поверхностного гликопротеида (gp120) и тремя трансмембранного (gp41). Связь между gp120 и gp41 довольно слабая, и поверхностный гликопротеид может спонтанно отсоединяться от вируса. Поэтому gp120 обнаруживается в сыворотке (6), а также лимфоидной ткани ВИЧ-инфицированных (7). При отпочковывании ВИЧ от клетки ее мембранные белки, в том числе HLA классов I и II, и молекулы адгезии, в частности ICAM-1, встраиваются в липидную мембрану вируса. Эти белки облегчают адгезию вируса к клет- кам-мишеням. Внутри к липопротеидной оболочке прилежит матриксный белок p17. Сердцевину вируса (капсид) составляет капсидный белок p24, который окружает белковонуклеиновый комплекс: две молекулы вирусной РНК, связанные с протеидом p7 и обратной транскриптазой p66. Вирус содержит все необходимые ферменты для репликации: обратную транскриптазу, интегразу p32 и протеазу p11 (рис. 1) (подробнее см. 8).
Геном ВИЧ
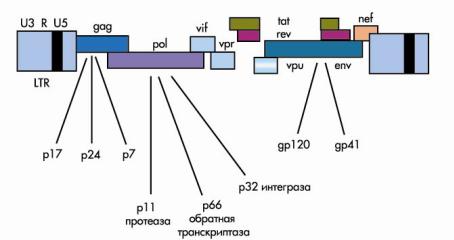
Репродукция большинства ретровирусов определяется тремя генами: gag, pol и env (рис. 2). Название генов произошло от кодируемых ими белков: gag — "group-antigen" (капсидный белок), pol — "polymerase" (полимераза), env — "envelope" (белки внешней оболочки) (подробнее см. 9). Классическая схема генома ретровирусов записывается как 5'LTR-gag-pol-env-LTR 3'. Оба конца генома содержат длинные концевые повторы LTR (от англ. long terminal repeat), которые обеспечивают интеграцию в клеточный геном и вирусных белков не кодируют. Гены gag и env кодируют белки капсида и внешней оболочки, ген pol — обратную транскриптазу и другие ферменты. Геном ВИЧ-1 в составе своих 9000 пар нуклеотидов содержит еще шесть генов — vif, vpu, vpr, tat, rev и nef. Ранее гены nef, vif, vpr и vpu называли дополнительными, поскольку репликация in vitro возможна и без их участия. В последние годы функция этих генов и кодируемых ими белков стала более понятна. Установлено, что продукты генов nef, tat и rev синтезируются в ранней фазе репликации ВИЧ.
Регуляторные белки Tat и Rev накапливаются в ядре и связываются с определенными участками вирусной РНК: первый с трансактивируемым регуляторным элементом (TAR) в области длинных концевых повторов, второй — с Rev-чувствительным регуляторным элементом (RRE) в области гена env. Белок Tat активирует транскрипцию промоторной области длинных концевых повторов и необходим для репликации вируса почти во всех культурах клеток. Белок Tat нуждается в клеточном кофакторе — циклине T1 (10). Белки Tat и Rev стимулируют транскрипцию провирусной ДНК в РНК, элонгацию РНК и транспорт РНК из ядра в цитоплазму и необходимы для трансляции. Белок Rev обеспечивает также транспорт компонентов вируса из ядра и переключение синтеза регуляторных белков на синтез структурных.
Рисунок 1.Схема строения ВИЧ (пояснения в тексте)
54 Патогенез ВИЧ-1-инфекции
Рисунок 2. Геном ВИЧ (пояснения в тексте)
Белок Nef выполняет несколько функций. Он подавляет экспрессию молекул CD4 (11) и HLA классов I и II (12) на поверхности инфицированных клеток, и тем самым позволяет вирусу ускользать от атаки цитотоксических T-лимфоцитов CD8 и от распознавания лимфоцитами CD4. Белок Nef может также угнетать активацию T-лимфоцитов, связываясь с различными белками — компонентами систем внутриклеточной передачи сигнала (подробнее см. 13).
У инфицированных вирусом иммунодефицита обезьян макак-резус активная репликация вируса и прогрессирование болезни возможны только при интактном гене nef. Делеции гена nef были обнаружены в штаммах ВИЧ, выделенных у группы австралийцев с длительным непрогрессирующим течением инфекции (5). Однако у части из них со временем появились признаки прогрессирования инфекции, в том числе снижение числа лимфоцитов CD4. Таким образом, хотя делеции гена nef и могут замедлять репликацию вируса, гарантией от СПИДа они не служат.
Белок Vpr необходим для репликации вируса в непролиферирующих клетках, в том числе макрофагах. Этот белок наряду с другими клеточными и вирусными промоторами активирует длинные концевые повторы генома ВИЧ. Недавно выяснено, что белок Vpr играет важную роль в переносе провируса в ядро (подробнее см. 14) и вызывает задержку пролиферации клетки в периоде G2.
Белок Vpu важен для отпочковывания вируса из клетки: мутации гена vpu приводят к накоплению вирусных частиц у внутренней поверхности клеточной мембраны. Этот белок участвует также в разрушении комплексов CD4-gp160 в эндоплазматическом ретикулуме, позволяя тем самым gp160 включаться в формирование новых вирионов (15).
Согласно последним публикациям белок Vif играет важную роль в поддержке репликации вируса (16). Штаммы, лишенные этого белка, не реплицируются в лимфоцитах CD4, некоторых линиях T-лимфоцитов («недоступных клетках») и макрофагах. Эти штаммы способны проникать в клет- ки-мишени и начинать обратную транскрипцию, однако синтез провирусной ДНК остается незавершенным. In vitro слияние «доступных» и «недоступных» клеток приводит к «недоступному» фенотипу; это означает, что репликация ВИЧ зависит от наличия или отсутствия клеточного ингибитора. Недавно та-
кой эндогенный ингибитор был выявлен — APOBEC3G (17). APOBEC3G (от англ. «apolipoprotein B mRNA editing enzyme catalytic polypeptide like 3G» — фермент-каталитический полипептид, корректи-
рующий мРНК апопротеина B, типа 3G») принадлежит к семейству внутриклеточных ферментов, специфически дезаминирующих цитозин в урацил в составе мРНК или ДНК, что приводит к накоплению мутаций G/A и распаду вирусной ДНК. Образуя комплекс с APOBEC3G, Vif блокирует ингибиторную активность APOBEC3G (рис. 3a). Примечательно, что противовирусная активность APOBEC3G очень специфична для разных видов животных, а блокада APOBEC3G белком Vif очень специфична для ВИЧ. Образуемый ВИЧ-1 белок Vif не образует комплекса с APOBEC3G мышей и макак-резус. В отсутствие Vif APOBEC3G встраивается в образующиеся вирусные частицы и затем проникает в клетки-мишени, блокируя провирусную ДНК (рис. 3б). При наличии же белка Vif APOBEC3G связывается, распадается и не встраивается в новые вирусные частицы. APOBEC3G синтезируется в лимфоцитах и макрофагах — основных мишенях ВИЧ-инфекции.
