
4 курс / Общая токсикология (доп.) / Врожденные пороки сердца
.pdf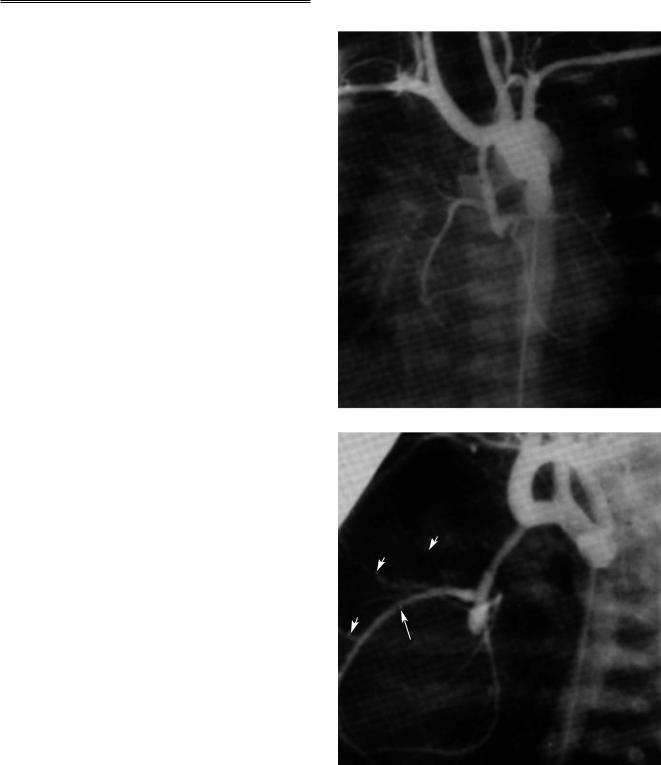
832
больных с антеградным кровотоком через левый желудочек. При атрезии аортального и митрально# го клапанов отмечается сброс крови слева направо на предсердном уровне и справа налево через ОАП. Насыщение системной венозной крови кис# лородом снижено, что указывает на уменьшенный объем системного кровотока и сердечную недос# таточность. Насыщение крови в восходящей и нисходящей аорте соответствует таковому в легоч# ной артерии, но не всегда. При наличии венозной обструкции возможно внутрилегочное шунтиро# вание справа налево, и насыщение системной ар# териальной крови при этом ниже. В случаях, когда аортальный и митральный клапаны не атрезиро# ваны, артериальное насыщение выше. Артериаль# ное насышение кислородом тем выше, чем больше соотношение объемов легочного и системного кровотока.
Давление в правых отделах сердца значительно повышено, в правом предсердии — из#за сердеч# ной недостаточности. В правом желудочке и ле# гочной артерии систолическое давление равно системному или превышает его. Это зависит от степени сужения артериального протока.
При катетеризации возможны эпизоды угрожа# ющей брадикардии, когда катетер проходит через узкий боталлов проток или когда его ретроградно проводят в гипоплазированную восходящую аор# ту. В обоих случаях нарушается коронарный кро# воток и возникает ишемия, проявляющаяся бра# дикардией. Сама по себе узкая восходящая аорта может создавать препятствие ретроградному коро# нарному кровотоку.
Давление в левом предсердии отражает адек# ватность межпредсердного сообщения. При ми# нимальном дефекте прямое измерение давления в левом предсердии невозможно. Однако о его вели# чине можно судить по давлению заклинивания ле# гочных капилляров. Давление в левом предсердии отражает степень гипоплазии митрального и аор# тального клапанов и выраженность сердечной не# достаточности.
При ангиокардиографии селективное введение контрастного вещества в правый желудочек и ле# гочный ствол позволяет диагностировать атрезию аорты при вторичном заполнении узкой восходя# щей аорты справа от легочного ствола. При прове# дении венозного катетера в ОАП и нисходящую аорту можно определить ее диаметр и наличие ко# арктации аорты, но только ретроградная аортогра# фия позволяет четко продемонстрировать восхо# дящую аорту, оценить ее просвет и распределение коронарных артерий (рис. 3).
Восходящая аорта может быть разных размеров
Часть 10. ПОРОКИ ВЫВОДНОГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА
Ао 
а
ПКА
б
Рис. 3. Фронтальная (а) и боковая (б) ретроградные аорто граммы у новорожденного с атрезией аорты. Узкая восходя щая аорта продолжается в коронарные артерии. На боковой аортограмме видно, что правая коронарная артерия (ПКА) с расширенными инфундибулярными ветвями (показаны малы ми стрелками) является доминирующей
— от нормальных до крошечных. Обычно аорта начинает суживаться на уровне безымянной арте# рии. Реже просвет аорты имеет грушеобразную форму, суживаясь к брахиоцефальным сосудам.
Прохождение коронарных артерий по эпикар#

Глава 56. СИНДРОМ ГИПОПЛАЗИИ ЛЕВЫХ ОТДЕЛОВ СЕРДЦА
ду позволяет приблизительно оценить размеры ле# вого желудочка, который ограничен простран# ством между передней нисходящей коронарной артерией и огибающей артерией. Идеальное за# полнение восходящей аорты и коронарных арте# рий можно получить с помощью методики бал# лонной окклюзии аорты. Редко при СГЛОС обе коронарные артерии отходят от легочного ствола. Баллонная окклюзия аорты не приносит пользы для визуализации восходящей аорты при таких не# обычных вариантах, как окклюзия и перерыв дуги аорты. В этих случаях кровоток в восходящей аор# те обеспечивается правосторонним боталловым протоком или открытым аортолегочным окном. Изредка источником кровоснабжения коронар# ной системы являются синусоиды в толще мио# карда, соединяющие полость левого желудочка с коронарными артериями аналогично тому, как это наблюдается при атрезии легочной артерии с ин# тактной межжелудочковой перегородкой.
В отличие от правого предсердия при атрезии легочной артерии или атрезии трехстворчатого клапана левое предсердие редко бывает расши# ренным. Обычно оно малых размеров и толстос# тенное. При атрезии митрального клапана дно ле# вого предсердия плоское. При малом межпредсе# рдном сообщении отмечается рефлюкс контраст# ного вещества в расширенные легочные вены. При левой атриографии может быть обнаружен дренирующийся в левое предсердие коронарный синус (unroofed).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА СГЛОС
Дифференциальная диагностика СГЛОС и критического аортального стеноза часто бывает трудна и чрезвычайно важна для выбора соответ# ствующей тактики лечения — бивентрикулярной коррекции (аортальной вальвулотомии) или одно# желудочковой гемодинамической коррекции. При обоих пороках полость левого желудочка умень# шена. Разными авторами были предложены раз# личные критерии оценки степени гипоплазии ле# вого желудочка: диаметр кольца митрального кла# пана, аортального клапана, восходящей аорты, размер полости левого желудочка. Бивентрику# лярная коррекция не показана, если эти размеры составляют менее 60% средних величин при дан# ной массе тела (1), а также если верхушка сердца не образована левым желудочком. Leung и соавто# ры (2) показали, что при критическом аортальном стенозе вальвулотомия опасна, если приточный размер по данным ЭхоКГ <25 мм, желудочково#
833
аортальное соединение < 5 мм, а диаметр кольца митрального клапана < 9 мм. В детском госпитале Бостона (4) разработаны свои индексы риска: пло# щадь митрального клапана < 4,75 см2/м2, отноше# ние размера левого желудочка по длинной оси к размеру сердца < 0,8, диаметр корня аорты < 3,5 см/м2, масса левого желудочка < 35 г/м2. Объем ле# вого желудочка, равный 20 мл/м2, в этом центре считают достаточным для выполнения вальвуло# томии.
ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ
В течение первой недели жизни развиваются отек легких и застойная сердечная недостаточ# ность. Больные умирают в период новорожден# ности от циркуляторного шока, прогрессирующей гипоксемии и ацидоза. Принципиально важное значение имеет дородовое эхокардиографическое исследование, которое позволяет заподозрить этот порок уже на 16–20#й неделе беременности и сра# зу после рождения транспортировать ребенка в специализированный центр. Иногда больных вы# писывают из роддома, не подозревая наличие по# рока. Это бывает при персистировании ОАП и благоприятном соотношении сопротивления большого и малого кругов кровообращения. Одна# ко после выписки ОАП может быстро закрыться, что приводит к тяжелому метаболическому ацидо# зу, шоку, вторичным поражениям всех жизненно важных органов. Обратимость этих изменений за# висит от тяжести ацидоза и его продолжительнос# ти. При условии своевременного начала введения простогландина можно выиграть время для транс# портировки больного в хирургический центр.
Возможен другой вариант течения. При инта# ктной перегородке или рестриктивном овальном окне затрудняется разгрузка левого предсердия. Это приводит к повышению левопредсердного давления, застою в легочном венозном и легочном артериальном русле, снижению объема легочного кровотока и увеличению системного кровотока. Однако такая ситуация не улучшает общего состо# яния пациента, так как при снижении легочного кровотока возникают цианоз и метаболический ацидоз в результате артериальной гипоксемии. Медикаментозное лечение не эффективно.
ДООПЕРАЦИОННОЕ ЛЕЧЕНИЕ
Синдром гипоплазии левых отделов сердца от# носится к группе пороков, хирургическое лечение которых сопровождается высокой степенью риска. Хотя выживаемость больных после первой стадии
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
834 |
Часть 10. ПОРОКИ ВЫВОДНОГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА |
|
|
|
|
реконструкции (операция Norwood) во многих за# |
рующему увеличению легочного кровотока и сер# |
падных центрах достигла 90% (5) и после последу# |
дечной недостаточности. |
ющих этапов по Fontan превысила 75%, опреде# |
Простогландин. Сразу после возникновения |
ленную часть младенцев не направляют на хирур# |
подозрения на сложный ВПС необходимо быть |
гическое лечение. Родители родившихся в срок де# |
готовыми начать инфузию ПГЕ1 и продолжать ее |
тей с установленным до родов диагнозом в 7–36% |
во время транспортировки. Лучше начинать инфу# |
случаев отказались от лечения (6, 7). Среди мла# |
зию ПГЕ1 уже в роддоме. При полностью откры# |
денцев, которым предполагалось проводить лече# |
том ОАП для стабилизации больного обычно дос# |
ние, у 14–21% имелись противопоказания к опера# |
таточна доза 0,01–0,025 мкг/кг/мин. Для больных, |
циям (хромосомные аномалии, черепно#мозговые |
поступивших со сниженным кровотоком через |
травмы в родах, врожденная патология жизненно |
ОАП, необходимая начальная доза составляет 0,1 |
важных органов, полиорганная недостаточность |
мкг/кг/мин. Детям более старшего возраста (1–2 |
вследствие шока, дооперационный сепсис) (6, 8). |
нед) могут потребоваться большие дозы для отк# |
Большинство больных прибывают для хирур# |
рытия уже закрывшегося протока. |
гического лечения из отделений интенсивной те# |
ПГЕ1 имеет два клинически значимых дозоза# |
рапии новорожденных с эхокардиографическим |
висимых побочных эффекта. Это гипотензия, ко# |
диагнозом СГЛОС. При постановке анатомичес# |
торая особенно неблагоприятна у больных, нахо# |
кого диагноза очень важно также оценить функ# |
дящихся в шоке и требующих более высоких доз |
цию миокарда, проходимость ОАП и нарушение |
препарата, и апноэ. Сосудорасширяющий эффект |
оттока легочной венозной крови. Когда эхокарди# |
ПГЕ1 можно компенсировать инфузией жидкости |
ографическое исследование ввиду каких#либо |
10–20 мл/кг и малых доз допамина (3–5 |
обстоятельств недоступно, СГЛОС может быть за# |
мкг/кг/мин. Ребенка, стабилизированного малы# |
подозрен среди других причин развития коллапса |
ми дозами ПГЕ1 без эпизодов апноэ, можно безо# |
кровообращения, слабого пульса, ацидоза. Следу# |
пасно транспортировать на самостоятельном ды# |
ет исключить инфекционные факторы риска или |
хании без интубации трахеи, однако сопровожда# |
лабораторные данные, указывающие на сепсис. |
ющий анестезиолог должен быть готов интубиро# |
Целью предоперационного ведения новорож# |
вать ребенка в случае возникновения остановки |
денных со СГЛОС является своевременная дос# |
дыхания |
тавка пациента в операционную с хорошим сер# |
Искусственная вентиляция легких. Эндотрахе# |
дечным выбросом, сохранной функцией всех ор# |
альная интубация и контролируемая вентиляция |
ганов и сбалансированным легочным и систем# |
могут оказаться полезными при нестабильной ге# |
ным кровотоком. Некоторые больные, поступаю# |
модинамике, обусловленной значительно возрос# |
щие в кардиохирургическую клинику в состоянии |
шим легочным кровотоком. Ребенок должен быть |
шока, нуждаются в реанимационных действиях, |
адекватно седирован на фоне нейромышечной бло# |
другие требуют энергичной коррекции резко уве# |
кады, необходимой для интубации. Для подавления |
личенного легочного кровотока, реже возникает |
вагусного эффекта ларингоскопии показана преме# |
необходимость ургентного вмешательства для уве# |
дикация атропином (0,02 мг/кг). Кетамин (0,5–2 |
личения легочного кровотока путем декомпрессии |
мг/кг) поддерживает системное давление крови и |
левого предсердия. |
хорошо переносится дооперационными больными |
Решающую роль в предоперационном ведении |
со СГЛОС. Фентанил (1–2 мкг/кг) или морфин |
больных со СГЛОС играют несколько важных |
(0,05–0,1 мг/кг) титруют до получения эффекта. |
анатомических факторов. Снижение функции |
Для обеспечения адекватной вентиляции следует |
правого желудочка и сопутствующая недостаточ# |
устранить ригидность грудной клетки нейромы# |
ность трехстворчатого клапана могут потребовать |
шечной блокадой. Преоксигенация 50–100% кис# |
инотропной поддержки. Степень проходимости |
лородом в течение нескольких минут хорошо пере# |
ОАП определяет дозировку ПГЕ1. Наличие ано# |
носится больными без существенной гипотензии, |
мального дренажа легочных вен может сопровож# |
несмотря на то что кислород является легочным ва# |
даться сдавлением вертикальной вены между |
зодилататором, способным увеличить легочный |
ветвью легочной артерии и главным бронхом. На# |
кровоток за счет системной перфузии. Показан ре# |
конец, при интактной межпредсердной перего# |
жим нормовентиляции (РаСО2 40 мм рт. ст.). Ги# |
родке или рестриктивном дефекте требуется сроч# |
первентиляция может нарушить соотношение ле# |
ное выполнение септостомии или септэктомии. В |
гочного и системного кровотока в пользу первого. |
то же время наличие широкого межпредсердного |
Кислород. На дооперационном этапе у детей со |
сообщения может привести к быстро прогресси# |
СГЛОС следует избегать применения кислорода, |

Глава 56. СИНДРОМ ГИПОПЛАЗИИ ЛЕВЫХ ОТДЕЛОВ СЕРДЦА
так как он повышает соотношение Qл/Qс. Необ# ходимость применения кислорода может возник# нуть при наличии легочной патологии (ателектаз, аспирация мекония, пневмония) или рестриктив# ного ДМПП. При отсутствии этих обстоятельств у большинства младенцев с СГЛОС на дохирурги# ческом этапе легочный кровоток увеличен и насы# щение артериальной крови кислородом при дыха# нии комнатным воздухом составляет 88–95% (РаО2 45–50 мм мм рт. ст.). Более низкое насыще# ние требует тщательной оценки. Хотя имеется соблазн назначения ингаляции кислорода, когда снижение SaO2 отражает гипоперфузию большого круга кровообращения при высоком Qл/Qс, до# бавление кислорода в дыхательную смесь может снизить SаО2 еще больше.
Инотропная поддержка. Больным со снижен# ной функцией правого желудочка показана инфу# зия допамина (до 5 мкг/кг/мин) или других карди# отонических средств. Следует предостеречь от введения больших доз допамина или иных инот# ропных средств, обладающих системным сосудо# суживающим действием, так как это может увели# чить соотношение Qл/Qс.
Милринон снижает как легочное, так и пери# ферическое сосудистое сопротивление после опе# рации у детей (9, 10). Добутамин снижает в боль# шей степени сопротивление системных артерий, чем легочных (11, 12, 13). В литературе отсутству# ют сведения о действии этих препаратов на сосу# дистое сопротивление легочных и системных ар# терий у младенцев с СГЛОС, поэтому их следует применять с осторожностью из#за непредсказуе# мого действия на Qл/Qс.
При назначении симпатомиметиков следует удовлетворяться минимально допустимыми пока# зателями достаточности системного кровотока: небольшим дефицитом оснований (от –3 до –6), небольшой концентрацией лактата и умеренной гипотензией (диастолическое давление менее 20 мм рт. ст.). Малые дозы допамина (5 мкг/кг/мин) оказывают минимальное действие на Qл/Qс, но увеличивают минутный объем сердца, доставку кислорода и уменьшают степень гипотензии.
Коррекция ацидоза. У дооперационных больных со СГЛОС введение щелочных растворов следует проводить с осторожностью, так как они могут снижать ЛСС и увеличивать Qл/Qc, тем самым уменьшая системный кровоток и способствуя уси# лению системного ацидоза. Однако больные, на# ходящиеся в шоке и глубоком метаболическом ацидозе, нуждаются в коррекции дефицита осно# ваний. При введении оснований (натрия бикарбо# ната или ТНАМ) следует добиваться оптимизации
835
Qл/Qс. Недоношенным младенцам щелочные растворы необходимо вводить медленно во избе# жание кровоизлияния в мозг.
Антибиотики назначают уже в роддоме при на# личии факторов риска инфекции и продолжают их введение в течение 48–72 ч, т.е. до тех пор, пока посевы, сделанные до начала терапии, не окажут# ся отрицательными. При отсутствии факторов риска антибиотики не назначают.
Рестриктивное межпредсердное сообщение.
Сбалансированность кровотока по большому и малому кругам кровообращения, обусловливаю# щая относительное благополучие ребенка со СГЛОС, или исключительная тяжесть состояния с глубокой гипоксемией, гипотензией и полной обструкцией легочного венозного возврата зави# сят от степени ограничения тока крови через ДМПП и выраженности гипоплазии левого желу# дочка. Интактная межпредсердная перегородка с наличием разгружающей вертикальной вены (ру# диментарной левой верхней полой вены) или без нее встречается у 6% пациентов (14). Результаты лечения таких больных неудовлетворительные.
Трудность лечения определяется необходи# мостью организации целенаправленных ургент# ных действий сразу после рождения, поэтому очень важны пренатальная диагностика и родо# разрешение в заранее выбранной больнице, в ко# торой есть отделение кардиохирургии или лабора# тория катетеризации сердца. Ребенок должен быть интубирован в родзале, и здесь же следует начи# нать введение ПГЕ1 через пупочную вену. Ребенка сразу транспортируют в кардиохирургическую операционную или лабораторию катетеризации для выполнения декомпрессии левого предсердия путем септэктомии, процедуры Рашкинда или стентирования вертикальной вены.
При отсутствии дородового диагноза больному клинически может быть ошибочно поставлен ди# агноз обструктивного ТАДЛВ. Тактика реанима# ционных действий при обеих аномалиях сходна: интубация, положительное давление на выдохе (РЕЕР), при показаниях — кислород, инотропная поддержка, восполнение объема жидкости и осно# ваний. Однако есть существенные отличия в ин# тервенционных действиях, которые и определяют исход лечения. Поэтому при клинической картине легочно#венозной обструкции крайне необходимо экст#ренное эхокардиографическое обследование. При обструкции легочно#венозного возврата в критических ситуациях используют венозно#арте# риальную ЭКМО или корригирующее хирургичес# кое лечение. При СГЛОС с интактной межпредсе# рдной перегородкой состояние больных можно
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
836 |
Часть 10. ПОРОКИ ВЫВОДНОГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА |
|
|
|
|
стабилизировать, только выполнив септ#эктомию или паллиативную операцию по Norwood. ЭКМО при СГЛОС требует осуществления транстора# кальной канюляции с лигированием ОАП.
ПРЕДОПЕРАЦИОННОЕ ОБСЛЕДОВАНИЕ
Предоперационное обследование в кардиохи# рургической клинике проводится в порядке подго# товки к экстренной операции. Исследуют газы крови, электролиты, ионизированный кальций и глюкозу. Рентгенограмма грудной клетки позволя# ет определить правильность расположении эндо# трахеальной трубки, желудочного зонда и рентге# ноконтрастного венозного катетера. Обычно отме# чаются умеренное увеличение размеров сердца и признаки увеличенного легочного кровотока. Ле# гочно#венозный застой является признаком рестриктивного межпредсердного сообщения или аномального дренажа легочных вен с обструкцией.
Физикальное обследование направлено на оценку состояния кровообращения. Слабый пери# ферический пульс свидетельствует об избыточном легочном кровотоке или небольшом ОАП. Одыш# ка указывает на застой в легких. Аускультация обычно не обнаруживает отклонений от нормы, за исключением нерасщепленного II тона. При вы# раженной гепатоспленомегалии может выслуши# ваться систолический шум трикуспидальной не# достаточности.
Уноворожденных с недостаточной системной перфузией и ацидозом необходимо оценить функ цию внутренних органов. При гипоксическом пов# реждении печени повышается концентрация пе# ченочных ферментов, снижаются уровень сыворо# точного альбумина, протромбиновый индекс, воз# растает уровень аммиака. Функция печени чаще всего восстанавливается, однако иногда развива# ется скоротечная печеночная недостаточность. Нормализация функции печени является одним из условий для выполнения первой стадии хирур# гического лечения порока. Это же относится к дисфункции почек, проявляющейся повышением уровня азота мочевины и креатинина. В этих слу# чаях уместно ультразвуковое исследование почек.
Увсех недоношенных и поступивших в состоя# нии шока необходимо исключить мозговое крово# излияние с помощью ультразвукового исследова# ния головы. Оно показано также у стабильных де# тей с сопутствующей врожденной патологией, особенно при микроцефалии. При обнаружении аномалий рутинно выполняют компьютерную то# мографию. Оптимальная хирургическая тактика у детей с кровоизлияниями в мозг не выработана.
Риск, связанный с гепаринизацией и остановкой кровообращения, превышает риск отсрочки опе# рации и чрезмерного увеличения легочного кро# вотока. В ведущих кардиохирургических центрах мира операцию откладывают на 1–3 дня.
У детей со СГЛОС высока вероятность разви# тия некротического энтероколита (15, 16). Паци# енты с молочнокислым ацидозом, расширенными петлями кишечника, примесью крови в стуле и тромбоцитопенией должны быть обследованы рентгенографически на наличие пневмотоза или свободного воздуха в брюшной полости. Если поз# воляют гемодинамические условия, пациентам с клинически выраженным некротическим энтеро# колитом назначают 7–10#дневный курс трех анти# биотиков для смягчения последствий ишемичес# ких и реперфузионных повреждений кишечника, связанных с искусственным кровообращением. Этот курс следует сократить, если у больного оп# ределяется значительный дисбаланс между легоч# ным и системным кровотоком, который может еще больше ухудшить перфузию кишечника. Больных, перенесших ургентное вмешательство в связи с некротическим энтероколитом, приходит# ся оперировать по поводу основного заболевания до истечения нормального периода восстановле# ния после абдоминальной операции.
ПРЕДОПЕРАЦИОННОЕ ВЕДЕНИЕ
Суть предоперационного ведения больных с о СГЛОС, как и при других пороках с функциональ# но единственным желудочком, заключается в дос# тижении баланса между легочным и системным кровотоком. Сниженный легочный кровоток (низкое соотношение Qp/Qs) приводит к гипоксе# мии. Резко увеличенный легочный кровоток (вы# сокое Qp/Qs) сопровождается системной гипопер# фузией, гипотензией, метаболическим ацидозом и поражением внутренних органов. Согласно урав# нению Фика:
Qp/Qs = (SaO2 — SvO2) / (SpvO2 — SaO2).
Если принять, что у больного со СГЛОС ми# нутный объем сердца в норме, насыщение сме# шанной венозной крови (SvO2) равно 60% и при отсутствии легочной патологии насыщение легоч# ной венозной крови (SpvO2) равно 100%, то насы# щение системной артериальной крови кислоро# дом, равное 80%, при соотношении Qp/Qs будет равно 1. У больнго с более высоким насыщением венозной крови (SvO2 75% и SpvO2 100%) соотно# шение Qp/Qs будет составлять 1, если SaO2 соста#

Глава 56. СИНДРОМ ГИПОПЛАЗИИ ЛЕВЫХ ОТДЕЛОВ СЕРДЦА
вит 87,5%. Очевидно, что при SaO2 > 90% соотно# шение Qp/Qs >1. К сожалению, SaO2 80% не всег# да свидетельствует о том, что кровоток в большом и малом кругах кровообращения одинаков (1:1). У больных с небольшим минутным объемом и SvO2 30%, SpvO2 100% и SaO2 80%, соотношение легоч# ного и системного кровотока Qp/Qs составляет 2,5/1, с клинически значимой легочной гиперво# лемией и большой артериовенозной разницей по кислороду (признак повышенной экстракции кислорода в тканях при гипоперфузии организма).
У кардиохирургических больных обычно мони# торируют SvO2. В венозной системе младенцев со СГЛОС нет места, где бы можно было измерить истинное SvO2. Правое предсердие и легочная ар# терия содержат смешанную легочную и систем# ную венозную кровь. Считается, что кровь из верхней полой вены с максимальным приближе# нием отражает SvO2. Хотя верхняя полая вена яв# ляется лучшим местом забора проб смешанной ве# нозной крови, длительное нахождение в ней кате# тера может привести к ее тромбозу и невозмож# ности выполнения двунаправленного кавопуль# монального анастомоза Glenn или паллиативной операции hemi#Fontan.
ВАРИАНТЫ КЛИНИЧЕСКОГО ТЕЧЕНИЯ И ТЕРАПЕВТИЧЕСКАЯ ТАКТИКА
Клинически стабильные младенцы до операции могут переносить увеличенный легочный кровоток достаточно продолжительное время. Если диагноз поставлен рано, своевременное начало инфузии ПГЕ1 (0,01–0,025 мкг/кг/мин) позволяет избежать ацидоза и интубации трахеи. Относительное благо# получие обусловлено оптимальными размерами межпредсердного сообщения (умеренно рестрик# тивное), что обеспечивает баланс Qp/Qs. Хотя час# тота дыхания достигает 60–80 в минуту, а SaO2 мо# жет превысить 90% при РаО2 40–50 мм рт. ст., они остаются клинически стабильными при мини# мальном вмешательстве. В этой группе пациентов несмотря на увеличенный легочный кровоток сох# раняется адекватная системная перфузия.
Другая группа младенцев со СГЛОС нуждается в интенсивной регуляции баланса легочного и системного кровотока. К ним относятся больные, поступившие в клинику в состоянии шока в ре# зультате поздней диагностики, а также пациенты с клинически выраженной легочной гиперволеми# ей, независимой от времени постановки диагноза.
У больных с поздним диагнозом может раз# виться кардиогенный шок, обусловленный одной из следующих причин:
837
•наличием рестриктивного межпредсердного со# общения с застоем крови в легочных венах;
•прекращением системного и коронарного кро# вотока из#за частичного или полного закрытия ОАП;
•недостаточной системной перфузией, вызван# ной чрезмерным легочным кровотоком при открытом ОАП.
Часто этих детей выписывают из роддома без
диагноза, в состоянии видимого благополучия, но вскоре они поступают в реанимационное отделе# ние с одышкой, холодными конечностями и други# ми признаками недостаточности периферического кровообращения. Обычно у этой когорты пациен# тов имеет место нерестриктивный ДМПП. Из#за тяжести состояния их не выписывали из стациона# ра и ошибочно назначали лечение кислородом и гипервентиляцией до постановки точного диагно# за. Вне зависимости от этиологии шока у больных часто снижена функция желудочка, сопровождаю# щаяся трикуспидальной недостаточностью и уве# личением печени, тяжелым метаболическим аци# дозом, печеночно#почечной недостаточностью, а также ишемией кишечника и диссеминированной внутрисосудистой коагулопатией.
Такие больные требуют быстрой и агрессивной реанимации. Необходимо начинать с инфузии ПГЕ1 в дозе, соответствующей степени проходи# мости ОАП (см. выше). Для увеличения общего сердечного выброса вводят допамин в дозе 5 мкг/кг/мин. Седация, релаксация и интубация трахеи позволяют контролировать вентиляцию и минимизировать потребление кислорода. Если вентиляция комнатным воздухом (21% FiO2) соп# ровождается неприемлемо увеличенным легоч# ным кровотоком, в дыхательную смесь добавляют СО2 (20 мм рт. ст.) для улучшения доставки кисло# рода в ткани. Функции всех внутренних органов должны быть восстановлены до операции. Если несмотря на реанимационные усилия сохраняется метаболический ацидоз, необходимо проверить проходимость ОАП с помощью ЭхоКГ. При ус# тойчивой к лечению выраженной легочной гипер# волемии прибегают к безотлагательной хирурги# ческой реконструкции.
Регуляция объема легочного кровотока изменением состава дыхательной смеси
Снижения соотношения Qp/Qs добиваются пу# тем повышения в газовой смеси содержания СО2 (14–35 мм рт.ст.)(17, 18) и создания альвеолярной гипоксии (14–19% FiO2) за счет добавления к вды# хаемому комнатному воздуху азота (19, 20). Гипо#
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
838 |
Часть 10. ПОРОКИ ВЫВОДНОГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА |
|
|
|
|
ксия и гиперкарбия повышают ЛСС, давление в ле# |
ника и использование пупочной артерии для ка# |
|
гочной артерии и снижают объем легочного крово# |
нюляции, рекомендуется парентеральное питание. |
|
тока. Одновременно при неизменяющемся среднем |
Недоношенные младенцы или дети |
|
артериальном давлении снижается периферическое |
||
с малой для гестационного возраста массой |
||
сосудистое сопротивление и увеличивается систем# |
||
|
||
ный кровоток. Гиперкарбия в большей степени уве# |
|
|
личивает системный кровоток, чем гипоксия. До# |
Ранняя выживаемость после первой стадии ре# |
|
бавляя СО2 во вдыхаемую смесь при спонтанном |
конструкции СГЛОС ниже у младенцев с массой |
|
дыхании ребенка, следует соблюдать осторожность, |
менее 2,5 кг по сравнению с детьми с нормальной |
|
так как даже небольшая гиповентиляция может |
массой (51% и 73% соответственно) (22). В насто# |
|
привести к значительной артериальной гипоксе# |
ящее время недоношенность сама по себе редко |
|
мии. Это следует из уравнения альвеолярного газа: |
является препятствием для хирургического вме# |
|
|
шательства. Попытки отсрочить вмешательство до |
|
PAO2 = (Pатм–Pвод ) • FiO2 – PaCO2/ RQ, |
тех пор, пока ребенок не наберет приемлемую |
|
|
массу тела, чреваты развитием обструктивных из# |
|
где РАО2 — альвеолярное парциальное давление |
менений в легочных сосудах, некротического эн# |
|
кислорода (мм рт. ст.), Ратм — атмосферное |
тероколита, инфекции и других осложнений ско# |
|
давление (760 мм рт. ст. на уровне моря), Рвод |
ротечного естественного течения порока. В веду# |
|
— парциальное давление водяного пара (47 мм |
щих мировых клиниках к операциям прибегают, |
|
рт. ст. при 37 °С), FiO2 — процентное содержа# |
когда масса тела ребенка превышает 1–1,2 кг (23). |
|
ние вдыхаемого кислорода, РаСО2 — парциаль# |
Одной из проблем у детей малого гестационно# |
|
ное давление углекислого газа в артериальной |
го возраста с ВПС являются большая частота кро# |
|
крови, RQ — дыхательный коэффициент (0,8). |
воизлияния в желудочки мозга, чем у нормальных |
|
|
новорожденных (24). С помощью МРТ у стабиль# |
|
Подставив соответствующие числовые значе# |
ных пациентов после коррекции СГЛОС в 71% |
|
ния, можно записать: |
случаев обнаружили внутрижелудочковые крово# |
|
|
излияния (разной степени) и в 45% — субдураль# |
|
РАО2 = 713 мм рт. ст. • FiO2 — PaCO2/0,8. |
ные. Отдаленные последствия этих находок в нас# |
|
|
тоящее время не известны. При обнаружении кро# |
|
Следовательно, если у больного, который нахо# |
воизлияний на дооперационном этапе выжидают |
|
дится на самостоятельном дыхании в условиях ги# |
2 сут перед операцией в условиях искусственного |
|
поксии (FiO2 17%), наступит кратковременное ап# |
кровообращения. |
|
ноэ, например в связи с инфузией ПГЕ1, может нас# |
|
|
тупить преходящее повышение РаСО2 до 70 мм рт. |
ИСТОРИЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ |
|
ст. При этом альвеолярное РАО2 станет равным 34 |
|
|
мм рт. ст. Парциальное давление системной артери# |
Термин «гипоплазия левых отделов сердца» был |
|
альной крови РаО2 определяется смешанным ве# |
введен в 1958 г. Noonan и Nadas (25) для обозначе# |
|
нозным (PvO2) и альвеолярным РАО2. При Qp/Qs, |
ния порока, характеризующегося недоразвитием |
|
равном 1, РаО2 = (PvO2 + PAO2) /2. Таким образом, |
или атрезией структур левых отделов сердца, хотя |
|
в условиях дыхания гипоксической газовой смесью |
первое описание патофизиологии, появившееся |
|
и умеренного дыхательного ацидоза может возник# |
еще в 1851 г., принадлежит доктору Bardeleben из |
|
нуть выраженная системная гипоксия. |
Гессена (Германия) (26). Схожесть порока с анало# |
|
У детей, находящихся на искусственной венти# |
гичной патологией правых отделов сердца, вклю# |
|
ляции, повышение концентрации вдыхаемого |
чающей атрезию трехстворчатого и легочного кла# |
|
СО2 (20 мм рт. ст.) улучшает доставку кислорода |
панов, и разработка Glenn, Fontan и Kreutzer физи# |
|
(21), однако у пациентов, находящихся на спон# |
ологической коррекции стимулировали примене# |
|
танном дыхании, этот механизм еще не доказан. |
ние этого принципа для лечения СГЛОС. Однако |
|
Повышение парциального давления СО2 увеличи# |
трудности создания беспрепятственного тока кро# |
|
вает потребление кислорода и вызывает тахипноэ, |
ви в аорту, обеспечения адекватного легочного и |
|
что потенциально может нивелировать ожидае# |
коронарного кровотока сделали вмешательства |
|
мый положительный эффект. |
при СГЛОС гораздо более сложными. |
|
Питание |
Первая (и неудавшаяся) попытка лечения |
|
СГЛОС была предпринята Redo и соавторами в |
||
|
||
Учитывая повышенный риск ишемии кишеч# |
1961 г. В условиях окклюзии притока через пра# |

Глава 56. СИНДРОМ ГИПОПЛАЗИИ ЛЕВЫХ ОТДЕЛОВ СЕРДЦА
востороннюю торакотомию была выполнена ат# риосептостомия. При посмертном исследовании была обнаружена атрезия аортального клапана с широким ОАП (27). Важный шаг сделали Sinha и соавторы (28), которые проанализировали аутоп# сии 30 случаев СГЛОС и сформулировали прин# ципы первого этапа реконструкции. Авторы пред# положили, что первоочередной целью вмешатель# ства является создание межпредсердного сообще# ния для свободного оттока легочной венозной крови в правые отделы сердца, обеспечение пра# во#левого шунта на уровне магистральных арте# рий и суживание легочной артерии для ограниче# ния легочного кровотока. Cayler и соавторы (29) в Сакраменто (США) впервые успешно применили эти принципы в клинике. Операция заключалась в суживании обеих ветвей легочной артерии, созда# нии межпредсердного дефекта и обеспечение ан# теградного кровотока в аорте путем анастомозиро# вания правой легочной артерии с восходящей аор# той. В комментарии авторы предположили необ# ходимость аортопластики для создания адекватно# го канала между местом легочно#аортального анастомоза и устьями коронарных артерий при выраженной гипоплазии аорты и прогнозировали существенный прогресс в этой области.
Очередной вехой на пути к современному мето# ду лечения СГЛОС была операция, описанная Litwin, van Praagh и Bernard (30) в 1972 г. У пациен# тов с перерывом дуги аорты был имплантирован сосудистый протез между легочным стволом и нисходящей аортой, а дистальные легочные арте# рии были сужены. Эта операция впоследствии бы# ла повторена двумя группами хирургов, однако без положительного эффекта (31, 32).
Несмотря на ранние неудачные попытки пал# лиативной реконструкции, Doty и Knott (33) в 1977 г. возлагали надежды на одноэтапную опера# цию Fontan при СГЛОС. Они описали пять закон# чившихся неудачей операций. В условиях гипо# термической остановки кровообращения перевя# зывали ОАП, иссекали межпредсердную перего# родку и предсердие перегораживали заплатой из аутоперикарда таким образом, чтобы легочный ве# нозный возврат направить в трехстворчатый кла# пан и правый желудочек. Легочный ствол соеди# няли с дугой аорты с помощью дакронового сосу# дистого протеза, а легочные артерии анастомози# ровали с правым предсердием. Все больные умер# ли от правожелудочковой слабости и недостаточ# ности коронарного кровотока. Стало ясно, что создание кровообращения по Fontan в неонаталь# ном периоде не может быть успешным из#за повы# шенного сопротивления легочных сосудов и слож#
839
ности операции. Смелые надежды и упорство ав# торов были вознаграждены формированием представления о безальтернативности этапного лечения этого порока.
Развитие успешного этапного лечения СГЛОС связано с именем доктора Norwood. В своем пер# вом сообщении в 1980 г. Norwood (34) описывал три случая начального этапа реконструкции. У первого больного был выполнен кавопульмональ# ный анастомоз по Glenn, однако этот пациент умер через 7 дней из#за прогрессирующего ацидо# за. Двое последующих новорожденных подвергну# ты модифицированной операции Litwin c исполь# зованием клапанного кондуита между правым же# лудочком и нисходящей аортой и суживанием дистальных легочных артерий. Оба пациента вы# жили и были выписаны из госпиталя в удовлетво# рительном состоянии. В этой статье Norwood предложил конфигурацию второго этапа лечения, который, по его мнению, должен был состоять в разделении системного и легочного кругов крово# обращения с максимальным использованием собственных тканей. Физиологическая коррекция атрезии аорты на втором этапе должна была пре# дусматривать анастомозирование проксимальной легочной артерии и устья правой ветви легочной артерии с гипоплазированной восходящей аортой, чтобы создать связь правого желудочка с аортой исключительно с помощью собственных тканей. Одновременно предполагалось иссечь кондуит. Затем пересеченную правую легочную артерию следовало анастомозировать с верхней полой ве# ной по Glenn, а левую легочную артерию рекон# струировать с помощью клапанного кондуита. Это было первым указанием на необходимость рекон# струкции аорты собственными тканями. Вариант этой техники был описан Behrendt и Rocchini (35).
При множестве предложенных вариантов пер# вой стадии реконструкции только заключитель# ный этап лечения — операция Fontan — определя# ет отдаленный результат всей системы лечения. Первый успешный результат этапного лечения со# общили Norwood, Lange и Hanson (36) в 1983 г. В настоящее время описанному в этой работе паци# енту более 20 лет. У него диагностированы хрони# ческая энтеропатия с потерей белка и предсерд# ные нарушения ритма. Методы первого этапа ле# чения СГЛОС эволюционировали в направлении ограничения использования инородных материа# лов и сокращения продолжительности гипотерми# ческой остановки кровообращения (37,38).
Операция Norwood предусматривает:
•создание свободного и постоянного выхода в системный круг кровообращения;
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
840 |
Часть 10. ПОРОКИ ВЫВОДНОГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА |
|
|
|
|
•обеспечение стабильного и контролируемого источника легочного кровообращения;
•создание широкого сообщения на предсердном уровне.
Выход в системный круг создают с помощью
модифицированной операции Damus–Kaye– Stansel в сочетании с реконструкцией гипоплази# рованной восходящей аорты, дуги и перешейка аорты лоскутом из легочного гомографта. Ткань протока радикально резецируют для предупрежде# ния рекоарктации. Легочное кровообращение осуществляется через модифицированный анас# томоз Blalock–Taussig между основанием безы# мянной или подключичной артерии и правой ле# гочной артерией. Отверстие в бифуркации легоч# ной артерии рутинно закрывают заплатой или ушиванием в поперечном направлении для устра# нения вероятности развития сужения легочной артерии в отдаленном периоде.
Из#за отсутствия роста чужеродного материала, его деформации по мере увеличения массы тела и ограниченной доступности гомографтов Brawn и cоавторы (134) модифицировали коррекцию дуги аорты следующим образом: иссекали ткань прото# ка и анастомозировали нисходящую аорту с дугой аорты, которую открывали с переходом на восхо# дящую аорту. Затем в разрез аорты вшивали прок# симальный конец легочного ствола. Таким обра# зом, процедура Damus–Kaye–Stansel увеличила проходное сечение аорты. Размер системно#ле# гочного шунта оптимизировали в ходе накопления клинического опыта. Большинство хирургов отка# зались от 4#мм протеза в пользу 3,5–3,0#мм. Из клинического опыта и ошибок выяснилось, что главным принципом ведения этих пациентов яв# ляется поддержание сбалансированного кровото# ка в легочном и системном кругах кровообраще# ния. Слишком большой шунт и, следовательно, легочный кровоток сопровождается утечкой кро# ви из коронарных артерий и гипоксической дис# функцией миокарда, чреватой смертельным исхо# дом. Некоторые специалисты связывают неудачи не с высокой сатурацией артериальной крови как признака легочной гиперволемии, а с гипоксеми# ей, ответственной за малый сердечный выброс. Однако гемодинамика при меньшем системно#ле# гочном анастомозе лучше управляема, несмотря на выраженную гипоксию в ближайшем послео# перационном периоде. Некоторые хирурги, ис# пользовавшие больший шунт, пытались регулиро# вать легочный кровоток вентиляцией гипоксичес# кой газовой смесью. Недавно установлено, что снижение насыщения легочной венозной крови в раннем периоде после операции Norwood влияет
на степень гипоксемии. Показано также, что ана# эробный порог достигается, когда сатурация сис# темной венозной крови ниже 30%, и что попытки поднять насыщение крови кислородом в верхней полой вене выше этого порога приводят к сниже# нию летальности. Применение регулирующего турникета для управления объемом легочного кровотока было признано полезным. Оксигена# ция системной артериальной крови после опера# ции Norwood зависит от ряда физиологических и анатомических факторов, среди них — состояние легочного сосудистого русла и размер межпредсе# рдного сообщения (30, 31, 33).
Избыточный легочный кровоток при больших размерах шунта увеличивает объемную работу ле# вого желудочка в условиях малого сердечного выб# роса, сниженного диастолического давления в аорте и неадекватной коронарной перфузии. Это является причиной смерти. Некоторые хирурги предлагали использовать гомографт подкожной вены бедра в качестве шунта, так как он ограничи# вает объем кровотока без риска тромбоза.
Пациентам с тяжелым клапанным стенозом ле# гочной артерии, выраженной врожденной органи# ческой (не функциональной) недостаточностью трехстворчатого клапана и односторонней гипо# плазией легочной артерии не может быть предоло# жена этапная одножелудочковая коррекция.
Одновременно с процессом усовершенствова# ния операции Norwood в Бостоне, а затем и в Фила# дельфии, где он продолжил работу, многие другие центры также начали осуществлять паллитивные операции, но с неудовлетворительными результа# тами. Возникли сомнения в целесообразности это# го подхода. Вследствие плохих хирургических ре# зультатов некоторые врачи советовали оказывать только сострадательную помощь. В 1983 г. Norwood и его сотрудники сообщили в New England Journal of Мedicine об успешном этапном лечении детей с атрезией аорты, заключительным этапом которого была операция Fontan. Эта работа возродила инте# рес к спасению детей со СГЛОС. Среди других под# ходов к лечению в 1985 г. была предпринята попыт# ка трансплантации сердца бабуина новорожденно# му со СГЛОС, но ребенок не выжил. Тем не менее этот опыт открыл эру трансплантации сердца уде# тей со СГЛОС. Впервые пересадку донорского че# ловеческого сердца при данном пороке произвели Bailley и сотрудники в Лома Линда (Калифорния). С конца 1980#х годов в одних центрах предпочитали реконструкцию по Norwood, в дру# гих — неонатальную аллотрансплантацию сердца или то и другое. Некоторые авторы считали, что оба подхода противоречат медицинской этике.

Глава 56. СИНДРОМ ГИПОПЛАЗИИ ЛЕВЫХ ОТДЕЛОВ СЕРДЦА
Усовершенствование операции Norwood по времени совпало с повсеместным накоплением опыта операции Fontan при различных ВПС. Бы# ли выполнены многие исследования после первой стадии этапного лечения. Они пролили свет на состояние реконструированной восходящей арты, адекватность коррекции дистальной дуги и коарк# тации, на проблему остаточной или возникшей обструкции легочных артерий и достаточности размеров ДМПП. Был проявлен интерес к функ# ции правого желудочка и влиянию недостаточнос# ти трехстворчатого клапана на краткосрочные и среднесрочные исходы. Эти исследования способ# ствовали уточнению и модификации хирургичес# кой техники и постепенному улучшению хирурги# ческих результатов. Были применены различные приемы для улучшения хирургических результа# тов, включая фенестрацию внутрипредсердного туннеля при операции Fontan с последуюшим зак# рытием отверстия. Установлен факт улучшения суммарных результатов путем применения этап# ных вмешательств для достижения полной кор# рекции гемодинамики по Fontan, поэтому хирур# гическое лечение СГЛОС стало трехэтапным. Промежуточной операцией является двунаправ# ленное кавопульмональное соединение или hemi# Fontan с коррекцией сопутствующих анатомичес# ких аномалий, повышающих риск неблагоприят# ных результатов. Этапное лечение разгружает сис# темный правый желудочек, улучшает его форму, снижает тенденцию к развитию недостаточности трехстворчатого клапана и улучшает коронарный кровоток. Однако необходимость этапных вмеша# тельств разделяют не все.
ТЕХНИКА ПЕРВОГО ЭТАПА ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ПО NORWOOD
Классическую операцию Norwood выполняют через срединную стернотомию. Из#за выражен# ной дилатации правый желудочек крайне возбу# дим, поэтому манипуляции должны быть осто# рожными, чтобы не вызвать фибрилляции во вре# мя выделения структур сердца. Очень тонкую вос# ходящую аорту отделяют на всем протяжении от легочного ствола и его правой ветви. Затем моби# лизуют дугу, ее ветви и нисходящую аорту дис# тальнее боталлова протока, избегая прямого натя# жения рыхлой ткани протока, из которого легко может возникнуть кровотечение. Выделяют би# фуркацию легочной артерии и ее ветви обводят те# семками, предназначенными для прекращения легочного кровотока во время фазы охлаждения
841
искусственного кровообращения. Накладывают кисетные швы для канюляции на легочный ствол у бифуркации и ушко правого предсердия.
После гепаринизации канюлируют легочный ствол и правое предсердие, начинают искусствен# ное кровообращение при пережатых ветвях легоч# ной артерии (рис. 4, а, б), больного охлаждают до назофарингеальной температуры 18 0С. Во время охлаждения сосудистым зажимом отжимают осно# вание безымянной артерии и выполняют прокси# мальный анастомоз с сосудистым протезом из Gore#Tex диаметром 3,5–4 мм (рис. 4, в), снимают сосудистый зажим, чтобы убедиться в хорошей проходимости центрального анастомоза. Сосудис# тый протез пережимают скобкой на время выпол# нения дальнейших этапов операции и останавли# вают кровообращение при температуре 18 0С (рис. 4, г). Дальнейшую операцию можно проводить в условиях регионарной перфузии сосудов дуги со сниженной объемной скоростью 10 мл/кг/мин. Для этого артериальную канюлю удаляют и вводят ее в сосудистый протез (рис. 4, д).
Линию для проведения кардиоплегии подсое# диняют к боковому патрубку артериальной каню# ли. Сосуды дуги аорты обтягивают турникетами, а нисходящую аорту дистальнее артериального про# тока пережимают сосудистым зажимом (рис. 4, е). Вводят кардиоплегический раствор ретроградно в дугу аорты и общую коронарную артерию (восхо# дящую аорту). Затем обе канюли и тесемки на вет# вях легочной артерии удаляют.
Основной этап операции начинают с перевязки и пересечения артериального протока у аорталь# ного конца (рис. 5, а). Через отверстие для веноз# ной канюли иссекают межпредсердную перего# родку для создания широкого межпредсердного сообщения (рис. 5, б). Затем поперечно пересека# ют легочный ствол на уровне правой легочной ар# терии, оставляя с левой стороны несколько боль# ший участок стенки легочного ствола (рис. 5, в). Если легочные артерии широкие, бифуркацию закрывают прямым ушиванием, при узких ветвях используют заплату из лоскута гомографта (рис. 5, г). После реконструкции бифуркации тщательно выполняют дистальный анастомоз сосудистого протеза с разрезом устья правой легочной артерии, стараясь не вызвать ее деформации (рис. 5, д). Для облегчения экспозиции восходящую аорту оттяги# вают медиально. Далее продольно рассекают ле# вую стенку восходящей аорты, начиная разрез на уровне пересечения проксимальной легочной ар# терии. Разрез продлевают на дугу, перешеек и нис# ходящую аорту дистальнее места отхождения про# тока (рис. 5, е).
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
