
3 курс / Патологическая физиология / Атеросклероз_сосудов_сердца_и_головного_мозга
.pdf20 |
Глава 1. ФУНКЦИОНАЛЬНАЯ АНАТОМИЯ КОРОНАРНОГО И МОЗГОВОГО КРОВООБРАЩЕНИЯ |
Âмагистральных артериях мозга, в местах отхождения радиальных артерий и капилляров находятся сфинктеры, сокращение которых может значительно снизить кровоток в дистальных сосудах. Это имеет существенное значение для регуляции кровоснабжения мозга.
Âобеспечении компенсаторных процессов в сосудистой системе головного мозга чрезвычайно велико зна- чение анастомозов и коллатерального кровообращения. Достаточно сказать, что последствия закупорки мозговых артерий зависят прежде всего от возможностей коллатерального кровоснабжения [24].
Богатая сеть анастомозов между артериями, осуществляющими кровоснабжение мозга, открывает широкие возможности для перераспределения крови между различными областями его сосудистой системы (рис. 6). Потребность в этом возникает как в нормальных, так и
âпатологических условиях.
Âнорме анастомозы сосудистой системы мозга не функционируют непрерывно. Они используются в основном для обеспечения перетока крови в тот бассейн мозга, кровоснабжение которого стало недостаточным
âñèëó каких-либо временных ограничений кровотока в приводящем сосуде.
Âусловиях патологии преимущество анастомозов типа Виллизиева круга заключается в том, что при их включении не требуется большой затраты времени на формирование путей коллатерального кровообращения (рис. 7). Разумеется, своевременное включение кровотока является важнейшей предпосылкой осуществления эффективного коллатерального кровообращения в мозге, ибо запас времени здесь ограничен весьма коротким промежутком из-за высокой чувствительности нервных клеток к гипоксии.
Âсоответствии с особенностями строения системы головного мозга различают 4 анатомических уровня коллатерального кровоснабжения: один внечерепной и три внутричерепных [24, 26].
Внечерепной уровень мозгового коллатерального кровообращения представляет собой группу анастомозов между системами сонных и подключично-позвоночных артерий.
Внутричерепные уровни мозгового коллатерального кровообращения представлены тремя группами анастомозов: Виллизиев круг, анастомозы между артериями на поверхности мозга и внутримозговая сосудистокапиллярная сеть (рис. 8).
Кроме того, имеется ряд других анастомозов, из которых наибольшее значение при закрытии ВСА придается прямому интра-экстракраниальному анастомозу одной из ее ветвей – глазничной артерии – с ветвями наружной сонной артерии в области угла глаза, лба и спинки носа. Обнаружены анастомозы ветвей глазнич- ной, а также средней мозговой артерии с артериями твердой мозговой оболочки.
Исключительно важное значение для обеспечения полноценного коллатерального кровообращения в мозге имеет нормальное состояние механизмов саморегуляции мозгового кровообращения (раздел 3.2). Однако у больных с сосудистыми заболеваниями мозга эти механизмы нередко функционируют в неустойчивом режиме. В связи с этим усиливается зависимость мозгового кровотока от состояния системной гемодинамики и других экстрацеребральных факторов.
Возрастные особенности магистральных артерий головы заключаются в волнообразном изменении гистологического строения стенки сосудов и их размеров на протяжении всей жизни человека [11].
Âпервые четыре десятилетия происходит утолщение внутренней оболочки сонной артерии, главным образом, за счет увеличения содержания волокнистых структур. При этом артерии удлиняются, просвет их увеличивается, что отражает рост сосудов. После 40 лет внутренняя и средняя оболочки продолжают утолщаться, но уже за счет распада и фрагментации эластических волокон, накопления мукополисахаридов*.
К 60 годам из-за распада волокон внутренней эластической мем-браны гиперпластический слой проксимального и дистального отделов общей сонной артерии теряет свое структурное строение. Параллельно процессы распада и фрагментации волокон протекают и в средней оболочке артерий. На месте распадающихся эласти- ческих и мышечных волокон во внутренней и средней оболочках общих сонных артерий развивается коллагеновая ткань, которая к 70–80 годам жизни человека занимает большую часть стенки сосуда. При этом оболоч- ки артерии истончаются.
Âсвязи с возрастными изменениями системной гемодинамики одновременно происходит приспособление артериального русла к условиям кровообращения, артерии удлиняются, их просвет расширяется [11, 27]. Эти изменения отмечаются не только в магистральных артериях головы, но и в других сосудистых регионах организма человека.

21
ГЛАВА 2
ФИЗИОЛОГИЯ СЕРДЕЧНО СОСУДИСТОЙ СИСТЕМЫ. ПРИНЦИПЫ РЕГУЛЯЦИИ
СИСТЕМНОЙ И РЕГИОНАРНОЙ ГЕМОДИНАМИКИ
Сердечно-сосудистая система является одной из наиболее совершенных систем человеческого организма. Совершенство ее структур и функции определяется ролью, которую она играет в жизни человека,-снабжение всех органов и тканей питательными веществами и кислородом. Сердце – единственный орган, обеспечивающий движение крови к другим многочисленным органам по сосудистой системе для обеспечения тканевого обмена.
В наши дни перечисленные выше положения воспринимаются как аксиома, но для их становления и утверждения понадобился весьма тернистый путь. Впрочем, в истории человечества представление о жизни, вероятно, всегда связывалось с движением крови. Так, еще Ибн Сина (Авиценна) писал:
«В сосудах жидкость бег свой совершает, ее избыток вены расширяет.
Когда ослабевает кровоток, похожи вены на пустой мешок».
Гиппократ в отношении кровеносных сосудов говорил, что «это суть источники человеческой природы, и здесь реки телесные, которые орошают целое; они же приносят жизнь человеку, и когда они высохнут, человек умирает» (цит. по [1]).
Сосудистое русло рассматривалось древними мыслителями как состоящее из двух самостоятельных отделов: артериального, наполненного воздухом, и венозного, или истинно кровеносного. Считалось, что воздух из легких проходит в сердце, а из него по артериям разносится по всему организму. Кровь образуется в печени и поступает в сердце, откуда по венам направляется в различные органы. Поскольку артерии у трупов всегда находили пустыми, считалось, что именно по ним и распространяется воздух в организме.
Это мнение впервые было опровергнуто Галеном (II в. н.э.), который в опытах на животных показал, что в артериях содержится кровь: она истекает из артерии после ее рассечения между двумя лигатурами. Как сам Гален, так и его последователи не могли объяснить, ка-
ким образом кровь переходит в вены, но сложное представление о движении крови, сформулированное им, просуществовало 14 веков.
По Галену, возникновение крови начинается в же- лудочно-кишечном тракте. В печени происходит превращение питательного сока в кровь, которая далее разносится венами ко всем частям тела и потребляется ими как пища. Венозной системе противопоставлялась независимая от нее артериальная, начало которой, как считал Гален, находится в легких, где воздух превращается в пневму (spiritus vitalis). Этот жизненный дух течет в левое сердце и здесь смешивается с венозной питательной кровью, проникшей из правой половины сердца через отверстие в перегородке между желудочками. Далее кровь разносится по всем частям тела и потребляется ими.
Массивное построение Галена лишь в XVI в. начало медленно уступать натиску новых представлений. Андрей Везалий в 1543 г. высказал большие сомнения в существовании отверстий в межжелудочковой перегородке. Спустя 10 лет М. Сервет обнаружил, что кровь из правого желудочка переходит в левый через легкие, то есть открыл малый круг кровообращения. Это открытие было обнародовано лишь в 1694 г., спустя 150 лет после сожжения М. Сервета на костре как еретика, та же участь постигла и его труд.
Термин «circulatio» по отношению к крови впервые употребил в литературе Цезальпин (XVI в.), который также показал в эксперименте, что вена постепенно набухает дистальнее от места наложения на нее лигатуры. Весьма существенным аргументом против мнения о движении крови в венах от сердца к тканям могло бы послужить открытие Дж. Фабрицием в 1574 г. венозных клапанов, но он считал, что их роль заключается в замедлении тока крови, «дабы ткани успевали получать от нее пищу» (цит. по [1]).
Это краткое путешествие в далекое прошлое необходимо для того, чтобы показать, на штурм какой вершины отважился Уильям Гарвей, опубликовав в 1628 году книгу «Аналитическое исследование о движении
22 |
Глава 2. ФИЗИОЛОГИЯ СЕРДЕЧНО СОСУДИСТОЙ СИСТЕМЫ. ПРИНЦИПЫ РЕГУЛЯЦИИ... |
сердца и крови у животных» [2], которая дала основание считать этот год временем открытия кровообращения.
Âсвоей книге У. Гарвей обосновал и доказал, что «…кровь проходит через легкие и сердце благодаря сокращению желудочков, из которых она посылается во все тело, проникает в вены и «поры ткани» и по венам, сначала по тонким, а потом по более крупным, возвращается от периферии к центру и, наконец, через полую вену приходит в правое предсердие. Таким образом, кровь течет по артериям из центра на периферию, а по венам от периферии к центру… Следовательно, необходимо заключить, что у животных кровь находится в круговом и постоянном движении» [2].
Как и каждый гениальный ученый, Гарвей намного опередил свою эпоху. Медицинская практика того времени не была готова к использованию его схемы кровообращения и Гарвей умер в 1657 г. так и не дождавшись признания. Но истина победила: уже в 1661 г. Марчелло Мальпиги описал обнаруженные им кровеносные капилляры в легких лягушки. В результате место туманных «пор» в учении Гарвея прочно заняли реально существующие кровеносные капилляры. В связи с этим надо отдать должное в предвидении Гарвея: не имея возможности увидеть капилляры, он догадался о существовании этого промежуточного участка в кровеносной системе.
И до сих пор, начиная со времени открытия Гарвеем циркуляции крови в организме, во всех учебниках физиологии, анатомических атласах и специальных руководствах приводится анатомическая схема путей кровотока в сердечно-сосудистой системе. При этом в схеме, разделенной поровну на артериальную и венозную части, зачастую окрашенные соответственно в красный и голубой цвета, стрелками указываются пути выхода крови из сердца, ее круговорот в большом и малом кругах кровообращения и возврат в предсердия. На концах схемы обычно отмечается в виде разветвлений существование капиллярной сети в органах и тканях.
Вместе с тем, имеющиеся в настоящее время коли- чественные данные об основных характеристиках функционирования сердечно-сосудистой системы не укладываются в рамки этой широко известной диаграммы. Имеются все основания учесть в ней количественную характеристику составляющих ее отделов, то есть определить их структурно-функциональную роль. Попытка создания такой схемы представлена на рисунке 9.
На этой схеме в прежних размерах изображена артериальная часть системы; при этом подчеркнуто (цифры внизу), что она содержит всего 15–20% общего объема крови и характеризуется высоким давлением (название области указано в верхней части рисунка).
Âцентр схемы вынесена область капиллярных (обменных) сосудов, на обеспечение оптимальной функции которых и направлена деятельность сердечно-сосудис- той системы. Надо заметить, что в условиях относительного покоя организма в капиллярах содержится сравни-
Рис. 9. Функциональная схема сердечно сосудистой си стемы [1]. Цифры у названия органов – величина крово тока в покое, в процентах к минутному объему кровообра щения; цифры внизу рисунка – объем содержащейся кро ви (в процентах к общему объему) в трех функционально различных областях сосудистого русла; в верхней части рисунка – название этих областей. Стрелками указано на правление кровотока
тельно небольшой объем крови (цифры в нижней части рисунка).
В соответствии с выделенными сосудистыми областями сосудистой системы функциональное назначе- ние различных отделов аппарата кровообращения классифицировано следующим образом (рис. 10):
1.Генератор давления и расхода – сердце, с определенной частотой и ритмом нагнетающее кровь в аорту и легочную артерию.
23
А |
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
120 |
3а |
|
|
100 |
100 мм рт.ст. |
|
|
80 |
|
Б |
|
60 |
|
40 |
25 мм рт.ст. |
|
|
20 |
|
0 |
|
Рис. 10. Схема, отражающая взаимоотношения различ ных функциональных отделов большого круга кровообра щения (А) и распределения давления в них (Б) [3]. 1 – сердце (насос, нагнетающий кровь); буферные (демпфи рующие) сосуды – аорта и крупные артерии; 3 – прека пиллярные резистивные сосуды (артерии) и среди них сфинктерные сосуды (3а), обусловливающие распределе ние кровотока; 4 – обменные сосуды (капилляры); 5 – посткапиллярные резистивные сосуды (венулы); 6 – ем костные сосуды (вены, обеспечивающие возврат крови к сердцу)
2.Сосуды высокого давления – аорта и крупные артериальные сосуды, в которых поддерживается высокий уровень давления.
3.Сосуды – стабилизаторы давления – мелкие артерии и артериолы (среди них сфинктерные сосуды), которые путем сопротивления кровотоку и во взаимоотношении с сердечным выбросом поддерживают оптимальный для системы уровень кровяного давления. Функция их в основном резистивная*.
4.Распределители капиллярного кровотока – терминальные (концевые) сосуды, гладкомышечные образования которых при сокращении прекращают кровоток в капилляре или при расслаблении возобновляют его, обеспечивая необходимое в данной ситуации число функционирующих капилляров; эти сосуды также обладают в основном резистивной функцией.
5.Обменные сосуды – капилляры и частично посткапиллярные участки венул, функция которых состоит в обеспечении обмена между кровью и тканями.
6.Аккумулирующие сосуды – венулы и мелкие вены, активные или пассивные изменения просвета которых ведут к накоплению крови (с возможностью ее последующего использования) или к экстренному
выбросу ее в циркуляцию. Функция этих сосудов в основном емкостная, но они обладают и резистивной функцией, хотя и намного меньшей, чем стабилизаторы давления.
7.Сосуды возврата крови – крупные венозные коллекторы и полые вены, через которые обеспечивается подача крови к сердцу.
8.Шунтирующие сосуды – различного типа анастомозы, соединяющие между собой артериолы и венулы, артерии и вены и обеспечивающие нутритивный* кровоток.
9.Резорбтивные сосуды – лимфатический отдел системы кровообращения, в котором главная функция лимфатических капилляров состоит в резорбции* из тканей белка и избытка жидкости, а лимфатических сосудов – в транспортировке резорбированного материала в кровь [1, 3].
Несмотря на то, что интерес клиницистов к эластическим свойствам артерий существует еще с 19-го столетия, только сравнительно недавно внимание было обращено на эластическую природу аорты.
Как было установлено, аорта обладает двойной физиологической функцией:
1)доставлять кровь, изгоняемую левым желудочком, – проводящая функция;
2)превращать систолические колебания, возникающие в результате прерывистого выброса крови желудоч- ком в непрерывный периферический кровоток – смяг- чающая (демпфирующая) функция.
Последнее достигается за счет эластических свойств сосуда: во время систолы сердца большая часть кинети- ческой энергии, производимой во время выброса ударного объема крови, сохраняется в виде потенциальной энергии внутри аортальной стенки. Эта потенциальная энергия затем преобразуется аортой во время диастолы в кинетическую энергию, помогающую крови достигать периферии.
Эластические свойства аорты оказывают свое влияние на многих уровнях сердечно-сосудистой системы. Эластичная аорта уменьшает постнагрузку* левого желудочка и улучшает левожелудочковую релаксацию, таким образом облегчая работу сердца. Более того, повышенные эластические свойства аорты улучшают коронарную перфузию* во время диастолы [4].
В системе высокого давления (артериальной) коли- чество гладкомышечных элементов сосудистой стенки постепенно нарастает по направлению к дистальным отделам и параллельно с уменьшением калибра сосуда. Последние мышечные элементы представлены на уровне прекапиллярных сфинктеров. Именно наличие мышечных волокон в сосудах определяет их реактивность, т.е. способность сосудов отвечать на различные воздействия путем изменения своего просвета.
Необходимость и целесообразность доставки крови к органам и тканям быстро и по кратчайшим путям от-
24 |
Глава 2. ФИЗИОЛОГИЯ СЕРДЕЧНО СОСУДИСТОЙ СИСТЕМЫ. ПРИНЦИПЫ РЕГУЛЯЦИИ... |
разились на строении транспортирующей артериальной системы, которая проще организована, чем венозная. Пути оттока крови от органов и тканей и доставка ее к сердцу устроены намного сложнее, число венозных сосудов на единицу площади большинства органов значи- тельно превышает количество артериальных ветвей.
Для поддержания нормального функционирования организма необходимо, чтобы кровь и скорость ее движения соответствовали уровню обменных процессов и адекватно обеспечивали их. Такой объективной мерой количества крови, протекающей по всей сосудистой системе в целом в единицу времени, является минутный объем кровообращения (МОК) или сердечный выброс, т.е. количество крови, которое поступает в аорту из левого желудочка за 1 минуту. Оно равняется произведению ударного объема (УО) левого желудочка на число сердечных сокращений (ЧСС) в минуту. Считается, что отнесение объемных показателей (УО, МОК) к поверхности тела с учетом роста и веса обследуемого (приложение 3) лучше отражает соотношение между сердеч- ным выбросом и размерами тела [3]. Полученные таким путем ударный (УИ) и сердечный (СИ) индексы широко используются при исследовании сердечно-сосудистой системы в условиях клиники.
Исследования показателей системного кровообращения в покое методом тетраполярной грудной реографии, проведенные И.К. Шхвацабая с соавт. [5], убедительно доказали гемодинамическую неоднородность здорового населения и возможность выделения трех вариантов нормального кровообращения в зависимости от диапазона колебаний уровня СИ в группах мужчин и женщин:
–гиперкинетический тип кровообращения:
СИ у мужчин 5,67–4,32 л/мин/м2, у женщин – 6,06–4,70 л/мин/м2;
–эукинетический тип кровообращения:
CИ у мужчин 4,31–2,96 л/мин/м2, у женщин – 4,69–3,33 л/мин/м2;
–гипокинетический тип кровообращения:
СИ у мужчин 2,95–1,59 л/мин/м2, у женщин – 3,32–1,95 л/мин/м2.
Очень важно, что выделение этих типов кровообращения проводилось среди здорового населения, являющегося качественно однородным. Гемодинамически эта однородность подтвердилась тем, что величины ЧСС, среднего динамического давления (СДД) и периода изгнания левого желудочка между всеми типами не разли- чались. Тождественность типов кровообращения в отношении здоровья проявлялась и в том, что все они оказались равноэкономичными, обеспечивая гемодинами- ческое функционирование при одинаковом расходе энергии.
Наряду с этим, механизмы, посредством которых обеспечивалась тензионная и энергетическая однородность, при всех типах оказались различными. При гиперкинетическом типе ведущим механизмом поддержа-
ния оптимального СДД является СИ на фоне достоверно более высоких значений УИ, в то время как удельное периферическое сосудистое сопротивление (УПСС) оказывается самым низким. При эукинетическом типе СИ уменьшается на фоне снижения УИ, а УПСС, наоборот, возрастает. При гипокинетическом типе преобладающее значение для поддержания необходимого СДД имеет артериолярный тонус, соответственно, УПСС оказывается наибольшим, а величины СИ и УИ – наименьшими (приложение 4).
Измерения регионарного кровотока в покое показали, что головной мозг получает 750 мл/мин крови, пе- чень – 1300 мл/мин, почки – 1200 мл/мин, мышцы – 1000 мл/мин, а само сердце – 250 мл/мин. Все это составляет 4,5 л/мин, не считая снабжения кровью кожи, жировой клетчатки и костей [3]. Сопоставление кровотока и потребления кислорода в различных органах (приложение 5) показывает, что чем интенсивнее обмен веществ в том или ином органе, тем выше расход крови в его сосудах, хотя, если исходить из значений этих параметров, выраженных в процентах, прямой зависимости нет [6].
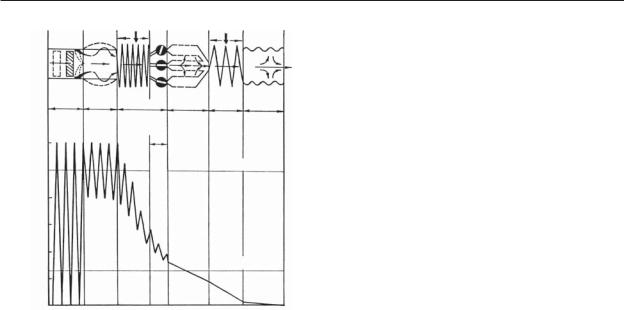
Сердце человека средней массы (около 70 кг) в состоянии покоя перегоняет приблизительно 5,0–5,5 литров крови в минуту, и, если объем крови составляет только 5-6 литров, то, следовательно, полный кругооборот всего объема крови происходит за 1 минуту. Во время интенсивной физической нагрузки у здорового человека МОК может увеличиться до 25 л/мин, а у спортсмена
– до 35–40 л/мин. Регионарный кровоток во время работы также подвергается значительным изменениям (рис. 11). При этом ясно, что сердце не может обеспечивать все ткани одновременно максимальным количеством крови, и в норме это никогда не имеет места. На рисунке показано, что физическая работа, которая создает наибольшую нагрузку на сердце, сопровождается перераспределением крови и ограничением кровотока в участках, лежащих за пределами мышц.
Как мы указывали, объем крови у человека составляет примерно 5,5 л (70–80 мл/кг). Считается, что 75– 80% крови в условиях нормальной жизнедеятельности организма находится в венозном русле. Вены представляют собой не только большой, но и мобильный, хорошо регулируемый резервуар крови, обеспечивающий изменения сердечного выброса. Сердечный выброс строго зависит от величины венозного возврата крови к сердцу. Дисбаланс между этими параметрами (за счет изменения внутрилегочного и внутрисердечного объемов крови) возможен в экстренных ситуациях лишь в тече- ние короткого промежутка времени, поэтому так важна тонкая регуляция венозного возврата крови [7, 8].
Важным аспектом кровоснабжения органов является то, что резистивная функция вен, не оказывая существенного влияния на общее или регионарное сосудистое сопротивление, способна оказывать решающее влияние на регуляцию внутрисосудистого объема крови за счет изменения посткапиллярного сопротивления, ка-

Основные принципы нервной регуляции кровообращения |
25 |
Рис. 11. Схема распределения кровотока в различных па раллельно соединенных отделах сосудистой системы че ловека в покое (цифры слева) и во время тяжелой физи ческой работы (цифры справа) [3]. Стрелками указано на правление кровотока; МОК – минутный объем кровообра щения
пиллярного гидростатического давления и связанного с ним процесса фильтрации – абсорбции* жидкости [3, 9].
Число капилляров в организме человека массой 70 кг составляет около 40 миллиардов, а суммарная площадь их поверхности – 1000 м2. В состоянии покоя функционирует лишь часть капилляров (25–35%), поэтому площадь функционирующей поверхности открытых капилляров составляет 250–350 м2. Поскольку объемный кровоток через капилляры тот же, что и через аорту, а площадь поперечного сечения капилляров в 700 раз больше, чем аорты, то соответственно линейная скорость кровотока, равная примерно 21 см/с в аорте, снижается в капиллярах до 0,3 см/с. Хотя объем крови в капиллярном русле небольшой (около 5% общего объема крови), низкая скорость кровотока в них обеспе- чивает оптимальный уровень обмена кислорода.
Плотность капилляров существенно различается в разных тканях, она выше в органах с высокой метаболи- ческой активностью. С увеличением функциональной активности возрастает и число функционирующих капилляров. Следствием этого является увеличение суммарной
площади функционирующей обменной поверхности и уменьшение межкапиллярного диффузионного расстояния, что вместе обеспечивает увеличение интенсивности транскапиллярного обмена [3, 7, 9].
Распределение МОК между различными сосудистыми отделами осуществляется соответственно регионарным метаболическим потребностям и определенным, выработанным в филогенезе* и онтогенезе* приоритетам. У человека кровоток поддерживается на достаточ- но высоком уровне и с большим постоянством прежде всего в сосудистых системах мозга и сердца.
Регуляция кровообращения тесно связана с регуляцией других физиологических систем. Большинство рефлекторных реакций системы кровообращения представляет собой лишь часть приспособительных реакций организма. Однако полагают, что существует и упорядоченная функциональная регуляция кровообращения, поскольку специфические и приспособительные реакции сердечно-сосудистой системы развиваются в соответствии с физиологическими потребностями организма [7, 10].
В развитии традиционных физиологических представлений о значении регуляции кровообращения фундаментальную роль сыграло введение понятия гомеостаз*. Соответственно этому, классический признак наличия регуляции (управления) усматривается в том слу- чае, когда обнаруживается стабильность одного из физиологических показателей при изменении связанных с ним других параметров.
Это положение иллюстрирует не только общеизвестное постоянство артериального давления, поддерживаемое вопреки разным возмущающим влияниям, но и выявившаяся стабильность соотношений объемов внеклеточной жидкости, плазмы крови, артериального и венозного объемов крови как признак гомеостатического управления в микроциркуляции [9] или существующее постоянство индивидуальных величин вязкости крови при изменчивости показателя гематокрита* и вязкости плазмы как признак управления специально вязкостью крови [11].
На основе доказанных экспериментальных фактов о стабильности некоторого физиологического показателя обычно и ведется дальнейший поиск механизмов регуляции, которыми обеспечивается данная стабилизация, рассматриваемая как цель управления [12].
Основные принципы нервной регуляции кровообращения
На протяжении последнего столетия основную роль в регуляции функции сердечно-сосудистой системы большинство исследователей отводили почти исключи- тельно образованиям, локализующимся в продолговатом мозге. Комплекс бульбарных* нейронов, оказывающих выраженное влияние на сосудистую систему, ранее обычно называли «вазомоторным центром». Однако на-
26 |
Глава 2. ФИЗИОЛОГИЯ СЕРДЕЧНО СОСУДИСТОЙ СИСТЕМЫ. ПРИНЦИПЫ РЕГУЛЯЦИИ... |
коплено достаточно данных в пользу регуляции им также деятельности сердца, а бульбарные симпатические* структуры и расположенные в продолговатом мозге ядра блуждающего нерва, оказывающие тормозящее влияние на сердце через холинергические* вагусные нейроны, так тесно взаимосвязаны, что справедливее называть этот комплекс нейронов продолговатого мозга «сердеч- но-сосудистым центром» [3] или «гемодинамическим центром» [13].
Бульбарный сердечно-сосудистый центр, даже буду- чи отключенным от высших отделов центральной нервной системы, способен, благодаря связям с интерорецепторами* сердца и сосудов, в известных пределах регулировать сердечный выброс, артериальное давление и регионарный кровоток, обеспечивая тем самым некоторый диапазон приспособительных реакций кровообращения. Эти и другие наблюдения послужили основой представлений о ключевой роли продолговатого мозга в центральной нервной регуляции тонуса сосудов, сердеч- ной деятельности и кровообращения в целом [14].
Ясно, что данные, полученные преимущественно на наркотизированных животных, могли существенно искажать представления о физиологических механизмах кардиоваскулярной регуляции. Поскольку большая часть используемых в эксперименте видов наркоза тормозит структуры коркового и диэнцефального уровней сильнее, чем образования продолговатого мозга, предполагают [10], что это служило одной из причин представления о доминирующей роли бульбарного отдела центральной нервной системы в регуляции гемодинамики.
В 1965 г. C. Peiss выдвинул предположение, согласно которому интегративный* механизм регуляции кровообращения состоит из четырех звеньев:
1)сенсорной* системы ввода информации;
2)центральной связующей системы;
3)эфферентных* проекций от центральной связующей системы к спинному мозгу;
4)общего конечного пути, включающего преганглионарные симпатические нейроны спинного мозга, который осуществляет конечную интеграцию центрального управления.
Наряду с продолговатым мозгом, в центральную связующую систему включены кора, лимбическая* система, промежуточный мозг и средний мозг [15].
Вегетативная (автономная) нервная система, иннервирующая гладкую мускулатуру всех органов, сердце и железы, отвечает за нервную регуляцию внутренней среды организма. Как указывает само название, влияние этой системы обычно не находится под непосредственным контролем со стороны сознания. В этом состоит отличие вегетативной нервной системы от соматической, которая ответственна за афферентные* и эфферентные связи организма с окружающей средой и в большинстве случаев управляется сознанием [16].
Вегетативная и соматическая нервные системы действуют «рука об руку». Их нервные центры, особенно на
уровне ствола и полушарий головного мозга, невозможно разделить морфологически. В то же время перифери- ческие отделы этих двух систем совершенно различны.
Периферическая часть вегетативной нервной системы подразделяется на три отдела – симпатический, парасимпатический* и энтеральный (или метасимпатический). Конечные симпатические и парасимпатические нейроны вынесены за пределы центральной нервной системы; их клеточные тела лежат в вегетативных ганглиях*. Эти нейроны называются постганглионарными, так как их аксоны* выходят из ганглиев и идут к исполнительным органам (эффекторам). Нервные клетки, аксоны которых направляются к вегетативным ганглиям и переключаются на телах и дендритах* постганглионарных нейронов, называются преганглионарными нейронами. Тела преганглионарных нейронов лежат в спинном мозге и стволовом отделе головного мозга. Таким образом, элементарным периферическим звеном как симпатической, так и парасимпатической нервной системы служит цепь из двух последовательно соединенных нейронных популяций.
Многие внутренние органы получают как симпати- ческую, так и парасимпатическую иннервацию. Влияние этих двух отделов часто носят антагонистический характер. Так, раздражение симпатических нервов приводит, в частности, к увеличению ЧСС; стимуляция же парасимпатических волокон оказывает противоположный эффект. В физиологических условиях деятельность органов зависит от преобладания тех или иных влияний.
Возбуждение от преганглионарных нейронов к постганглионарным и от постганглионарных нейронов к эффекторным органам передается при помощи химических медиаторов*.
Ацетилхолин*, по-видимому, высвобождается в окон- чаниях всех преганглионарных вегетативных волокон и большинства постганглионарных парасимпатических нейронов. Некоторые симпатические постганглионарные клетки (нейроны потовых желез) и, возможно, нейроны, вызывающие расширение резистивных сосудов скелетных мышц, также являются холинергическими [16].
Действие ацетилхолина на постсинаптическую мембрану постганглионарных нейронов может быть воспроизведено никотином, а влияние ацетилхолина на эффекторные органы – мускарином. В связи с этим возникла гипотеза о наличии двух типов рецепторов* ацетилхолина, и влияния на них этого медиатора были названы никотиноподобным и мускариноподобным. Никотиноподобное действие ацетилхолина на постганглионарные нейроны может блокироваться четвертичными соединениями аммония (ганглиоблокаторами); мускариноподобный эффект ацетилхолина избирательно блокируется атропином.
Поскольку окончания симпатическх постганглионарных нейронов выделяют в качестве медиаторов норадреналин, эти нейроны называются адренергическими.
Аналогичным медиаторным действием обладает àäðå-
Основные принципы нервной регуляции кровообращения |
27 |
налин, высвобождающийся в кровоток из мозгового слоя надпочечников. Синтетическим катехоламином, не образующимся в организме, является изопротеренол.
Химические соединения, воспроизводящие действие симпатических адренергических нейронов, называются симпатомиметическими веществами, а блокирующие это действие – симпатолитическими веществами.
Реакции различных органов на норадреналин и адреналин (так же как на ацетилхолин и другие медиаторы) опосредованы взаимодействием катехоламинов с особыми структурами в составе клеточных мембран – клеточными рецепторами.
Обратим особое внимание на то, что необходимо строго различать клеточные рецепторы, специализированные на восприятии действия определенных химических раздражителей, и рецепторы в виде концевых образований афферентных нервных волокон, раздражение которых является источником рефлекторных эффектов (механорецепторы, барорецепторы и пр.).
Под клеточными рецепторами понимают некие молекулы, молекулярные комплексы или атомные группировки в молекулярной структуре, обладающие избирательным сродством к определенным химическим агентам и к тем блокаторам, которые действие данных агентов столь же избирательно выключают. Наиболее детально разработана теория действия холинорецепторов и адренорецепторов, реальное существование которых подтверждается убедительными данными исследований, проведенных еще в 60–70-х годах [17, 18]. В отношении реагирования кровеносных сосудов наибольшее значе- ние имеют факты, относящиеся к адренорецепторам, обеспечивающим сосудистые реакции на местно освобождаемые и приносимые кровью катехоламины.
Давно установлено, что адреналин в малых концентрациях может вызвать в мускулатуре не сужение, а расширение сосудов, но после введения препаратов спорыньи его констрикторное влияние полностью исчезает. Когда затем был синтезирован или выделен ряд других катехоламинов, выяснилось, что фенилэфрин обладает только констрикторным действием, норадреналин проявляет слабые признаки сосудорасширяющего действия, адреналин обладает им в большей степени, а изопротеренол вызывает только расширение сосудов. Были получены вещества, специфически блокирующие либо только сосудосуживающие эффекты катехоламинов (например, фентоламин), либо только их сосудорасширяющие влияния (например, пропранолол). После введения фентоламина норадреналин и адреналин вызывают в ряде сосудистых областей только вазодилатацию, а фенилэфрин не действует вовсе. После введения пропранолола исчезают все признаки дилататорных влияний адреналина и норадреналина, а их сосудосуживающее действие усиливается, тогда как «чисто дилататорный» изопротеренол не проявляет никакой активности [19].
Приведенные в очень схематизированном виде факты позволили считать, что среди адренорецепторов надо
различать α -адренорецепторы и β -адренорецепторы. В той мере, в какой катехоламин обладает сродством к α - адренорецепторам, он оказывает констрикторное действие на сосуды, в гладких мышцах которых эти рецепторы содержатся. То же самое относится к возодилатации при действии катехоламинов на β -адренорецепто- ры. Так, фенилэфрин не способен реагировать с β -адре- норецепторами и поэтому вызывает лишь сужение сосудов. Изопротеренол имеет сродство только к β -адре- норецепторам и соответственно вызывает только вазодилатацию. Адреналин и норадреналин могут реагировать как с α -, òàê è ñ β -адренорецепторами, но сродство первого с β -адреноблокаторами больше, тогда как норадреналин реагирует с β -адренорецепторами сильнее, чем адреналин.
Представление об α - è β -адренорецепторах даже в той конспективной форме, в какой оно представлено выше, позволяет интерпретировать особенности действия, катехоламинов в разных отделах сосудистой системы.
Âгладкой мускулатуре артерий скелетных мышц содержатся оба типа рецепторов. Возбуждение α -адрено- рецепторов вызывает сужение сосудов, а возбуждение
β-адренорецепторов приводит к их расширению. При
высоком уровне адреналина в крови мышечные сосуды суживаются в результате преобладания α -адренергичес- кого действия. После выключения α -адренорецепторов специфическим блокатором наблюдается расширение мышечных сосудов и снижение периферического сопро-
тивления в ответ на введение адреналина, поскольку в этом случае возбуждаются только β -адренорецепторы. После блокирования этих рецепторов β -адреноблокато- рами адреналин практически не оказывает влияния на мышечные сосуды. Полагают [16], что в физиологических условиях при нормальном, достаточно низком, уровне адреналина в крови он оказывает расширяющее дей-
ствие на мышечные артерии, поскольку преобладает эффект β -адренорецепторов (рис. 12).
Âбольшинстве органов, реагирующих на катехоламины, клеточные мембраны содержат как α -, òàê è β -адре- норецепторы, и эффекты возбуждения рецепторов этих двух типов, как правило, бывают противоположными (антагонистическими). В физиологических условиях реакция какого-либо органа на адреналин и норадреналин, по-
ступающие с кровью либо выделяющиеся при возбуждении симпатических нервов, зависит от преобладания α - èëè β -адренергического эффекта.
Норадреналин вызывает слабую реакцию β -адрено-
рецепторов гладких мышц сосудов, бронхов и трахеи, но очень сильно активирует β -рецепторы миокарда. В связи с этим сердечные β -адренорецепторы называют рецепторами типа β 1, à β -рецепторы сосудов и бронхов
– òèïà β 2. Пока еще разделить все β -адренорецепторы организма по категориям β 1 è β 2 не представляется возможным [16].
Âфармакологических исследованиях было показа-

28 |
|
|
|
|
|
|
Глава 2. ФИЗИОЛОГИЯ СЕРДЕЧНО СОСУДИСТОЙ СИСТЕМЫ. ПРИНЦИПЫ РЕГУЛЯЦИИ... |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А Д Р Е Н А Л И Í |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Орган- |
|
|
Бронхи |
|
Сердце |
|
|
|
Вены |
|
Артерии |
|
Скелетные |
|
|
|
Печень |
|
Жировая |
|
||||||||||||||
|
рецептор |
|
|
|
β |
|
β |
|
|
|
α |
|
α |
|
|
β |
|
мышцы β |
|
|
|
β |
|
ткань β |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реакция |
|
|
Расши- |
|
Увеличение |
|
|
Сужение |
|
Суже- |
Расши- |
|
Усиление |
|
|
Усиление |
|
Усиление |
|
|||||||||||||||
|
|
|
рение |
|
силы и |
|
|
|
ние |
|
рение |
|
сокраще- |
|
|
гликогено- |
|
липолиза |
|
||||||||||||||||
|
|
|
|
|
частоты |
|
|
|
|
|
|
(кожа, |
|
(мыш- |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
сокращений и |
|
|
|
|
|
|
брыжей- |
|
цы, |
|
ний |
|
|
|
лиза |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
скорости |
|
|
|
|
|
|
ка, |
|
корон. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
арте- |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
метаболизма |
|
|
|
|
|
|
почки) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Венозный |
|
|
|
|
|
|
|
|
|
|
|
|
|
Повыше- |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
возврат |
|
|
|
|
|
|
|
|
Повыше- |
|
|
Повыше- |
|
ние |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
содержа- |
|
||||||
|
|
|
|
|
|
|
|
|
Увеличение |
|
|
|
|
|
|
|
|
|
|
|
|
|
ние |
|
|
|
ние |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ния |
|
||||||||
|
|
|
|
|
|
|
|
|
сердечного |
|
|
|
|
|
|
|
|
|
|
|
|
|
содержа- |
|
|
содержа- |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
свобод- |
|
|||||||||
|
|
|
|
|
|
|
|
|
выброса |
|
|
|
|
|
|
|
|
|
|
|
|
|
ния |
|
|
|
ния |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ных |
|
||||||||
|
|
|
Увеличе- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лактата в |
|
|
глюкозы в |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
жирных |
|
|||||||||||
|
|
|
|
|
ние |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
крови |
|
|
|
крови |
|
|
||||||
|
|
|
|
|
|
Увеличение мышечного, сердечного и |
|
|
|
|
|
|
|
|
кислот в |
|
|||||||||||||||||||
|
Конеч- |
|
вентиля- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
мозгового кровотока |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
крови |
|
|||||||||||||
|
ные |
|
|
|
ции |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
эффек- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Увеличение |
|
|
|
||||||
|
ты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Увеличение доставки кислорода к мышцам, |
|
|
|
|
|
поступления |
|
поступление глюкозы |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
сердцу и мозгу |
|
|
|
|
|
|
|
лактата к |
|
и свободных жирных |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сердцу и |
|
кислот к мышцам, |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
печени |
|
|
сердцу и мозгу |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Рис. 12. Влияние адреналина на различные органы
но, что в периферическом отделе вегетативной нервной системы существуют пресинаптические и постсинапти- ческие рецепторы, не относящиеся к холино- и адренорецепторам. Это рецепторы дофамина, опиатов, ангиотензина, простагландинов. Возможно, что все эти рецепторы не играют какой-либо роли в физиологических условиях, хотя имеют большое значение для медикаментозной терапии. Все виды рецепторов, обнаруженные в вегетативной нервной системе, были также найдены в пре- и постсинаптических мембранах нейронов центральной нервной системы. В последнем случае эти рецепторы имеют большое физиологическое значение для регуляции нервных процессов, а также служат участниками действия многих нейротропных веществ.
Рефлекторные влияния на сердечно сосудистую систему
Основное тоническое* влияние на сердечно сосудистый центр продолговатого мозга исходит из рецепторов растяжения (барорецепторов*, механорецепторов*), локализующихся в так называемых рефлексогенных зонах. Кроме того, имеются хеморецепторы*, тоническая активность которых в покое незначительна, но при некоторых обстоятельствах хеморецепторы играют чрезвычайно важную роль.
К рефлексогенным зонам относятся каротидный синус, дуга аорты, тирео-каротидная и сердечно-легочная области. Рецепторы растяжения, расположенные в этих стратегических участках отделов «высокого давления» и «низкого давления» кардиоваскулярной системы, посылают в сердечно-сосудистый центр продолговатого мозга информацию об уровне давления, о степени на-
полнения и т.п. в разных отделах, создавая, таким образом, условия для надлежащих неврогенных приспособительных изменений, цель которых заключается в поддержании сердечно-сосудистого гомеостаза.
В настоящее время имеется громадное количество работ, в которых в условиях острого и хронического экспериментов показаны изменения артериального давления, тонуса резистивных и емкостных сосудов, работы сердца при активации механорецепторов рефлексогенных зон. Общепризнано, что электрическая стимуляция синусового или аортального нервов или повышение давления в каротидных синусах или дуге аорты приводят к понижению системного АД, брадикардии и расширению сосудов [7, 10, 12, 16, 20].
• Каротидный синус, благодаря своей локализации, поддается изучению лучше, чем все другие рефлексогенные зоны. Он представляет собой расширение у на- чала внутренней сонной артерии и получает иннервацию через нерв каротидного синуса, который является одной из ветвей языко-глоточного нерва. В каждом синусном нерве есть несколько сот миелизированных* афферентных волокон и еще больше немиелизированных волокон, что наводит на мысль об их функциональной дифференциации [21].
Эти афференты обычно называют барорецепторами [20], хотя их нервные окончания, разветвляющиеся в адвентиции синуса, возбуждаются под влиянием не самого давления, а под влиянием растяжения артериальной стенки, обусловленного повышением давления. Другими словами, они представляют собой механорецепторы, или рецепторы растяжения. В этом аспекте заслуживает внимания остроумный эксперимент, описанный
Рефлекторные влияния на сердечно сосудистую систему |
29 |
B. Folkow и E. Neil, результаты которого имеют большое клиническое значение для понимания механизмов регуляторных нарушений при атеросклерозе сонных артерий. Итак, если растяжение каротидного синуса предотвратить наложением на стенку сонной артерии гипсовой манжеты, то при искусственном повышении давления в сосуде разряд нервных окончаний не усиливается. Удаление ригидной манжеты приводит к восстановлению их реактивности. Если внутрисосудистое давление постепенно понижается, их активность уменьшается и исчезает при давлении около 40–60 мм рт. ст., при котором артериальная стенка растянута незначительно. При дальнейшем понижении давления до такого уровня, при котором сосуд спадается, активность некоторых нервов возобновляется, что обусловлено деформацией сосудистой стенки. Это опять-таки свидетельствует о том, что эти структуры являются механорецепторами, а не барорецепторами [3].
В большом числе наблюдений показано, что повышение давления в каротидном синусе вызывает рефлекторную брадикардию, что частично обусловлено возбуждением блуждающих нервов, и системную гипотонию. Падение давления в синусе приводит к рефлекторному повышению АД и учащению сердечных сокращений [3, 16, 20, 21].
• Дуга аорты также богата механорецепторами и импульсная активность в аортальных нервах похожа на активность в нервах каротидных синусов. Вспышка импульсов в аортальных нервах во время каждого сердеч- ного сокращения возникает чуть раньше вспышек в синусовых нервах, так как при изгнании крови сердцем во время систолы аорта расширяется раньше, чем каротидный синус, расположенный дальше от сердца [3].
Описанные выше рефлекторные влияния на системное кровообращение, в частности на уровень АД, представляют собой регуляцию «на выходе» системы, работающую по принципу отрицательной обратной связи: при отклонении АД от нормальной величины включа- ются регуляторные (компенсаторные) реакции, восстанавливающие это давление до нормы. Это – регуляция «по рассогласованию».
Существует еще один, принципиально иной, механизм регуляции системного АД «по возмущению» «на входе» системы. В данном случае регуляторные реакции включаются еще до того, как АД изменится, предупреждая отклонения его от нормы. Необходимые для этого механизмы запускаются сигналами, возникающими в рецепторах растяжения миокарда и коронарных сосудов, несущих информацию о степени наполнения кровью полостей сердца и артериальной системы. В этом случае регуляторные реакции реализуются через внутрисердечную нервную систему, а также через вегетативные центры ЦНС [22]. (Рефлексам с рецепторов сердца в нашей книге посвящен специальный раздел).
Рефлекторная регуляция кровообращения осуществляется при помощи не только механорецепторов, но и
хеморецепторов, сосредоточенных в каротидном синусе и дуге аорты. Хеморецепторы чувствительны к двуокиси углерода и недостатку кислорода в крови; они раздражаются также окисью углерода, цианидами, никотином. Возбуждение хеморецепторов аорты и сонной артерии вызывает сосудистые прессорные рефлексы, в то время как раздражение механорецепторов – депрессорные рефлексы [22].
•Рефлексы с хеморецепторов аортальных и синокаротидных телец на сердечно-сосудистую систему нельзя отнести, подобно рефлексам с механорецепторов,
êистинной ауторегуляции кровообращения, так как адекватным раздражителем для хеморецепторов служат сни-
жение напряжения кислорода (PO2) и повышение напряжения двуокиси углерода (PCO2) или увеличение концентрации водородных ионов в крови. Импульсы от хеморецепторов поступают как в «дыхательные», так и в «циркуляторные» центры продолговатого мозга, в результате чего возникают рефлекторные реакции, часто носящие противоположный характер [23].
•Реакция на ишемию ЦНС заключается в возбуждении циркуляторных центров продолговатого мозга, сопровождающемся преимущественно сужением сосудов и повышением системного АД. Эта реакция возникает при недостаточном кровоснабжении головного мозга, падении АД, снижении содержания кислорода в артериальной крови или нарушении мозгового кровообращения вследствие сосудистой патологии. Повышение
концентрации ионов водорода, РСО2 и, возможно, других метаболитов в мозговой ткани приводит к возбуждению центров продолговатого мозга – либо в результате прямого действия на ретикулярную формацию*, либо вследствие влияния внеклеточной концентраци ионов водорода (сдвиг pH) на хеморецепторные области поверхности ствола мозга. Допускается, что при сниже-
íèè ÐÎ2 в артериальной крови возникают также рефлекторные реакции, связанные с раздражением артериальных хеморецепторов. При этом интенсивность реакции на ишемию ЦНС зависит от степени нарушения кровоснабжения головного мозга. Так, при крайне выраженной церебральной ишемии, в результате рефлекторного сужения почечных сосудов, кровоток в почках может упасть вплоть до прекращения мочеотделения, в результате системное АД повышается до 250 мм рт.ст. и более [24].
Таким образом, в зависимости от текущего функционального состояния организма и от условий внешней среды интегративный нер-вный контроль кровообращением реализуется на разных уровнях центральной нервной системы с вовлечением нейронных систем на других уровнях (рис. 13). Причем сочетание вовлекаемых в регуляцию интегративных зон может быть различным. Такой многоконтурностью и возможностью в определенных границах взаимного дублирования и обеспечиваются надежность и точность нервного управления кровообращением.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
