
- •3.1. Онкогены
- •4.2. Выявление и мониторинг химических канцерогенов
- •5.1. Общая характеристика онкогенных вирусов
- •5.2. Онкогенный потенциал вирусов и механизмы его проявления
- •5.3. Вирусы папиллом и их роль в канцерогенезе шейки матки
- •5.4. Роль вируса гепатита в развитии рака печени
- •5.8. Ретровирусы типа D (SRV)
- •5.9. Эндогенные ретровирусы человека
- •5.10. О возможном участии ретровирусов в индукции рака молочных желез человека
- •7.1. Цитоскелет
- •7.2. Распластывание и локомоция нормальных клеток
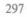
Рекомендуемая литература |
|||
Киселев |
Ф. Л., |
Павлиш О. Α., Татосян А. Г. |
|
Молекулярные основы канцерогенеза у |
|||
человека. — М.: Медицина, 1990. |
|||
Киселев |
Ф. Л. |
Вирус-ассоциированные |
|
опухоли человека: рак шейки матки и |
|||
вирусы папиллом // Биохимия. — |
|||
2000. |
- |
№. |
65. - С. 7 9 - 9 1 . |
Zur Hausen |
Η. |
Papillomavirus infections: a |
|
major cause of human cancers // Biochim. |
|||
Biophys. Acta. — 1996. — Vol. 1288. — P. |
|||
F55 - F78 .
Zur Hausen H. Molecular pathogenesis of cancer of the cervix // Topics in Microbi ology and Immunology / ed. H. zur Hausen. — Berlin: Springer, 1994. — Vol. 186. - P. 136-157.
Zur Hausen H. Papilloma virus causing cancer: evasion from control in early events of carcinogenesis // J. Nat. Cancer Inst. — 2000. - Vol. 92. - P. 690 - 698 .
Phillips A. C, Vousden К. H. Human papillo maviruses and cancer // Viruses and hu
man |
cancer / Ed. A. J. Arrand, |
D. R. |
Harper // Bios Sci. Publ. — Oxford, |
1998. |
|
- P. |
3 9 - 6 5 . |
|
5.4. Роль вируса гепатита в развитии рака печени
Ф. Л. Киселев
Можно считать установленным, что около 15 % опухолей человека этиологически связаны с наличием в них вирусного генетического материа ла. Среди таких опухолей 30 % прихо дится на рак печени, ассоциирован ный с вирусами гепатита В и С (HBV и HCV соответственно), что составля ет 4,5 % от всех известных опухолей.
Эпидемиологические данные сви детельствуют о том, что у мужчин с хронической инфекцией вирусами ге патита В и С риск возникновения опухоли возрастает почти в 100 раз. Наиболее четкие эпидемиологические данные получены в отношении вируса гепатита В. Существует четкая географическая корреляция между присутствием основного антигена это го вируса (HbsAg) и частотой возник новения гепатита печени (НСС). В настоящее время на земном шаре ин фицированы около 200 млн человек;
каждый год в результате заражения HBV погибают 2 млн заболевших, из которых 700 тыс. человек умирают от рака печени, ассоциированного с HBV. Хотя в настоящее время активно внедряется вакцина против HBV, по подсчетам ВОЗ, к 2000 г. более 400 млн людей остаются хронически инфицированными. Поскольку инку бационный период для HBV-ассоции- рованного рака печени составляет не менее 30 лет, можно полагать, что опухоли печени будут представлять серьезную проблему для здравоохра нения еще многие десятилетия.
Не менее сложна и ситуация с ви русом гепатита С. В настоящее время только в СШ А инфицировано 3,9 млн человек, из которых хронически ин фицировано 2,7 млн. Ситуация скла дывается таким образом, что в тече ние последующих 20 лет количество HCV-инфицированных может возрас ти в 3 раза, что в свою очередь увели чит риск возникновения опухолей пе
чени на 68 %. |
|
|
Гепатоцеллюлярные |
карциномы |
|
представляют |
интересную |
модель для |
изучения молекулярных |
аспектов |
|
опухолевого |
процесса, |
поскольку |
один и тот же тип опухолей индуци руется как ДНК-содержащим (HBV), так и РНК-содержащим (HCV) ви русом.
Активные исследования роли HBV
вэтиологии рака печени были начаты
в1970 г., когда был клонирован геном этого вируса и выявлено очень сход ное заболевание у земляных сурков: выделенный от них вирус гепатита по всем параметрам был сходен с HBV и вызывал опухоли печени у 100 % ин фицированных животных.
ВHBV-позитивных опухолях ви русная Д Н К , как правило, интегриру ется в клеточный геном, и такие клет ки активно пролиферируют. Индиви дуальные опухоли являются моноклональными по типу интеграции вирус ной ДНК . При этом интеграция не имеет специфического сайта в клеточ ном геноме и может происходить в различных его участках без каких-ли-
бо закономерностей, в связи с чем представляется маловероятным пред положение о прямой активации (цис активации) определенных клеточных генов в результате интеграции вирус ного генома. До сих пор не удалось идентифицировать какого-либо гепа- тоцит-специфического онкогена, ко торый узнавался бы HBV.
Более естественным представля лось предположение о транс-активи- рующем потенциале генома HBV. В настоящее время в составе генома HBV идентифицировано несколько генов, продукты которых обладают способностью активировать транс крипцию других генов. Это продукты так называемого гена X (НВх) и гена PreS2 в форме крупного поверхност ного белка LHBs и в форме белка, ре дуцированного по С-концу, MHBs(t) (схема 5.8). При этом экспрессия про дуктов НВх и LHBs возможна с ин - тактного вирусного генома, в то время как кодирующая рамка MHBs(t) — только после разрыва кольцевой мо лекулы Д Н К HBV и ее интеграции в клеточный геном.
транскриптазу), а также ТБ, ассоции рованный с минус-нитью Д Н К . O R F С (на схеме nucleocapsid) кодирует структурный белок нуклеокапсида (НВс), a O R F S/preS (на схеме preS, + preS2 + surface) — гликопротеиды оболочки вириона. O R F X кодирует специфический белок в 17 кДа, обла дающий транс-активирующими по тенциями . O R F S/preS может коди ровать несколько белков, наиболее крупный из них (L) имеет молекуляр ную массу 39 кДа, другой — 31 кДа. Оба белка имеют общий S-домен и отличаются по размеру и структуре своего Ν - домена. Классический Н В - sAg содержит только S-домен. Белки L и М, кодируемые pre-S-участком, составляют незначительную часть циркулирующих S-родственных ан тигенов (для М-белка — 5—10 %, для белка L - 1-2 % ) .
Репликация происходит через прегеномную РНК-матрицу, что сближа ет гепаднавирусы с ретровирусами. Вирус обладает высоким уровнем видо- и тканеспецифичности.
Как правило, вирусная Д Н К в
5.4.1. Геном вируса гепатита В
Геном вируса гепатита В, относя щегося к группе гепаднавирусов, име ет ряд характерных особенностей. Его Д Н К размером 3200 пар оснований является частично двунитевой (см. схему 5.5). Структура необычна тем, что нити Д Н К несимметричны — ми нус-нить является полноразмерной и на 5'-конце с ней ковалентно связан так называемый терминальный белок (ТБ). Плюс-нить существенно короче и на 5'-конце заканчивается олигорибонуклеотидом. На 5'-концах каждой из нитей имеются 11-членные нуклеотидные повторы.
В составе Д Н К идентифицирова но 4 открытые рамки считывания (ORF). Ген Ρ (на схеме primer + polymerase + Rnase Η) кодирует соб ственный фермент — РНК-зависи мую ДНК - полимеразу (обратную
С х е м а 5.8. Генетическая структура ви
руса гепатита В
3189
298
опухолевых клетках |
интегрируется в |
ми |
возможностями |
|
в |
модуляции |
|||||||||||
клеточный геном в виде одной или |
транскрипции. Аминокислотная |
по |
|||||||||||||||
нескольких копий. В большинстве |
следовательность в 12 остатков на С- |
||||||||||||||||
случаев |
интеграция |
сопровождается |
конце белка ответственна за трансак- |
||||||||||||||
реаранжировкой вирусной Д Н К и де- |
тивационные потенции. Использова |
||||||||||||||||
лецией части генома. Естественно, |
ние вариантов с внутренними деле- |
||||||||||||||||
это приводит к потере способности |
циями, инсерциями и точечными му |
||||||||||||||||
продукции вирусных частиц. При |
тациями по различным участкам гена |
||||||||||||||||
реаранжировке в основном |
наруша |
показало, что участки белка, локали |
|||||||||||||||
ются гены полимеразы и белков яд |
зованные |
|
между |
|
аминокислотами |
||||||||||||
ра, в то время как участок S и ген |
67—69 и 110—139, являются абсолют |
||||||||||||||||
НВх остаются интактными. Во мно |
но |
необходимыми |
для |
проявления |
|||||||||||||
гих случаях участок S подвергается |
указанной функции, а замена одной |
||||||||||||||||
делеции, |
что сопровождается |
продук |
аминокислоты в позициях 69 (Cys) и |
||||||||||||||
цией белка MHBs(t), который реду |
132 |
(Phe) |
|
полностью |
элиминирует |
||||||||||||
цирован по С-концевым аминокис |
транс-активирующий потенциал. |
||||||||||||||||
лотам по сравнению с исходным про |
Существуют противоречивые |
дан |
|||||||||||||||
дуктом. |
|
|
|
|
|
|
|
ные о локализации НВх: по-видимо |
|||||||||
|
|
|
|
|
|
|
|
|
му, он локализуется как в цитозоль- |
||||||||
5.4.2. Белок НВх |
|
|
|
|
ной фракции, так и в ядре, и не |
||||||||||||
|
|
|
|
|
|
|
|
|
исключено, |
что |
механизм действия |
||||||
HBV |
содержит |
открытую |
рамку |
НВх в этих фракциях может разли |
|||||||||||||
считывания X, которая кодирует бе |
чаться. |
|
|
|
|
|
|
|
|||||||||
лок, содержащий 154 аминокислоты с |
В цитозольной фракции НВх мо |
||||||||||||||||
уникальной |
последовательностью. |
жет |
активировать |
компоненты |
пути |
||||||||||||
Поскольку у этого белка отсутствует |
передачи |
сигнала, |
контролируемого |
||||||||||||||
какая-либо гомология с известными |
фосфокиназой С (РКС) или онкоге |
||||||||||||||||
клеточными белками, можно |
предпо |
ном Ras, и дерегулировать точки кон |
|||||||||||||||
ложить, что белок X относится к ка |
троля (checkpoint) клеточного цикла. |
||||||||||||||||
кому-то новому классу клеточных |
Показано, что НВх может активиро |
||||||||||||||||
белков. Этот белок в зараженных |
вать |
транскрипционный |
фактор |
API |
|||||||||||||
клетках |
|
экспрессируется |
|
на |
низком |
(комплекс |
продуктов онкогенов fos + |
||||||||||
уровне и имеет короткий период по |
jun), |
опосредованный |
РКС. По другим |
||||||||||||||
лужизни. |
|
|
|
|
|
|
|
данным, НВх может также влиять на |
|||||||||
Установлено, что белок X имеет |
путь Ras-Raf-MAК-киназа. Kpoмe то |
||||||||||||||||
важное значение в процессе реплика |
го, НВх способен напрямую взаимо |
||||||||||||||||
ции вируса. Но для канцерогенеза, |
действовать с ядерными белками ос |
||||||||||||||||
по-видимому, определяющую роль |
новного |
транскрипционного |
пути, |
||||||||||||||
играет такая функция НВх, как |
прежде всего RP85, ТВР, компонента |
||||||||||||||||
транскрипционная |
транс-активация. |
ми TRIIH, элементами ДНК-репари- |
|||||||||||||||
Этот белок |
способен |
активировать |
рующей системы |
или |
непосредствен |
||||||||||||
аутологичные |
(например, |
|
энхансер |
но взаимодействовать с такими транс |
|||||||||||||
HBV) |
и |
гетерологичные |
вирусные |
крипционными факторами, как CREB |
|||||||||||||
последовательности |
(например, |
LTR |
(белок, взаимодействующий с CRE- |
||||||||||||||
HIV), а также клеточные промотор- |
областью), ATF2 или Octl. Следует |
||||||||||||||||
ные и энхансерные элементы (к при |
подчеркнуть, |
однако, |
что |
идентифи |
|||||||||||||
меру, |
гены |
с-тус, API, АР2, |
NF-KB). |
кация белков, способных |
взаимодей |
||||||||||||
При этом уровень транс-активации |
ствовать с НВх, во многом зависит от |
||||||||||||||||
сравнительно |
невысок |
(8—15 |
раз), |
используемого метода, и иногда наи |
|||||||||||||
что позволяет предполагать, что этот |
более популярные среди них — аф |
||||||||||||||||
белок является слабым плейотроп- |
финная хроматография и метод двой |
||||||||||||||||
ным неспецифическим транскрипци |
ных гибридов — дают несопоставимые |
||||||||||||||||
онным |
транс-активатором |
с широки |
результаты. |
|
|
|
|
|
|
|
|||||||
5.4.3.PreS'2-активаторы: утери части последовательностей в
LHBs и MHBs(t)
НВх и LHBs обладают конститу тивными транс-активирующими свойствами, в то время как у MHBs(t) (MHBs, редуцированный по С-концу) эти свойства проявляются только по сле делеции З'-концевой области гена preS/S, которая происходит в резуль тате рекомбинации вирусной и кле точной Д Н К в процессе интеграции. Активация под действием LHBs и MHBs(t) базируется на одних и тех же структурных элементах (домен pre-S2) и вовлечена в одни и те же пути пере дачи сигнала.
Ген preS/S содержит одну откры тую рамку считывания, которая разде лена на 3 кодирующих участка — PreSl, PreS2 и S, каждая из которых инициируется с внутреннего A T G - K O - дона. В результате альтернативной инициации могут синтезироваться 3 гликопротеида оболочки — крупный (LHBs, PreSl + PreS2 + S), средний (MHBs; PreS2 + S) и мелкий (SHBs; S), все 3 гликозилированы по амино кислоте 146 внутри участка S. MHBs дополнительно гликозилируется по аспарагину в 4-й позиции в области PreS2 и может выявляться в негликозилированной (р30), моногликозилированной (gp33) и бигликозилированной формах (gp36). MHBs содержит 3 гидрофобных участка, входящих в со став трансмембранного домена. MHBs синтезируется как нейтральный мем бранный белок, который секретируется в эндоплазматический ретикулум (ЭР) и аппарат Гольджи (АГ). Если MHBs экспрессируется с вирусного генома, то он образует смешанные частицы с SHBs и LBHs в липидной оболочке.
Активатор MHBs(t) был впервые выявлен во многих культивируемых клетках гепатом и может быть обнару жен и в опухолях печени, содержащих интегрированный геном HBV.
Детальный анализ клонированной Д Н К HBV показал, что активирую щий потенциал возникает в результате
3'-области гена preS2/S. Эта делеция касается последовательностей, коди рующих гидрофобный участок III, в основном 70 С-концевых аминокис лот. Участок pre/S1 не является обяза тельным для проявления транс-акти- вирующих функций MHBs(t). Экспе рименты по контрансфекции показа ли, что эти функции теряются при му тации со сдвигом рамки по позиции 129 (аминокислота 47), а отрезание ге нома по нуклеотиду 221 (аминокисло ты 76) приводит к образованию функ ционального MHBs(t) транс-актива- тора.
MHBs(t), по-видимому, локализу ется в ЭР и не способен процессироваться в АГ и затем секретироваться. В этом, по-видимому, заключается принципиальное отличие MHBs и MHBs(t). Белки MHBs(t), утерявшие все 3 трансмембранных домена, также обладают транс-активирующими функциями, но они не связаны с мем бранами ЭР и гомогенно распределе ны по цитоплазме и ядру.
Таким образом, существуют 2 типа MHBs(t) транс-активаторов, один из которых локализуется в ЭР, а второй диффузно распределенный по клетке. В отличие от полноразмерного MHBs оба субтипа имеют одно общее свой ство, состоящее в том, что их preS2 домены экспонированы в цитоплазму. Еще одно отличие MHBs(t) от полно размерного MHBs состоит в том, что MHBs(t) может подвергаться фосфорилированию под действием РКС .
MHBs(t) — зависимая транскрип ционная активность — является плейотропной, и достаточно широкий спектр различных мишеней-последо
вательностей |
может |
подвергаться |
транс-активации. Оба |
субтипа М Н - |
|
Bs(t)-aктиватopoв не выявляют разли чий по их специфичности и активи рующему потенциалу. Эта активность не является тканеили видоспецифической. Поскольку MHBs(t) не спосо бен связываться непосредственно с Д Н К или с ДНК-связующими белка ми и проявляет свой эффект путем
300
активации различных неродственных транскрипционных факторов, таких как AP1, АР2, NF - KB и SP1, можно предполагать, что MHBs(t), как и НВх, интерферируются с ранними процессами в пути передачи клеточ ного сигнала.
С помощью специально разрабо танных экспериментальных подходов удалось установить, что РКС являют ся специфическими партнерами свя зывания и играют ключевую роль в МНВs(t)-зависимой транскрипцион ной активации. Кроме того, оказа лось, что MHBs(t) активирует РКС независимо от 1,2-диацилглицерина (DAG). Следовательно, MHBs(t) пред ставляет собой новый тип индуктора РКС. МНВs(t)-зависимая активация РКС является необходимой для М Н - Bs(t)-ассоциированной активации AP1 и NF-KB. При этом также показано, что эта активация в отличие от HBs запускается независимо от онкогена Ras 1 и сопровождается активацией клеточных киназ c-Raf и МАР2. Сово купность этих данных позволяет пред положить следующую модель М Н - Bs(t)-опосредованной транскрипцион ной активации: MHBs(t) связывается с РКС, индуцируя ее активацию, не зависимую от DAG. Активация РКС передается через c-Raf-1 и МАР2 киназы в ядро и в итоге приводит к ак тивации транскрипционных факто
ров AP1 и N F - K B .
5.4.4. Роль хронической инфекции HBV для развития опухолей печени
Выше отмечалось, что на основа нии эпидемиологических данных бы ло высказано предположение о том, что H B V играет ключевую роль в раз витии гепатом, которое получило серьезное подтверждение после выяв ления вирусной Д Н К в этих опухолях. В настоящее время существует еще одна группа данных, подтверждающих это положение.
С 1970 г. началась регулярная вакцинация людей против HBV, и, по
предварительным данным, в этой по пуляции отмечается снижение часто ты рака печени, однако однозначных конкретных результатов, видимо, ожидать после 2005 г.
Не надо забывать, что HBV не содержит собственного онкогена и опу холевый процесс проявляется через очень длительный период после первичной инфекции (до 30 лет), что свидетельствует о многостадийности процесса. При этом совершенно не понятно, играет ли HBV ключевую роль на одном или на нескольких I критических этапах.
Подавляющее большинство боль ных с HBV-ассоциированными опухо лями являются позитивными по ос новному вирусному антигену HBsAg. Представленные выше данные позво ляют предполагать, что экспрессия LBHs (транскрипционного активато ра) может иметь важное значение в развитии опухоли, однако существую щими ныне методами экспрессию LBHs выявить не удалось. В свою оче редь это может быть связано с не сколькими обстоятельствами:
•используемые методы недоста точно чувствительны для выяв ления весьма малых количеств LBHs;
•функция LBHs необходима толь ко на ранних стадиях развития гепатом;
•его функции на поздних этапах опухолевой прогрессии переда ются НВх или MHBs(t).
При изучении экспрессии различ ных рамок считывания было обнару жено, что активируются рамки, коди рующие НВх или MHBs(t) — транс- активаторы, стимулирующие пути пе редачи сигналов, т. е. те пути, кото рые активируются опухолевыми про моторами типа ТРА, как это имеет место и при химическом канцерогене зе. В связи с этим можно предпола гать, что опухолевая промоция, осу ществляемая в данном случае за счет HBV, может быть первичным факто ром инициации онкогенеза.
301
Не менее важным является вопрос о возможном участии опухолевого ге- на-супрессора р53 в развитии гепатом. Существуют противоречивые данные о взаимодействии НВх и MHBs(t) с р53. Анализ состояния р53 в гепатоцеллюлярных раковых опухолях пока зал, что мутации в этом гене проявля ются только в опухолях тех больных, которые содержат Д Н К HBV или под вергались воздействию афлатоксина. Возможно, что появление мутаций в гене р53 является независимым про цессом и не связано с HBV.
Если |
предположить, что опухолевая |
|||||
промоция, |
направляемая транс-актива- |
|||||
торами HBV, является первым ключе- |
||||||
вым |
моментом |
в гепатоцеллюлярном |
||||
онкогенезе, |
то, |
очевидно, возможен |
||||
следующий |
сценарий |
развития опухо |
||||
левого процесса, начинающегося с ин |
||||||
фицирования вирусом. В силу непол |
||||||
ноценности |
(может быть, генетически |
|||||
детерминированного) иммунного отве |
||||||
та |
инфицированные |
гепатоциты |
не |
|||
удаляются из организма в течение не |
||||||
скольких месяцев и инфекция стано |
||||||
вится хронической. В некоторых гепа- |
||||||
тоцитах |
таких |
вирусоносителей |
HBV |
|||
интегрирует в клеточный геном. В ре |
||||||
зультате |
генетических |
реаранжировок |
||||
происходит делеция гена НВс и части |
||||||
генов HBsAg. Клетки при этом стано |
||||||
вятся HBcAg- и |
HBsAg-негативными и |
|||||
фактически уходят из-под иммуноло гического контроля, поскольку именно эти антигены являются мишенями для иммунного ответа. В результате этого происходит селекция клеток с интегри рованной Д Н К HBV, кодирующей 3 основных транс-активатора — НВх, LНВ-и/или MHBs(t). Возможно (и это может бытъ важным моментом), эти транс-активаторы могут активировать не только гены, контролирующие про лиферацию клеток, но и ряд других ге нов и прежде всего генов цитокинов, в частности интерлейкина-6 (IL-6). Эти цитокины, секретируемые из транс-ак тивированных клеток, могут создавать специфическое микроокружение со седствующих фибробластов, эндотелиальных и других клеток, что приводит
к освобождению из этих клеток других ростовых факторов, например инсулиноподобный ростовый фактор II, кото рый в свою очередь стимулирует по паракринному типу пролиферацию транс-активируемых гепатоцитов. Эта новая эпигенетическая ситуация может способствовать проявлению дальней ших процессов в канцерогенезе, таких как мутации, хромосомные аберрации, которые будут способствовать селек ции клеток с ускоренной полиферацией за счет транс-активирующих потен ций вирусных генов.
Необходимо подчеркнуть, что, кроме возможной этиологической ро ли HBV в гепатоканцерогенезе, в опу холевых клетках выявлены многие мо- лекулярно-генетические изменения, характерные и для развития опухоле вых процессов в других органах. Наи более частыми событиями в опухолях печени являются делеции или инакти вация таких опухолевых супрессоров, как р53, Rb, BRCA 2 и Е-кадхерин. Среди других факторов следует отме тить активацию теломеразы на пред раковых стадиях в карциномах и дерегуляцию факторов, участвующих в сигнальных путях, контролируемых Wnt и MAPK/ERK.
Такая схема не только может объ яснять длительный латентный период, но и позволяет предполагать, что про цесс в каждом индивидуальном случае протекает по своему собственному плану. В результате этого каждая опу холь должна иметь свой генетический портрет, т. е. различные типы мута ций и хромосомальных реаранжиро вок. Подобная индивидуализация гепатоцеллюлярных карцином ставит серьезнейшие вопросы для создания эффективных терапевтических прото колов, и это задача будущего.
5.4.5. Геном вируса гепаmuma С
Вирус гепатита С относится к се мейству Flaviviridae и его геном пред ставлен однонитевой РНК, содержа щей 9033 нуклеотида, которые спо-
302

С х е м а 5.9. Структура РНК вируса гепатита С
собны кодировать ~3000 аминокислот (схема 5.9). Функционально геном мо жет быть разделен на 2 участка, один из которых кодирует 3 белка вириона, из них 2 представлены белками обо лочки, а один составляет ядро вирио на; другой участок генома может ко дировать несколько белков, обладаю щих важными ферментативными свойствами. Среди них металлопро теаза, еще один протеолитический фермент, хеликаза, РНК-зависимая РНК-полимераза и один из кофакто ров протеазы. Какова роль этих фер ментов в абортивном цикле размно жения вируса (включая роль в канце рогенезе), — в настоящее время неиз вестно. Следует также отметить, что на обеих концах вирусной Р Н К име ются регуляторные последовательно сти (UTR), и Р Н К HCV в этом плане напоминает РН К ретровирусов.
Остается неясным, в какой форме РНК HCV персистирует при хрониче ской инфекции (и в опухолях печени тоже). Серологические методы на бел ки оболочки или ядра вирусной час тицы не являются адекватными, но при этом вирусная Р Н К регулярно выявляется в опухолях с помощью RT-PCR. Никаких доказательств об ратной транскрипции Р Н К HCV не получено и, таким образом, форма персистенции вирусной Р Н К остается неясной. Отсутствие адекватных кле
точных моделей для репродукции ви руса серьезно осложняет разрешение этой проблемы.
Рекомендуемая литература
Киселев Ф. Л., Павлиш О. Α., Татосян А. Г.
Молекулярные основы канцерогенеза у человека. — М.: Медицина, 1990.
Blumberg В. S. Hepatitis В virus, the vaccine,
and the |
control of primar |
cancer of |
the |
|
liver |
// |
Proc. Nat. Acad. |
Sci. USA. |
- |
1997. |
- |
Vol. 94. - P. 7121-7125. |
|
|
Colombo M. Natural history and pathogenesis of hepatatis С virus related hepatocellular carcinoma. — 1999. — Vol. 31 (suppl. 1).
-P. 2 5 - 3 0 .
Harrison T. J. Viral hepatitis and primary liver cancer // Viruses and human cancer / eds. J. R. Arrand, D. R. Harper. — Oxford: Bios Scientific Publishers, 1998. — P. 17.
Hildt £., Hofschneider P. H., Urban S. The role of hepatitis В virus (HBV) in the de velopment of hepatocellular carcinoma // Seminars in Virology. — 1996. — Vol. 7.
-P. 333 - 347 .
Kondola |
N.. |
Wakatsiki |
Т., |
Hada A. et al. // |
Int. |
J. |
Oncology. |
- |
2001. - Vol. 18. - |
P. 1271-1278. |
|
|
||
5.5. ДНК-содержащие вирусы: герпеевирусы
В. Э. Гурцевич
Герпеевирусы — семейство Д Н К - содержащих вирусов, встречающихся в естественных условиях у человека и
303
животных. Герпесвирусы характеризу ются сходным устройством вириона и обладают следующими важными био логическими свойствами:
• кодируют большой спектр фер ментов, вовлеченных в метабо лизм нуклеиновых кислот, син тез Д Н К и процессинг белков;
•синтез вирусной Д Н К и сборка капсида у герпесвирусов проис ходит в ядрах инфицированных клеток;
•образование потомства у герпесвирусов обычно сопровождается разрушением инфицированных клеток;
•герпесвирусы могут оставаться в латентном состоянии и персистировать в течение всей жизни у их природных хозяев в опреде ленном типе клеток, которые могут быть различными для раз ных вирусов;
•латентные геномы герпесвиру сов обычно принимают форму циркулярно замкнутых эписом, при этом экспрессируется не большая часть вирусных генов.
Типичный вирион герпесвирусов
состоит из |
сердцевины, содержащей |
|
2-нитевую |
Д Н К , |
икосаэдрального |
капсида, окруженного аморфной обо лочкой, и внешней липидной оболоч ки с вирусными гликопротеиновыми шипами на поверхности вириона. Диаметр герпесвирусных частиц варь ирует между 120 и 200 нм. Кроме ви русной Д Н К , вирусные частицы со держат 25—30 кодируемых вирусным геномом белков и фосфолипиды клет ки хозяина, происходящие из ядерной мембраны. Диаметр упакованной сердцевины зрелых вирионов, содер жащих 2-нитевую вирусную ДНК, со ставляет примерно 75 нм. Икосаэдральный капсид диаметром 100— 110 нм содержит 162 капсомера.
Герпесвирусная Д Н К может отли чаться по размеру, составу оснований и расположению уникальных и повто ряющихся последовательностей. Раз мер герпесвирусной Д Н К варьирует
от 120 до 230 т. п.н. и характерен для каждого рода.
Семейство герпесвирусов делят на 3 подсемейства — α, β и γ в зависимо сти от биологических свойств и ткане вого тропизма вирусов. Подразделе ние каждого подсемейства на роды базируется на гомологии последова тельностей Д Н К , сходства организа ции генома и антигенного родства ви русных белков. Так, подсемейство альфагерпесвирусов включает два рода —
Simplexvirus и Varicellovirus, известны ми представителями которых являют ся Herpes Simplex Virus-1 (HSV-1), Her pes Simplex Virus-2 (HSV-2) и Varicellazoster Virus (VZV). Другое обозначение этих вирусов - HHV1, HHV2 и HHV3 соответственно. Представители а-гер- песвирусов имеют достаточно широ кий круг хозяев, а также относительно короткий продуктивный цикл в эпи телиальных клетках. Отличительной чертой данного подсемейства является их способность к установлению пер вичной латентной инфекции в сен сорном ганглии.
Подсемейство β-герпесвирусов со стоит из 2 родов — Cytomegalovirus и Muromegalovirus, прототипами кото рых являются соответственно цитомегаловирус человека (CMV или HHV5) и цитомегаловирус мышей (CMV мышей или MHV-1). HHV6 и HHV7 также отнесены к этому подсе мейству на основании их генетиче ской гомологии с CMV, хотя эти ви русы обладают некоторыми биологи ческими свойствами, характерными для γ-герпесвирусов. β-Герпесвирусы имеют ограниченный круг хозяев, и большинство видов (species) инфици рованы собственным CMV. Реплика ция β-герпесвирусов in vivo происхо дит в различных типах клеток, вклю чая эпителиальные. В латентном со стоянии вирусы могут находиться в лимфоретикулярных клетках, клетках секреторных желез, почек и других тканей. Инфекционный процесс на растает медленно и сопровождается увеличением размеров инфицирован ных клеток (цитомегалия) с появле-
304
нием в ядрах характерных эозино- |
Вирус саркомы Капоши (KSHV или |
|||||||||||||||||||||
фильных включений в виде телец, |
HHV8) также отнесен к этому роду |
|||||||||||||||||||||
которые образуются в результате на |
благодаря его выраженному сходству с |
|||||||||||||||||||||
копления |
дефектных |
|
частиц, |
содер |
Herpesvirus |
saimiri. |
|
|
|
|
||||||||||||
жащих |
оболочечные |
|
вирусные |
белки |
|
|
|
|
|
|
|
|
|
|
||||||||
без Д Н К |
или |
без |
собранных |
|
кап- |
5.5.1. Вирус |
|
|
|
|
||||||||||||
сидов. |
|
|
|
|
|
|
γ-герпесвирусов |
Эпштейна—Барр. |
|
|
|
|||||||||||
Подсемейство |
|
|
Общая |
|
характеристика |
|||||||||||||||||
включает |
роды |
Lymphocriptovirus |
и |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Rhadinovirus. Для |
представителей |
этого |
Вирус Эпштейна—Барр (EBV) от |
|||||||||||||||||||
подсемейства |
характерен |
тропизм к |
носится к подсемейству γ-герпесвиру |
|||||||||||||||||||
лимфоидным |
клеткам. |
Вирусы |
|
спо |
сов, роду лимфокриптовирусов (Lym- |
|||||||||||||||||
собны |
стимулировать |
пролиферацию |
phocryptovirus). В классификации, ос |
|||||||||||||||||||
лимфоидных клеток in vivo, вызывая |
нованной |
на |
таксономии герпетиче |
|||||||||||||||||||
транзиторные или хронические лим- |
ских вирусов, EBV обозначен также |
|||||||||||||||||||||
фопролиферативные |
процессы |
у |
ин |
как HHV4 (human herpes virus 4). |
||||||||||||||||||
фицированных лиц, |
|
инфицирование |
EBV впервые выделен в 1964 г. из |
|||||||||||||||||||
же лимфоидных клеток in vitro приво |
культуры |
лимфоцитов |
ребенка, |
боль |
||||||||||||||||||
дит к их иммортализации. γ-Герпес- |
ного лимфомой Беркитта (ЛБ). Даль |
|||||||||||||||||||||
вирусы имеют узкий круг природных |
нейшие |
исследования |
показали, что |
|||||||||||||||||||
хозяев. Большая их часть интенсивно |
этот |
вирус |
|
является |
убиквитарным |
|||||||||||||||||
реплицируется |
в |
гематопоэтических |
для человека и персистирует пример |
|||||||||||||||||||
клетках, а некоторые способны также |
но у 85—100 % взрослого населения |
|||||||||||||||||||||
размножаться в фибробластах и эпи |
планеты. Инфицирование EBV обыч |
|||||||||||||||||||||
телиальных клетках. Как правило, ла |
но происходит в раннем детстве и |
|||||||||||||||||||||
тентную |
инфекцию |
|
можно |
обнару |
протекает, |
как правило, бессимптом |
||||||||||||||||
жить в клетках лимфоидных органов. |
но. При более позднем контакте с ви |
|||||||||||||||||||||
Представители |
рода |
|
|
Lymphocriptovirus |
русом в старшем детском и юноше |
|||||||||||||||||
(или γ-1-герпеевирусы) включают ви |
ском возрасте примерно в 50 % случа |
|||||||||||||||||||||
рус Эпштейна—Барр (EBV или HHV4) |
ев возникает классический инфекци |
|||||||||||||||||||||
и родственные вирусы приматов Ста |
онный мононуклеоз (ИМ) . После |
|||||||||||||||||||||
рого Света, такие как герпеевирусы |
первичного |
инфицирования |
EBV че |
|||||||||||||||||||
шимпанзе (Herpesvirus pari), орангута |
ловек пожизненно становится носите |
|||||||||||||||||||||
нов (Herpesvirus orangutan) и горилл |
лем вируса, |
который |
локализуется в |
|||||||||||||||||||
(Herpesvirus gorilla). Объединяют эти |
В-лимфоцитах периферической крови |
|||||||||||||||||||||
вирусы тропизм к В-лимфоцитам, ар |
и в эпителиальных клетках ротоглот |
|||||||||||||||||||||
хитектура генома и сходная организа |
ки. В В-лимфоцитах периферической |
|||||||||||||||||||||
ция генов. Более того, некоторые |
крови вирус находится в латентном |
|||||||||||||||||||||
структурные |
и |
неструктурные |
|
белки |
состоянии, |
при этом экспрессируется |
||||||||||||||||
этих вирусов |
антигенно |
родственны, |
только часть вирусного генома, тогда |
|||||||||||||||||||
особенно |
среди |
|
вирусов |
приматов, |
как в эпителиальных клетках ротог |
|||||||||||||||||
следствием |
чего |
является |
перекрест |
лотки имеет место продуктивная (ли- |
||||||||||||||||||
ная реактивность обнаруживаемых ви- |
тическая) |
|
инфекция, |
сопровождаю |
||||||||||||||||||
русспецифических |
антител. В |
проти |
щаяся |
|
продукцией |
зрелых |
вирусных |
|||||||||||||||
воположность |
этому у |
представителей |
частиц |
и |
гибелью |
инфицированных |
||||||||||||||||
родов |
Lymphocriptovirus |
|
и |
Rhadinovirus |
клеток. |
Предполагается, что |
главным |
|||||||||||||||
гомологии |
нуклеотидных |
последова |
резервуаром |
|
вируса |
является |
малая |
|||||||||||||||
тельностей или антигенной кросс-ре |
фракция В-лимфоцитов — покоящие |
|||||||||||||||||||||
активности практически не выявлено. |
ся В-клетки с фенотипом CD19+, |
|||||||||||||||||||||
Представителями |
|
рода |
|
Rhadinovirus |
CD23+ |
, CD80-. Инфицирование В- |
||||||||||||||||
(или γ-2-герпесвирусов) являются гер |
клеток |
|
осуществляется |
через |
взаимо |
|||||||||||||||||
пеевирусы приматов, такие как Her |
действие вирусного оболочечного гли- |
|||||||||||||||||||||
pesvirus |
ateles, |
Herpesvirus |
saimiri |
и |
т. д. |
копротеина |
gp350(gp340)/220 |
с |
рецеп- |
|||||||||||||
20-7908 Д. Г. Заридзе |
305 |
тором для СЗс1-компонента компле мента CR2 (CD21). Идентичные или схожие молекулы были обнаружены и на Т-лимфоцитах, клетках фоллику лярного дендритического ретикулума и, возможно, некоторых эпителиаль ных клетках. Исследования показали, что клеточный тропизм EBV не огра ничен механизмом его взаимодейст вия с CD21, поскольку вирус был об наружен и в CD21-негативных клетках.
Заражение В-клеток EBV in vitro индуцирует их переход от стадии GO к стадии G1 клеточного цикла с после дующим синтезом Д Н К и клеточным делением. Активация вирусом клеточ ного цикла в значительной степени имитирует нормальный антигензависимый путь В-клеточной активации. Инфицированные клетки подвергают ся бласттрансформации с последую щим возникновением иммортализованных лимфобластоидных клеточных линий. Способность трансформиро вать В-клетки in vitro — характерное свойство EBV. В инфицированных клетках синтезируются многочислен ные белки, кодируемые вирусными и клеточными генами.
Начальные события при инфици ровании EBV В-клеток in vivo, вероят но, напоминают таковые in vitro при инфицировании покоящихся В-лим- фоцитов и заключаются в синтезе полного спектра вирусных латентных белков. При этом происходит быстрая поликлональная экспансия пула ин фицированных В-клеток, поскольку эффективный иммунный ответ еще не возник. Кроме того, пролиферация этих клеток in vivo стимулируется дву мя клеточными белками (Bcl-2, А-20), синтез которых усиливается под воз действием латентного мембранного белка LMP-1. Ранняя фаза индуциро ванной вирусом В-клеточной проли ферации тем не менее обрывается на растающим действием Т-клеточного иммунного ответа, что сопровождает ся уничтожением большей части ин фицированных клеток цитотоксическими Т-лимфоцитами. Несмотря на это, пул В-клеток, латентно инфици
рованных EBV, и его репликация в клетках ротоглотки никогда полно стью не элиминируются.
5.5.2. Молекулярногенетическая организация
Геном EBV представляет собой двойную спираль Д Н К длиной около 172 т. п.н. Вирионная Д Н К вируса ли нейна. В латентно-инфицированных клетках Д Н К вируса существует в ос новном во внехромосомной эписомной ковалентно-замкнутой форме, ко торая образуется в результате циркуляризации вирусного генома по его терминальным повторам. При латент ном типе инфекции экспрессируется лишь небольшая популяция кодируе мых EBV белков, а вирусный геном в ядрах инфицированных клеток нахо дится в виде низкокопийных Д Н К - овых эписом. Эписомы EBV реплици руются на ранней стадии S-фазы кле точного цикла под воздействием кле точной ДНК-полимеразы, при этом число эписом может возрастать в те чение нескольких дней после инфи цирования клеток. Обнаружено также, что cis-действующая последователь ность, названная ori-P (точка инициа ции репликации), является важной для репликации и сегрегации эписом EBV. В некоторых случаях, в основ ном в определенных клеточных лини ях ЛБ, вирус включается в клеточный геном, хотя чаще всего остается во внехромосомной форме. В различных клеточных линиях вирусная Д Н К ин тегрирует в разные участки клеточно го генома. Биологическое значение интеграции вирусного генома остается неясным. Высказываются предполо жения, что эписомальная Д Н К необ ходима для литического цикла репли кации EBV, поскольку вирусную про дукцию ,не удавалось наблюдать в клетках, которые содержали только интегрированную Д Н К вируса.
Характерная черта генома EBV — наличие в нем большого числа повто ров, отличающихся в разных штаммах вируса и определяющих полиморфизм
306

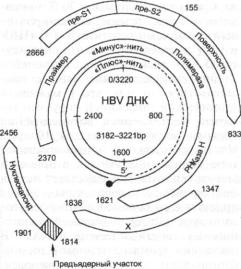
Схема 5.10. Геном вируса Эпштейна—
Барр (Epstein—Вагг virus, EBV) и его экспрессия в латентно инфицированных клетках
ряда кодируемых белков по молеку лярной массе (схема 5.10). Большой внутренний повтор (IR1) разделяет ге ном ВЭБ на короткую (US) и длин ную (UL) уникальные области, кото рые находятся в одной и той же ори ентации относительно друг друга. В UL-области уникальные последова тельности U2 — U 5 чередуются с об ластями внутренних повторов IR2 — IR4, среди которых следует особо от метить гомологичные IR2 и IR4. Для идентификации и изучения индивиду альных генов вируса геном лаборатор ного штамма В95-8, являющегося прототипом EBV, разрезали с помо щью рестриктазы BamH I и получили соответствующие фрагменты рестрик ции, на которых базируется номенк латура открытых рамок считывания (ORFs) этого вируса (схема 5.11).
Представлены большие ДНК-повторы (1-IR4, TR), уникальные области (Ul—U5), а также транскрипты латентной инфекции EBV (EBNA, LMP, EBER, BARFO). EBNA мРНК транскрибируются с промоторных областей, расположенных в IR1 и U1 областях генома. Ori-P — точка начала репликации. Делеционные характеристики В95-8 и P3HR-1 штаммов EBV показаны затемненными блоками (B95DEL и P3DEL соответственно) (no Ro bertson Ε., Kieff Е., 1995)
5.5.3. Продукты вирусных генов
5.5.3.1. Экспрессия генов латентной инфекции
В многочисленных исследованиях показано, что в злокачественных клетках различных EBV-ассоцииро-
Схема 5.11. Рестрикционная карта генома EBV (по Bam-H1) и транскрипты ла
тентной инфекции вируса
W, H, F, Q и т. д. — Bam-ΗI-фрагменты геномной Д Н К EBV. WO — >Y1 — обозначение экзонов области WY повторов.
Объяснения для других аббревиатур, использованных в рисунке, находятся в списке сокра щений и терминов (Epstein—Вагг virus. IARC Monogr. Eval Carcinom Risks. Hum. — 1997. —
P. 70-51). |
|
20* |
307 |
ванных опухолей, в том числе и эпи телиального происхождения, вирус находится в латентном состоянии. Это открытие сразу поставило ряд вопро сов: существует ли взаимосвязь между латентной инфекцией EBV и злокаче ственной трансформацией клеток хо зяина, какие — вирусные и/или кле точные — продукты контролируют статус инфекции, как осуществляется иммунный надзор и какие факторы приводят к реактивации инфекции. К настоящему времени обнаружено 11 генов латентной инфекции EBV: два из них кодируют малые неполиаденированные Р Н К (EBER-1 и EBER-2); шесть генов кодируют ядерные белки (ΕΒΝΑ-1, -2, -ЗА, -ЗВ, -ЗС и -LP) и три — мембранные белки вируса (LMP-1, LMP-2A и LMP-2B).
РНК, кодируемые EBV. Как уже было сказано, в латентно инфициро ванных клетках обнаружены по край ней мере две малые неполиаденированные Р Н К , кодируемые EBV (EBER-1 и EBER-2; EBERs). Количе ство этих Р Н К обычно достигает 107 копий на клетку. Они транскрибиру
ются |
клеточной РНК-полимеразой |
III, |
хотя РНК-полимераза II может |
также принимать участие в их транс крипции. Большинство EBERs лока лизуется в ядре. Их биологическая
роль |
не |
ясна, хотя в литературе на |
этот |
счет |
высказываются различные |
предположения. Согласно одному из них, роль EBERs заключается в сплайсинге первичных транскриптов м Р Н К EBNA и LMP. Эта и другие ги потезы, однако, находятся в противо речии с наблюдением, согласно кото рому экспрессия EBERs происходит уже после экспрессии EBNA и LMP генов, а также начала синтеза Д Н К . В опытах же по трансфекции было по казано, что рекомбинанты EBV, в ко торых EBERs были делетированы, осуществляют инфицирование В-кле- ток и их трансформацию точно так же, как и дикий тип вируса.
Кроме того, в клетках, латентно инфицированных EBV, происходит также синтез РНК, кодируемых дру
гими открытыми рамками считыва ния, например BHRF1, ВатH1 А и BARF0. По-видимому, эти продукты не играют существенной роли в инду цированной вирусом трансформации и выполняют какие-то вспомогатель ные функции.
Ядерные белки EBV. Гены, коди рующие группу ядерных белков EBV (EBNAs), транскрибируются клеточ ной РНК-полимеразой II с образова нием единой м Р Н К длиной около 100 т. п.н. Эта транскрипционная единица начинается от двух вирусных промо торов, расположенных в областях ВатH1 С и ВатH1 W вирусного гено ма (Ср, Wp соответственно). Общий
предшественник |
м Р Н К претерпевает |
|
сплайсинг |
с использованием альтер |
|
нативных |
сайтов |
полиаденилирова- |
ния. |
|
|
EBNA-LP — белок, который коди руется геном, расположенным в об ластях BamH1 С, BamH1 W и BamH1 Υ вирусного генома. Размер EBNA-LP у разных вирусных изолятов варьирует благодаря изменяющемуся числу внутренних повторов (IR1), которые содержат W1 и W2 экзоны EBNA-LP. Этот белок фосфорилирован, вероят но, по сериновым остаткам, располо женным в экзоне W2 недалеко от мес та фосфорилирования казеинкиназы II. Транзиторная трансфекция EBNALP и EBNA-2 в первичные В-лимфо- циты, ко-стимулированные gp350, по казала, что оба белка, кооперируя ме жду собой, способствуют прохожде нию В-клетками GO и G1 фаз клеточ ного цикла, что подтверждалось ин дукцией циклина D-2. Механизм это го феномена остается пока не ясным. В целом же можно, по-видимому, предположить, что EBNA-LP необхо дим для трансформации В-лимфоци- тов, поскольку предполагается, что он вовлечен в регуляцию аутокринных факторов, необходимых для роста В- клеток. Показана ассоциация EBNALP in vivo и in vitro с белками теплово го шока.
EBNA-1 — единственный белок из группы ядерных белков EBV, который
308
связывается с хромосомами в период |
нально |
EBNA-2 выполняет роль |
|||
митоза, а определенная часть его так |
транс-активатора вирусных генов, |
||||
же связывается с ядерным матриксом. |
включая LMP-1, LMP-2A, LMP-2B и |
||||
Этот белок (мол. масса 68—88 кДа) |
вирусный промотор Ср, а также кле |
||||
кодируется областью ВатH1 К вирус |
точных генов: он индуцирует экспрес |
||||
ного генома. Его молекулярная масса |
сию поверхностных В-клеточных мар |
||||
непостоянна и зависит от молекуляр |
керов, таких как CD23, CD21, и кле |
||||
ной массы сополимерного глицин- |
точных протоонкогенов c-fgr и с-тус. |
||||
аланинового |
участка |
молекулы. |
EBNA-1 может действовать и как ре- |
||
EBNA-1, по-видимому, |
необходим |
прессор, эффективно подавляя, напри |
|||
для репликации и стабильного сохра |
мер, экспрессию IgM. Две большие де |
||||
нения эписомного вирусного генома в |
лении участков между кодонами 112— |
||||
латентно инфицированных |
клетках. |
230 и 463—483 снижают трансформи |
|||
Кроме того, этот белок может высту |
рующую и транс-активирующую ак |
||||
пать в роли |
транс-активатора |
транс |
тивность этого белка. Делеция же оли- |
||
крипции генов латентного цикла EBV. |
гомера Arg-Gly в участке 337—357 при |
||||
EBNA-1 — единственный |
белок из |
водит |
к снижению трансформирую |
||
группы |
EBNA, |
который |
продолжает |
щей активности EBNA-1 на 90 %, но |
|||||||||||
обнаруживаться |
во |
время |
литической |
усилению транс-активации промотора |
|||||||||||
инфекции. |
Предполагается, |
что |
LMP-1 по крайней мере в 10 раз. |
|
|||||||||||
EBNA-1 не обладает ферментативной |
EBNA-3 — семейство белков |
||||||||||||||
активностью, а его влияние опосреду |
(EBNA-3А, -ЗВ, -ЗС), кодируемых |
||||||||||||||
ется |
взаимодействием с клеточными |
тремя различными тандемно располо |
|||||||||||||
факторами. |
Экспрессия |
EBNA-1 в |
женными генами области ВатШ Ε |
||||||||||||
В-клетках трансгенных мышей приво |
вирусного |
генома. Они локализуются |
|||||||||||||
дит к развитию В-клеточной лимфо- |
в ядерном матриксе, хроматине и ци- |
||||||||||||||
мы, что свидетельствует об онкоген- |
топлазматических фракциях, но отсут |
||||||||||||||
ности этого белка in vivo. Хотя белок |
ствуют в ядрышках. Их мол. масса ко |
||||||||||||||
EBNA-1 обнаруживают в клетках всех |
леблется от 141 до 163 кДа. Благодаря |
||||||||||||||
EBV-ассоциированных опухолей и |
сходству структурной |
организации |
и |
||||||||||||
имеется ряд сообщений о его онко- |
аминокислотного |
состава |
эти |
белки, |
|||||||||||
генном |
потенциале, |
стимулированная |
вероятно, |
выполняют |
одинаковую |
||||||||||
экспрессия одного только EBNA-1 в |
роль при латентной инфекции и |
||||||||||||||
EBV-негативных, |
|
нетуморогенных, |
трансформации. Было показано, что |
||||||||||||
клетках линии Akata не приводила к |
EBNA-3C |
усиливает |
|
экспрессию |
|||||||||||
восстановлению |
их |
злокачественных |
м Р Н К CD21 в трансфицированных |
||||||||||||
свойств. |
|
|
|
|
|
|
клетках ЛБ и экспрессию LMP-1 в |
||||||||
EBNA-2 — белок с мол. массой 85 |
клетках линии Raji. В то же время |
||||||||||||||
кДа; кодируется в областях ВатШ Υ и |
экспрессия EBNA-3B коррелирует с |
||||||||||||||
Η вирусного генома, который транс |
активацией |
виментина |
и |
экспрессией |
|||||||||||
крибируется с промоторов Ср или Wp |
клеточного антигена CD40, с одной |
||||||||||||||
с образованием бицистронной мРНК . |
стороны, а также подавлением экс |
||||||||||||||
Этот белок локализуется в больших |
прессии антигена CD77 — с другой. |
||||||||||||||
гранулах ядра и связывается с нуклео- |
Опыты |
с |
рекомбинантными |
вирус |
|||||||||||
плазматическим |
хроматином и фрак |
ными |
мутантами |
свидетельствуют |
о |
||||||||||
циями ядерного матрикса. EBNA-2, |
том, что EBNA-ЗА и EBNA-3C важ |
||||||||||||||
по-видимому, принимает непосредст |
ны для EBV-индуцированной клеточ |
||||||||||||||
венное участие в трансформации кле |
ной трансформации В-лимфоцитов. |
||||||||||||||
ток, |
инфицированных |
EBV. |
Так, |
EBNA-3A, |
-ЗВ и -ЗС подавляют |
||||||||||
штамм вируса P3HR1 с делецией |
ΕΒΝΑ-2-опосредованную трансакти |
||||||||||||||
фрагмента |
Д Н К , |
включающего |
ген |
вацию LMP-2A. EBNA-ЗА способен |
|||||||||||
EBNA-2, теряет способность к транс |
также предотвращать Jk-опосредован- |
||||||||||||||
формации |
В-лимфоцитов. |
Функцио |
ную транскрипцию. |
|
|
|
|
||||||||
309
По современной классификации все выделенные изоляты EBV могут быть отнесены к 1-му (А) или 2-му
(В) типу (EBV-1 и EBV-2 соответст венно) на основании их различий в областях BamH1 WYH и HindIII Ε ви русного генома. Изоляты EBV-1 обла дают более выраженной способностью трансформировать В-лимфоциты по сравнению с изолятами EBV-2. Кроме того, белки ΕΒΝΑ-2, кодируемые ви русными изолятами 1-го и 2-го типов, различаются по своим антигенным де терминантам, что позволяет различать их серологически. В мире первый тип вируса наиболее распространен, в то время как второй тип вируса больше распространен у лиц африканского происхождения.
Латентные мембранные белки. LMP-1 — латентный мембранный бе лок EBV (мол. масса 58—63 кДа), ко дируется геном с тремя различными рамками считывания в области ВатН1 N вирусного генома. Уровень его син теза в латентно инфицированных клетках выше уровня синтеза других
белков |
латентного цикла EBV. Ν- и |
С-концевые участки LMP-1 локализо |
|
ваны |
на внутриклеточной стороне |
мембраны. Кроме того, белок состоит из 6 трансмембранных доменов, в пределах которых рассеяны короткие гидрофильные аминокислотные по следовательности. По крайней мере половина количества LMP-1 связана с цитоскелетом. Подобно ΕΒΝΑ-1, LMP-1 также транскрибируется во время литической инфекции. LMP-1 существенно изменяет рост EBV-нега- тивных В-лимфобластов и индуцирует множество изменений, которые обыч но ассоциируются с инфекцией EBV первичных В-клеток. Кроме того, LMP-1 усиливает продукцию опреде ленных цитокинов, таких, например, как IL-10, повышающих В-клеточную активность. В опытах по трансфекции единичного гена обнаружено, что LMP-1 обладает трансформирующими свойствами. Так, при трансфекции ге на LMP-1 в иммортализованные фибробласты грызунов наступала злокаче
ственная трансформации клеток, под тверждаемая в опытах in vitro и in vivo. Рекомбинантные варианты EBV, в ко торых отсутствовал LMP - 1, не были способны трансформировать В-клетки.
Иммортализация клеток с помо щью EBV, как известно, зависит от постоянного контроля клетки за про цессами, регулирующими ее деление и апоптоз, и связана с функциями р53. При исследовании взаимоотно шений между латентными белками EBV и р53 обнаружено, что на 4—5-й день после инфицирования вирусом находящихся в покое очищенных В- клеток содержание в них р53 дикого типа увеличивается приблизительно в 10 раз. Вместе с тем в иммортализованных EBV В-клетках обнаружена экспрессия семейства белков, контро лирующих апоптоз, при этом рези стентность к апоптозу коррелировала с экспрессией Вс1-2 и А20, блокирую щих р53-индуцированную гибель кле ток. Экспрессия А20, как и р53, может регулироваться транскрипционным фактором NF-kB, активируемым, как известно, белком LMP -1 . Количест венные исследования показали, что во время протекания инфекции сущест вует прямая, хотя и временная, зави симость между уровнями белка LMP -
1и активностью NF-kB. Обнаружено также, что антиапоптотический эф фект EBV ассоциирован с высоким уровнем экспрессии Вс1-2 и EBV-за- висимым снижением устойчиво ста бильных уровней белка с-тус. За держки клеток в фазе G1 в результате нарушения регуляции экспрессии Bcl-
2при этом не происходит, т. е. LMP-1 не влияет на индукцию и функцию WAFl/p21, являющегося универсаль ным ингибитором циклинзависимых киназ. Приведенные выше и убеди тельные данные многих других иссле дований, свидетельствующие о транс формирующих потенциях LMP - 1, по зволили отнести этот ген к числу ви русных онкогенов.
LMP-2. Уникальная особенность генов LMP-2 (А и В) заключается в том, что транскрипционные единицы
310
для обоих белков образуются в резуль |
фекция |
может |
быть |
|
индуцирована |
|||||||||||||||||||
тате |
циркулизации |
вирусного |
генома |
экспериментально |
в латентно |
инфи |
||||||||||||||||||
(т. е. образования эписомы) в резуль |
цированных клеточных линиях с по |
|||||||||||||||||||||||
тате |
самолигирования |
линейной |
мо |
мощью химических индукторов, |
таких |
|||||||||||||||||||
лекулы Д Н К по ее терминальным по |
как ТРА или бутират Na. При этом |
|||||||||||||||||||||||
вторам. LMP-2A (54 кДа) и LMP-2B |
репликация вируса может быть ини |
|||||||||||||||||||||||
(40 кДа) имеют сходную молекулярно- |
циирована не более чем у 5—10 % |
|||||||||||||||||||||||
генетическую |
организацию |
и |
включа |
клеток. |
Другой |
способ |
индуцировать |
|||||||||||||||||
ют в свой состав 8 общих экзонов, ко |
вирусную репликацию состоит в су |
|||||||||||||||||||||||
дируемых US-областью вирусного ге |
перинфекции клеток линии Raji де |
|||||||||||||||||||||||
нома. Несмотря на высокую гомоло |
фектным штаммом EBV (P3HR-1). |
|||||||||||||||||||||||
гию, м Р Н К LMP-2A и LMP-2B транс |
Клетки, |
ставшие |
пермиссивными для |
|||||||||||||||||||||
крибируются |
с |
разных |
промоторных |
вирусной |
репликации, |
подвергаются |
||||||||||||||||||
областей. В цитоплазматической мем |
цитоплазматическим изменениям, ти |
|||||||||||||||||||||||
бране ВЭБ-инфицированных В-лим- |
пичным для герпес-вирусов, включая |
|||||||||||||||||||||||
фоцитов LMP-2A локализован вместе |
окаймление ядерного хроматина, |
син |
||||||||||||||||||||||
с LMP-1. Белок LMP-2A связан с ти- |
тез вирусной Д Н К , сборку нуклеокап- |
|||||||||||||||||||||||
розиновыми киназами семейства src и |
сидов, одевание вируса в оболочку пу |
|||||||||||||||||||||||
является субстратом для них; по-ви |
тем |
почкования |
|
через |
внутреннюю |
|||||||||||||||||||
димому, он участвует в процессе ви- |
мембрану и ингибирование макромо- |
|||||||||||||||||||||||
русиндуцированной |
клеточной транс |
лекулярного синтеза клетки |
хозяина. |
|||||||||||||||||||||
формации. Опыты |
с |
использованием |
Предранние гены. Как уже |
было |
||||||||||||||||||||
рекомбинантных |
EBV-мутантов, |
со |
||||||||||||||||||||||
отмечено ранее, |
EBV в |
В-лимфоцитах |
||||||||||||||||||||||
держащих |
полноразмерный |
LMP-2A |
||||||||||||||||||||||
инфицированного |
им |
человека |
уста |
|||||||||||||||||||||
либо |
отдельные |
его |
фрагменты, |
не |
||||||||||||||||||||
навливает |
персистируюший |
тип |
ин |
|||||||||||||||||||||
подтвердили, |
однако, |
этого предполо |
||||||||||||||||||||||
фекции |
и |
остается в |
латентном |
со |
||||||||||||||||||||
жения. |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
стоянии в течение всей жизни хозяи |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
В |
заключение |
следует |
отметить, |
на. Механизмы, лежащие в основе |
||||||||||||||||||||
что при латентной инфекции большая |
поддержания латенции EBV и пере |
|||||||||||||||||||||||
часть генома EBV постепенно подвер |
ключения транскрипции его генов на |
|||||||||||||||||||||||
гается метилированию, в то время как |
литический цикл, изучались в послед |
|||||||||||||||||||||||
регуляторные |
домены, |
участвующие |
в |
ние годы довольно интенсивно. В ча |
||||||||||||||||||||
поддержании |
латентной |
|
инфекции, |
стности, |
|
обнаружены |
|
три |
вирусных |
|||||||||||||||
например ori-P, оказываются более |
гена (BZLF1, BRLF1 и BFLF4), коди |
|||||||||||||||||||||||
резистентными к метилированию. Об |
руемые белки которых являются мощ |
|||||||||||||||||||||||
ширное метилирование |
участков |
ге |
ными транс-активаторами экспрессии |
|||||||||||||||||||||
нома, "молчащих" при латентной ин |
ранних вирусных генов. Белок, коди |
|||||||||||||||||||||||
фекции, |
может |
способствовать |
под |
руемый |
BZLF1, |
назван |
ZEBRA, |
или |
||||||||||||||||
держанию латенции благодаря инги- |
Ζ-белком. Белок, кодируемый BRLF1, |
|||||||||||||||||||||||
бированию экспрессии генов литиче- |
назван R-транс-aктивaтopoм, или R- |
|||||||||||||||||||||||
ского цикла инфекции. Обработка ла |
белком. Показано, что оба белка мо |
|||||||||||||||||||||||
тентно инфицированных |
клеток |
пре |
гут |
взаимно |
стимулировать |
экспрес |
||||||||||||||||||
паратами, |
снижающими |
метилирова |
сию друг друга и синергически акти |
|||||||||||||||||||||
ние ДНК, увеличивает число клеток, |
вировать |
|
промоторы |
некоторых |
ви |
|||||||||||||||||||
входящих в продуктивный цикл. |
|
|
русных генов, включая BHRF1, коди |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
рующий |
|
EBV-гомолог bcl-2, |
и |
|||||||||
5.5.3.2. Гены продуктивного |
|
BMRF1, кодирующий фактор процес- |
||||||||||||||||||||||
|
синга Д Н К |
полимеразы. |
Известно |
|||||||||||||||||||||
цикла инфекции |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
также, что м Р Н К BZLF1 сплайсирует- |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Известно, |
что |
лишь |
небольшая |
ся и состоит из 3 экзонов: первый эк- |
||||||||||||||||||||
зон |
включает |
транс-активирующий |
||||||||||||||||||||||
фракция |
латентно |
инфицированных |
||||||||||||||||||||||
домен, |
второй |
— |
включает |
домен, |
||||||||||||||||||||
В-лимфоцитов спонтанно |
входит |
в |
||||||||||||||||||||||
имеющий |
гомологию |
с |
консерватив- |
|||||||||||||||||||||
продуктивный |
цикл. Литическая |
ин |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
311
ной областью модуляторов транс |
сом и рецептором CD21 В-лимфоци |
||||||||||||||||||
крипции семейства c-jun/c-fos и обла |
тов и являющийся основной мише |
||||||||||||||||||
дающий |
способностью |
взаимодейст |
нью для нейтрализующих EBV-специ- |
||||||||||||||||
вовать с AP1-подобными |
участками |
фических |
антител; |
gpll0 |
|
(ORF |
|||||||||||||
на ДНК; третий экзон кодирует до |
BALF4) — один из наиболее обильно |
||||||||||||||||||
мен, необходимый |
для |
взаимодейст |
представленных |
белков EBV, |
локали |
||||||||||||||
вия Ζ-белка с р53. Чрезмерная экс |
зующийся на внутренней и внешней |
||||||||||||||||||
прессия р53 |
ингибирует |
способность |
ядерных мембранах литически инфи |
||||||||||||||||
Ζ-белка нарушать латентное состоя |
цированных клеток; |
gp85 |
|
(ORF |
|||||||||||||||
ние вируса. Таким образом, прямое |
BXLF2) |
представляет |
собой |
|
относи |
||||||||||||||
взаимодействие между Ζ-белком и р53 |
тельно |
минорный |
вирусный |
компо |
|||||||||||||||
может играть важную роль в регуля |
нент, |
который |
выполняет |
|
важную |
||||||||||||||
ции переключения латенции на лити- |
роль в процессе слияния вируса с кле |
||||||||||||||||||
ческую инфекцию. |
|
|
|
|
|
|
точными мембранами. В процессе |
||||||||||||
Ранние |
гены |
транскрибируются |
проникновения вируса в клетку участ |
||||||||||||||||
при индукции литического цикла в |
вуют два других гликопротеина — |
||||||||||||||||||
присутствии |
ингибиторов |
синтеза |
gp25 и gp42 (ORF BZLF2), которые |
||||||||||||||||
Д Н К . На основании этого критерия |
формируют 3-компонентный ком |
||||||||||||||||||
по крайней мере 30 м Р Н К EBV пред |
плекс с gp85. Среди поздних генов |
||||||||||||||||||
ставляют собой продукты ранних ге |
привлекают к себе внимание гены |
||||||||||||||||||
нов. Среди белков с изученными |
BCRF1 и BHRF1 . Первый локализует |
||||||||||||||||||
функциями следует назвать белок, ко |
ся в середине регуляторного домена |
||||||||||||||||||
дируемый O R F BHRF1, имеющий вы |
EBNA между ori-P и Ср и является |
||||||||||||||||||
раженную |
гомологию |
с |
|
клеточным |
близким гомологом гена IL-10 челове |
||||||||||||||
онкогеном bcl-2, обладающий, как из |
ка. Продукт этого гена оказывает не |
||||||||||||||||||
вестно, антиапоптотическим действи |
гативное |
воздействие |
на |
функции |
|||||||||||||||
ем. Известен также ряд ранних генов, |
макрофагов и клеток NK и ингибиру |
||||||||||||||||||
продукты которых связаны с реплика |
ет продукцию IF-гамма. Второй ген, обо |
||||||||||||||||||
цией Д Н К и размещенных в длинном |
значенный также v-bcl-2, является ви |
||||||||||||||||||
уникальном домене Д Н К EBV. К ним |
русным |
|
гомологом |
клеточного |
гена |
||||||||||||||
относятся |
гены, |
кодирующие |
Д Н К |
bcl-2, функция кодируемого белка ко |
|||||||||||||||
полимеразу |
(BALF5), |
мажорный |
бе |
торого состоит в предохранении инфи |
|||||||||||||||
лок, связывающийся с Д Н К (BALF2), |
цированных вирусом клеток от апопто- |
||||||||||||||||||
рибонуклеотидредуктазу |
|
(BORF2 |
и |
за. Недавно в геноме EBV была иден |
|||||||||||||||
BARF1), |
тимидинкиназу |
(BXLF1) |
и |
тифицирована и охарактеризована но |
|||||||||||||||
некоторые другие. |
|
|
|
|
|
|
|
вая ORF — BALF1, имеющая, как ока |
|||||||||||
Поздние гены. Среди негликозили- |
залось, |
существенное |
сходство |
после |
|||||||||||||||
довательностей с клеточным |
bcl-2 |
и его |
|||||||||||||||||
рованных |
белков |
позднего |
цикла ин |
||||||||||||||||
вирусным |
гомологом |
(v-bcl-2). |
Транс- |
||||||||||||||||
фекции |
можно |
назвать |
мажорный |
||||||||||||||||
фекция клеток к Д Н К BALF1, как ока |
|||||||||||||||||||
нуклеокапсидный |
белок, |
кодируемый |
|||||||||||||||||
залось, |
обеспечивает |
апоптотическую |
|||||||||||||||||
ORF cLF1, |
мажорный |
внешний |
не- |
||||||||||||||||
резистентность. Эти |
результаты свиде |
||||||||||||||||||
гликозилированный |
белок |
вириона |
|||||||||||||||||
тельствуют о том, что EBV кодирует и |
|||||||||||||||||||
(ORF NRF1) и основной белок вирус |
|||||||||||||||||||
второй функциональный v-bcl-2. |
|
||||||||||||||||||
ного ядра (ORF BXRF1). Структур |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
ный капсидный белок, VCA р18, ко |
|
|
|
|
|
|
|
|
|
||||||||||
дируется O R F BFRF3. У человека этот |
5.5.4. |
Дифференциальная |
|||||||||||||||||
белок высокоиммуногенен. |
|
|
|
||||||||||||||||
|
|
|
экспрессия генов EBV |
|
|
||||||||||||||
Среди гликопротеинов EBV в на |
|
|
|||||||||||||||||
в латентно |
|
|
|
|
|
||||||||||||||
стоящее время известны |
следующие: |
инфицированных |
клетках |
||||||||||||||||
gp350/220 (кодируемый ORF BLLF1) — |
|
|
|
|
|
|
|
|
|
||||||||||
доминантный наружный |
белок вирус |
Различают три различных варианта |
|||||||||||||||||
ных частиц, выступающий в качестве |
экспрессии вирусных генов в клетках, |
||||||||||||||||||
"соединительного |
звена" |
между |
виру |
латентно |
инфицированных |
|
in |
vivo |
|||||||||||
312
EBV. Первый тип латентности (под разделяемый по уровню экспрессии еще на 3 группы), как правило, огра ничен экспрессией лишь EBER-1, -2 и EBNA-1. Экспрессия же других ге нов латентного цикла EBV существен но подавлена. Серийные пассажи та ких клеток in vitro сопровождаются расширением спектра экспрессии ви русных генов вплоть до появления фенотипических характеристик, свой ственных клеткам латентности типа III. При втором типе латентности спектр экспрессирующихся генов рас ширяется и к уже перечисленным вы ше генам в определенном проценте
случаев |
добавляется |
экспрессия |
LMP-I, |
-2А, -2В и |
продукт O R F |
BARF0. |
Экспрессия же всех латент |
|
ных вирусных генов, обнаруживаемая, например, в лимфобластоидных кле точных линиях (ЛКЛ) in vitro, а также клетках больных ИМ in vivo, расцени вается как латентность типа III.
5.5.5. Экспрессия вирусных генов
при EBV-ассоциированных заболеваниях человека
Спектр патологических процессов у человека, в возникновении которых, как полагают, участвует EBV, посто янно расширяется. Гены EBV экспрессированы при целом ряде как доброкачественных, так и злокачест венных лимфопролиферативных забо леваний, таких как инфекционный мононуклеоз, лимфома Беркитта, не которые гистологические варианты болезни Ходжкина (лимфогранулема тоза), определенные формы Т-клеточ- ных и В-клеточных лимфом и др. Кроме того, EBV ассоциирован и с за болеваниями, патогенез которых свя зан с малигнизацией эпителиальных клеток. К числу последних относят недифференцированный рак носо глотки, определенные гистологиче ские варианты рака желудка, слюнных и околоушных желез, а также ряд дру гих эпителиальных опухолей.
Лимфома Беркитта (ЛБ). Для Л Б
характерен тип I латентности с экс прессией только EBERs и EBNA-1. Лишь в редких опухолевых клетках наблюдают экспрессию других вирус ных генов (EBNA-2, LMP-1 и BZLF1), и еще реже клетки ЛБ могли входить в литический цикл.
Болезнь Ходжкина (БХ). При БХ (тип II латентности) показана экс прессия EBNA-1, поддерживающего вирус в эписомальном состоянии, LMP-1, индуцирующего экспрессию каскада маркеров, активирующих клетки, а также LMP-2A, блокирую щего индукцию литического цикла инфекции и усиливающего эффект трансформации.
Другие неходжкинские лимфомы.
Для относительно небольшой части лимфом характерен тип III латентно сти, в то время как для мономорфных опухолей экспрессия латентных бел ков EBV могла быть ограничена I или II типом. Кроме того, обнаружены опухоли, клетки которых экспрессировали EBNA-2 при отсутствии LMP-1, как это имеет место при ин фекционном мононуклеозе. Одна из форм СПИД-ассоциированных НХЛ, встречающаяся у больных с выражен ной иммуносупрессией, — диффузная крупноклеточная лимфома — являет ся, как правило, EBV-позитивной злокачественной опухолью и характе ризуется типом II или III латентности.
Рак носоглотки (РНГ). Анализ экс прессии латентных генов EBV пока зал, что для опухолевых клеток РНГ характерен тип II латентности. В част ности, обнаружена постоянная экс прессия генов BARFO, EBERs, LMP-1 и EBNA-1, в то время как EBNA-2, - ЗА, -ЗВ, -ЗС и -LP не экспрессируются. Экспрессия LMP-1 не всегда опре деляется во всех опухолевых клетках и исследуемых опухолях.
Рак желудка (РЖ). Анализ экс прессии латентных генов EBV в опу холевых клетках показал, что EBERs и EBNA-1 экспрессируются постоянно, но экспрессию EBNA-2 и LMP-1 об наружить не удается. Кроме того, по казана экспрессия LMP-2A и BZLF1.
313
Таким образом, тип латентности EBV |
|
рогенеза, |
ассоциированного |
с |
вирусом |
|||||||||||||||||||||||||||
при РЖ |
ближе |
к ЛБ |
(I), |
чем |
к |
РНГ |
|
Эпштейна—Барр // Мол. биол. — |
||||||||||||||||||||||||
(II), но с дополнительной экспресси |
|
1998. - |
Т. 32, № 6. |
- |
С. |
940-947. |
|
|
||||||||||||||||||||||||
Advances |
in |
Viral Oncology. Analysis of multi- |
||||||||||||||||||||||||||||||
ей |
LMP-2A. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
step |
scenarios |
in |
the natural |
history of hu |
|||||||||||||||
|
Т-клеточные лимфомы и другие но |
|
||||||||||||||||||||||||||||||
|
|
man and animal |
cancer / Ed. G. Klein // |
|||||||||||||||||||||||||||||
вообразования. В дополнение к опреде |
|
|||||||||||||||||||||||||||||||
|
Raven |
Press |
Books, |
Ltd. |
— |
1987. |
— |
|||||||||||||||||||||||||
ленной |
части |
EBV-ассоциированных |
|
|||||||||||||||||||||||||||||
|
Vol. 7. - P. 1-211. |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
Т-клеточных лимфом, встречающихся |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
Epstein—Ban virus. IARC |
Monogr. Eval. Car- |
|||||||||||||||||||||||||||||||
преимущественно среди |
населения |
ев |
|
cinog. Risks Hum. — 1997. — Vol. 70. - |
||||||||||||||||||||||||||||
ропейских |
стран, |
описаны |
также |
ан- |
|
P. 47 - 373 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
гиоцентрические |
синоназальные |
Т- |
Griffin В. E., Xue S. A. Epstein—Barr virus in |
|||||||||||||||||||||||||||||
|
fections |
and their association with human |
||||||||||||||||||||||||||||||
клеточные |
лимфомы |
среди |
|
азиатских |
|
|||||||||||||||||||||||||||
|
|
malignancies: some key |
questions |
// |
Ann |
|||||||||||||||||||||||||||
популяций. |
Роль |
вируса |
в |
патогенезе |
|
|||||||||||||||||||||||||||
|
Med. |
- |
1998. |
- |
Vol. 30, |
N 3. |
- |
|||||||||||||||||||||||||
этих |
опухолей |
не |
|
ясна, |
однако |
кло- |
|
|||||||||||||||||||||||||
|
|
P. 249 -59. Review. |
|
|
|
|
|
|
|
|
||||||||||||||||||||||
нальная природа генома EBV и его об |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
Kieff E. Current perspectives on the |
molecular |
|||||||||||||||||||||||||||||||
наружение в опухолевых клетках пред |
||||||||||||||||||||||||||||||||
|
pathogenesis of virus-induced cancers in |
|||||||||||||||||||||||||||||||
полагают участие вируса в канцероге |
|
human |
immunodeficiency |
virus |
infection |
|||||||||||||||||||||||||||
незе. Частая экспрессия гена LMP-1 в |
|
and acquired |
immunodeficiency syndrome |
|||||||||||||||||||||||||||||
Т-клеточных |
лимфомах |
как |
|
будто |
бы |
|
// J. Natl. Cancer Inst. Monogr. — 1998. |
|||||||||||||||||||||||||
подтверждает |
эту гипотезу. |
|
|
|
|
|
|
- Vol. |
23. - |
P. 7 - 1 4 . |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
Klein E. The complexity of the |
Epstein—Barr |
||||||||||||||||||||||||||
|
Таким образом, |
несмотря на мно |
||||||||||||||||||||||||||||||
|
|
virus |
infection |
in |
humans |
// Pathol. On |
||||||||||||||||||||||||||
голетнее |
изучение |
ассоциации |
EBV с |
|
||||||||||||||||||||||||||||
|
col. Res. - 1998. - Vol. 4, N 1. - P. 3. |
|||||||||||||||||||||||||||||||
некоторыми |
злокачественными |
забо |
|
|||||||||||||||||||||||||||||
Lyons S. |
F., Liebowitz D. N. |
The role of hu |
||||||||||||||||||||||||||||||
леваниями человека, вопрос о роли |
||||||||||||||||||||||||||||||||
|
man viruses in the pathogenesis of lym |
|||||||||||||||||||||||||||||||
вируса в их возникновении смыкается |
|
phoma: Seminars in Oncology. — 1998. — |
||||||||||||||||||||||||||||||
с |
исследованиями |
|
фундаментальной |
|
Vol. 25, N 4. - P. 461 - 475 . |
|
|
|
|
|||||||||||||||||||||||
проблемы взаимоотношения |
вируса и |
Niedobitek |
G., |
Young L. S., |
Herbst |
H. |
Ep |
|||||||||||||||||||||||||
клеток-мишеней |
— |
главным |
образом |
|
stein—Barr |
virus |
infection |
and |
the patho |
|||||||||||||||||||||||
|
genesis of malignant lymphomas // Cancer |
|||||||||||||||||||||||||||||||
В-лимфоцитов |
и |
эпителиальных |
кле |
|
||||||||||||||||||||||||||||
|
Surv. - |
1997. |
- |
Vol. |
30. |
- |
P. |
143-162. |
||||||||||||||||||||||||
ток. Доказательства |
возможного |
|
уча |
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
стия EBV в этиопатогенезе злокачест |
|
5.6. Вирус герпеса человека |
||||||||||||||||||||||||||||||
венных |
новобразований |
базируются, |
|
|||||||||||||||||||||||||||||
как правило, на обнаружении вирус |
|
8-го типа (HHV-8) |
|
|
|
|
|
|
|
|||||||||||||||||||||||
ного |
генома |
в |
трансформированных |
|
В. Э. Гурцевич |
|
|
|
|
|
|
|
|
|||||||||||||||||||
клетках, |
установлении |
моноклональ- |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
ности |
вируса |
и |
характеристике |
спек |
|
Впервые вирус обнаружен |
в |
1994 г. |
||||||||||||||||||||||||
тра синтезируемых им белков, |
а также |
|
||||||||||||||||||||||||||||||
в |
виде чужеродных Д Н К , |
выделенных |
||||||||||||||||||||||||||||||
на изучении вирусспецифического гу |
||||||||||||||||||||||||||||||||
из |
кожных |
поражений |
больного |
СК, |
||||||||||||||||||||||||||||
морального |
ответа. |
|
Учитывая |
|
тот |
|||||||||||||||||||||||||||
|
|
возникшей на фоне СПИДа, что по |
||||||||||||||||||||||||||||||
факт, |
что |
число |
заболеваний, |
в |
|
воз |
||||||||||||||||||||||||||
|
служило |
основой для |
его |
исходного |
||||||||||||||||||||||||||||
никновении |
которых EBV принимает |
|||||||||||||||||||||||||||||||
названия |
— |
"герпесвирус, |
ассоцииро |
|||||||||||||||||||||||||||||
участие, постоянно растет, понимание |
||||||||||||||||||||||||||||||||
ванный с СК (KSHV)". Последующие |
||||||||||||||||||||||||||||||||
стратегии вируса in |
vivo |
и механизмов, |
||||||||||||||||||||||||||||||
эпидемиологические |
и |
молекулярно- |
||||||||||||||||||||||||||||||
контролирующих |
статус |
инфекции в |
||||||||||||||||||||||||||||||
биологические |
исследования |
подтвер |
||||||||||||||||||||||||||||||
организме, |
|
представляется |
|
важным |
||||||||||||||||||||||||||||
|
|
дили выраженную ассоциацию |
между |
|||||||||||||||||||||||||||||
для |
разработки |
эффективных |
|
мер |
||||||||||||||||||||||||||||
|
вирусом и различными формами |
СК. |
||||||||||||||||||||||||||||||
борьбы и профилактики заболеваний, |
||||||||||||||||||||||||||||||||
В дальнейшем была выявлена тесная |
||||||||||||||||||||||||||||||||
ассоциированных с этим вирусом. |
|
|||||||||||||||||||||||||||||||
|
связь между вирусом и PEL или |
|||||||||||||||||||||||||||||||
Рекомендуемая литература |
|
|
|
|
|
|
BCBL, а также некоторыми случаями |
|||||||||||||||||||||||||
|
|
|
|
|
|
мультицентрической |
болезни |
Кас- |
||||||||||||||||||||||||
Афанасьева |
Т. Α., |
Гурцевич |
В. Э. |
Молеку- |
тельмана (MCD) . Анализ полученного |
|||||||||||||||||||||||||||
полного |
аминокислотного |
сиквенса |
||||||||||||||||||||||||||||||
|
лярно-биологические |
аспекты |
канце |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
314
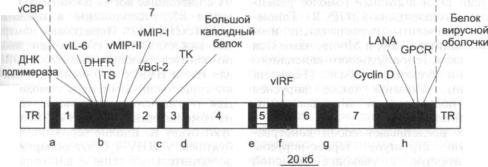
KSHV позволил отнести его к подсе мейству гамма (γ) герпесвирусов, роду радиновирусов (Rhadinovirus), 8-му ти пу, на основании чего он был обозна чен как HHV-8 (Human Herpesvirus type 8). При этом было отмечено, что
HHV-8 содержит |
последовательно |
|
сти, |
гомологичные |
двум известным |
онкогенным герпесвирусам — HVS и |
||
EBV, а также последовательностям ге |
||
нов |
человека, осуществляющих кон |
|
троль за пролиферацией клеток. При водимые в настоящем обзоре данные, хотя и ограниченные, указывают на возможную этиологическую роль HHV-8 в возникновении СК и, воз можно, некоторых других неоплазий.
5.6.1 Морфология
имолекулярно-генетическая организация
HHV-8 по своим морфологическим характеристикам является типичным представителем подсемейства γ-гер- песвирусов с размером вирусных час тиц примерно 110 нм. Они имеют электронно-плотное ядро и окружены липидной оболочкой. Нуклеокапсиды с оптически плотным ядром обнару живаются в ядрах инфицированных лимфомных клеток, в то время как зрелые, содержащие оболочку вирионы размером 140 нм, — в их цито плазме. Подобные частицы наблюда
ли и в биоптатах опухолей больных СК, где они локализовались в единич ных клетках веретенообразной морфо логии, представляющих собой опухо левые клетки эндотелиального проис хождения. Полагают, что, подобно другим герпесвирусам, HHV-8 в ла тентно инфицированных клетках реп лицируются в виде циркулярной кова- лентно-замкнутой эписомы и приоб ретают линейную геномную форму во время литического репликативного цикла. Размер и структура генома HHV-8 очень схожи с таковыми HVS: L U R размером 140,5 т. п.н., содержа щая все кодирующие области, флан кируется двумя TR варьирующей дли ны. Последние состоят из повторяю щихся функциональных единиц с вы соким соотношением G:C (84,5 %) и размером ~ 800 пар нуклеотидов. Об щая длина вирусного генома состав ляет примерно 165 кб (схема 5.12).
Линейный вирусный геном состо ит из длинной уникальной кодирую щей области (140,5 кб), фланкирован ной повторяющимися терминальными повторами (TR). Геном подразделяет ся на 7 блоковых областей (1—7), ко торые, как предполагают на основа нии гомологии с другими герпесвирусами, кодируют структурные белки и репликативные энзимы. Межблоко вые области генома (а—h) кодируют уникальные вирусные белки. Некото-
С х е м а 5.12. Геном HHV-8 (объяснение в тексте) (по Gillison Μ. L., Ambinder R. F.,
1997)
315
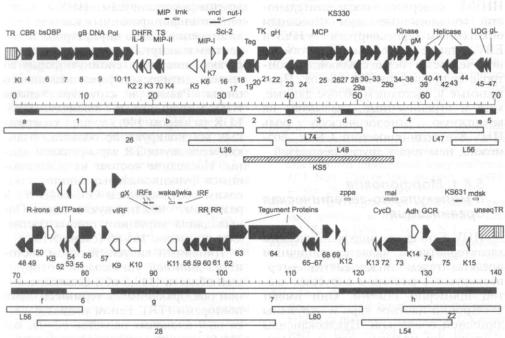
С х е м а 5.13. Длинная уникальная область (LUR) HHV-8, ограниченная областями
терминальных повторов (TR) с высоким содержанием G:C и содержащая 81 ген, идентифицированный к настоящему времени. Гены ННУ-8, начиная с левого конца генома, обозначены аналогично соответствующим генам HVS (герпесвируса Саймири). Для обозначения генов ННУ-8, не имеющих значительной гомологии с HVS, в название включен символ "К" (без ORF) (по Russo et al., 1996)
рые открытые рамки считывания в ге номе HHV-8 кодируют белки, гомоло гичные известным белкам человека: дигидрофолатредуктаза ( D H F R ) , тимидилатсинтаза (TS), вирусный ин - терлейкин-6 (vIL-б), вирусный макрофагальный воспалительный белок I и II типов (vMIP-I, vMIP-II), вирусный Bcl-2 (vBcl-2), вирусный циклин D (v- cyclin D) и вирусный гомолог рецеп тора интерлейкина-8 (GPCR) . Геном ные фрагменты, первоначально изо лированные Chang и Moore, находятся в области генов большого капсидного белка и оболочечного белка (Tegument protein). Указаны также вирусная ДНК-полимераза и вирусная тимидинкиназа (ТК).
TR представляет собой консерва тивную структуру герпес-вирусов, участвующую в упаковке вирусной
Д Н К в новые вирионы во время литического цикла репликации вируса. Эта область HHV-8 не содержит ни одной из O R F , имеющихся в соответствую щей области генома EBV. Гибридиза ция с TR, используемой в качестве пробы, является чувствительным тес том для детекции Д Н К HHV-8.
Все известные для HHV-8 ORFs, а их в настоящее время насчитывают не
менее 81, |
расположены |
в пределах |
||
L U R (схема 5.13). Порядковые номера |
||||
для |
каждой |
O R F HHV-8 |
были |
даны |
по |
соответствующим номерам |
O R F |
||
для генов HVS, с которыми они име ют существенную степень гомологии. Для обозначения уникальных генов, не гомологичных генам HVS, исполь зуют букву К. Вполне вероятно, что в будущем у HHV-8 будут обнаружены дополнительные гены и альтернатив-
316
но транскрибируемые ORF. Важно от |
свойства, |
изучение которых |
позволит |
|||||||||||||||||
метить, что LUR вируса содержит |
нам взглянуть на биологию их клеточ |
|||||||||||||||||||
блоки генов, имеющиеся у представи |
ных прототипов и, возможно, исполь |
|||||||||||||||||||
телей всех подсемейств герпесвиру- |
зовать их для успешной терапии. |
|
||||||||||||||||||
сов, включая гены, которые кодируют |
Гомолог |
клеточного антиапоптоти- |
||||||||||||||||||
структурные белки и ферменты, необ |
ческого белка Bcl-2 (v-Bcl-2). ORF 16 |
|||||||||||||||||||
ходимые для репликации и сборки ви |
HHV-8 кодирует гомолог клеточного |
|||||||||||||||||||
русных частиц. Между этими блоками |
антиапоптотического белка Bcl-2 (v- |
|||||||||||||||||||
генов расположены уникальные гены, |
Bcl-2), участвующего в регуляции про |
|||||||||||||||||||
характерные только для HHV-8 или |
цесса апоптоза. Известно, что Bcl-2, |
|||||||||||||||||||
других представителей рода Rhadinovi- |
кодируемый геном bcl-2, способствует |
|||||||||||||||||||
rus (см. схему 5.12). Характерная осо |
выживанию |
клеток благодаря блоки |
||||||||||||||||||
бенность этого рода γ-герпесвирусов |
рованию |
апоптоза. Нарушенная |
экс |
|||||||||||||||||
заключается в том, что их уникальные |
прессия этого гена приводит к накоп |
|||||||||||||||||||
области содержат |
большую |
коллек |
лению генетических мутаций, что в |
|||||||||||||||||
цию генов, |
гомологичных |
клеточным |
свою очередь может привести к воз |
|||||||||||||||||
генам. Вирусные гены-гомологи, уча |
никновению |
опухоли. |
Повышенная |
|||||||||||||||||
ствующие |
в |
регуляции |
|
клеточного |
экспрессия Bcl-2 в инфицированных |
|||||||||||||||
цикла |
или |
соответствующих |
сигналь |
вирусом |
клетках |
может |
предохранить |
|||||||||||||
ных путей клетки, и были, по-види |
их от гибели, увеличивая как продук |
|||||||||||||||||||
мому, захвачены этими вирусами из |
тивность вируса, так и выживаемость |
|||||||||||||||||||
клеточной |
Д Н К |
на |
раннем |
этапе |
их |
клеток. Белок, кодируемый v-Bcl-2, |
||||||||||||||
эволюции. В настоящее время обнару |
имеет только 15—20 % гомологии по |
|||||||||||||||||||
жены по крайней мере 14 ORFs, кото |
аминокислотным |
последовательно |
||||||||||||||||||
рые вне всякого сомнения являются |
стям |
с |
соответствующим клеточным |
|||||||||||||||||
гомологами |
|
клеточных |
генов. |
Воз |
белком; |
последовательности |
же, |
от |
||||||||||||
можные функции продуктов этих ге |
ветственные |
|
за |
антиапоптотическую |
||||||||||||||||
нов в жизненном цикле вируса и про |
активность, являются идентичными. |
|||||||||||||||||||
цессе |
формирования |
опухоли |
рас |
Вирусный циклин D. Циклин-гомо- |
||||||||||||||||
сматриваются |
ниже. |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
лог, кодируемый |
ORF 72 |
HHV-8, |
обо |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
значен как v-cyclin D. Он имеет 27 % |
||||||||
5.6.2. Функции |
вирусных |
|
|
гомологии |
по |
аминокислотному |
со |
|||||||||||||
генов, |
|
контролирующих |
|
|
ставу с циклином D2, одним из пред |
|||||||||||||||
пролиферацию |
клеток |
|
|
ставителей |
Gl - циклинов |
человека. |
||||||||||||||
|
|
При этом последовательности так на |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Геном HHV-8 содержит чрезвы |
зываемого |
типичного |
циклинового |
|||||||||||||||||
чайно большое число генов, когда-то |
бокса |
клеточных |
циклинов, |
взаимо |
||||||||||||||||
захваченных из |
клеточной Д Н К эука- |
действующих |
с |
циклинзависимыми |
||||||||||||||||
риотов. Структурные белки и вирус |
киназами, в вирусном гомологе кле |
|||||||||||||||||||
ные ферменты, |
являющиеся |
общими |
точных циклинов практически полно |
|||||||||||||||||
для большинства герпесвирусов, веро |
стью |
сохранены. |
Взаимодействуя с |
|||||||||||||||||
ятно, происходят от древних предше |
cdk-6, v-cyclin D ее активирует, что |
|||||||||||||||||||
ственников современных герпес-виру |
приводит |
к |
фосфорилированию |
фи |
||||||||||||||||
сов. В то же время гены HHV-8, за |
зиологической |
мишени |
циклинов ти |
|||||||||||||||||
хваченные из клеток, могут поддержи |
па D — белка pRb, являющегося регу |
|||||||||||||||||||
вать репликацию вирусного генома в |
лятором клеточного цикла. Следстви |
|||||||||||||||||||
специфическом |
микроокружении. |
В |
ем фосфорилирования |
pRb |
являются |
|||||||||||||||
настоящее время мы только начинаем |
потеря его сродства к факторам транс |
|||||||||||||||||||
понимать, как HHV-8 взаимодейству |
крипции группы E2F и освобождение |
|||||||||||||||||||
ет с клеточным механизмом, чтобы |
последних. В результате таких собы |
|||||||||||||||||||
обеспечить |
выживание |
в |
латентном |
тий указанные факторы транскрипции |
||||||||||||||||
состоянии. |
Захваченные эукариотиче- |
становятся |
активными, |
способными |
||||||||||||||||
ские |
гены |
|
приобрели |
|
уникальные |
активировать транскрипцию ранее ре- |
||||||||||||||
317
премированных генов, продукты ко торых важны для вхождения клетки в S-фазу. В противоположность ком плексу, сформированному из клеточ ного циклина типа D и cdk, комплекс, состоящий из v-cyclin D и cdk 6, не
подавляется ингибиторами cdk, таки ми как pl6lnk4a, p21Cipl и p27Kipl [8]. Ви
русный гомолог клеточных циклинов является одним из немногих белков HHV-8, которые экспрессируются в веретеновидных клетках СК и латент но инфицированных клетках PELпроизводных клеточных линий. Исхо дя из вышеизложенного, следует, повидимому, заключить, что белок v-cy clin D может имитировать функцию мутантного белка ретинобластомы и приводить к подавлению ингибирования клеточного роста.
Гомологи ростовых факторов. Три гена HHV-8 обладают сходством сво их последовательностей с членами СС семейства ростовых факторов (хемокинов) человека. В частности, выявле ны два вирусных гомолога хемокинов, близких к белкам макрофагального воспаления MIP-I и MIP-11 (v-MIP-I и v-MIP-II), которые кодируются ORF Кб и ORF К4 соответственно. Белки, кодируемые ORF К6, по своему ами нокислотному составу примерно на 40 % идентичны белку MIP-II челове ка. Вопрос о том, играют ли v-MIP-I и v-MIP-II паракринную роль в воз никновении веретеновидных клеток СК либо их функция заключается лишь в усилении неоангиогенеза или модуляции инфильтрации макрофага ми и эозинофилами опухолевой тка ни, остается пока открытым.
Третий ген HHV-8 (ORF К2) из указанной группы кодирует вирусный гомолог интерлейкина-6 человека — v-IL-6. Оба белка на аминокислотном уровне имеют 25 % гомологию. v-IL-6 экспрессируется в латентно инфици рованных HHV-8 лимфомных и PELпроизводных клеточных линиях, но, как правило, не экспрессируется в опухолевых клетках СК. Эти данные, а также результаты эксперименталь ных исследований на бестимусных
мышах позволяют предположить, что v-IL-6 способствует пролиферации клеток гемопоэза, плазматических и эндотелиальных клеток. Подобно IL-6 человека, v-IL-6 через Jak-Stat-сиг- нальный путь активирует фосфорилирование STAT1, STAT3 и Jak 1, что ведет к индукции синтеза Д Н К , одна ко механизмы взаимодействия вирус ного и клеточного лигандов с клеточ ным рецептором IL-6 различаются. Экспрессия v-IL-6 в инфицированных HHV-8 В-клетках напоминает индук цию IL-6 человека в клетках, инфици рованных EBV. Вопрос о том, вносит ли свой вклад v-IL-6 в пролиферацию В-клеток, пока не решен.
Гены латентного цикла инфекции.
ORF 73 HHV-8 кодирует большой ядерный белок с мол. массой 224—236 кДа. Этот белок, обозначенный как LNA, является компонентом ядерного антигена, ассоциированного с латент ным состоянием HHV-8 (LANA) и об наруживается с помощью сывороток больных СК методами иммунофлюоресценции и иммуноблоттинга. LNA экспрессируется в латентно инфици рованных HHV-8 клетках PEL (и по лученных из них клеточных линиях), а также веретеновидных клетках СК. По аналогии с транс-активирующими белками других герпесвирусов, напри мер EBNA-1, EBNA-2 EBV, вполне логично предположить, что LNA ис ходно участвует в контроле за транс крипцией других вирусных генов, хо тя не исключается его воздействие и на экспрессию генов клетки-хозяина.
Вирусный интерферон-регулирую- щий фактор (v-IRF). ORF К9 кодирует вирусный гомолог IFR (v-IRF). Этот ген имеет небольшую, но достаточную гомологию с семейством белков IRF, ответственных за передачу сигнала интерферона. Два члена этого сиг нального пути, IRF-1 и IRF-2, явля ются антагонистами по отношению друг к другу в их эффекторных функ циях. IRF-1 позитивно регулирует сигналы интерферона, присоединяясь к специфическим энхансерным эле ментам (называемым интерферонсти-
318
мулирующими респонсивными эле ментами), расположенным в промоторных областях интерферониндуцибельных генов. Активированная транскрипция генов, стимулирован ная интерфероном, приводит к фенотипическим изменениям, характер ным для антивирусного состояния, индуцированного интерфероном. Это состояние включает индукцию белка р21 CDKI, который может привести к остановке клеточного цикла через ингибирование Rb и некоторые другие механизмы. IRF-2 обладает онкогенным действием на клетки N I H 3Т3, которое может быть отменено повы шенной экспрессией IRF - 1 . Подобно гомологам ростовых факторов, v-IRF экспрессируется в латентно инфици рованных клетках PEL, и экспрессия этого белка существенно усиливается после индукции литического цикла.
Вирусные белки, ингибирующие се мейство клеточных белков, содержа щих так называемый домен смерти. v-FLIP — вирусный белок, конверти рующий фермент 1В; является fas-ас социированным и содержит домен смерти, ингибирующий FLICE. Этот белок (кодируется O R F К13, также обозначаемой O R F 71) принадлежит к вновь открытому классу v-FLIP. v-FLIP вначале были идентифициро ваны у HHV-8 и других представите лей радиновирусов, так же как и ви руса контагиозного моллюска, на ос нове присутствия в них так называе мых эффекторных доменов смерти (DEDs). В последующем были также открыты клеточные гомологи этих белков [18]. v-FLIP обладает единст венным доменом D E D . Подобно кле точному гомологу, v-FLIP, кодируе мый HHV-8, может блокировать один из важнейших путей, с помо щью которого иммунный механизм приводит к гибели клеток, т. е. к ин дукции апоптоза с помощью семей ства рецепторов фактора некроза опухоли.
Вирусный гомолог рецептора, свя занного с G-белком. ORF 74 HHV-8 и HVS кодируют белок-гомолог рецепто-
ра, связывающий G-белок (v-GPCR), структура которого содержит 7 транс мембранных доменов. Этот рецептор обладает чрезвычайно высокой гомо логией на уровне аминокислотных по следовательностей к рецепторам рос тового фактора IL-8, ростового факто ра эндотелиальных клеток и ангиогенного фактора роста. Исследования транзиторной экспрессии v - GPCR по зволили предположить, что он конституитивно активен и не требует присоединения лиганда или активиру ется с помощью лиганда, обычно экспрессируемого клетками в культуральную среду. Трансфекция v - GPCR уси ливает пролиферацию фибробластов почек крыс, что говорит о его транс формирующих потенциях. Клеточ ный GPCR, который постоянно сти мулируется или становится конституитивно активным благодаря мута циям, может трансформировать клет ки и быть вовлеченным в патогенез некоторых новообразований челове ка. v - GPCR способен запускать сиг нальные каскады, ведущие к актива ции АР-1, являющегося транскрип ционным фактором, вовлеченным в процессы выживания клеток и их пролиферации, а также в активацию воспалительных и ангиогенных фак торов роста. Усиленная экспрессия v - GPCR в клеточных линиях PEL, обработанных ТРА, предполагает, од нако, что он экспрессируется в ос новном во время литической репли кации. В то время как его экспрессия в тканях СК была документирована с помощью RT-PCR, до сих пор не яс но, экспрессируется ли он в верете новидных клетках СК, латентно ин фицированных HHV-8, или в ограни ченном числе клеток в этих пораже ниях, подвергающихся литической репликации.
Другие вирусные гены. Первый ген на левом конце генома HHV-8 (ORF К1) кодирует трансмембранный гликопротеин, состоящий из 289 амино кислот. Его внеклеточный домен обо гащен цистеином и частично гомоло гичен легким цепям иммуноглобули-
319
на γ. ORF K1 проявляет выраженные трансформирующие свойства в экспе риментальных условиях in vitro и in vi vo. Дополнительные исследования, однако, показали, что ORF К1 в ла тентно инфицированных клетках кле точной линии BCBL не экспрессиру ется. Таким образом, роль O R F К1 в HHV-8-ассоциированном канцероге незе требует дальнейшего изучения, хотя его свойства, нарушающие регу ляцию роста клеток, позволили неко торым исследователям отнести его к онкогенам.
Известны и другие O R F HHV-8, гомологичные и негомологичные ге нам человека. Среди них гены, участ вующие в синтезе нуклеиновых ки слот, а также кодирующие различные белки. К числу последних относят бе лок-гомолог рецептора IL-8 (ORF 74), малый гидрофобный белок "капошин" (ORF К12) и ряд других белков с неиз вестной функцией. Изучение функ ций этих белков и их роли в транс формации клетки позволит, вероятно, в недалеком будущем пролить свет на молекулярную основу HHV-8-ассо- циированных патологий.
Сиквенсный анализ. При молеку- лярно-биологических исследованиях HHV-8 оказалось, что его изоляты
различного происхождения |
облада |
ют чрезвычайно стабильным |
гено |
мом. Имеются тем не менее сообще ния о незначительных вариациях в последовательностях ORF 26 и неко торых областей ORF 75. Было также показано, что последовательности одного из генов (ORF К1), находяще гося на левом конце генома, могут
варьировать в |
большей |
степени, |
чем |
у структурных |
генов |
HHV-8. |
При |
комплексном анализе нескольких ге номных областей общая вариабель ность нуклеотидного состава между изолятами достигала 1,5 %, что дало возможность разделить все известные вирусные изоляты на 4 основные группы, предварительно обозначен ные как А, В, С и D. Дальнейший си квенсный и филогенетический ана лиз вирусных изолятов различного
происхождения, возможно, поможет выяснить географическое происхож дение HHV-8 и пути его распростра нения на земном шаре.
5.6.3. Биологические свойства вируса. Клеточный тропизм
Персистенция в клетках СК. В на стоящее время последовательности HHV-8 могут быть обнаружены с по мощью таких методов исследования, как PCR в разных вариантах, PCR в сочетании с гибридизацией in situ или общепринятая гибридизация in situ. При помощи указанных тестов специ фические последовательности HHV-8 были обнаружены в эндотелиальных и веретенообразных клетках опухоле вой ткани больных СК, циркулирую щих эндотелиальных клетках этих же больных, лимфомных клетках боль ных PEL, макрофагах, дендритных клетках и железистом эпителии пред стательной железы у инфицированных вирусом лиц. В опытах с использова нием PCR в реакции гибридизации in situ было показано, что HHV-8 можно часто обнаружить как в атипических, так и опухолевых (веретенообразных), но не в нормальных эндотелиальных клетках здоровых тканей больных СК. Эти данные были подтверждены в опытах с использованием микродиссекции, а также методами гибридиза ции in situ и иммуногистохимии с LANA. Исследования показали, что в большинстве веретенообразных кле ток СК имеет место персистирующая инфекция HHV-8, о чем свидетельст вует экспрессия генов, кодируемых в
ORF К12, ORF 72 и ORF 73. Как уже было сказано выше, ORF 72, коди рующий гомолог циклинов типа D млекопитающих, проявляет свою функциональную активность, фосфорилируя ретинобластомный белок pRb, являющийся опухолевым супрессором. ORF 73 кодирует LANA, функ ция которого пока не известна, как и функция небольшого гидрофобного белка, состоящего из 60 аминокислот
320
и кодируемого ORF К12. Вирусный гомолог IL-6, кодируемый ORF К2, синтезируется в латентно инфициро ванных клетках PEL, но обычно не выявляется в опухолевых клетках больных СК. В атипических клетках плоскоклеточного эндотелия, обнару живаемых на ранних стадиях СК (пят на), выявляют только РНК-транс крипт Т0.7 ORF 12, соответствующий латентному циклу инфекции. Таким образом, в настоящее время имеется ряд независимых доказательств, сви детельствующих о том, что HHV-8 ин фицирует опухолевые клетки больных СК и персистирует в них. В то же вре мя практически все первичные кле точные линии, полученные из клеток биоптатов опухолей этих же больных, в процессе культивирования теряли вирусный геном и лишь очень немно гие сохранили HHV-8 на протяжении серии пассажей.
Персистенция в гематологических клетках. Большинство активно экспрессируемых транскриптов HHV-8 в клеточных линиях, полученных из PEL, представляют собой полиаденилированные транскрипты, кодируе мые ORF К12 (ТО.7) и ядерной нетранслируемой Р Н К (Т1.1). В этих же клеточных линиях экспрессируются (хотя на очень низких уровнях) и бел
ки, |
кодируемые |
целым |
спектром |
|
ORFs, |
|
например |
ORF 16 (v-bcl-2), |
|
ORF |
73 |
(LANA), |
ORF 74 (v-GCR), |
|
ORF K2 (v-IL-6), ORF K4 |
(v-MIP-II), |
|||
ORF K6 |
(v-MIP-I), |
ORF |
K9 (v-IRF) |
|
и др. В-клетки и макрофаги также мо гут содержать генетическую информа цию этого вируса. Обнаружение в крови и очагах поражения больных СК клеток с маркерами эндотелиаль ных макрофагов, инфицированных HHV-8, помогает объяснить вирусную нагрузку, ассоциированную с возник новением СК. Эти данные позволяют также предположить, что инфициро ванные моноциты могут привносить вирус в ткань, переносить инфекцию или дифференцироваться локально в веретенообразные клетки, несущие маркеры эндотелиальных макрофагов.
Персистенция в клетках простаты.
Другим местом возможной локализа ции вируса является простата. У неко торых мужчин из эндемичных для HHV-8 регионов вирусные маркеры обнаруживали в семенной жидкости. Нельзя исключить, что источником HHV-8 в семени являются мононуклеарные клетки крови, инфицирован ные вирусом. В то же время у больных СПИД-ассоциированной формой СК геном HHV-8 с постоянством обнару живали в тканях простаты. Выполнен ные с помощью метода гибридизации in situ исследования показали, что в железистом эпителии простаты лиц даже без СК могут быть экспрессированы некоторые гены латентной ин фекции HHV-8. Эти находки позволя ют предположить, что данный вирус довольно широко распространен сре ди мужчин, по крайней мере в геогра фических регионах, эндемичных для этого вируса. Вне эндемичных регио нов анализ простатической ткани с помощью PCR у лиц без СК вирусных последовательностей не обнаружил.
HHV-8 также находили в мокроте, слюне, смывах из ротоглотки, про мывных бронхоальвеолярных водах, но эти находки были сделаны глав ным образом у больных СК.
5.6.4. Эпидемиология HHV-8
5.6.4.1. Данные PCR-анализа
Распространение HHV-8 среди на селения различных географических регионов и отдельных групп риска оценивается главным образом по дан ным PCR и серологических исследо ваний. Поскольку используемые мето ды различаются по своей чувствитель ности и специфичности, то получае мые результаты неоднозначны и могут варьировать.
При изучении РВМС здоровых лиц из стран с низкой заболеваемостью СК, таких как США, Франция или Англия, специфические последова тельности HHV-8 не были выявлены даже методом "гнездной" PCR. В стра-
21-7908 Д. Г. Заридзе |
321 |
|
нах же с достаточно высоким уровнем |
мый |
ORF 65 и обозначаемый vpl9/ |
||||||||||||||
заболеваемости |
классической |
формой |
ORF 65. Последний активно исполь |
|||||||||||||
СК, например в Италии, вирусные |
зуется |
в |
качестве |
рекомбинантного |
||||||||||||
последовательности были |
обнаружены |
белка для ELISA и иммуноблоттинга. |
||||||||||||||
в РВМС и лимфоидной ткани при |
Антитела к этому белку обнаруживают |
|||||||||||||||
мерно у 9 % ВИЧ-инфицированных |
в сыворотках примерно 80 % больных |
|||||||||||||||
лиц. В Уганде, где зарегистрирована |
СПИДом с СК и 85—90 % больных |
|||||||||||||||
эндемичная форма СК, вирусные по |
классической |
(идиопатической) фор |
||||||||||||||
следовательности |
были определены |
у |
мой СК, хотя вопрос о его возможной |
|||||||||||||
14 % больных с опухолями, не связан |
перекрестной реактивности с белками |
|||||||||||||||
ными с СК. Такие исследования со |
EBV еще полностью не решен. Таким |
|||||||||||||||
гласуются с находками более высоко |
образом, из всего сказанного можно |
|||||||||||||||
го уровня |
инфицированности |
РВМС |
сделать вывод о том, что пока только |
|||||||||||||
HHV-8 среди лиц с повышенным рис |
LANA является наиболее приемлемым |
|||||||||||||||
ком возникновения СК . |
|
|
|
|
для диагностики антигеном, с помо |
|||||||||||
|
|
|
|
|
|
|
|
|
|
щью которого может быть выявлено |
||||||
5.6.4.2. Данные |
|
|
|
|
|
большинство |
случаев |
HHV-8-инфек- |
||||||||
|
|
|
|
|
ции, а из антигенов литического цик |
|||||||||||
серологических исследований |
|
|||||||||||||||
|
ла сравнимые результаты могут быть |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
В |
настоящее |
время |
большинство |
получены |
только при |
использовании |
||||||||||
серологических |
|
исследований, |
на |
vpl9/ORF |
65. |
|
|
|
|
|||||||
правленных на |
|
поиски |
антител |
к |
Важно отметить, что в одних и тех |
|||||||||||
HHV-8, проводят с использованием |
же группах больных и здоровых лиц |
|||||||||||||||
антигенпродуцирующих |
В-клеточных |
частота обнаружения антител к вирус |
||||||||||||||
линий, выведенных из клеток боль |
ному |
капсидному |
антигену (кодируе |
|||||||||||||
ных |
PEL, |
инфицированных |
только |
мому ORF 65, vpl9/ORF 65) и LANA |
||||||||||||
одним HHV-8. Клетки этих линий |
была примерно одинаковой: > 80 % — |
|||||||||||||||
экспрессируют |
|
ассоциированный |
с |
у больных СПИД-ассоциированной |
||||||||||||
латентным |
состоянием |
вируса |
ядер |
формой СК, > 90 % — у больных |
||||||||||||
ный антиген LANA, который в ульт |
классической |
формой |
СК и |
почти у |
||||||||||||
рафиолетовом |
свете |
можно |
увидеть |
30 % мужчин-гомосексуалистов, ин |
||||||||||||
как светящиеся гранулы в ядре. Обна |
фицированных ВИЧ, но без СК и т. д. |
|||||||||||||||
ружение LANA при иммунофлюорес- |
Среди населения С Ш А и стран За |
|||||||||||||||
центном тестировании тесно коррели |
падной Европы с низкой заболеваемо |
|||||||||||||||
рует с выявлением в иммуноблоттинге |
стью СК лица, содержащие антитела к |
|||||||||||||||
ядерного антигена с мол. массой 226— |
HHV-8, практически отсутствовали |
|||||||||||||||
234 кДа, кодируемого ORF 73. Уточ |
(0—2 % ) . Иную картину наблюдали |
|||||||||||||||
няющие |
исследования |
позволили |
среди |
населения |
некоторых |
странах |
||||||||||
предположить, |
|
что |
LANA |
частично |
Средиземноморья. В Италии (Милан), |
|||||||||||
или, скорее, полностью состоит из |
где обнаружена относительно |
высокая |
||||||||||||||
белка, кодируемого ORF |
73. |
|
|
|
заболеваемость СК, процент серопо- |
|||||||||||
Структурные |
|
антигены |
HHV-8, |
зитивных лиц среди доноров крови |
||||||||||||
т. е. антигены литического цикла, так |
составил 4 %. В Греции (также отно |
|||||||||||||||
же реагируют с сыворотками больных |
сящейся к странам с высокой заболе |
|||||||||||||||
СК. Кроме структурного белка с мол. |
ваемостью СК) число лиц, содержа |
|||||||||||||||
массой 40 кДа, антитела к которому |
щих антитела к vpl9/ORF 65, достига |
|||||||||||||||
обнаруживали примерно у 70 % боль |
ло 12 % среди не инфицированных |
|||||||||||||||
ных СК, у некоторых больных выяв |
ВИЧ |
больных хирургических отделе |
||||||||||||||
ляли антитела и к другим структур |
ний |
ряда |
обследованных |
больниц. |
||||||||||||
ным белкам вируса с мол. массой 27 и |
По-видимому, в Европе уровень ин |
|||||||||||||||
60 |
кДа. |
Наибольшее |
практическое |
фицированности населения HHV-8 |
||||||||||||
значение, однако, приобрел белок ви |
выше в тех странах, где зарегистриро |
|||||||||||||||
русного капсида (19 |
кДа), |
кодируе |
вана |
более |
высокая |
заболеваемость |
||||||||||
322
СК, хотя это наблюдение нуждается в дальнейшем подтверждении. Но самый высокий процент серопозитивных лиц к различным антигенам HHV-8 был обнаружен в странах Восточной, Цен тральной и Западной Африки. При этом в регионах, эндемичных для СК, уровень инфицированности среди на селения достигал 50—70 %.
Таким образом, данные серологи ческих исследований позволяют сде лать вывод о том, что HHV-8 не явля ется убиквитарной инфекцией для на селения западноевропейских стран и США, но приближается к таковой для населения некоторых регионов Аф рики.
5.6.4.3. Пути передачи инфекции
Основной путь передачи HHV-8 в странах с низким уровнем инфициро ванности населения — половой путь. Высказанное предположение подтвер ждается и данными PCR, согласно ко торым вирус у инфицированных лиц часто обнаруживается в клетках семе ни, а также, хотя и крайне редко, в цервико-вагинальном секрете. Остает ся все же неясным вопрос, какую роль играет половой путь передачи вируса, поскольку СК по наблюдениям в раз личных странах у мужчин встречается в 2—5 раз чаще, чем у женщин. Обна ружение вирусспецифических антител и вирусных последовательностей в клетках крови детей, не достигших половозрелого возраста, из эндемич ных по СК стран, например Замбии, где общая инфицированность среди лиц 14—84 лет достигает 58 %, так же как нарастание процента инфициро ванных детей с увеличением их воз раста, указывает на возможность и не
полового |
пути |
распространения |
HHV-8. |
Один из таких путей — пере |
|
дача вируса со слюной. Действитель но, вирус, изолированный из образ цов слюны инфицированных лиц, проявлял свои инфекционные свойст ва в культуре ткани, что свидетельст вует о его биологической активности.
21*
5.6.5. Заболевания человека, связанные с HHV-8
5.6.5.1. Саркома Капоши
Саркома Капоши (СК) представля ет собой многофокусный неопластиче ский процесс, возникший из эндоте лия кровеносных и лимфатических со судов, главным образом дермы. В соот ветствии с международной классифи кацией ВОЗ СК — это злокачественная опухоль кровеносных сосудов.
В настоящее время различают не сколько форм СК: спорадическую (так называемую классическую, или идиопатическую), эндемическую (аф риканскую), эпидемическую (СПИД - ассоциированную) и связанную с иммунодефицитными состояниями (обычно у реципиентов органных и тканевых трансплантатов). Гистологи ческая картина при всех указанных формах болезни существенно не раз личается и характеризуется периваскулярными инфильтратами в сетча том слое дермы, состоящими из ок руглых клеток с крупными ядрами: лимфоцитов, гистиоцитов, реже плазмоцитов. В инфильтратах формируют ся сосуды, представляющие собой скопления концентрически располо женных веретенообразных опухолевых клеток.
Результаты многочисленных иссле дований, проведенных в последние годы, свидетельствуют о том, что наи более вероятным фактором, вызываю щим СК, является HHV-8. Основани ем для такого утверждения являются следующие положения:
•данные PCR-анализа сотен об разцов опухолевой ткани боль ных СК, согласно которым при мерно в 90 % случаев удается вы явить вирусспецифические по следовательности, при этом ви русные Р Н К и Д Н К можно об наружить в большинстве опухо левых клеток;
•моноклональность вируссодержащих опухолевых клеток сар-
323
коматозных узлов больных СК, что свидетельствует о его проис хождении из одной единствен ной клетки, исходно инфициро ванной HHV-8;
холевых клетках СК . Клетки PEL, од нако, в отличие от клеток СК очень активно экспрессируют v-IL-6.
Другое лимфопролиферативное за болевание, с которым ассоциация
•результаты серологических ис HHV-8 была подтверждена, — это
следований: более высокий про цент серопозитивных лиц в оп ределенных географических ре гионах и группах риска, как пра вило, совпадает с повышенной заболеваемостью среди них СК.
К группам риска относятся ВИЧинфицированные лица, больные СΠ ИДом, мужчины-гомосексуалисты, больные иммунодефицитными со стояниями различного генеза и т. д. Было также показано, что по крайней мере у больных С П И Д о м инфициро вание HHV-8 предшествует появле нию СК.
5.6.5.2. Лимфопролиферативные заболевания
Кроме СК, заболеванием, тесно ассоциированным с HHV-8, является BCBL, обычно выявляемая у ВИЧинфицированных больных с тяжелы ми иммунодефицитными состояния ми. При этом довольно редком забо левании опухолевые массы и пора женные опухолевым процессом лим фатические узлы отсутствуют, в то время как лимфомные клетки в виде выпота обнаруживают в плевральной, перикардиальной или перитонеальной полостях. Такая особенность клини ческого проявления болезни позволи ла некоторым исследователям назвать это патологическое состояние первич но выпотной лимфомой (PEL). Клет ки выпота состоят из зрелых В-клеток нулевого фенотипа, хотя описаны слу чаи PEL с клетками, содержащими на своей поверхности В- и/или Т-кле- точные маркеры. Как показали иссле дования, характер и спектр экспрес сии вирусных генов в клетках PEL (анализируемые главным образом на стабильных клеточных линиях) прак тически совпадают с таковыми в опу
M C D . Болезнь характеризуется поликлональной лимфопролиферацией с выраженной васкуляризацией лимфо - идной ткани. Образцы биопсийного материала от ВИЧ-инфицированных больных M C D в большинстве случаев содержали вирусные последовательно сти HHV-8. Наоборот, у ВИЧ-нега тивных больных присутствие вируса обнаруживали не так часто (до 40 % ) . Таким образом, несмотря на клиниче ское сходство между M C D и СК, осо бенно проявляющееся у больных СПИДом, ассоциация HHV-8 с M C D (в отличие от СК и PEL) не является универсальной.
* * *
Подводя итог нашим знаниям о HHV-8, следует сказать, что его роль в патогенезе СК, PEL и M C D до сих пор окончательно не выяснена. Из вестно, что вирус постоянно присут ствует в опухолевых клетках СК и PEL, причем эти клетки моноклональны по своему происхождению. Известно также, что в клетках этих опухолей экспрессируется вирусный гомолог клеточных циклинов типа D, который может привести к наруше нию контроля за клеточным циклом и, таким образом, играть важную роль в генезе патологических состояний, ассоциированных с HHV-8. В то же время до сих пор не ясно, нужна ли HHV-8 для осуществления клеточной трансформации программа латентной экспрессии генов, обнаруженная у EBV. Если нужна, то как это сочетает ся с литическим циклом инфекции HHV-8, имеющим место в веретено образных клетках СК? Ответ на этот
вопрос предположительно могут |
дать |
наблюдения, свидетельствующие |
о |
том, что некоторые гены HHV-8, ко |
|
дирующие ростовые факторы и |
чья |
324
экспрессия усиливается во время ли тической инфекции (например, v-IL- 6), могут способствовать опосредован ной вирусом экспансии веретенооб разных клеток. Существует также оп ределенная гомология между генами HHV-8 и клеточными генами, участ вующими в контроле роста и проли ферации клеток. Сказанное в равной степени относится к патогенезу СК и PEL. Таким образом, кодируя целый набор белков, гомологичных клеточ ным белкам, вовлеченным в цикл кле точной прогрессии и передачи сигна лов, HHV-8 является неоспоримым кандидатом в онкогенные вирусы че ловека.
Дальнейшие исследования, по-ви димому, будут сфокусированы на изу чении онкогенного потенциала виру са, идентификации кодируемых виру сом белков, принимающих участие в трансформации клеток, анализе взаи моотношений вируса с иммунной системой хозяина, выявлении кофак торов, необходимых для реализации его онкогенных потенций, поиске удобных и чувствительных моделей in vitro и in vivo и т. д. Но уже сегодня можно с уверенностью сказать, что HHV-8 представляет собой уникаль ный и весьма перспективный объект для изучения, который в руках иссле дователей откроет новые, еще не из вестные стороны сложных процессов взаимоотношений между вирусом и клеткой, приводящих к возникнове нию опухоли.
Рекомендуемая литература
Казанцева И. А. Саркома Капоши: этиоло гия, патогенез, гистогенез, патоморфологическая диагностика // Российск. журн. кожн. и венер. бол. — 1998. — Т. 1. - С. 6 - 9 .
Chang Y, Gesarman Ε., Pessin Μ. S. et al.
Identification of herpesvirus-like DNA se quences in AIDS-associated Kaposi's sar coma // Science. — 1994. — Vol. 206. — P. 1865-1869.
Epstein—Barr virus and Kaposi's sarcoma herpesvirus/human herpesvirus-8 // Monogr. Eval. Carcinog. Risks. Hum . — Lyon:
IARC Press, |
1997. - Vol. |
70. - |
P. 3 7 5 - |
||
492. |
|
|
|
|
|
Moore P. S., |
Chang Y. Kaposi's sarcoma-asso |
||||
ciated herpesvirus-encoded oncogenes and |
|||||
oncogenesis |
// |
Monogr. |
Natl. |
Cancer. |
|
Inst. - 1998. - Vol. 23. - |
P. 6 5 - 7 1 . |
||||
Neipel F., |
Albrecht |
J.-Chr., |
Fleckenstein B. |
||
Human herpesvirus 8 — the first human |
|||||
Rhadinovirus |
// |
Monogr. |
Natl. |
Cancer. |
|
Inst. - |
1998. |
- |
Vol. 23. - |
P. 7 3 - 7 7 . |
|
Schulz T. F. Kaposi's sarcoma-associated her pesvirus (human herpesvirus-8) // J. Gen. Virology. - 1998. - Vol. 79. — P. 1573.
5.7. Ретровирусы: вирус Т-клеточного лейкоза человека
В. Э. Гурцевич
Ретровирусы — группа РНК-содер- жащих вирусов, способных на геном ной РНК, как на матрице, с помощью фермента обратной транскриптазы соз давать комплементарную копию Д Н К и инкорпорироваться в геном клеткихозяина. Все ретровирусы образуют се мейство (Retroviridae), в котором на ос новании комплекса критериев, таких как ассоциация с болезнью, морфоло гия вирусных частиц и способность вызывать цитопатогенный эффект in vitro, были выделены три подсемейства. Среди них различают подсемейства он ковирусов, лентивирусов и спумавирусов. Онковирусы в свою очередь состо ят из четырех морфологических субти пов — ретровирусов типа А, В, С и D. Согласно сообщению Международного комитета по таксономии вирусов, все ретровирусы подразделяются на 7 ро дов:
•род ретровирусов млекопитаю щих типа В;
•род ретровирусов млекопитаю щих типа С;
•род ретровирусов птиц типа С;
•род ретровирусов типа D;
•род ретровирусов HTLV-BLV;
•род лентивирусов;
•род спумавирусов.
Существует еще одна классифика ция онкогенных ретровирусов по био-
325
логическим свойствам и структуре ге нома, согласно которой выделяют 3 основных типа онковирусов: саркомные, вирусы острой лейкемии и лим- фоидно-лейкозные вирусы.
Ретровирусы подразделяют еще на простые и сложные, исходя из орга низации их генома. К сложным отно сят ретровирусы, которые, кроме структурных генов gag, pol и env, со держат гены, регулирующие экспрес сию структурных генов. Большая часть онковирусов, лентивирусов и спумавирусов, полученных от челове кообразных и нечеловекообразных приматов, относится к сложным ретровирусам (см. также табл. 5.2 в раз деле 5.1).
Вирионы ретровирусов, диаметр которых составляет 80—100 нм, имеют сферическую форму и покрыты гликопротеиновой оболочкой. В располо женной внутри вириона сферической или икосаэдральной формы сердцеви не упакован вирусный нуклеокапсид. В вирусных частицах типа В нуклео капсид расположен эксцентрично, в вирионах типа С, HTLV-BLV и спу мавирусов — по центру, а в вирионах лентивирусов имеет форму палочки или усеченного конуса.
Плавучая плотность вирионов рет ровирусов составляет 1,16—1,18 г/см3 в градиенте сахарозы. Они чувствитель ны к нагреванию, детергентам и фор мальдегидам. Различают 2 белка вирус ной оболочки (поверхностный — SU и трансмембранный — ТМ), кодируемых вирусным геном env, и 3—6 внутрен них негликозилированных структурных белков, кодируемых геном gag. В ви рионах описаны также белки матрикса (МА), капсида (СА) и нуклеокапсида (NC). Среди других белков выделяют протеазу (ПР), кодируемую геном pro, обратную транскриптазу (RT) и интегразу (IN), кодируемые геном pol.
Многочисленными исследования ми показано, что онкорнавирусы типа С являются возбудителями лейкозов и сарком у рептилий, птиц, мышей, крыс, кошек, крупного рогатого ско та, обезьян и человека. Онковирусы
В-типа — это возбудители опухолей молочной железы мышей и, возмож но, обезьян и человека. Роль ретрови русов типа D в патологии человека пока не ясна, однако известно, что вирус вызывает иммунодефицитные состояния обезьян и, вероятно, ассо циируется с развитием аденокарцином легких. Настоящий и следующие разделы будут посвящены некоторым членам этой разнообразной группы ретровирусов, онкогенный потенциал которых интенсивно изучается.
5.7.1. Вирус Т-клеточного лейкоза человека
HTLV относится к сферическим, оболочечным ретровирусам диаметром 80—100 нм. Вирион HTLV состоит из внешней двухслойной липидной обо лочки и нуклеокапсида. Последний со держит различные типы белков, а так
же две |
ковалентно |
связанные |
нити |
||||
Р Н К в комплексе |
с |
обратной |
транс- |
||||
криптазой, |
интегразой |
и |
протеазой. |
||||
Согласно |
|
существующей |
классифика |
||||
ции, HTLV относятся к семейству рет |
|||||||
ровирусов |
(Retroviridae), |
роду |
BLV- |
||||
HTLV, |
членами |
которого |
являются |
||||
BLV, HTLV-I, HTLV-II и STLV.
HTLV-I и HTLV-II, открытые в 1980 и 1981 гг. соответственно, очень близки по структуре своего генома и серотипу, хотя имеют и некоторые различия. Среди указанных двух пред
ставителей HTLV |
наиболее генетиче |
ски вариабельным является HTLV-I. |
|
Секвенирование |
наиболее вариабель |
ных участков |
провирусной Д Н К |
HTLV-I (LTR и области гена env) с их последующим филогенетическим ана лизом позволило идентифицировать 4
основных |
молекулярных |
субтипа |
HTLV-I: |
космополитический |
(HTLV- |
1а), центральноафриканский |
(HTLV- |
|
Ib), меланезийский (HTLV-I с) и но вый субтип HTLV-Id, недавно обнару женный у пигмеев Центрально-Афри канской Республики. На основе ана лиза LTR в составе космополитиче ского субтипа выделены еще 5 групп вирусов: трансконтинентальная груп-
326
па (А), включающая вирусные изоля ты практически из любого географи ческого региона планеты (Южная Аф рика, Япония, Северная и Южная Америка, Индия, Иран, Россия и т. д.), Японская группа (В), западноафриканская/карибская группа (С), североафриканская группа (D) и не давно выделенная от негров Перу группа (Е). В отличие от изолятов группы А изоляты, входящие в группы В, С, D и Е, обнаружены в строго оп ределенных географических регионах. Что касается HTLV-II, то этот вирус ный тип филогенетически подразде ляется на 3 молекулярных субтипа: HTLV-IIa, HTLV-IIb и HTLV-IIc. Ин тересно отметить, что около 70 % нар команов в Европе и Северной Амери ке, применяющих наркотики внутри венно, инфицированных этим типом вируса, содержат субтип HTLV-IIa. Племена американских индейцев Центральной и Северной Америки инфицированы различными варианта ми HTLV-IIb, в то время как среди
изолированных от внешнего мира племен на Амазонке персистирует главным образом HTLV-IIa.
Поскольку биологические свойства и молекулярная структура генома у HTLV и STLV очень сходны, оба типа вирусов помещены в одну объединяю щую их группу — группу Т-лимфо- тропных вирусов приматов (PTLV).
Учитывая генетическое родство между двумя представителями HTLV, HTLV-I и HTLV-II, с одной стороны, а также выраженную биологическую активность вируса первого типа (в от личие от вируса второго типа) — с другой, дальнейшее описание свойств этой группы вирусов будет проводить ся на примере HTLV-I.
5.7.1.1. Структура генома HTLV-I и основные кодируемые белки
Структура генома HTLV-I сходна с другими ретровирусами, но обладает существенным отличием (схема 5.14).
С х е м а 5.14. Генетическая организация HTLV-1
rof(l) rex(lll)
LTR — длинные концевые повторы, состоящие из U5 и U3 уникальных и R-повторяю- щихся концевых РНК последовательностей; gag, pol, env — гены, характерные для всех представителей семейства ретровирусов (Retroviridae); рХ — дополнительная область, ха рактерная для рода BLV-HTLV-ретровирусов и содержащая четыре открытые рамки
считывания, которые кодируют соответствующие белки: pl2rof (ORF I), р13tof и p30tof (ORF II), р27rex и р21геx (ORF III) и р40tах (ORF IV)
327
Кроме генов gag, pol, env |
и двух |
LTR, |
рионах) или на стадии провируса в |
|||||||||||||||
характерных для |
классических лейкоз- |
форме ДНК, интегрированной в одну |
||||||||||||||||
ных вирусов, у HTLV-I на З'-конце ге |
из хромосом клетки-хозяина в соот |
|||||||||||||||||
нома имеется уникальная область рХ, |
ношении одна копия на гаплоидный |
|||||||||||||||||
в состав которой входят по крайней |
геном. |
Клетками-мишенями |
для |
|||||||||||||||
мере 4 |
O R F |
для |
регуляторных |
генов |
HTLV-I |
являются |
преимущественно |
|||||||||||
tax, |
rex, |
tof и rof. |
При этом ген gag ко |
Т-лимфоциты, |
имеющие |
фенотип |
||||||||||||
дирует следующие ядерные белки: бе |
CD4 (Т-хелперы), реже CD8 (Т-су- |
|||||||||||||||||
лок матрикса — ΜА (19 кДа), капсид- |
прессоры). Менее эффективно вирус |
|||||||||||||||||
ный белок — СА (24 кДа) и нуклео- |
может инфицировать В-лимфоциты и |
|||||||||||||||||
капсидный белок — NC (12-15 кДа), а |
ряд других |
клеток. |
|
|
|
|||||||||||||
ген env — трансмембранный белок — |
|
|
|
|
|
|
|
|
|
|||||||||
ТМ |
(21 |
|
кДа) |
и |
белок |
поверхности |
5.7.1.2. Основные свойства |
|||||||||||
оболочки |
— |
SU (около 60 кДа). Ген |
||||||||||||||||
Tax-белка HTLV-I |
|
|
||||||||||||||||
tax кодирует ядерный фосфорилиро- |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
ванный белок Tax с мол. массой 42 |
Имеется |
|
ряд |
убедительных |
доказа |
|||||||||||||
кДа, который является транс-актива |
тельств, свидетельствующих о том, что |
|||||||||||||||||
тором транскрипции генома HTLV-I с |
белок — транс-активатор Tax — обла |
|||||||||||||||||
LTR 5'-конца и транс-активатором |
дает |
иммортализующими и |
трансфор |
|||||||||||||||
широкого |
спектра |
клеточных |
генов, |
мирующими функциями in vitro. В ча |
||||||||||||||
включая клеточные онкогены. Ген rex |
стности, трансдукция Tax в первичные |
|||||||||||||||||
кодирует также ядерный фосфорили- |
Т-лимфоцеть взрослого человека или |
|||||||||||||||||
рованный белок Rex с мол. массой 27 |
пупочного канатика |
приводит |
к их |
|||||||||||||||
кДа, являющийся транс-регулятором |
усиленной, хотя и IL-2-зависимой |
|||||||||||||||||
процессинга вирусной РНК . Экспрес |
пролиферации. Кроме того, Tax может |
|||||||||||||||||
сия Rex является позитивным сигна |
оказать трансформирующее |
воздейст |
||||||||||||||||
лом для экспрессии вирусных струк |
вие и на клеточные культуры фибро- |
|||||||||||||||||
турных белков (Gag и Env), но нега |
бластов |
различного |
происхождения, |
|||||||||||||||
тивным сигналом для всего вирусного |
вызывая образование колоний в мяг |
|||||||||||||||||
генома. Оба регуляторных белка генов |
ком агаре и морфологическую транс |
|||||||||||||||||
tax и rex кодируются дважды сплани |
формацию клеток, а их инокуляция |
|||||||||||||||||
рованной полицистронной м Р Н К с IV |
бестимусным |
мышам |
приводила к воз |
|||||||||||||||
и III O R F области рХ соответственно. |
никновению опухолей. Более того, Tax |
|||||||||||||||||
Эта же |
м Р Н К кодирует еще один бе |
в комбинации с активированным На- |
||||||||||||||||
лок группы Rex — р21 Rex, локали |
ras-белком |
|
способен трансформировать |
|||||||||||||||
зующийся в цитоплазме, и его функ |
первичные |
крысиные эмбоиональные |
||||||||||||||||
ции до сих пор не известны. Белки |
фибробласты. Tax вызывает у транс- |
|||||||||||||||||
р27 |
и |
р12, |
кодируемые |
геном rof с |
генньгх мышей in vivo прямой или опо |
|||||||||||||
ORF I, а также белки р30 и р13, коди |
средованный |
трансформирующий эф |
||||||||||||||||
руемые геном tof с открытой рамкой |
фект. Лимфомы CD4 фенотипа, схо |
|||||||||||||||||
считывания II области рХ, экспресси- |
жие по клеточному составу с HTLV-I- |
|||||||||||||||||
руются в ядре. Их функции в настоя |
ассоциированными Т-клеточными лей- |
|||||||||||||||||
щее время интенсивно изучаются. Что |
козами/лимфомами взрослых (ATLL) у |
|||||||||||||||||
касается LTR, то этот элемент генома |
человека, наблюдали только у битранс- |
|||||||||||||||||
HTLV-I размером около 550—750 н |
генных |
мышей, |
несущих |
сложную |
||||||||||||||
состоит из области U3 длиной 200— |
(HTLV-I LTR/c-mус и Ig/tax) экспрес- |
|||||||||||||||||
300 н R-последовательностей разме |
сирующую |
|
конструкцию, |
отстоящую |
||||||||||||||
ром 135—235 н и области U5 разме |
из гена с-тус под контролем промото |
|||||||||||||||||
ром 100-200 н. |
|
|
|
|
ра LTR-HTLV-I и гена tax под контро |
|||||||||||||
|
Геном |
HTLV-I |
может существовать |
лем |
промотора/энхансера |
Ig, |
однако |
|||||||||||
|
реальная роль повышенной экспрессии |
|||||||||||||||||
в 2 формах: в форме двух идентичных |
||||||||||||||||||
c-myc или tax развитии опухолей на |
|
|||||||||||||||||
нековалентно |
|
связанных |
"плюс"-це- |
|
||||||||||||||
пей Р Н К длиной около 9 тыс. н (в ви |
этой модели пока не ясна. |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
328
Трансформирующую |
активность |
во всех |
уголках земного шара. Выяв |
Tax, наблюдаемую в экспериментах in |
лены и |
высокоэндемичные зоны, где |
|
vitro и in vivo (на трансгенных мышах), связываютуровнис его инфицированностдуциспособностьюнаселения
|
|
|
|
|
|
|
|
|
|
|
колеблются |
от |
0,2 |
до |
30 %. |
К энде |
|||||||
ровать |
экспрессию широкого спектра |
мичным |
зонам |
относят |
|
несколько |
|||||||||||||||||
клеточных генов (включая гены цито- |
японских островов (Окинава, Кюшу и |
||||||||||||||||||||||
кинов |
и их |
рецепторов), |
участвующих |
Шикоку), большинство стран Эквато |
|||||||||||||||||||
в процессе роста и пролиферации кле- |
риальной Африки, |
Латинской |
Амери |
||||||||||||||||||||
ток. Вышеназванные клеточные гены |
ки, Карибского бассейна, а также Ме |
||||||||||||||||||||||
относятся |
к |
следующим |
|
основным |
ланезию, |
где высокий |
уровень |
инфи |
|||||||||||||||
группам: |
интерлейкин |
(IL)-кодирую- |
цированности |
обнаружен |
у |
абориге |
|||||||||||||||||
щие гены, |
гены |
ростовых |
факторов |
и |
|||||||||||||||||||
нов |
Папуа |
— |
Новой Гвинеи, |
Австра |
|||||||||||||||||||
гормонов, клеточные онкогены, вирус |
|||||||||||||||||||||||
лии и Соломоновых островов. В Рос |
|||||||||||||||||||||||
ные промоторы |
и некоторые другие. |
||||||||||||||||||||||
сии |
и |
странах С Н Г также |
зарегистри- |
||||||||||||||||||||
Кроме |
того, |
Tax |
оказывает |
негативное |
|||||||||||||||||||
рованы |
спорадические |
случаи |
HTLV-I |
||||||||||||||||||||
воздействие |
на экспрессию |
В-полиме- |
|||||||||||||||||||||
инфекции, |
а ее очаг обнаружен среди |
||||||||||||||||||||||
разы — фермента, участвующего |
в ре |
||||||||||||||||||||||
нивхов |
на |
Сахалине. |
Инфицирован |
||||||||||||||||||||
парации клеточной ДНК, вызывая, та |
|||||||||||||||||||||||
н ы е |
семьи, кроме |
того, |
выявлены |
в |
|||||||||||||||||||
ким образом, |
ее |
нестабильность и |
в |
||||||||||||||||||||
Туркменистане и Грузии. |
|
|
|
|
|||||||||||||||||||
конечном |
итоге |
хромосомную |
неста |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
бильность. |
Негативной |
регуляции |
со |
5.7.1.4. Пути передачи |
|
|
|||||||||||||||||
стороны Tax подвергаются и так назы |
|
|
|||||||||||||||||||||
ваемые антионкогены — р53 и pl6INC, |
инфекции |
|
|
|
|
|
|
|
|||||||||||||||
подавляя |
их |
функцию |
супрессоров |
Известны три основных пути пере |
|||||||||||||||||||
опухолевого |
роста. |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
дачи |
HTLV-I: |
|
|
|
|
|
|
|
||||||||||
Следует |
отметить, |
что |
транскрип- |
|
|
|
|
|
|
|
|||||||||||||
• |
от матери к ребенку при грудном |
||||||||||||||||||||||
ционную активность указанных |
выше |
||||||||||||||||||||||
|
вскармливании с молоком мате |
||||||||||||||||||||||
клеточных |
и |
вирусных |
генов Tax осу |
|
|||||||||||||||||||
|
ри, |
содержащим |
инфицирован |
||||||||||||||||||||
ществляет не напрямую, а через спе- |
|
||||||||||||||||||||||
цифические последовательности-ми- |
|
|
|
ные |
|
мононуклеарные клетки; |
|
||||||||||||||||
шени |
расположенные |
в |
соответст |
• |
половой |
— через инфицирован |
|||||||||||||||||
вующем промоторе. В настоящее вре |
|
ные лимфоциты, находящиеся в |
|||||||||||||||||||||
мя известны 3 типа таких последова |
|
эякуляте; |
|
|
|
|
|
|
|||||||||||||||
тельностей, |
опосредующих |
активацию |
• |
гематогенный при |
гемотрансфу- |
||||||||||||||||||
большинства |
клеточных |
генов: |
CRE; |
|
зиях |
контаминированной крови |
|||||||||||||||||
ядерный |
транскрипционный |
ком |
|
(главным образом лимфоцитар- |
|||||||||||||||||||
плекс kВ (NFkB), являющийся чле |
|
ной массы) либо при пользова |
|||||||||||||||||||||
ном rel семейства протоонкогенов, и |
|
нии |
|
общим |
шприцем |
наркома |
|||||||||||||||||
SRE. |
Модифицированные |
цикличе |
|
нами. |
|
|
|
|
|
|
|
||||||||||||
ские АМР-респонсивные элементы |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
обнаружены |
и |
в трех состоящих |
из 21 |
5.7.1.5. Заболевания человека, |
|||||||||||||||||||
пары оснований повторах LTR HTLV- |
|||||||||||||||||||||||
ассоциированные с HTLV-I |
|
||||||||||||||||||||||
I, два из которых участвуют в реализа |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
ции Tax-индуцированной транс-акти- |
Т-клеточный лейкоз (лимфома) |
||||||||||||||||||||||
вации |
вируса. |
|
|
|
|
|
|
|
взрослых (ATLL) — агрессивное зло |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
качественное |
заболевание |
с |
плохим |
|||||||||
5.7.1.3. Географическое |
|
|
прогнозом |
и короткой |
продолжитель |
||||||||||||||||||
|
|
ностью жизни после установления ди |
|||||||||||||||||||||
распространение HTLV-I |
|
|
|||||||||||||||||||||
|
|
агноза |
(около |
6 мес) |
— |
был |
описан |
||||||||||||||||
инфекции |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
Т. Учияма как самостоятельный кли- |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
HTLV-1 не является убиквитарным |
нико-патологический |
комплекс |
в |
||||||||||||||||||||
вирусом, |
но |
спорадические |
случаи |
1977 г. Дальнейшие серо-эпидемиоло |
|||||||||||||||||||
инфекции |
|
обнаружены |
практически |
гические |
исследования |
показали, что |
|||||||||||||||||
329
кластеры ATLL встречаются в зонах, эндемичных по HTLV-I. Заболевание также было обнаружено среди имми грантов из эндемичных зон в Европе и США. Основные клинические про явления заболевания заключаются в сплено- и/или гепатомегалии, сущест венном увеличении числа клеток бе лой крови с лимфоцитозом, высоких уровнях лактатдегидрогеназы, гиперкальциемии и кожной сыпи. Картина крови при лейкемической форме ATLL плеоморфна, преимуществен ным типом клеток являются среднего размера лимфоциты с многодольчаты ми ядрами, напоминающими лепест ки цветка. Частота серопозитивности к HTLV-I при ATLL в эндемичных регионах настолько велика (более 90 % ) , что обнаружение вирусных маркеров было принято в качестве до полнительного диагностического кри терия этого заболевания. При этом выявляются, как правило, очень вы сокие титры вирусспецифических ан тител к широкому спектру белков, ко дируемых генами gag и env HTLV-I. В атипичных случаях, когда клиниче ские и лабораторные находки доста точно ограничены, присутствие HTLV-I в опухолевых клетках может быть подтверждено с помощью анали за Д Н К опухолевых клеток в PCR и/ или в реакции гибридизации по Саузерну (с использованием проб, специ фических по HTLV-1-последователь- ностям).
TSP/HAM — еще одна патология человека, ассоциированная с этим ви русом и отнесенная к группе так на зываемых воспалительно-дегенератив ных заболеваний. Впервые ассоциа ция между HTLV-I и TSP/HAM опи сана на Мартинике в 1985 г. и вскоре была подтверждена на Ямайке, в Ко лумбии, а затем и в Японии. TSP/ НАМ чаще встречается у женщин и является одним из наиболее распро страненных неврологических заболе ваний в эндемичных для HTLV-I ре гионах. В этих регионах заболевае мость TSP/HAM существенно варьи рует и составляет от 8 до 128 случаев
на 100 000 жителей, при этом число ежегодно зарегистрированных случаев колеблется от 0,04 до 3 на 100 000. Лица, инфицированные HTLV-I в ре зультате гемотрансфузии, подвержены наибольшему риску возникновения TSP/HAM по сравнению с лицами, инфицированными другим путем. За болевание представляет собой про грессивную форму хронической спа стической миелопатии, связанную с демиелинизацией двигательных ней ронов спинного мозга. Основные кли нические проявления заболевания — слабость и ригидность нижних конеч ностей, дисфункция мочевого пузыря, парестезии, боль в поясничном отделе позвоночника и импотенция. Объек тивные клинические критерии диаг ностики TSP/HAM опубликованы ра бочей группой ВОЗ. Основные же ви русологические находки у этих боль ных состоят в обнаружении широкого спектра антител к белкам HTLV-I в высоких титрах в сыворотке крови и цереброспинальной жидкости, разно образии клеточных элементов в це реброспинальной жидкости, высокой провирусной нагрузке на геном кле ток периферической крови, циркуля ции активированных Т-клеточных по пуляций и присутствии цитотоксических Т-клеток, которые распознают эпитопы продуктов гена tax HTLV-I.
Среди других воспалительно-деге неративных заболеваний, ассоцииро ванных с HTLV-I, следует назвать увеиты, инфекционные дерматиты, полимиозиты, артриты (или HTLV-I- ассоциированная артропатия), тироидиты (болезнь Хашимото), синдром Сьегрена и некоторые другие. Важно отметить, что лишь часть указанных выше заболеваний этиологически свя зана с вирусом. Последние встречают ся преимущественно в эндемичных для HTLV-I зонах и практически от сутствуют в других географических ре гионах.
Таким образом, важным свойством вируса является его мультипотентность, т. е. способность вызывать це лый спектр заболеваний, включая
330
лейкоз/лимфому. В то же время ана лиз LTR, env- и tax-областей генома вирусных изолятов от больных ATLL и TSP/HAM, представляющих собой разные по своей природе заболевания, не выявил последовательностей, спе цифически обусловливающих лимфоили нейротропизм.
5.7.1.6. Роль различных факторов
для HTLV-1-ассоциированного канцерогенеза
Роль вируса. Известно, что инфи цирование человека HTLV-I чаще всего не приводит к возникновению ATLL или каких-либо других ассо циированных с вирусом патологиче ских состояний. Инфицированные лица пожизненно становятся бессим птомными вирусоносителями, и лишь у незначительной их части после дли тельного латентного периода, продол жающегося, как правило, десятиле тиями, возникает ATLL. Латентный период при воспалительно-дегенера тивных HTLV-I-ассоциированных за болеваниях обычно короче и не пре вышает нескольких лет. При этом число РВМС, содержащих провирус HTLV-I (провирусная нагрузка), у этих больных обычно в 10—100 раз выше (например, у больных TSP/ НАМ), чем у здоровых вирусоносителей, и составляет примерно 10 и 1 % соответственно. Провирусная нагруз ка при ATLL в значительной степени зависит от числа лейкемических кле ток и может быть очень высокой, хотя вирусные гены в опухолевых клетках не экспрессируются. Представляется важным, что инфицированные виру сом клетки проявляют тенденцию к клональной экспансии даже у здоро вых вирусоносителей. При этом число провирусных копий увеличивается преимущественно за счет митотического деления клеток, но не обратной транскрипции. Несмотря на то что лица, инфицированные HTLV-I, со держат провирус в значительной части клонально расширенной Т-клеточной
популяции, возникновение ATLL представляет собой редкое событие и встречается примерно у 1 из 1500— 3000 инфицированных лиц. На осно вании этих фактов был сделан вывод, что для возникновения ATLL одного инфицирования HTLV-I еще недоста точно и требуются дополнительные условия и факторы для реализации онкогенных потенций вируса и воз никновения опухолевого процесса.
Роль организма. Из приведенных выше наблюдений следует, что на ис ход HTLV-I-инфекции в значитель ной мере влияют собственные факто ры организма, так называемые факто ры хозяина. Важную роль среди них, вероятно, играет HLA-гаплотип инфи цированного лица, поскольку такая связь с HLA для многих других ин фекционных и воспалительных забо леваний доказана. К сожалению, до настоящего времени не было сделано полного статистического анализа, и эта работа требует еще своего завер шения.
Среди других факторов организма следует назвать факторы иммуноло гического надзора. При этом гумо ральный иммунный ответ не оказыва ет, по-видимому, существенной роли в ограничении репликации HTLV-I, поскольку вирусная нагрузка возрас тает главным образом не за счет реп ликации вируса, а в результате деле ния инфицированных, содержащих провирусную Д Н К клеток. В то же время именно уровни антител скорее всего отражают эту провирусную на грузку. Наиболее важным элементом иммунной системы, контролирую щим HTLV-I-инфекцию у инфици рованных лиц, являются цитотоксические Т-лимфоциты (CTL). Мощ ный, хронически активированный ответ CTL обнаружен у большинства больных TSP/HAM и у здоровых ви русоносителей. Более того, большин ство вовлеченных в процесс CTL специфически взаимодействуют с Tax-белком HTLV-I, указывая на их важную роль в ограничении вирус ной репликации. Предполагают, что
331
возникновение ATLL связано с не |
|
5.7.2. |
Происхождение |
|
|
|
|||||||||||||||
эффективностью иммунного |
надзора |
|
и распространение HTLV-I |
||||||||||||||||||
со стороны CTL, что в свою очередь |
на планете |
|
|
|
|
|
|
||||||||||||||
могло |
быть |
результатом |
низкого |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
уровня экспрессии белка Тах-лейкоз- |
|
Как было отмечено выше, отличи |
|||||||||||||||||||
ными |
клетками. |
|
|
|
|
|
|
тельной особенностью HTLV-I явля |
|||||||||||||
Генетический |
и |
другие |
факторы. |
ется |
удивительная |
стабильность |
его |
||||||||||||||
Действительно, |
хромосомные |
анома |
генома. Было подсчитано, что генети |
||||||||||||||||||
лии |
постоянно |
сопровождают |
воз |
ческий дрейф HTLV-I составляет при |
|||||||||||||||||
никновение |
ATLL, |
хотя |
|
определен |
мерно |
0,02—0,1 |
% |
на |
столетие |
(т. е. |
|||||||||||
ных специфических для данного за |
~ 1 |
% за 1000—5000 лет) для gp21 |
|
гена |
|||||||||||||||||
болевания |
повреждений |
хромосом не |
env. Кроме того, доказано, что HTLV- |
||||||||||||||||||
обнаружено. В то же время на моле |
I является одним из самых древних |
||||||||||||||||||||
кулярном |
уровне |
как |
|
в |
клетках |
вирусов человека, так как его обнару |
|||||||||||||||
ATLL, так и в трансформированных |
жили |
в |
популяциях, |
изолированных |
|||||||||||||||||
HTLV-I-клетках Т-клеточных линий |
от внешнего мира южноамериканских |
||||||||||||||||||||
человека |
обнаружены мутации |
трех |
(палеоиндейцы) |
и |
африканских |
(пиг |
|||||||||||||||
генов-супрессоров опухолевого рос |
меи) |
племен, история |
существования |
||||||||||||||||||
та, |
кодирующих |
соответствующие |
которых насчитывает по крайней мере |
||||||||||||||||||
белки: р53, pl6ink4a и pl5ink4b. В ча |
20 000 лет. Указанные выше свойству |
||||||||||||||||||||
стности, |
нарушающие |
|
смысловую |
вируса позволили |
высказать |
предпо |
|||||||||||||||
последовательность |
(миссенс) |
мута |
ложение о том, что молекулярная ге |
||||||||||||||||||
ции гена р53, а также аберрантный |
терогенность HTLV-I на планете свя |
||||||||||||||||||||
синтез белка р53 (вне зависимости от |
зана |
с |
географическими |
перемеще |
|||||||||||||||||
наличия или отсутствия миссенс-му- |
ниями наших предков, инфицирован |
||||||||||||||||||||
таций гена р53) обнаружены в значи |
ных этим вирусом, в историческом |
||||||||||||||||||||
тельной части свежих образцов опу |
прошлом. Это предположение в свою |
||||||||||||||||||||
холевой ткани больных ATLL и в |
очередь послужило основой для созда |
||||||||||||||||||||
клеточных |
линиях, |
трансформиро |
ния ряда гипотез о происхождении |
||||||||||||||||||
ванных HTLV-I. В отношении корре |
HTLV-I и о возможных путях мигра |
||||||||||||||||||||
ляции между экспрессией генов tax и |
ции человека в древние времена. Так,- |
||||||||||||||||||||
р53 существуют |
противоречивые |
дан |
филогенетический |
анализ |
|
вирусных |
|||||||||||||||
ные. Известно, например, что в Т- |
изолятов |
американского |
прохожде |
||||||||||||||||||
клеточных линиях, трансформирован |
ния показал, что в Америке циркули |
||||||||||||||||||||
ных HTLV-I, ген р53 функционально |
руют в основном представители двух |
||||||||||||||||||||
неполноценный, несмотря на усилен |
групп |
космополитического |
субтипа |
||||||||||||||||||
ную экспрессию белка p21waf1/cip1, осу |
HTLV-I — А и В, причем большинст |
||||||||||||||||||||
ществляющего |
контроль |
|
за |
прохож |
во вирусных изолятов принадлежит к |
||||||||||||||||
дением клеткой клеточного цикла. |
группе А. Учитывая тот факт, что дру |
||||||||||||||||||||
Обнаружено также, что белок Tax по |
гой эндемичной зоной, где циркули |
||||||||||||||||||||
вреждает функцию pl6ink4a, а гомо |
рует вирус группы А, является Япо |
||||||||||||||||||||
зиготные делеции генов-супрессоров |
ния, |
было |
сделано предположение, |
||||||||||||||||||
опухолевого роста — p15 и/или p16 — |
что |
некая |
популяция |
монголоидов, |
|||||||||||||||||
выявлены |
примерно у |
1 |
/3 |
больных |
инфицированных этим вирусом, зане |
||||||||||||||||
ATLL, что свидетельствует о возмож |
сла его в Новый Свет еще в доистори |
||||||||||||||||||||
ной связи между делециями в генах и |
ческие |
времена. |
Действительно, |
на |
|||||||||||||||||
прогрессией заболевания. Таким об |
основании |
данных |
антропологиче |
||||||||||||||||||
разом, делеции, мутации и аберрант |
ских, |
генетических и лингвистических |
|||||||||||||||||||
ные экспрессии могут, по-видимому, |
исследований сделан вывод о том, что |
||||||||||||||||||||
играть существенную роль в патоге |
предками американских индейцев бы |
||||||||||||||||||||
незе ATLL, хотя и нет других доказа |
ли |
монголоиды |
азиатского |
происхож |
|||||||||||||||||
тельств, что все они обусловлены |
дения. Во время последнего леднико |
||||||||||||||||||||
действием |
HTLV-I. |
|
|
|
|
|
вого |
периода, |
примерно |
10—40 |
|
тыс. |
|||||||||
332
лет назад, эта популяция, вероятно, пересекла Берингию (перешеек, ко гда-то соединявший Евразию и Се верную Америку) и достигла Южной Америки. При этом палеоиндейцы из Сибири первыми населили Американ ский континент. Отсутствие вирусов группы В среди аборигенов Южной Америки объясняется, вероятно, тем, что представители этой группы появи лись в Азии гораздо позже, когда Ев разийский и Американский материки уже разошлись
Наличие двойной инфекции в Японии (А- и В-группы вирусов кос мополитического типа HTLV-I), пр мнению некоторых исследователей, отражает несколько волн миграции монголоидов из Азии на Японский архипелаг, имевших место примерное 10 000 и 2300 лет назад.
Филогенетический анализ вирус ных изолятов, полученных от инфи цированных этим вирусом лиц в Рос сии (о. Сахалин) и некоторых респуб ликах бывшего ССС Р (Туркменистан, Грузия), показал, что все они относят ся к трансконтинентальной группе (А) космополитического типа HTLV-I и в филогенетическом древе образуют кластеры с изолятами японского и иранского происхождения соответст венно.
* * *
Являясь по оценке экспертов МАИР прямым канцерогеном для челове ка, HTLV-I по существу лишь ини циирует патологический процесс, на деляя инфицированные им клетки способностью к неограниченной про лиферации. Дополнительный каскад событий, включающих как одно из наиболее важных составляющих звеньев активацию определенных кле точных генов, является, по-видимому, совершенно необходимым для реали зации HTLV-I своих онкогенных по тенций. Центральная роль в этом про цессе, по-видимому, принадлежит Tax-белку вируса, транс-активирую- щего экспрессию ряда вирусных и
клеточных генов, нарушающего нор мальную регуляцию транскрипции, оказывающего супрессивное воздейст вие на ряд клеточных белков и участ вующего в поддержании нестабильно сти клеточного генома. Изучение тон ких механизмов HTLV-1-ассоцииро- ванного канцерогенеза является пред метом интенсивных научных исследо ваний.
Рекомендуемая литература
Гурцевич В. Э., Сенюта Н. Б. HTLV-I как канцерогенный фактор и инструмент изучения миграционной истории древ него человека // Вопр. вирусол. — 1998. - № 2. - С. 6 2 - 6 6 .
Павлиш О. А. Вирус Т-клеточного лейкоза в России: Сероэпидемиологические, вирусологические и молекулярно-био- логические исследования: Автореф. дис. ... докт. мед. наук. — М., 1999. — 42 с.
Coffin J. Μ. Retroviridae and their replication.
Virology, |
2nd |
— ed./Ed. |
B. N. Fields, |
D. M. Knipe. — New Yourk: Raven Press, |
|||
Ltd. - P. 1437-1500. |
|
||
IARC: Monogr. |
Eval. Carcinogc. Risks to |
||
Hum. — Vol. 67: Human T-Cell Lympho- |
|||
tropic Viruses. — 1996. — P. 261—390. |
|||
Lyons S. F., |
Liebowitz. The role of human vi |
||
ruses in the pathogenesis of lymphoma // |
|||
Seminars |
in |
Oncology. |
— 1998. — |
Vol. 25, N 4. |
- P. 4 6 1 - 4 7 5 . |
||
Meinl E., Fickenscher H., Thome |
M. et al. An- |
||
ti-apoptotic strategies of lymphotropic vi |
|||
ruses // Immunol. Today. — 1998. — Vol. 19, N 10. - P. 474 - 479 .
Mosialos G. The role of Rel/NF-kappa В pro teins in viral oncogenesis and the regula tion of viral transcription // Semin Biol.
-1997. - Vol. 8 (2). - P. 121-129. Uchiyama T. Human T-cell leukemia virus
type I (HTLV-1) and human diseases // Ann. Rev. Immunol. — 1997. — Vol. 15.
-P. 15-37.
Virus Taxonomy. Sixth Report of the Interna tional Committee on Taxonomy of Viruses
/Ed. F. A. Murphy, С. M. Fauquet et al..
-Wien — New York: Springer-Verlag, 1995. - P. 193-204.
Yoshida M. Howard Temin Memorial Lec tureship. Molecular biology of HTLV-I: deregulation of host cell gene expression and cell cycle // Leukemia. — 1997. — Vol. 11 (3). - P. 1-2.
333
