
- •I. История хирургии, общие вопросы
- •II. Асептика и антисептика.
- •III. Кровотечения. Остановка кровотечений.
- •1. Кровотечения, классификация, симптоматология. Особенности кровопотери у детей.
- •2. Диагностика наружных и внутренних кровотечений.
- •3. Методы временной и окончательной остановки кровотечения.
- •4. Окончательная остановка кровотечения. Сосудистый шов, пластика сосудов.
- •5. Лабораторная диагностика кровопотери. Оценка тяжести кровопотери и определение ее величины.
- •6. Кровотечения в ткани и полости. Аневризмы.
- •IV. Местная анестезия.
- •1. Местная анестезия. Виды, анестетики.
- •2. Местное обезболивание в детской хирургии, виды, показания к применению.
- •2.Инфильтративная анестезия по а. В. Вишневскому.
- •3. Инфильтрационная анестезия. Местная анестезия по а.В.Вишневскому.
- •4. Внутривенная и внутрикостная анестезии. Показания, техника выполнения.
- •5. Спинномозговая и перидуральная анестезия. Роль с.С.Юдина.
- •6. Спинномозговая и перидуральная анестезия. Опасности и осложнения.
- •7. Классификация способов местного обезболивания.
- •V. Трансфузиология. Переливание крови и кровезаменителей.
- •VI. Раны и раневой процесс.
- •Проникающие ранения грудной клетки
- •Принципы и методы лечения инфицированных ран.
- •I. Местные симптомы
- •II. Общие симптомы
- •Лечение гнойных ран в зависимости от фазы раневого процесса
- •VII. Общие нарушения жизнедеятельности у хирургического больного.
- •8. Электротравма и ее профилактика. "Мнимая смерть". Доврачебная помощь.
- •VIII. Механическая травма. Переломы.
- •IX. Термические и химические ожоги и отморожения.
- •X. Хирургическая инфекция.
- •XI. Гнойная хирургия кожи, клетчатки. Гнойная хирургия кисти.
- •XII. Гнойная хирургия серозных полостей, костей, суставов.
- •XIII. Специфическая хирургическая инфекция.
- •7. Актиномикоз, сифилис, проказа. Диагностика. Роль хирурга в лечении.
- •XIV. Общая гнойная хирургическая инфекция.
- •XV. Основы хирургии нарушений кровообращения.
- •XVI. Онкология.
- •XVII. Основы пластической хирургии и трансплантологии.
- •XVIII. Пред- и послеоперационный период.
- •1. Пред- и послеоперационный период
- •XIX. Практические навыки.
- •Правила наложения жгута
- •Повязка «Дезо»
- •Повязка «Вельпо»
- •Приготовление раствора и мытье рук по (Спасокукоцкому – Кочергину).
- •Холодный компресс:
XIX. Практические навыки.
1. Наложить шину при переломе плечевой кости.
Этапы выполнения транспортной иммобилизации переломов плечевой кости лестничной шиной Крамера:
Показание: перелом, вывих плеча.
Оснащение: лестничная шина Крамера, 2 бинта, вата, ножницы.
Примечание: фиксация трех суставов (лучезапястного, локтевого, плечевого).
Последовательность действий:
1. Усадить пациента лицом к себе, успокоить.
2. Объяснить ход предстоящей манипуляции.
3. Разрезать одежду по шву, открыть место травмы (если одежда не свободно облегает конечность).
4. Осмотреть место травмы, убедиться в наличии перелома или вывиха.
5. Выбрать лестничную шину Крамера: 120 см длиной, 11 см шириной.
6. Обернуть с двух сторон шину ватой и прибинтовать вату к шине.
7. Приложить шину к здоровой конечности пациента, от кончиков пальцев до локтевого сустава.
8. Убрать шину и в месте предполагаемого сустава согнуть ее под прямым углом.
9. Приложить шину к здоровой конечности и измерить от локтевого сустава к плечевому суставу.
10. Согнуть шину в месте предполагаемого плечевого сустава под тупым углом.
11. Приложить шину к здоровой конечности так, чтобы кисть предплечье и плечо было охвачено шиной, конец шины должен проходить по спине (плечевому поясу) до противоположного плечевого сустава (проверить правильность подготовки шины).
12. Придать поврежденной конечности среднефизиологическое положение (по возможности руку согнуть в локтевом суставе), кисть уложить на шине в положение между супинацией и пронацией.
13. Уложить на внутреннюю поверхность смоделированной шины кисть, предплечье и захватив свободной рукой другой конец, направить шину по задненаружной поверхности конечности через плечо, спину до плеча противоположной стороны.
14. Связать концы шины через здоровое надплечье и подмышечную ямку.
15. Вложить валик из ваты и марли в подмышечную впадину больной конечности и валик под пальцы кисти.
16. Зафиксировать шину на конечности спиральными ходами бинта до средней трети плеча.
17. Наложить повязку «Дезо» для лучшей фиксации конечности.
Примечание: наложение бинтовой повязки при травме плеча рекомендуется до локтевого сгиба или средней трети плеча, так как отведение руки во время бинтования очень болезненно.
2. Наложить жгут. Правила наложения жгута.
Правила наложения жгута
- жгут накладывают выше раны на расстоянии 5-7 см от ее верхнего края;
- конечность перед наложением жгута поднимают вверх.
- на место наложения жгута предварительно накладывают какую-либо ткань;
- жгут затягивают только до остановки кровотечения. Под него следует положить записку с указанием времени его наложения;
- перед наложением жгута кровоточащий сосуд выше раны прижимают пальцем, что позволяет без излишней спешки подготовиться к выполнению этой манипуляции;
- в теплое время года жгут можно не снимать в течении 2 ч, а в холодное время года- 1 ч.
Наложение кровоостанавливающего жгута – основной способ временной остановки кровотечений при повреждении крупных артериальных сосудов конечностей. Резиновый жгут состоит из толстой резиновой трубки или ленты длиной в 1-1,5 метра, к одному концу которой прикреплен крючок, а к другому – металлическая цепочка. Резиновый жгут растягивают, в растянутом виде прикладывают к конечности, предварительно наложив подкладку (одежда, бинт и другие предметы), и, не ослабляя натяжения, обертывают вокруг нее несколько раз так, чтобы витки ложились вплотную один к другому и чтобы между ними не попали складки кожи. Концы жгута скрепляют с помощью цепочки и крючка. При отсутствии резинового жгута можно использовать подручные материалы, например поясной ремень, галстук, веревку, бинт, носовой платок. При этом перетягивают конечность, как жгутом, или делают закрутку с помощью палочки. Жгут накладывают выше раны и как можно ближе к ней. Чтобы не повредить кожу, жгут накладывают поверх одежды или место наложения жгута несколько раз обертывают бинтом, полотенцем и тому подобное. При неумелом наложении жгута конечность может быть сдавлена слишком сильно или слишком слабо.
Если жгут наложен слабо, артерия оказывается пережатой не полностью и кровотечение продолжается; так как при этом вены пережаты жгутом, то конечность наливается кровью, повышается давление в сосудах и кровотечение может даже усилиться, кожа конечности из-за переполнения вен кровью приобретает синюшную окраску. При слишком сильном сдавливании конечности жгутом повреждаются подлежащие ткани, в том числе нервы, в результате чего может наступить паралич конечности. Жгут нужно затягивать только с такой силой, чтобы остановить кровотечение, но не более. При правильном наложении жгута кровотечение сразу же прекращается, а кожа конечности бледнеет. Степень сдавливания конечности жгутом можно определить по пульсу на какой-либо артерии ниже наложенного жгута – исчезновение пульса указывает на то, что артерия сдавлена. Наложенный жгут может оставаться не более двух часов, так как при длительном сдавливании может наступить омертвление конечности ниже жгута. К жгуту прикрепляется лист бумаги (картона) с указанием времени наложения жгута. В тех случаях, когда с момента наложения жгута прошло более двух часов, а пострадавший по какой-либо причине еще не доставлен в лечебное учреждение, на короткое время жгут снимают. Делаю это вдвоем: один производит пальцевое прижатие артерии выше жгута, другой медленно, чтобы поток крови не вытолкнул образовавшийся в артерии тромб, распускает жгут на 3-5 минут и снова накладывает его, но чуть выше предыдущего места. За раненым, которому наложен жгут, необходимо наблюдать, так как жгут может ослабнуть и кровотечение возобновится.
3. Определение групп крови.
Суть метода сводится к обнаружению в исследуемой крови групповых антигенов А и В с помощью стандартных изогемагглютинирующих сывороток. Для этого используют реакцию агглютинации. Постановку реакции проводят в помещении с хорошим освещением при температуре 15-25?С.
Необходимое оснащение
1. Стандартные изогемагглютинирующие сыворотки групп 0(I), A(II), В(III) и АВ(IV) двух различных серий. Сыворотки для определения групп крови изготавливают в специальных серологических ла- бораториях из донорской крови. Сыворотки хранят при температуре 4-8 С (в холодильнике).
Для удобства стандартные гемагглютинирующие сыворотки различных групп подкрашивают так, чтобы они имели определённый цвет: 0(I) - бесцветная, А(II) - синяя, В(III) - красная, АВ(IV) - ярко-жёлтая. Следует отметить, что указанные цвета сопутствуют всем этикеткам на препаратах крови, имеющих групповую принадлежность (кровь, эритроцитарная масса, плазма и др.) 2. Белые фарфоровые или эмалированные тарелки, или любые другие; пластинки со смачиваемой поверхностью, маркированные 0(I), А(П), В(Ш), AB(IV). 3. Изотонический раствор хлорида натрия. 4. Иглы, пипетки, стеклянные палочки (предметные стёкла).
Методика проведения реакции
1. Перед началом реакции подписывают тарелку (наносят фамилию и инициалы исследуемого), после чего на неё под соответствующие обозначения наносят стандартные изогемагглютинирующие сыворотки I, II и III групп в объёме 0,1 мл (капля около 1 см в диаметре). Во избе- жание ошибок наносят две серии сывороток каждой из групп, так как одна из серий может иметь низкую активность и не дать чёткой агглютинации. Всего получается шесть капель, образующих два ряда по три капли в следующем порядке слева направо: 0(I), А(П), В(Ш). 2. Кровь для исследования берут из пальца или из вены
на тарелку наносят одну большую каплю крови, из которой её забирают уголком предметного стекла и переносят в каждую каплю сыворотки, аккуратно перемешивая с последней. При этом всякий раз кровь берут новым уголком стекла, следя за тем, чтобы капли не сливались. 3. После смешивания тарелку периодически покачивают. Агглютинация начинается в течение первых 10-30 с, однако наблюдение следует обязательно вести до 5 мин ввиду возможности более поздней агглютинации, например с эритроцитами группы A2(II). 4. В те капли, где произошла агглютинация, добавляют по одной капле изотонического раствора хлорида натрия, после чего оценивают результат реакции.
Трактовка результатов
Реакция агглютинации может быть положительной или отрицательной. При положительной реакции обычно в течение первых 10- 30 с в смеси появляются видимые невооружённым взглядом мелкие красные зёрнышки (агглютинаты), состоящие из склеенных эритроцитов. Мелкие зёрнышки постепенно сливаются в более крупные зёр- на, а иногда в хлопья неправильной формы. При этом сыворотка частично или полностью обесцвечивается. Положительная реакция может быть пескообразной или лепестковой
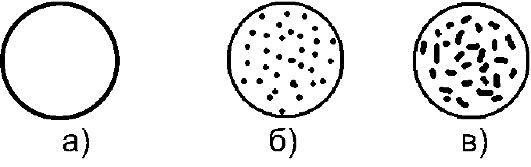
а - агглютинации нет; б - пескообразная агглютинация; в - лепестковая агглютинация
При отрицательной реакции капля остаётся равномерно окрашенной в красный цвет, в ней не обнаруживают никаких зёрнышек (агглютинатов).
Результаты реакций в каплях с сыворотками одной и той же группы (двух серий) должны совпадать.
Принадлежность исследуемой крови к соответствующей группе определяют по наличию или отсутствию агглютинации при реакции с соответствующими сыворотками после наблюдения в течение 5 мин При этом следует отметить, что если сыворотки всех трёх групп дали положительную реакцию, это указывает на то, что испытуемая кровь содержит оба агглютиногена (А и В) и принадлежит к группе AB(IV). Однако в таких случаях для исключения неспецифической реакции агглютинации необходимо провести дополнительное контрольное исследование испытуемой крови со стандартной изогемагглютинирующей сывороткой группы AB(IV), не содержащей агглю-
Оценка результатов реакции со стандартными изогемагглютинирующими сыворотками
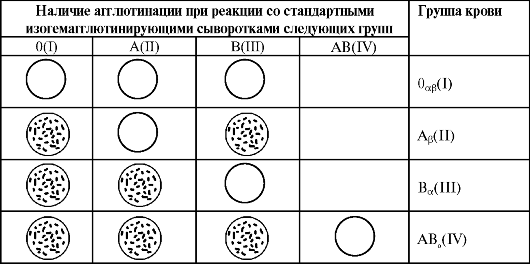
Лишь отсутствие агглютинации в этой капле при наличии агглютинации в каплях, содержащих стандартные сыворотки групп 0(I), А(II) и В(III), позволяет считать реакцию специфической и отнести исследуемую кровь к группе АВ0(IV).
4. Произвести иммобилизацию при переломе шейного отдела позвоночника.
Иммобилизацию шеи и головы производят с помощью мягкого круга, ватномарлевой повязки или специальной транспортной шины Еланского.
При иммобилизации мягким подкладным кругом пострадавшего укладывают на носилки и привязывают во избежание движений. Ватно-марлевый круг кладут на мягкую подстилку, а голову пострадавшего - на круг затылком в отверстие.
Иммобилизацию ватно-марлевой повязкой - «воротником типа Шанца» - можно производить в том случае, если нет затрудненного дыхания, рвоты, возбуждения. На шею пострадавшего в положении лежа накладывается циркулярно заранее приготовленная высокая ватно-марлевая повязка со слоем ваты толщиною около 4-5 см. Повязку фиксируют марлевыми бинтами. Воротник должен упираться в затылочный бугор и в оба сосцевидных отростка, а снизу опираться на грудную клетку, что устраняет боковые движения головы во время транспортировки.
При иммобилизации шиной Еланского обеспечивается более жесткая фиксация. Шина изготовлена из фанеры, состоит из двух половин-створок, скрепленных между собой петлями. В развернутом виде шина воспроизводит контуры головы и туловища. В верхней части шины имеется выемка для затылка, по бокам которой идут два полуокружных валика из клеенки. На шину накладывают слой ваты или мягкотканную подкладку. Шину тесемками крепят к туловищу и вокруг плеч.
5. Подготовить систему для переливания крови.
Для переливания крови следует пользоваться пластиковой системой разового пользования с капроновым фильтром, который позволяет предупредить попадание тромбов в кровяное русло больного. Система состоит из короткой трубки с иглой и фильтром для поступления воздуха во флакон, длинной трубки для вливания крови с двумя иглами на концах для введения во флакон и для пункции вены больного. Система снабжена капельницей с капроновым фильтром и пластинчатым зажимом для регулирования скорости введения. Выпускается в стерильном виде в полиэтиленовом мешке, из которого ее извлекают непосредственно перед использованием.
Монтируя систему для переливания крови, необходимо соблюдать правило: переливать кровь из того же сосуда, в котором она была заготовлена и хранилась. При переливании крови из пластикового мешка кровь в мешке перемешивают, на центральную отводную трубку мешка накладывают кровоостанавливающий зажим, а трубку обрабатывают спиртом или 10% йодной настойкой и обрезают на 1-1, 5 см ниже зажима. С канюли системы для переливания снимают предохранительный колпачок и систему подсоединяют к мешку путем соединения конца трубки мешка и канюли системы. Мешок подвешивают вверх дном к штативу, систему с капельницей приподнимают и переворачивают таким образом, чтобы фильтр в капельнице располагался сверху. Снимают зажим с трубки, капельницу наполовину заполняют кровью и накладывают зажим. Систему возвращают в исходное положение, фильтр в капельнице находится внизу и должен быть заполнен кровью. Снимают зажим и заполняют кровью часть системы, расположенной ниже фильтра, до полного вытеснения из нее воздуха и появления из иглы капель крови. Несколько капель крови из иглы пускают на тарелку для контрольного определения группы крови донора и проведения проб на совместимость. На глаз определяют отсутствие в системе пузырьков воздуха. Система готова для переливания. Скорость инфузии регулируют с помощью зажима. При необходимости присоединить новый мешок зажимом перекрывают систему, кровоостанавливающим зажимом перекрывают трубку, мешок отсоединяют и заменяют новым. При переливании крови из стандартного флакона алюминиевый колпачок с крышки снимают, резиновую пробку обрабатывают спиртом или йодной настойкой и прокалывают двумя иглами. К одной из этих игл подсоединяют короткую трубку для поступления воздуха, конец которой устанавливают выше дна флакона, к другой-систему для разового пользования и флакон располагают в штативе вверх дном. Систему заполняют кровью аналогичным образом. Закончив монтирование и заполнение системы, определив групповую совместимость крови по системе AВO и резус-фактору, приступают непосредственно к переливанию крови, подсоединив систему к игле, если вена была пунктирована заранее и в нее вливались кровезаменители, или осуществляют пункцию вены и подсоединяют систему для трансфузии крови.
6. Измерение абсолютной и относительной длины конечности.
Для правильного измерения длины конечностей необходимо соблюдение следующих условий: а) измерение должно быть сравнительным (измеряется одновременно здоровая и больная конечности); б) опознавательными точками для измерения служат костные выступы; в) при измерении необходимо пользоваться симметричными костными выступами.
Длина конечностей определяется сопоставлением симметричных опознавательных точек на глаз и с помощью простейших измерительных приборов.
Производится с помощью сантиметровой ленты.
Абсолютная длина: плечо - от большого бугорка плечевой кости до наружного надмыщелка плеча; предплечье - от вершины локтевого отростка до шиловидного отростка; бедро - от большого вертела до наружного надмыщелка бедра; голень - от головки малоберцовой кости до наружной лодыжки.
Относительная длина: верхняя конечность - от акромиального конца лопатки до кончика III пальца;
нижняя конечность - от передней верхней ости подвздошной кости до внутренней кости.
7. Определение индивидуальной совместимости крови перед гемотрансфузией.
Для постановки реакций необходимо получить сыворотку реципиента. Поэтому предварительно у него из вены берут кровь, которую разделяют на сгусток и сыворотку (отстаиванием или центрифугированием).
Проба на индивидуальную совместимость по системе АВ0: На белую поверхность (тарелку, пластинку) наносят крупную каплю (0,1 мл) сыворотки крови реципиента и маленькую каплю (0,01 мл) крови донора из флакона, смешивают их между собой, периодически покачивая тарелку (пластинку). Реакцию проводят при температуре 15-25 ?С, результаты оценивают через 5 мин: отсутствие агглютинации эритроцитов донора свидетельствует о совместимости крови донора и реципиента по системе АВ0. Появление агглютинации указывает на их несовместимость - такую кровь данному больному переливать нельзя.
Проба на индивидуальную совместимость по резус-фактору: После того как установлена совместимость крови донора и реципиента по системе АВ0, необходимо установить совместимость в отношении резус-фактора. Пробу на совместимость по резус-фактору проводят с использованием 33% декстрана (ср. мол. масса 50 000- 70 000). Реакцию проводят в центрифужной пробирке без подогрева в течение 5 мин. На дно пробирки вносят 2 капли сыворотки реципиен- та, 1 каплю донорской крови и 1 каплю 33% раствора декстрана (ср. мол. масса 50 000-70 000). После этого содержимое перемешивают, наклоняя пробирку и вращая её вокруг оси, распределяя содержимое по стенкам ровным слоем. Пробирку вращают в течение 5 мин, после чего добавляют 3-4 мл физиологического раствора и аккуратно перемешивают, 2-3 раза наклоняя пробирку до горизонтальной плос- кости (не взбалтывая!). После этого оценивают результат: наличие агглютинации эритроцитов свидетельствует о несовместимости крови донора и реципиента по резус-фактору, такую кровь переливать нельзя. Равномерное окрашивание содержимого в пробирке, отсутствие реакции агглютинации указывает на совместимость крови донора и реципиента по резус-фактору.
При совместимости крови донора и реципиента по системе АВ0 и резус-фактору можно приступать к дальнейшим операциям. Однако у некоторых реципиентов (при наличии неполных скрытых или блокирующих антител, низкой активности иммунных антител) указанные пробы не выявляют несовместимости. Поэтому определённой категории лиц проводят индивидуальный подбор крови.
8. Определить вид и особенности переломов костей на рентгенограммах.
Рентгенологическую диагностику осуществляют в соответствии с изложенными выше принципами проведения рентгенологического исследования у пострадавших с острой травмой. Для выявления нарушения целостности костной ткани рентгенограмму лучше всего анализировать на негатоскопе, при этом особое внимание уделяют целостности кортикального слоя. Нарушение его непрерывности позволяет обнаружить зону перелома. Также необходимо уточнить другие рентгенологические характеристики (точная локализация, характер смещения костных отломков, полностью проследить линию перелома и др.). В сложных диагностических случаях дополнительно могут быть выполнены рентгенограммы повреждённого сегмента в специальном положении, а также КТ или МРТ. При переломе костей без смещения отломков на рентгенограмме определяется более или менее узкая полоска просветления, соответствующая плоскости П.— линия П., которая, прерывая костную структуру, проходит через корковый и губчатый слои кости, но наиболее отчетливо прослеживается в корковом веществе. Края линии П. обычно неровные, а направление ее различно в зависимости от вида П. При неполных переломах — трещинах (рис. 14, 1, 2), чаще встречающихся в плоских костях, линия П. не достигает противоположного края кости, а, постепенно суживаясь, теряется в структуре неповрежденного костного вещества. Иногда трещины и П. без смещения отломков непосредственно после травмы выявляются настолько неотчетливо, что увидеть их удается только при очень тщательном анализе рентгенограммы (или томограммы) и то при помощи лупы. В зависимости от плоскости П. различают: поперечный, косой, продольный и спиральный переломы. Комбинацию продольного и поперечного П. обозначают как Т-образный перелом, двух косых — как V-образный П., двух косых и продольного — как Y-образный П. По характеру смещения отломков различают: угловое, боковое, продольное — с захождением и расхождением отломков, с вклинением отломков — так называемый вколоченный перелом (рис. 14, 7—9), а также смещение по периферии (с поворотом по окружности). Описание рентгенограмм проводят по определенной схеме: дата рентгенографии и номер рентгенограммы (для документирования динамики исследований, так как каждому пострадавшему обычно проводят 4-6 исследований, для контроля за стоянием отломков и процессом сращения перелома); указывается анатомический сегмент, отраженный на рентгенограмме, и количество проекций; при наличии перелома: указывается его локализация и вид - уровень, линия перелома, смещение костных отломков;
дают рентгенологическое заключение о диагнозе; в ходе процесса сращения переломов дают оценку стояния костных отломков и состояния костной мозоли.
9. Определение годности консервированной крови. Хранение.
Определять годность консервированной крови, эритроцитной массы нужно при достаточном освещении на месте хранения, т.к. малейшее взбалтывание крови может привести к ошибочному заключению из-за окрашивания плазмы в розовый цвет от смешивания с эритроцитами.
Критериями годности крови или эритроцитной массы для переливания являются: прозрачность плазмы, отсутствие в ней мути, хлопьев, нитей фибрина, выраженного гемолиза (красное окрашивание плазменного слоя), равномерность слоя глобулярной массы и отсутствие в нем сгустков, наличие четкой границы между глобулярной массой и плазмой.
При бактериальном загрязнении компонентов крови цвет плазмы становится тусклым, серовато-буроватого оттенка, она теряет прозрачность и в ней появляются взвешенные частицы в виде хлопьев или пленок. Если такие компоненты крови обнаружены, их переливать нельзя, они подлежат возврату в учреждение-производитель.
Хранение крови. Кровь следует хранить при температуре от 4 до 6° С в холодильниках (на нижних полках). Одним из условий сохранения биологически полноценной крови является по возможности более полный покой.
В процессе хранения рекомендуется как можно реже передвигать флаконы и тем более взбалтывать кровь. Наиболее целесообразно хранить их в вертикальном положении, так как именно в этом положении лучше всего производить ежедневный осмотр на наличие гемолиза. При более высоких и низких температурных режимах гемолиз крови наступает быстрее обычных сроков. Целесообразно переливать кровь не более 10-дневной давности, так как в дальнейшем она частично утрачивает свои полноценные физиологические и биологические свойства; максимальный срок хранения крови 21 день.. Хранившуюся кровь следует подвергать ежедневному визуальному осмотру с целью выявления изменений (гемолиз, сгустки, помутнения), а данные осмотра заносить в специальный журнал. Срок хранения эритроцитной массы — от 7 до 23 дней в зависимости от консерванта
10. Повязки на грудную клетку, голову, Дезо, Вельпо, суставы.
