
3 курс / Общая хирургия и оперативная хирургия / Сосудистая_хирургия_по_Хаймовичу_Том_2_Ашер_А_,_Покровский_А_В_2012
.pdf
334 Раздел XI. Артерио-венозные мальформации
А
Б |
|
В |
|
|
|
Ж
Г
Д
Е
З
Рис. 83.17. (А) Артерио-венозная мальформация с высокой степенью сброса. (Б) Клиническая картина подтверждается при правосторонней каротидной ангиографии, при которой диагностируется питание из сети наружной сонной артерии. (В) Состояние после эмболизации. (Г) Резекция ангиодисплазии спустя 48 ч после эмболизации с использованием реконструктивной техники по Karapandzic. (Д) Патологические ткани удалены. (Е) Реконструкция губ и подбородочной области. (Ж) Результат после операции. (З) Функция губ. (С разрешения из Forbes G., May G.R., Jackson I.T. Vascular animalies in children. In Jackson I.T., Mustarde J. Plastic surgery in infancy and childhood. New York: Churchill Livingstoone, 1988; 691–710.)
A |
|
Б |
|
|
|
Рис. 83.18. (А) Ангиография при АВ-мальформации плеча с высокой степенью сброса. Зона дисплазии питается из a.circumflexa humeri. (Б) Ангиограмма после эмболизации сгустками крови, большинство артерий окклюзировано. Оперативное вмешательство произведено через 24 ч после эмболизации. (С разрешения из Forbes G., May G.R., Jackson I.T. Vascular animalies in children. In Jackson I.T., Mustarde J. Plastic surgery in infancy and childhood. New York: Churchill Livingstoone, 1988; 691–710.)
https://t.me/medicina_free

Глава 83. Артерио-венозные свищи и мальформации 335
требует тщательного планирования, хороших знаний анатомии сосудистой системы, участия рентгенорадиолога или нейрорадиолога, владеющих техникой селективной или суперселективной катетеризации. Источниками питания врожденных АВ-дисплазий часто бывают несколько артерий, поэтому может потребоваться катетеризация всех задействованных сосудов. Основная задача эмболизации — ликвидация патологического шунтирования на уровне прекапилляров и капиллярного русла. Окклюзия основного артериального ствола является серьезной ошибкой, так как это делает невозможным проведение дальнейших эмболизаций в зоне АВ-мальфор- мации и запускает процесс развития дистальной коллатерализации.
Материалы, используемые для эмболизации, должны быть такими малыми, чтобы достичь уровня капиллярного русла, но в то же время больше диаметра АВ-фистул для предупреждения легочной эмболии. Эти материалы подразделяются на две группы: временные и постоянные. Временные эмболизирующие агенты (сгустки крови, желатиновая губка или микрофибриллы коллагена) чаще используются для предоперационной эмболи-
зации с целью уменьшения интраоперационной кровопотери. Они не наносят вреда нормальным тканям и рассасываются в течение нескольких дней или недель. К группе постоянных эмболов относятся силиконовые сферы, частицы поливинил-алко- голя, стальные спирали и для закрытия крупных свищей — съемные баллоны. Могут использоваться и жидкие субстанции (абсолютный спирт или бикрилат), хотя применение второго менее предпочтительно из-за выявленного у него в последнее время канцерогенного эффекта.
Силиконовые сферы обладают точно выверенным размером, но их недостатком является необходимость использования для доставки катетера с большим диаметром. Среди больших преимуществ эмболов из поливинил-алкоголя (Ivalon): 1) возможность использования катетеров малого диаметра и 2) увеличение диаметра данных частиц в размерах до 10 раз. Эти эмболы вводятся в виде жидкой суспензии с использованием контраста и теплого солевого раствора, содержащего частицы диаметром от 100 мкм до 1 мм в диаметре [19].
Стальные спирали, покрытые дакроном, предназначены для адекватной окклюзии крупных сосудов (рис. 83.19). Тромбоз, ин-
A |
|
Б |
|
|
|
|
|
|
|
|
Рис. 83.19. (А) Артерио-венозная мальфор- |
|
|
|
|
|
|
|
|
|
|
|
мация левой верхней конечности и кисти у |
|
|
|
|
|
26-летней женщины с высокой степенью |
|
|
|
|
|
сброса. (Б) На артериограмме отмечается экс- |
|
|
|
|
|
тенсивная мальформация с поражением ко- |
|
|
|
|
|
сти и мягких тканей. (В) При селективной |
|
|
|
|
|
ангиографии глубокой артерии плеча выяв- |
|
|
|
|
|
ляются афферентные межкостные ветви. |
|
|
|
|
|
(Г) Крупная артерио-венозная фистула с ло- |
|
|
|
|
|
кализацией в костно-мозговом канале эм- |
|
|
|
|
|
болизирована с использованием 13 спиралей |
|
|
|
|
|
и трех пучков шелка № 2–3. Достигнута поч- |
|
|
|
|
|
ти полная окклюзия артерио-венозной фис- |
|
|
|
|
|
тулы плечевой кости. (Courtesy of A. W. |
В |
|
|
|
Г |
Stanson, Mayo Clinic and Foundation.) |
|
|
|
|
|
|
https://t.me/medicina_free

336 Раздел XI. Артерио-венозные мальформации
дуцируемый пучком дакрона, может быть дополнительно усилен инъекциями тромботического материала.
Эмболизацию можно провести в одну или несколько сессий с использованием постоянного мониторирования и техники низкоскоростного введения эмболов через однопросветный конусовидный катетер, описанный Kerber в 1977 г. [98]. Эта методика предложена с целью избежать рефлюкса и достичь лучшего расположения эмболизирующих частиц.
Осложнения при данном методе лечения не возникнут, если правильно использовать различные типы эмболов с четким соблюдением всех технических моментов при хорошем знании и учете ангиоархитектоники зоны поражения. В то время, как некоторые сосуды (ветви a. hypogastrica, a. profunda femorois, некоторые мышечные ветви) являются идеальными субстратами для эмболизации, постэмболическая окклюзия дистальных артерий может совершенно непредсказуемо привести к ишемическим расстройствам тканей и даже гангрене.
Forbes с соавторами [19] сообщил о 31 лечебной эмболизации у 23 пациентов с экстракраниальными сосудистыми мальформациями головы. У 7 из 9 пациентов с АВ-дисплазиями достигнут отличный результат — степень окклюзии составила 80% и больше. Двое оставшихся пациентов с высокоскоростными поражениями потребовали в дальнейшем после эмболизации проведения хирургического вмешательства. Хорошие результаты лечения приводятся при эмболизационном лечении АВД таза [99–102] и конечностей [100, 102].
Jacobowitz с соавторами [104] из госпиталя Нью-Йорка представили отдаленные результаты транскатетерной эмболизации симптомных АВ-дисплазий таза у 35 пациентов. Наиболее часто в клинической картине отмечались боли в животе (59%), определяемое при пальпации дрожание или шумовая симптоматика (44%), кровотечения (27%). В 18% наблюдений отмечены проявления перегрузки миокарда. В 89% случаев подтверждено АВ-шунтирование. Потребовалось 2,4 эмболизационные сессии (варьирование от 1 до 11 процедур), со средним периодом 23,3 месяца (от 1 до 144 месяцев). Наиболее часто использовались быстро полимеризующиеся эмболы из адгезивного акрилата. У 20 пациентов (53%) потребовалось проведение более одной процедуры. Хирургическое лечение как дополнительное вмешательство проведено только 5 пациентам (15%). В отдаленном периоде (сроки наблюдения от 1 до 204 месяцев, средний показатель 84 месяца) 83% пациентов оставались асимптомными или отмечали значимое улучшение. Авторы делают вывод, что транскатетерная эмболизация является методом выбора при симптомных АВД тазовой локализации. Лигирования проксимальных афферентных артерий следует избегать, так как это не позволяет при необходтимости выполнить эмболизацию в дальнейшем.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Еще раз стоит подчеркнуть, что методика лигирования проксимальных афферентых артерий не должна применяться в лечении АВ-дисплазий. Она неизменно ведет к развитию коллатерального кровообращения и делает невозможным проведение эндоваскулярной эмболизации. Прямые афферентные артериальные сосуды могут быть лигированы только в редких случаях, когда сразу же планируется проведение радикальной резекции зоны ангиодисплазии.
Наличие АВ-дисплазии не всегда предполагает использование агрессивной хирургической тактики. Применение консер-
вативной тактики отражено в работе Gomes и Bernatz [105] из клиники Mейo: из 80 пациентов с врожденными АВ-дисплази- ями конечностей хирургическому вмешательству были подвергнуты только 10. Показаниями к хирургическому лечению считаются быстрое прогрессирование патологического процесса, распространение на важные окружающие анатомические структуры, ишемия конечностей, трофические язвы, кровотечение, инфекция, редко косметические проблемы, появление признаков сердечной недостаточности. При этом хирургическое вмешательство должно быть тщательно спланировано. По нашему мнению, оптимальным вариантом должно быть проведение эмболизации с последующим радикальным хирургическим иссечением зоны ангиоматоза. При этом эмболизация может выполняться до тех пор, пока не будет достигнута окклюзия всех главных питающих артерий.
При обсуждении плана операции мы должны стремиться к проведению резекционного вмешательства в один этап. Только у 20 % пациентов с АВ-дисплазиями возможно проведение радикальной резекции [106]. При поражении конечностей с целью уменьшения интраоперационной кровопотери необходимо пользоваться методикой наложения проксимального турникета. Во время операции необходимо стремиться с выполнению тщательного гемостаза. Рутинным должно стать использование во время операции с целью аутотрансфузии аппарата возврата крови (Cell-saver). Для удаления обширных АВ-дисплазий можно использовать методики обходного шунтирования, искусственного кровообращения, гипотермии [107]. Интраоперационное применение ультразвуковой допплерографии может быть полезным для уточнения объема поражения и локализации питающих сосудов [108]. Использование техники тщательного предварительного лигирования всех ветвей крупных артериальных и венозных магистралей конечностей позволило Vollimar и Stalker [69] достигнуть положительного результата у 19 из 21 пациента с АВ-мальформациями конечностей. Только в 2 случаях потребовалось выполнение ампутации. Мы сочетаем подобную методику с радикальной резекцией даже в том случае, если образуется большой дефект тканей. Это требует реконструктивного вмешательства с использованием расщепленного или полнослойного лоскута на сосудистой ножке. К сожалению, опираясь на собственные данные, можно заявить, что в большинстве случаев обширные поражения не возможно удалить. Szilagyi [106] cообщил о 5 неудовлетворительных результатах из 8 пациентов с глубокими диффузными поражениями арте- рио-венозным ангиоматозом, где была предпринята попытка резекционного вмешательства. Основная цель при операции достигнута только у одного, в 5 случаях результаты оценены как неудовлетворительные. Trout с соавторами [109] выполнил оперативные вмешательства при поражении АВД нижних конечностей у 4 пациентов — в 2 случаях в дальнейшем потребовалось проведение ампутации. По данным нашего ретроспективного исследования [78], у симптомных пациентов после хирургического лечения достигнуты лучшие результаты. Возможно, это было связано с тем, что большое число АВ-дисплазий при локализованных поражениях лечилось консервативно. Группа оперированных пациентов (82 человека) включала 18, где потребовалось проведение ампутации на том или ином уровне конечности. Большинство этих ампутаций, однако, были спасительными для пациентов, предотвратив тяжелые осложнения вследствие неуклонного прогрессирования патологического процесса. На рис. 83.20 обобщены наши данные на сегодняшний день по концепции лечения АВ-дисплазий.
https://t.me/medicina_free

Глава 83. Артерио-венозные свищи и мальформации 337
Клиническое исследование Неинвазивные методы исследования Магнитно-резонансное исследование
Локализованное |
|
|
Диффузное |
|
|
поражение |
|
|
поражение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Артериография |
|
|
С высокой |
|
|
С низкой |
|
|
|
степенью |
|
|
степенью |
||
|
|
|
|
|
|||
|
|
|
шунтирования |
|
|
шунтирования |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кровотечение?
Критическая ишемия? Нет Неустранимый болевой синдром?
Трофические язвы?
Да |
Возвышенное положение |
|
конечности |
|
Эластическая компрессия |
|
|
Ангиография с эмболизацией + хирургическое вмешательство или ампутация
Хирургическое лечение по особым показаниям
Рис. 83.20. Лечение врожденных артерио-венозных мальформаций периферической локализации. (С разрешения из Rutherford R.B. St.Belov D.A., Loose J.W. Periodica Angiologica 16, Vacular Malformatioms. Hamburg, Germany: Einhorn-Presse Verlag, 1989; 64.)
Артерио-венозные мальформации висцеральных органов
Как результат развития диагностических методик, особенно при проведении селективных катетеризаций кардиальных артерий и в бассейне верхней брыжеечной артерии, за последнее время значительно возросли выявляемость и значимость таких поражений как АВ-мальформации желудочного-кишечного тракта. Для I типа (классификация Moore с соавторами) [110] характерно возникновение поражения, как правило, у пожилых пациентов с нарушениями функции клапанов сердца или проявлениями выраженного атеросклероза с локализацией в терминальном отделе подвздошной кишки, слепой или восходящей толстой кишки. Второй тип является истинно врожденным, чаще встречается у молодых пациентов, наиболее характерная локализация — верхние отделы тонкой кишки. Третий тип поражения — т.н. «точечные ангиомы», при которых возможны гастроинтестинальные проявления врожденных геморрагических телеангиоэктазий (синдром Rendu–Osler–Weber).
Для объективизации поражения необходимо проведение селективной или суперселективной ангиографии с усилением, при этом отмечается появление на ангиограмме так называемого синдрома «извитой дорожки» с одновременным избыточным контрастированием питающих артерий и дренирующих вен.
В случае осложненного течения поражения (некорригируемое в результате консервативных мероприятий кровотечение) требуется проведение эмболизации, эндоскопическеских манипуляций и даже хирургических вмешательств. Эмболизация должна выполняться только по очень жестким показаниям и только
всуперселективном исполнении, учитывая достаточно большую вероятность возникновения некроза кишки [102]. Для этих же целей могут быть применены эндоскопические манипуляции с использованием моноили биполярной коагуляции, термальных датчиков или фотокоагуляции — наибольшую популярность в последнее время завоевывает Nd-YAG лазер. Он вызывает тепловую деструкцию сосудистых образований, особенно в субмукозном слое, провоцирующую появление язвенных поражений на слизистой; последние требуют заживления в течение нескольких недель. Эта методика весьма эффективна в случае остановки кровотечения из сосудистых образований, хотя частота их рецидивов достаточно велика и достигает по сообщениям 25%. В наблюдении за 59 пациентами, в лечении которых использовался лазер,
вдвух случаях были отмечены перфорации слепой кишки, потребовавшие гемиколэктомии [111].
Если поражение четко идентифицируется на ангиограмме, весьма эффективным является хирургическое вмешательство. Интраоперационное определение слизистых АВ-мальформаций может быть облегчено использованием трансиллюминации. Частота повторных кровотечений, возникающих, как правило, из других источников, составляет при этом методе лечения 10% [112].
https://t.me/medicina_free

338 Раздел XI. Артерио-венозные мальформации
Почечные АВ-мальформации, располагающиеся обычно под слизистой коллекторной системы, могут провоцировать боли в пояснице или гематурию и чаще всего выявляются при выполнении ангиографии почечных артерий по другому поводу. Описаны случаи массивных кровотечений из почечных АВ-мальформа- ций во время беременности [113].
С лечебной целью используется транскатетерная эмболизация. В случае ее неудачи возможно проведение частичной или полной нефрэктомии.
АВ-мальформации печени или селезенки встречаются достаточно редко и являются, как правило, манифестацией геморрагических телеангиоэктазий (синдром Rendu–Osler–Weber) [114]. В клинической картине могут встречаться желтуха, выраженная спленомегалия и даже сердечная недостаточность, обусловленная высоким объемом шунтирования. При симптоматических поражениях методами выбора являются эмболизация и хирургическое вмешательство.
АВ-мальформации легких почти в 40% случаев ассоциируют с врожденными геморрагическими телеангиоэктазиями. В клинической картине наиболее часто отмечаются диспноэ, кровохарканье, усиленное сердцебиение; у 60% пациентов отмечается шумовая симптоматика [115]. Дополнительным признаком может быть цианоз. В случае врожденных геморрагических телеангиоэктазий, как правило, отмечаются множественные фистулы. С течением времени отмечается увеличение объема шунтирования и частоты связанных с этим фактом осложнений (особенно цереброваскулярного характера).
Ангиография подтверждает многоочаговость поражения и позволяет определить источники сброса. Хирургическое лечение показано при наличии клинической симптоматики, наличия одиночного АВ-свища, а также в редких случаях системного шунтирования [115]. При множественных АВ-мальформациях с двухсторонней локализацией требуется выполнение этапной двухсторонней то-
ракотомии [116]. Barth с соавторами описали опыт успешного эмболизационого лечения множественных двухсторонних поражений с применением съемных баллонов [103].
Синдром Клиппеля–Треноне
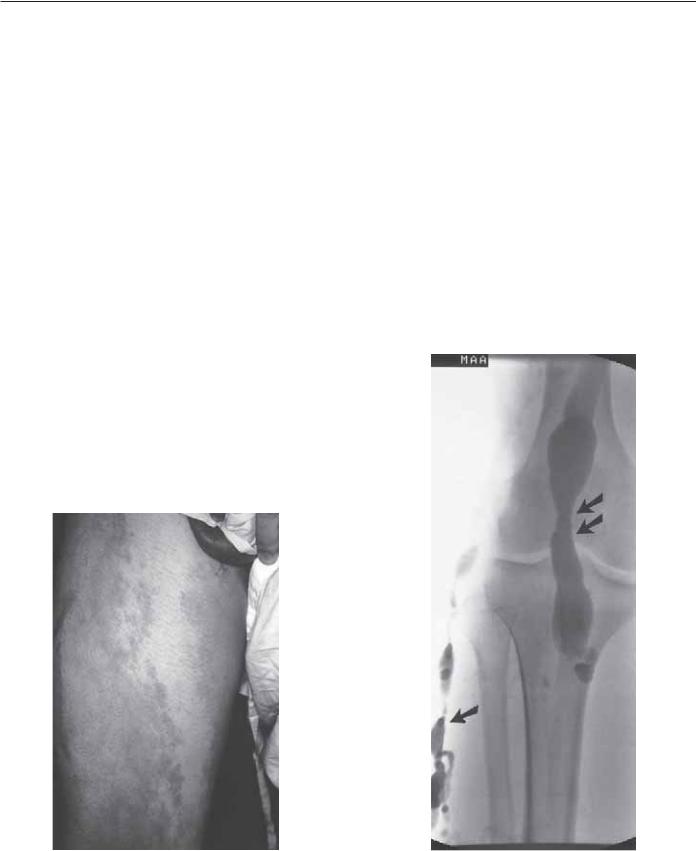
Cиндром Клиппеля–Треноне (CКТ) — одна из наиболее известных сосудистых мальформаций с поражением вен, капилляров и лимфатической системы [76, 77, 81, 82, 117–123]. При данном синдроме наиболее часто поражаются сосуды нижних или верхних конечностей, реже поражение локализуется на теле, голове или шее. Наиболее важными признаками синдрома являются наличие варикозного расширения вен, капиллярной мальформации (кожный невус) и гипертрофии мягких тканей и костей (рис. 83.21А, Б и 83.22). Патология лимфатической системы — достаточно распространенное явление при этой комплексной мальформации. Одним из часто встречающихся клинических признаков считается наличие персистирующих эмбриональных вен, агенезии, гипоплазии, клапанной недостаточности или аневризматической перестройки глубоких вен (рис. 83.23).
СКТ является следствием появления аномалий мезодермального происхождения (кровеносных сосудов, костных структур и мягких тканей). Клинически значимого АВ-шунтирования не определяется. Развитие аномалий связано с процессом ангиогенеза и влиянием ряда сосудистых факторов, наиболее известным из которых является эндотелиальный фактор роста сосудов (VEGF). Влияние гемодинамических факторов на гипертрофию конечностей не доказано и, скорее всего, их роль менее значима, чем ранее считалось. По нашему мнению, гипертрофия мягких тканей и костей не имеет прямой причинной связи с имеющимся венозным стазом. По поводу симптоматического варикоза и прогрессирующей венозной недостаточности, обусловленной клапанной не-
|
|
|
Рис. 83.21. (А) 19-летний пациент с рез- |
|
|
|
ко выраженной эмбриональной веной по |
|
|
|
латеральной поверхности от лодыжки до |
|
|
|
сафено-феморального соустья. (Б) Тот же |
|
|
|
пациент после 5 мин нахождения в верти- |
|
|
|
кальном положении, вены перед операци- |
|
|
|
ей отмечены маркером. (С разрешения из |
|
|
|
Noel A.A. Gloviczki P. Et al. Surgical treat- |
|
|
|
ment of venous malformations in Кlippel- |
|
|
|
Trenaunay syndrome. J Vasc Surg 2000; 32: |
A |
|
Б |
|
|
840–847.) |
||
|
|
|
|
|
|
|
https://t.me/medicina_free
Глава 83. Артерио-венозные свищи и мальформации 339
состоятельностью, пациенты нуждаются в оперативном лечении значительно реже, чем в случае окклюзии магистральных вен.
Большинство клинических наблюдений являются спорадическими, в литературе встречается описание небольшого числа наблюдений наследственной предрасположенности [126]. У 14 пациентов из Испании проведен анализ взаимосвязи отцовского и материнского возраста, количества беременностей с развитием заболевания, что, по мнению авторов, подтверждало непостоянно-выраженный аутосомно-доминантный наследственный характер [127].
В большинстве случаев клинически синдром проявляется с рождения или в первые годы жизни. По данным нашей клиники, из 252 пациентов с СКТ кожный невус отмечался у 98%, варикоз — у 72%, гипертрофия конечностей — у 67% из них [123]. 63% пациентов имели сразу все три основных клинических признака. У 29% были отмечены различные аномалии пальцев — синдактилия, макродактилия, полидактилия [123]. Клиническая симптоматика определялась локализацией и протяженностью гипертрофии и сосудистой мальформации, варьирующей от легко выраженного варикоза до массивного поражения венозных магистралей.
Лечение чаще всего консервативное и включает эластическую компрессию, возвышенное положение конечностей, лазеротерапию при кожных поражениях, физиолечение при лимфатических отеках (мануальный лимфатический дренаж, интремиттирующая пневматическая компрессия).
Нами проведен анализ результатов хирургического лечения 20 пациентов с СКТ, что составило 6,9% из 290 пациентов с дан-
Рис. 83.22. «Винные пятна» (капиллярная мальформация) пораженной конечности у пациента с синдромом Клиппеля–Треноне. Небольшая эмбриональная вена на бедре (показано стрелкой) (С разрешения из Noel A.A. Gloviczki P. Et al. Surgical treatment of venous malformations in Кlippel–Trenaunay syndrome. J Vasc Surg 2000; 32: 840–847.)
ной патологией. У всех 20 пациентов (100%) отмечалось наличие варикозного расширения вен. Наиболее часто возникающей клинической жалобой были боли (80%), отечность (75%), кровотечение (40%). Во всех случаях при оперативном вмешательстве выполнялись стриппинг вен латеральной локализации, флебэктомия варикозных узлов. У трех пациентов потребовалось проведение этапных вмешательств. Дополнительными вмешательствами являлись флеболиз подколенной вены, формирование под- коленно-подкожного шунтирования, удаление персисистирующей v. ischiatica, лигирование перфорантных вен с использованием «открытой» или эндоскопической методик. В двух случаях (12%) послеоперационный период осложнился гематомой, потребовавшей ее эвакуации. Тромбоэмболических осложнений не отмечалось. У всех пациентов отмечено клиническое улучшение (средний период наблюдения — 64 месяца). Рецидив варикозного расширения наблюдался у 10 пациентов (50%), в одном случае трофическая язва не зажила, еще у одного отмечено появление новой язвы. Повторные операции по поводу рецидива варикоза проведены в 3 случаях.
Рис. 83.23. Восходящая флебография 19-летнего пациента. Большая эмбриональная вена с множественным варикозом (указано стрелкой) и флебэктазией (двойная стрелка) подколенной вены с наличием участка ее сужения. (С разрешения из Noel A.A. Gloviczki P. Et al. Surgical treatment of venous malformations in Кlippel– Trenaunay syndrome. J Vasc Surg 2000; 32: 840–847.)
https://t.me/medicina_free

340 Раздел XI. Артерио-венозные мальформации
Lee с соавторами придерживается тактики использования склеротерапии 96%-м спиртом у пациентов с венозными мальформациями, в том числе и при СКТ [75]. Хорошие результаты были достигнуты в группе из 30 пациентов с венозными мальформациями, у которых в общей сложности выполнены 98 сеансов склерозирования. Улучшение достигнуто у 96% пациентов (период наблюдения 10 месяцев). У 27% пациентов, или во время 16% сеансов, были отмечены те или иные осложнения, включавшие образование ишемических булл, образование фиброза, тромбозов глубоких вен, тромбоэмболические осложнения, периферические нейропатии. Все возникшие осложнения после лечения полностью регрессировали после проведенного лечения за исключением одного случая нейропатии берцового нерва. Рецидивов после склеротерапии не отмечено. Внедрение и первые результаты использования foamform склеротерапии полидоканолом для лечения варикозного расширения вен [126–128] дают определенные перспективы использования этой методики в большинстве случаев венозных и даже АВ-мальформаций с низким объемом сброса.
Заключение
В связи с наличием выраженных местных эффектов и системного воздействия на гемодинамику большинство травматических АВ-свищей требуют проведения операций. Хирургические вмешательства при приобретенных свищах обычно оправданы и достигают поставленной цели. С хорошими результатами стали все чаще использоваться эндоваскулярные технологии. Большое число сосудистых мальформаций имеют в своем механизме патологическое АВ-шунтирование. Поэтому методика транскатетерной рентгеноэндовакулярной эмболизации с или без резекции ангиоматозных тканей позволяет значительно улучшить результаты лечения этих пациентов, особенно при локализации в области лица и шеи, таза и некоторых форм висцеральных мальформаций. Использование лазера наиболее предпочтительно при лечении кожных проявлений заболевания. При распространенных поражениях конечностей с высоким объемом шунтирования, несмотря на комбинацию эндоваскулярных и хирургических вмешательств, не всегда удается остановить прогрессирование процесса и в редких случаях альтернативой может быть только выполнение ампутации. Лечение большинства пациентов с СКТ является консервативным, хотя у некоторой части пациентов с состоятельными глубокими венами может быть выполнена симптоматическая флебэктомия варикозных вен и венозного ангиоматоза. И, несмотря на достаточно высокую частоту рецидивов, клиническое улучшение является достаточно существенным. В случае необходимости возможно проведение повторных оперативных вмешательств. У пациентов с симптоматическими венозными мальформациями возможно проведение и склеротерапии.
Литература
1.Virchow R. Pathologie des tumeurs: cours professé à l’Université de Berlin, vol 4. Paris: Germer-Bailliére, 1876; 169.
2.Hunter W. The history of an aneurysm of the aorta, with some remarks on aneurysms in general. Med Observations Inquiries 1757; 1: 323.
3.Hunter W. Further observations upon a particular species of aneurysm. Med Observations Inquiries 1764; 2: 390.
4.Breichet G. Mémoire sur les aneurysmes. Mem Acad Med (Paris) 1833; 3:101.
5.Norris G. Varicose aneurism at the bend of the arm: ligature of the artery above and below the sac; secondary hemorrhages with a return of the aneurismal thrill on the tenth day; cure. Am J Med Sci 1843; 5: 28.
6.Nicoladoni C. Phlebarteriectasie der rechten oberen Extremitat. Arch Kim Chir 1875; 18: 252.
7.Branham HH. Aneurismal varix of the femoral artery and vein following a gunshot wound. Int J Surg 1890; 3: 250.
8.Holman E. Arteriovenous aneurysm: abnormal communications between the arterial and venous circulations. New York: Macmillan, 1937.
9.Shumacker HB Jr, Carter KL. Arteriovenous fistulas and arterial aneurysms in military personnel. Surgery 1946; 20: 9.
10.Hughes CW, Jahnke EJ Jr. The surgery of traumatic arteriovenous fistulas and aneurysms: a five-year follow-up study of 215 lesions. Ann Surg 1958; 148: 790.
11.Rich NM, Hobson RW II, Collins GJ Jr. Traumatic arteriovenous fistulas and false aneurysms: a review of 558 lesions. Surgery 1975; 78: 817.
12.Reid MR. Studies on abnormal arteriovenous communications, acquired and congenital: I. Report of a series of cases. Arch Surg 1925; 10: 601.
13.de Takats G. Vascular anomalies of the extremities: report of five cases. Surg Gynecol Obstet 1932; 55: 227.
14.Coursley G, Ivins JC, Barker NW. Congenital arteriovenous fistulas in the extremities: an analysis of sixty-nine cases. Angiology 1956; 7: 201.
15.Malan E, Puglionisi A. Congenital angiodysplasias of the extremities. (Note I: Generalities and classification; venous dysplasias.) (Note II: Arterial, arterial and venous, and haemolymphatic dysplasias.) J Cardiovasc Surg 1964; 5: 87; 1965; 6: 255.
16.Szilagyi DE, Elliott JP, et al. Peripheral congenital arteriovenous fistulas. Surgery 1965; 57: 61.
17.Szilagyi DE, Smith RF, et al. Congenital arteriovenous anomalies of the limbs. Arch Surg 1976; 111: 423.
18.Natali J, Merland JJ. Supers elective arteriography and therapeutic embolisation for vascular malformations (angiodysplasias). J Cardiovasc Surg (Torino) 1976; 17: 465.
19.Forbes G, Earnest F IV et al. Therapeutic emboluation angiography for extra-axial lesions in the head. Mayo ClinProc 1986; 61: 427.
20.Belov DA. Classification of congenital vascular defects. Int Angiol 1990; 9(3): 141–146.
21.Patman RD, Poulos E, Shires GT. The management of civilian arterial injuries. Surg Gynecol Obstet 1964; 118: 725.
22.Kollmeyer KR, Runt JL, et al. Acute and chronic traumatic arteriovenous fistulae in civilians: epidemiology and treatment. Arch Surg 1981; 116: 697.
23.Lamar R, Berg R, Rama K. Femoral arteriovenous fistula as a complication of percutaneous transluminal coronary angioplasty: a report of five cases. Am Surg 1990; 56: 702–706.
24.Oweida SW, Roubin GS, et al. Postcatheterization vascular complications associated with percutaneous transluminal coronary angioplasty. J Vasc Surg 1990; 12: 310–315.
25.McCann RL, Schwartz LB, Pieper KS. Vascular complications of cardiac catheterization. J Vasc Surg 1991; 14: 375–381.
26.Kim D, Orron DE, et al. Role of superficial femoral artery puncture in the development of pseudoaneurysm and arteriovenous fistula complicating percutaneous transfemoral cardiac catheterization. Cathet Cardiovasc Diagn 1991; 25: 91–97.
https://t.me/medicina_free

Глава 83. Артерио-венозные свищи и мальформации 341
27.Rivers SP, Lee ES, et al. Successful conservative management of iatrogenic femoral arterial trauma. Ann Vasc Surg 1992; 6: 45–49.
28.Feld R, Patton GM, et al. Treatment of iatrogenic femoral artery injuries with ultrasound-guided compression. J Vasc Surg 1992;
16:832–840.
29.Kent KC, McArdle CR, et al. A prospective study of the clinical outcome of femoral pseudoaneurysms and arteriovenous fistulas induced by arterial puncture. J Vasc Surg 1993; 17: 125–131.
30.Linton RR, White PD. Arteriovenous fistula between the right common iliac artery and the inferior vena cava: report of a case of its occurrence following an operation for a ruptured intervertebral disk with cure by operation. Arch Surg 1945; 50: 6.
31.Quigley TM, Stoney RJ. Arteriovenous fistula following lumbar laminectomy: the anatomy defined. J Vasc Surg 1985;
2:828.
32.Christensen C, Bank A. Arteriovenous fistula complicating lumbar disc surgery. Case report. Eur J Surg 1991; 157: 145–146.
33.Sande E, Myhre HO, et al. Vascular complications of lumbar disc surgery. Case report. Eur J Surg 1991; 157: 141–143.
34.Machado-Atias I, Fornes O, et al. Iliac arteriovenous fistula due to spinal disk surgery causes severe hemodynamic repercussion with pulmonary hypertension. Texas Heart Inst J 1993; 20: 60–65 (discussion 65).
35.Hollingsworth EW. Arteriovenous fistula of the renal vessels. Am J Med Sci 1934; 188: 399.
36.Dzsinich C, Szabó, et al. Arteriovenous fistula after partial nephrectomy: successful surgical repair: report of a case. Thorac Cardiovasc Surg 1984; 32: 325.
37.Mono RP, Dunn EJ, Wright CB. Renal arteriovenous fistulas: a review of etiology, diagnosis, and management. Surgery 1986;
99:114.
38.Lord RSA, Ehrenfeld WK, Wylie EJ. Arterial injury from the Fogarty catheter. Med J Aust 1968; 2: 70.
39.Shifrin EG, Anner H, et al. Arterio-venous fistula in the lower limb in consequence of Fogarty balloon catheter embolectomy: case report and review of the literature. J Cardiovasc Surg (Torino) 1985; 26: 310.
40.Schweitzer DL, Aguam AS, Wilder JR. Complications encountered during arterial embolectomy with the Fogarty balloon catheter: report of a case and review of the literature. Vasc Surg 1976; 10: 144.
41.McAuley CE, Peitzman AB, et al. The syndrome of spontaneous iliac arteriovenous fistula: a distinct clinical and pathophysiologic entity. Surgery 1986; 99: 373.
42.Davis PM, Gloviczki P, et al. Aorto-caval and ilio-iliac arteriovenous fistulae. Am J Surg 1998; 176: 115–118.
43.Holman E. Abnormal arteriovenous communications. Springfield, IL: Charles C Thomas, 1968.
44.Davis JO, Urquhart J, et al. Hypersecretion of aldosterone in dogs with a chronic aortid-caval fistula and high output heart failure. Circ Res 1964; 14: 471.
45.Epstein FR, Ferguson TB. The effect of formation of an arteriovenous fistula upon blood volume. J Clin Invest 1955; 34: 434.
46.Callander CL. Study of arterio-venous fistula with an analysis of 447 cases. Johns Hopkins Hosp Rep 1920; 19: 259.
47.Sirinek KR, Gaskill HV III, et al. Exclusion angiography for patients with possible vascular injuries of the extremities: a better use of trauma center resources. Surgery 1983;
94:598.
48.Vollmar J, Krumhaar D. Surgical experience with 200 traumatic arteriovenous fistulae. In: Hiertonn T; Rybeck B, eds. Symposium on traumatic arterial lesions, Uppsala. Stockholm: Försvarets forskningsanstalt, 1968.
49.Shumacker RB Jr, Wayson EF. Spontaneous cure of aneurysms and arteriovenous fistulas, with some notes on intrasaccular thrombosis. Am J Surg 1950; 79: 532.
50.Linder F. Acquired arterio-venous fistulas: report of 223 operated cases. Ann Chir Gynaecol 1985; 74: 1.
51.Harris AE, McMenamin PG. Carotid artery-cavernous sinus fistula. Arch Otolaryngol 1984; 110: 618.
52.Janes JM, Jennings WK Jr. Effect of induced arteriovenous fistula on leg length: 10-year observations. Proc Staff Meeting Mayo Clin 1961; 36: 1.
53.Sumner DS. Diagnostic evaluation of arteriovenous fistulas. In: Rutherford RB, ed. Vascular surgery, 2nd ed. Philadelphia: WB Saunders, 1984.
54.Rutherford RB. Noninvasive testing in the diagnosis and assessment of arteriovenous fistula. In: Bernstein EF, ed. Noninvasive diagnostic techniques in vascular disease, 3rd ed. St Louis: CV Mosby, 1985; 666–679.
55.White RA, Donayre CE, et al. Preliminary clinical outcome and imaging criterion for endovascular prosthesis development in high-risk patients who have aortoiliac and traumatic arterial lesions. J Vasc Surg 1996; 24: 556–571.
56.Gloviczki P, Pairolero PC, et al. Reconstruction of large veins for nonmalignant venous occlusive disease. J Vasc Surg 1992; 16: 750–761.
57.Mann ML, Veith FJ, et al. Percutaneous transfemoral insertion of a stented graft to repair a traumatic femoral arteriovenous fistula. J Vasc Surg 1993; 18: 299–302.
58.Marin ML, Veith FJ, et al. Transluminally placed endovascular stented graft repair for arterial trauma. J Vasc Surg 1994; 20: 466–473.
59.Debrun G, Lacour P, et al. Treatment of 54 traumatic carotidcavernous fistulas. J Neurosurg 1981; 55: 678.
60.Herbreteau D, Aymard A, et al. Endovascular treatment of arteriovenous fistulas arising from branches of the subclavian artery. J Vasc Interv Radiol 1993; 4: 237–240.
61.Levey DS, Teitelbaum GP, et al. Safety and efficacy of transcatheter embolization of axillary and shoulder arterial injuries. J Vasc Interv Radiol 1991; 2: 99–104.
62.Fellmeth BD, Roberts AC, et al. Postangiographic femoral artery injuries: nonsurgical repair with ultrasound guided compression. Radiology 1991; 178: 671–675.
63.Oweida SW, Roubin GS, et al. Postcatheterization vascular complications associated with percutaneous transluminal coronary angioplasty. J Vasc Surg 1990; 12: 310–315.
64.Lin PH, Dodson TF, et al. Surgical intervention for complications caused by femoral artery catheterization in pediatric patients. J Vasc Surg 2001; 34: 1071–1078.
65.Robinson DL, Teitelbaum GP, et al. Transcatheter embolization of an aortocaval fistula caused by residual renal artery stump from previous nephrectomy: a case report. J Vasc Surg 1993; 17: 794–797.
66.Mulliken JB, Glowacki J. Hemangiomas and vascular malformations in infants and children: a classification based on endothelial characteristics. Plast Reconstr Surg 1982; 69: 412.
67.Malan E, Sala A, Tardito E. Arteriovenous fistulas. In: Haimovici H, ed. Vascular surgery: principles and techniques, 2nd ed. Norwalk, CT: Appleton-Century Crofts, 1984; 777–794.
https://t.me/medicina_free

342 Раздел XI. Артерио-венозные мальформации
68.Rohrich RJ, Spicer TE. Hemangiomas and vascular malformations/lymphedema. Selected Readings Plast Surg 1986; 4: 1.
69.Vollmar JF, Stalker CG. The surgical treatment of congenital arterio-venous fistulas in the extremities. J Cardiovasc Surg (Torino) 1976; 17: 340.
70.Merland JJ, Riche MC, et al. Classification actuelle des malformations vasculaires. Ann Chir Plast 1980; 25: 105.
71.Forbes G, May GR, Jackson IT. Vascular anomalies in children. In: Jackson IT, Mustarde J, eds. Plastic surgery in infancy and childhood. New York: Churchill Livingstone, 1988; 691–710.
72.Woollard RH. The development of the principal arterial stems in the forelimb of the pig. In: Carnegie Institution of Washington: Contributions to embryology, vol. 14, No. 70. Publication No. 277. Washington, DC: Carnegie Institution of Washington, 1992; 139–154.
73.Mulliken JB, Zetter BR, Folkman J. In vitro characteristics of endothelium from hemangiomas and vascular malformations. Surgery 1982; 92: 348.
74.Glowacki J, Mulliken JB. Mast cells in hemangiomas and vascular malformations. Pediatrics 1982; 70: 48.
75.Lee BB, Kim I, et al. New experiences with absolute ethanol sclerotherapy in the management of a complex form of congenital venous malformation. J Vasc Surg 2002; 33: 764–772.
76.Eifert S, Villavicencio JL, et al. Prevalence of deep venous anomalies in congenital vascular malformations of venous predominance. J Vasc Surg 2000; 31: 462–471.
77.Noel AA, Gloviczki P, et al. Surgical treatment of venous malformations in Klippel–Trénaunay syndrome. J Vasc Surg 2000; 32: 840–847.
78.Schwartz RS, Osmundson PJ, Roilier LH. Treatment and prognosis in congenital arteriovenous malformation of the extremity. Phlebology 1986; 1: 171.
79.Weber FP. Angioma-forma~ion in connection with hypertrophy of limbs and hemi-hypertrophy. Br J Dermatol 1907; 19: 231.
80.Weber FP. Haemangiectatic hypertrophy of limbs: congenital phlebarteriectasis and so-called congenital varicose veins. Br J Child Dis 1918; 15: 13.
81.Gloviczki P, Hollier LR, et al. Surgical implications of Klippel–Trénaunay syndrome. Ann Surg 1983; 197: 353.
82.Gloviczki P, Stanson AW, et al. Klippel–Trénaunay syndrome: the risks and benefits of vascular interventions. Surgery 1991; 110: 469–479.
83.Servelle M. Stase veineuse et croissance osseuse. Bull Acad Natl Med 1948; 132: 471.
84.Hutchison WJ, Burdeaux BD Jr. The influence of stasis on bone growth. Surg Gynecol Obstet 1954; 99: 413.
85.Boyd JB, Mulliken JB, et al. Skeletal changes associated with vascular malformations. Plast Reconstr Surg 1984; 74: 789.
86.Decker DG, Fish CR, Juergens JL. Arteriovenous fistulas of the female pelvis: a diagnostic problem. Obstet Gynecol 1968; 31: 799.
87.Pritchard DA, Maloney JD, et al. Surgical treatment of congenital pelvic arteriovenous malformation. Mayo Clin Proc 1978; 53: 607.
88.Haimovici H, Sprayregen S. Congenital microarteriovenous shunts: angiographic and Doppler ultrasonographic identification. Arch Surg 1986; 121: 1065.
89.Pritchard DA, Maloney JD, et al. Peripheral arteriovenous fistula: detection by contrast echocardiography. Mayo Clin Proc 1977; 52: 186.
90.Horton BT, Ghormley RK. Congenital arteriovenous fistulae of the extremities visualized by arteriography. Surg Gynecol Obstet 1935; 60: 978.
91.Amparo EG, Higgins CB, Hricak H. Primary diagnosis of abdominal arteriovenous fistula by MR imaging. J Comput Assist Tomogr 1984; 8: 1140.
92.Berquist TH. Bone and soft tissue tumors. In: Berquist TH, ed. Magnetic resonance of the musculoskeletal system. New York: Raven Press, 1987; 85–108.
93.Pearce WR, Rutherford RB, et al. Nuclear magnetic resonance imaging: its diagnostic value in patients with congenital vascular malformations of the limbs. J Vasc Surg 1988; 8: 764–770.
94.Noe JM, Barsky SH, et al. Port wine stains and the response to argon laser therapy: successful treatment and the predictive role of color, age, and biopsy. Plast Reconstr Surg 1980; 65: 130.
95.Achauer BM, Vander-Kam VM. Vascular lesions. Clin Plast Surg 1993; 20: 43–51.
96.Goldman MP, Fitzpatrick RE, Ruiz-Esparza J. Treatment of portwine stains (capillary malformation) with the flashlamp-pumped pulsed dye laser. J Pediatr 1993; 122: 71–77.
97.Pickering JW, Walker EP, et al. Copper vapour laser treatment of port-wine stains and other vascular malformations. Br J Plast Surg 1990; 43: 273–282.
98.Kerber CW. Catheter therapy: fluoroscopic monitoring of deliberate embolic occlusion. Radiology 1977; 125: 538.
99.Kaufman SL, Kumar AAJ, et al. Transcatheter embolization in the management of congenital arteriovenous malformations. Radiology 1980; 137: 21.
100.Widlus DM, Murray RR, et al. Congenital arteriovenous malformations: tailored embolotherapy. Radiology 1988; 169: 511–516.
101.Van Poppel H, Claes H, et al. Intraarterial embolization in combination with surgery in the management of congenital pelvic arteriovenous malformation. Urol Radiol 1988; 10: 89–91.
102.Gomes AS, Mali WI, Oppenheim WL. Embolization thera py in the management of congenital arteriovenous malformations. Radiology 1982; 144: 41.
103.Barth KR, White RI Jr, et al. Embolotherapy ofpulmonary arteriovenous malformations with detachable balloons. Radiology 1982; 142: 599.
104.Jacobowitz GR, Rosen RJ, et al. Transcatheter embolization of complex pelvic vascular malformations: results and long-term follow-up. J Vasc Surg 2001; 33: 51–55.
105.Gomes MMR, Bernatz PE. Arteriovenous fistulas: a review and ten-year experience at the Mayo Clinic. Mayo Clin Proc 1970; 45: 81.
106.Szilagyi DE. Vascular malformations (with special emphasis on peripheral arteriovenous lesions). In: Moore W, ed. Vascular surgery: a comprehensive review, 2nd edn. New York: Grune & Stratton, 1986; 773–790.
107.Fowl RJ, Kempczinski RF, et al. Management of a complex, posttraumatic, pelvic arteriovenous fistula with the use of cardiopulmonary bypass: case report and review ofthe literature. J Vasc Surg 1987; 6: 257–261.
108.Cormier JM, Laurian C, et al. Traitement chirurgical des fistules arterio-veineuses congenitales des membres sous controle ultrasonographique. Chirurgie 1981; 107: 424.
109.Trout RH III, McAllister RA Jr, et al. Vascular malformations. Surgery 1985; 97: 36.
110.Moore JD, Thompson NW, et al. Arteriovenous malformations of the gastrointestinal tract. Arch Surg 1976; 111: 381.
https://t.me/medicina_free

Глава 83. Артерио-венозные свищи и мальформации 343
111.Rutgeerts P, Van Gompel F, et al. Long-term results of treatment of vascular malformations of the gastrointestinal tract by neodymium:YAG laser photocoagulation. Gut 1985; 26: 586.
112.Richardson JD, Max MH, et al. Bleeding vascular malformations of the intestine. Surgery 1978; 84: 430.
113.Klimberg I, WilsonJ, et al. Hemorrhage from congenital renal arteriovenous malformation in pregnancy. Urology 1984; 23: 381.
114.Burckhardt D, Stalder GA, et al. Hyperdynamic circulatory state due to Osler–Weber–Rendu disease with intrahepatic arteriovenous fistulas. Am Heart J 1973; 85: 797.
115.Dines DE, Arms RA, et al. Pulmonary arteriovenous fistulas. Mayo Clin Proc 1974; 49: 460.
116.Brown SE, Wright PW, et al. Staged bilateral thoracotomies for multiple pulmonary arteriovenous malformations complicating hereditary hemorrhagic telangiectasia. J Thorac Cardiovasc Surg 1982; 83: 285.
117.Klippel M, Trénaunay P. Du naevus variquex osteohypertrophique. Archives of General Medicine (Paris) 1900; 3: 641–672.
118.Servelle M. Klippel and Trénaunay’s syndrome: 768 operated cases. Ann Surg 1985; 201: 365–373.
119.Baskerville PA, Ackroyd JS, et al. The Klippel–Trénaunay syndrome: clinical, radiological and haemodynamic features and management. Br J Surg 1985; 72: 232–236.
120.Lindenauer SM. The Klippel–Trénaunay syndrome: varicosity, hypertrophy and hemangioma with no arteriovenous fistula. Ann Surg 1965; 162: 303–313.
121.Villavicencio JL. Congenital vascular malformations of venous predominance: Klippel–Trénaunay syndrome. In: Raju S, Villavicencio JL, eds. Surgical management of venous disease. 1st edn. Baltimore: Williams & Wilkins, 1997; 445–461.
122. Baskerville PA, Ackroyd JS, Browse NL. The etiology of the Klippel–Trénaunay syndrome. Ann Surg 1985; 202: 624–627.
123.Jacob AG, Driscoll DJ, et al. Klippel–Trénaunay syndrome: spectrum and management. Mayo Clin Proc 1998; 73: 28–36.
124.Eifet S, Villavicencio JL, et al. Prevalence of deep venous anomalies in congenital vascular malformations of venous predominance. J Vasc Surg 2000; 31: 462–471.
125.Lorda-Sanchex I, Prieto L, et al. Increased parental age and number of pregnancies in Klippel–Trénaunay–Weber syndrome. Ann Hum Genet 1998; 62: 235–239.
126.Frullini A, Cavezzi A. Sclerosing foam in the treatment of varicose veins and telangiectases: history and analysis of safety and complications. Dermatol Surg 2002; 28: 11–15.
127.Tessari L, Cavezzi A, Frullini A. Preliminary experience with a new sclerosing foam in the treatment of varicose veins. Dermatol Surg 2001; 27: 58–60.
128.Cabrera Garrido JR, Cabrera Garcia-Olmedo JR, Garcia-Olmedo Dominiguez MA. Extending the limits of sclerotherapy: new sclerosing agents. (in French.) Phlebologie 1997; 50: 181–188.
https://t.me/medicina_free
