
3 курс / Общая хирургия и оперативная хирургия / Сосудистая_хирургия_по_Хаймовичу_Том_2_Ашер_А_,_Покровский_А_В_2012
.pdf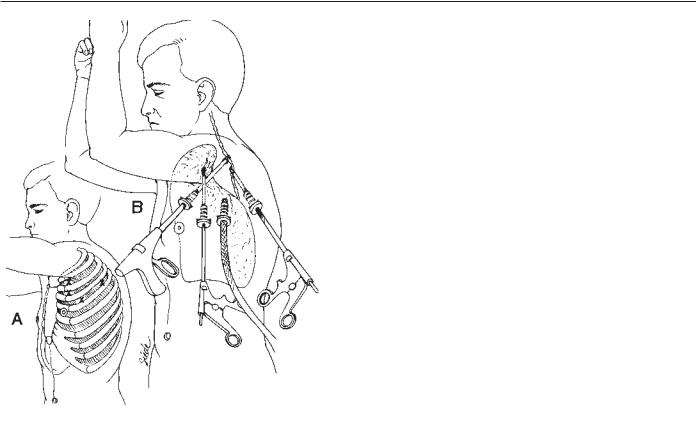
314 Раздел X. Патология верхних конечностей
|
|
|
|
Верхний шейный |
|
|
|
|
симпатический ганглий |
|
|
|
|
(С1–С4) |
|
|
|
|
Средний шейный |
|
|
|
|
симпатический ганглий |
|
|
|
|
(С5–С6) |
|
|
|
|
Нижний |
|
|
Б |
|
|
|
|
|
симпатический шейный |
|
|
|
|
Звездчатый |
|
|
|
|
ганглий |
|
|
|
|
ганглий |
(С7–С8) |
|
|
|
(С7–Т1) |
|
|
|
|
|
Грудной |
А |
|
|
|
симпатический |
|
ганглий |
|||
|
|
|
|
|
Рис. 82.1. Торакоскопическая симпатэктомия проводится в положении, аналогичном положению при торакотомии. (А). Проколы располагаются в 3 и 4 межреберьях в форме треугольника. Могут понадобиться множественные проколы. (Б). Рабочие порты располагаются по бокам от видеоассистирующего торакоскопа.
шейные симпатические ганглии осуществляют симпатическую иннервацию ипсилатеральной части лица и головы. Включение Т1 в объем резекции может привести к развитию синдрома Горнера [22]. По мнению Полумбо, успешная грудная симпатэктомия возможна и без резекции Т1 симпатического ганглия [23]. При таких состояниях, как ладонный гипергидроз или болевые синдромы в кисти и пальцах, можно проводить резекцию симпатического ствола от Т2 до Т4. Однако полное избавление от боли, распространяющейся на плечо и нижнюю часть шеи, не может произойти без иссечения Т1. Мы пытались включить Т1 в объем иссекаемых тканей посредством удаления нижней одной четвертой–одной третьей части звездчатого ганглия. Такой консервативный подход не привел к развитию стойкого синдрома Горнера у наших пациентов.
Париетальная плевра, покрывающая симпатический ствол на уровне 3–4 ребра, может быть вскрыта ножницами либо приподнята и рассечена крючком электрокоагулятора. Главный симпатический ствол выделяется вместе с соединительными ветвями от звездчатого ганглия до Т4. Звездчатый ганглий выделяется острым путем на уровне первого ребра. Звездчатый ганглий близко прилежит к позвоночной и щитошейной ветвям подключичной артерии, которые могут быть повреждены во время выделения (рис. 82.3). Ствол приподнимается зажимом либо крючком, ветви клипируются (рис. 82.4). Затем ветви пересекаются ножницами между основным стволом и клипсой. Применение сосудистых клипс на главном симпатическом стволе было отвергну-
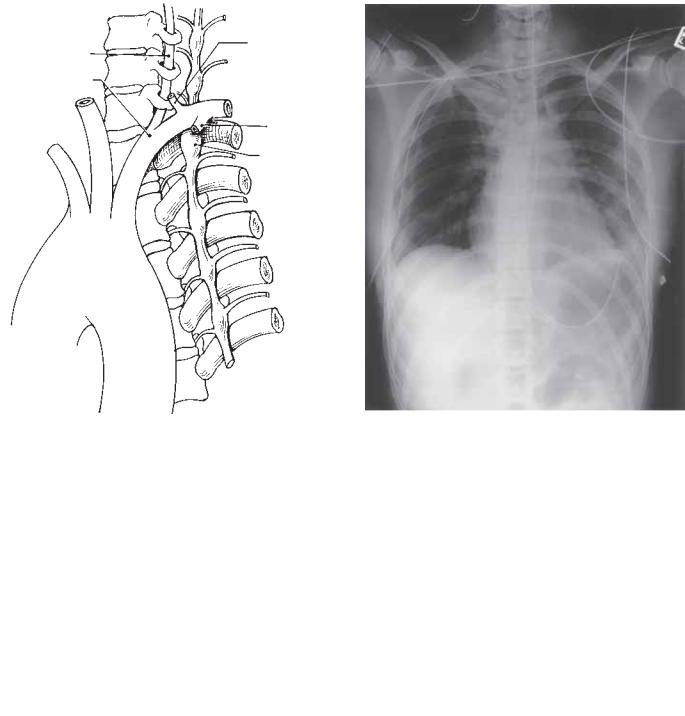
Рис. 82.2. Анатомия шейной и грудной части симпатического ствола. Первый грудной ганглий (Т1) формирует нижнюю часть звездчатого ганглия. Включение Т1 в объем резекции при грудной симпатэктомии может повлечь за собой возникновение синдрома Горнера.
то некоторыми исследователями по причине возможности развития послеоперационной невралгии. Мы в своей практике применяем клипирование ствола дистальнее четвертого ганглия и на нижней части звездчатого ганглия перед его пересечением. Применение клипс обеспечивает надежный гемостаз, служит ориентиром при радиографической оценке верхней и нижней границ симпатэктомии после хирургического вмешательства (рис. 82.5). В нашей практике послеоперационная невралгия не возникала.
Торакоскопическая визуализация удаляемых тканей рекомендуется во избежание потери их в плевральной полости. С помощью электрокоагуляции или наложения сосудистых клипс производится тщательнейший гемостаз в зоне операции. До получения гистологического подтверждения того, что в удаленном образце — ткань симпатического ствола, операцию не заканчивают. По окончании операции через отверстие торакопорта производится дренирование плевральной полости. Некоторые авторы сообщают об удовлетворительных результатах без дренирования плевральной полости [24]. Оставшиеся разрезы ушиваются рассасывающимися подкожными и внутрикожными швами, накладывается асептическая повязка.
Пациент переворачивается на спину и экстубируется в операционной. В послеоперационном отделении производится рентгенография грудной клетки и контроль дыхательной функции. При отсутствии осложнений пациент переводится в палату. Плевральный дренаж обычно удаляется на вторые сутки по-
https://t.me/medicina_free
Глава 82. Торакоскопическая симпатэктомия |
315 |
|
|
Щитошейный Позввоночная ствол
артерия
Подключичная
артерия
IMA
Звездчатый
ганглион
Рис. 82.3. Связь левого грудного симпатического ствола и его ганглиев с сосудистыми и костными структурами верхней части грудной клетки. IMA — внутренняя грудная артерия.
Рис. 82.5. Послеоперационный снимок грудной клетки после торакоскопической симпатэктомии. Металлические клипсы в правом верхнем средостении показывают верхнюю и нижнюю границы торакоскопической симпатэктомии, выполненной пациенту по поводу гипергидроза ладоней.
Рис. 82.4. Верхнегрудной отдел симпатического ствола (Т1–Т4) и сопровождающие соединительные ветви изолированы посредством клипирования и резецированы под прямым визуальным контролем видеоторакоскопа.
сле операции. На 2–3-и сутки после операции пациент может быть выписан. Перед выпиской записываются проявившиеся результаты симпатэктомии. Изучение промежуточных результатов симпатэктомии и ее эффектов в отдаленном периоде после операции требует тщательного и регулярного послеоперационного наблюдения.
Результаты
Ближайшие послеоперационные результаты торакоскопической симпатэктомии при лечении вегетативно-опосредованных расстройств на верхней конечности были отличными [1, 24–27]. Результаты видеоассистированной торакоскопической симпатэктомии в промежуточном и отдаленном послеоперационном периоде до сих пор не описаны. В будущем понадобится сравнение результатов открытой симпатэктомии и торакоскопической симпатической криообляции. Обращение к нашим собственным данным показывает, что результаты видеоассистированной торакоскопической симпатэктомии будут такими же или лучшими, чем предыдущие хирургические подходы.
Гипергидроз
Исторически, хирургическое лечение гипергидроза ладоней давало стойкий эффект в течение одного года в 85–95% случаев [24]. Drott с соавторами сообщили о стойком хорошем эффекте торакоскопической симпатэктомии на протяжении 5 лет [3]. Неудачи при симпатэктомии случились всего у 5 (1,4%) из 367 пациентов, а ранние рецидивы наблюдались у 4 пациентов (1,1%). Успешные повторные операции были выполнены торакоскопически у 8 пациентов. Fritsch с соавторами сообщили о стойких результа-
https://t.me/medicina_free

316 Раздел X. Патология верхних конечностей
тах в течение более 10 лет наблюдений [28]. Основная масса симпатэктомий в этих исследованиях выполнена посредством торакоскопической криообляции и без применения видеоассистированных техник.
Результаты торакоскопического лечения гипергидроза подмышечной области были менее обнадеживающими, чем при лечении гипергидроза ладоней. В исследовании Kux у 18,6% пациентов после грудной симпатэктомии продолжался аксиллярный гипергидроз, несмотря на полное разрешение гипергидроза ладоней [26]. Kux считал, что иссечение Т5 симпатического ганглия во время симпатэктомии улучшило результаты лечения аксиллярного гипергидроза. Adams и Poskirt получили одинаково хорошие результаты при лечении подмышечного и ладонного гипергидроза [29].
В настоящее время показана возможность достижения превосходных результатов в лечении и ладонного, и аксиллярного гипергидрозов (табл. 82.1). Эти данные вполне согласуются
спревосходными результатами, суммированными в обзоре Drott
ссоавторами [3] и сообщении Lin [31], в которых торакоскопическая криообляция и химическая обляция симпатического ствола производились в отсутствие видеоассистированных методик. Довольно часто встречаются среди побочных эффектов торакоскопической симпатэктомии потоотделение при приеме пищи и компенсаторное потоотделение туловища и нижних конечностей. К счастью, со временем они обычно проходят [30]. Наиболее нежелательным и угнетающим послеоперационным осложнением является синдром Горнера. Эндоскопическая грудная симпатэктомия редко приводит к этому синдрому. В обзоре Drott с соавторами [3] синдром Горнера развился у 17 (1,86%) из 912 пациентов. У 12 из 17 этих пациентов (71%) данная проблема носила транзиторный характер. Стойкий синдром Горнера возник лишь у 0,54% пациентов, которым была выполнена эндоскопическая грудная симпатэктомия по поводу гипергидроза ладоней.
Отраженная симпатическая дистрофия и каузалгия
Отраженная симпатическая дистрофия (RSD) — это посттравматический болевой синдром, опосредованный вегетативной нервной системой. Термин «каузалгия» употребляют в случае прямого повреждения периферического нерва. Ключом к успешной борьбе с этим состоянием является возможно раннее вмешательство и лечение. Олкот и сотрудники нашли консервативный подход, включающий повторные блокады звездчатого ганглия, применение анальгетиков и физиотерапию, что позволило достичь успеха в лечении 50–70% пациентов с RSD [32]. Авторы заострили внимание на комплексном подходе к оценке посттравматических болевых синдромов, так как эти состояния трудно диагностировать и лечить. Видеоассистированная торакоскопическая симпатэктомия в лечении RSD и каузалгии еще практически не применялась. Результаты этой операции необходимо сравнить с результатами, полученными с помощью обляционных торакоскопических не видеоассистированных методик. Кроме того, метод требует сравнения с открытой хирургической симпатэктомией. Olcott с соавторами сообщили об успешном лечении 74% пациентов, хороших результатах в 17% случаев, и неудовлетворительных результатах — в 9% хирургических симпатэктомий [32]. Patman с соавторами достигли отличных результатов в 84% случаев, хороших — в 8,9% и неудовлетворительных — в 7,1% случаев [33]. Есть сообщения о значительном улучшении состояния у 94% их пациентов [34].
Данные последних лет, касающиеся видеоассистированных торакоскопических методик лечения RSD и каузалгии, обнадеживают (табл. 82.2). Не сообщается ни об одном смертельном исходе и ни об одном осложнении, требующем конверсии на открытую торакотомию. Результаты в раннем послеоперационном периоде были превосходными, и частота возникновения синдрома Горнера — низкая. Результаты видеоассистированной торакоскопиче-
Таблица 82.1. Результаты видеоассистированной торакоскопической симпатэктомии при гипергидрозе.
Источник |
|
|
|
(№ ссылки) |
Количество операций |
Результаты |
Синдром Горнера |
|
|
|
|
Adams и Poskitt 1991 [29] |
13 (25) |
Превосходные (один поздний рецидив) |
Не установлен |
Pace с соавт. 1992 [2] |
1 (2) |
Превосходные |
Нет |
Mack с соавт. 1992 [25] |
1 (1) |
Превосходные |
2 (один преходящий, |
|
|
|
один постоянный)* |
Edmonson с соавт. 1992 [30] NS (50) |
Хорошие–превосходные |
Нет |
|
Krasna с соавт. 1993 [27] |
1 (1) |
Превосходные |
Нет |
* — не установлено, какая из шести симпатэктомий (проводимых по поводу гипергидроза) стала причиной развития синдрома Горнера NS — не установлено
Таблица 82.2. Результаты видеоассистированных торакоскопических симпатэктомий в лечении отраженной симпатической дистрофии и каузалгии
Источник |
|
|
|
|
(№ ссылки) |
Количество операций |
Уровень |
Результаты |
Синдром Горнера |
|
|
|
|
|
Pace с соавт., 1992 [2] |
2 |
T2–4 |
Значительное улучшение |
0 |
Mack с соавт., 1992 [25] |
6 (5 пациентов) |
Т1–4 |
Превосходные и полные у 5 из 6 |
2 (1 — транзиторный, |
|
|
|
|
1 — постоянный) |
Krasna с соавт., 1993 [27] |
1 |
T1–4 |
Превосходные |
0 |
|
|
|
|
|
https://t.me/medicina_free
Глава 82. Торакоскопическая симпатэктомия |
317 |
|
|
ской симпатэктомии по поводу RSD и каузалгии, впрочем, как и результаты других методов, сильно зависят от правильного отбора пациентов.
Болезни периферических сосудов, не поддающиеся реконструкции, и вазоспастические расстройства
Результаты хирургических симпатэктомий при окклюзивных заболеваниях сосудов и вазоспастических расстройствах верхней конечности оказались менее достоверными. Эффекты операций при этих патологиях обычно непостоянны и менее длительны, чем при гипергидрозе, отраженной симпатической дистрофии и каузалгии [35, 36]. Симпатэктомию применяли для спасения конечностей у пациентов с облитерирующими заболеваниями артерий при невозможности реконструктивных вмешательств, а также в комбинации с артериальной реконструкцией в случае наличия ишемических трофических нарушений.
Результаты симпатэктомии при лечении облитерирующих заболеваний артерий лучше, чем при лечении вазоспастических расстройств [37]. Kux с соавторами [38] описали в своем сообщении превосходные результаты в раннем послеоперационном периоде, полученные при невидеоассистированной торакоскопической симпатэктомии у 34 пациентов с вазоспастическими нарушениями. Однако в позднем послеоперационном периоде у 15 пациентов (44%) клиническая симптоматика вернулась. Такой временный эффект был подтвержден и Дроттом с соавторами у 12 пациентов, перенесших торакоскопическую криообляцию симпатического ствола [3]. Необходимо отметить, что язвы конечностей зажили у большинства пациентов.
Bardaxoglou с соавторами [39] сообщили о хороших результатах торакоскопической химической симпатэктомии при проксимальной окклюзии у 1 пациента, дистальной окклюзии артерии у 3 и при синдроме Рейно у 2 пациентов. У всех пациентов полностью исчезли симптомы заболеваний и зажили трофические язвы. В течение 6 месяцев рецидивов не наблюдалось.
Симпатэктомия при болезни Бюргера приводила к неоднозначным результатам. Факторами, наилучшим образом ограничивающими эту болезнь, являются изменения предсуществующих факторов риска и прекращение курения. Однако симпатэктомия также применяется при этой болезни, когда консервативное лечение оказывается неудачным [40]. Результаты торакоскопических операций при этом состоянии достоверно не установлены.
видеоассистированные торакоскопические резекции легких, по сравнению с теми, кого лечили методом открытой торакотомии, наблюдается меньшая стойкость болевого синдрома, реже возникает дисфункция плечевого пояса и меньше ранних легочных осложнений [41]. Они продемонстрировали меньшую потребность
внаркотиках при среднем пребывании в больнице в течение 5 дней,
вто время как после торакотомической операции больные проводили в больнице в среднем 7,5 дней. Количество койко-дней наших пациентов, идущих на торакоскопическую симпатэктомию, составляет в среднем 2,5 дня. В будущем при лечении заболеваний грудной клетки ожидается возрастание значения таких преимуществ торакоскопического подхода, как снижение болезненности, ускоренное восстановление и экономия финансовых средств и ресурсов.
Выводы
Торакоскопическая симпатэктомия является эффективным методом лечения целого ряда вегетативно-опосредованных расстройств в верхней конечности. Результаты торакоскопической симпатэктомии сильно выигрывают в сравнении с результатами открытых хирургических вмешательств. Превосходные отдаленные результаты могут быть получены у более чем 90% пациентов, страдающих от гипергидроза, отраженной симпатической дистрофии и каузалгии. Метод дает приемлемые результаты при лечении пациентов с окклюзивными заболеваниями сосудов, не поддающимися реконструкции, и вазоспастическими расстройствами; однако у пациентов с вазоспастическими расстройствами эффект может быть преходящим и нестойким. Крайне редко симпатэктомия помогает при лечении системных коллагенозов.
Трансторакальная симпатэктомия вытеснила более традиционные открытые шейный, спинной и трансторакальный хирургические доступы. Операция проста, эффективна и минимально инвазивна. При использовании видеоассистированного торакоскопа достигаются отличная визуализация и экспозиция, позволяющие произвести прецизионную симпатэктомию. Возникновение послеоперационной боли и болезненности после этой операции минимально. Ранняя реабилитация пациента и более короткая госпитализация привели к снижению затрат и лучшему распределению ресурсов. Несмотря на то что отдаленные результаты видеоассистированной грудной симпатэктомии еще предстоит изучить, операция уже сегодня видится крайне многообещающей в лечении вегетативно-опосредованных расстройств в верхней конечности.
Патология соединительной ткани
Применение симпатэктомии для лечения эффектов, оказываемых на верхнюю конечность системными коллагенозами, такими как склеродермия, ревматоидный артрит, системная красная волчанка и болезнь Рейно, не дало результатов. Симпатэктомия при этих расстройствах неэффективна по причине патологических изменений подлежащей соединительной ткани. Широкое применение данного метода не рекомендуется в лечении системных коллагенозов. Прогнозируется, что мини-инвазивные торакоскопические подходы в лечении различных патологий грудной клетки обеспечат выигрыш в финансовом и других аспектах по отношению к открытым торакотомическим вмешательствам. Landreneau с соавторами продемонстрировали, что у пациентов, перенесших
Литература
1.Goetz RH. Collective review: the surgical physiology of the sympathetic nervous system with special reference to cardiovascular disorders. Int Abstract Surg 1948; 87: 417–459.
2.Pace RF, Brown PM, Gutelius JR. Thoracoscopic transthoracic dorsal sympathectomy. Can J Surg 1992; 35: 509–511.
3.Drott C, Gothberg C, Claes C. Endoscopic procedures of the upper-thoracic sympathetic chain: a review. Arch Surg 1993; 128: 237–241.
4.Jaboulay M. Le traitment de quelques troubles trophique dupiedetdelajambeparia denudation de l’artereet la distension des nerfs vasculaires. Med Lyon 1899; 91: 467.
https://t.me/medicina_free

318 Раздел X. Патология верхних конечностей
5.Kotzareff A. Resection partielle de tronc sympathetique cervical droit pour hyperhidrose unilaterale. Rev Med SuisseRom 1920; 40: 111.
6.Jonnesco T. Le sympathizue cervico-thoracico. Paris: Mason &Cie, 1923.
7.Bruning F. Resection of cervical sympathetic nerves. Zentralbl Chir 1923; 50: 1056–1059.
8.Goetz RH, Marr JAS. Importance of the second thoracic ganglion for sympathetic supply of the upper extremities with a description of 2 new approaches for its removal in cases of vascular surgery. Clin Proc 1944; 3: 102–114.
9.Kwan ST. The treatment of causalgia by thoracic sympathetic ganglionectomy. Ann Surg 1935; 101: 222–227.
10.Atkins HJB. Sympathectomy by the axillary approach. Lancet 1954; 1: 538–539.
11.Carry TP, Henry AK. Anterior transcostal access to upper parts of thoracic sympathetic chain. Ir J Med Sci 1949; Oct: 757–761.
12.Palumbo LT. Anterior transthoracic approach for upper extremity thoracic sympathectomy. Arch Surg 1956; 72: 659–666.
13.Kirtley JA, Riddell DH, et al. Cervicothoracic sympathectomy in neurovascular abnormalities of the upper extremities: experiences in 76 patients with 104 sympathectomies. Ann Surg 1967;
165:869–879.
14.Smithwick RH. Modified dorsal sympathectomy for vascular spasm (Raynaud's disease) of upper extremity: preliminary report. Ann Surg 1936; 104: 339–350.
15.Klemert HE, Cook FW, Kutz JE. Neurovascular disorders of the upper extremity treated by transaxillary sympathectomy. Arch Surg 1965; 90: 612–616.
16.Roos DB. Sympathectomy for the upper extremities: anatomy, indications and techniques. In: Rutherford RB, ed. Vascular surgery. Philadelphia: WB Saunders, 1977; 623–628.
17.Bozzini P. Der Lichleiter oder Beschreibank einer einfachen Vorrichtung und inhern Anwendung surer/echtung innerer Hohlen und Wischenraume des lebenden animalischen Korpers. Weimar, Germany, 1907.
18.Jacobaeus HC. Possibility of the use of the cystoscope for the investigation of serous cavities. Munch Med Wochenschr 1910;
57:2090–2092.
19.Jacobaeus HC. Endopleural operations by means of a thoracoscope. Beitr Klin Tuberk 1915; 35: 1.
20.Weiss SJ, Cheung AT. Anesthesia for thoracoscopic surgery. In: Kaiser LR, Daniel TM, eds. Thoracoscopic surgery. Boston: Little, Brown, 1993; 17–36.
21.Kraenzler EJ, Hearn CJ. Anesthesia for video-assisted thoracoscopy. Semin Thorac Cardiovasc Surg 1993; 5(4): 321–326.
22.Mack MJ. Thoracoscopy and its role in mediastinal disease and sympathectomy. Semin Thorac Cardiovasc Surg 1993; 5: 332–336.
23.Palumbo LT. Upper dorsal sympathectomy without Homer’s syndrome. Arch Surg 1955; 71: 743–751.
24.Hazelrigg SR, Mack MJ. Surgery for anatomic disorders. In: Kaiser LR, Daniel TM, eds. Thorascopic surgery. Boston: Little, Brown, 1993; 189–202.
25.Mack MJ, Aronoff RJ, et al. Present role of thoracoscopy in the diagnosis and treatment of diseases of the chest. Ann Thorac Surg 1992; 54: 403–409.
26.Kux M. Thoracic endoscopic sympathectomy in palmar and axillary hyperhidrosis. Arch Surg 1978; 113: 264–266.
27.Krasna MJ, Flowers J, Morvick R. Thoracoscopic sympathectomy. Surg Laparosc Endosc 1993; 3: 391–394.
28.Fritsch A, Kokoschka R, Mach K. Ergebnisse der thorakoskopischen Sympathektomie bei: Hyperhidrosis der oberen Extremitat. Wien Klin Wochenschr 1975; 87: 548–550.
29.Adams DCR, Poskitt KR. Surgical management of primary hyperhidrosis [letter]. Br J Surg 1991; 78: 1019–1020.
30.Edmonson RA, Banerjee AK, Rennie JA. Endoscopic transthoracic sympathectomy in the treatment of hyperhidrosis. Ann Surg 1992; 15: 289–293.
31.Lin CC. Extended thoracoscopic T2 sympathectomy in treatment of hyperhidrosis: experience with 130 consecutive cases. J Laproendosc Surg 1992; 2: 1–6.
32.Olcott C IV, Eitherington EG, et al. Reflex sympathetic dystrophy: the surgeon’s role in management. J Vasc Surg 1991; 14: 488–495.
33.Patman RD, Thompson JE, Persson AV. Management of posttraumatic pain syndromes; report of 113 cases. Ann Surg 1973; 177: 780–787.
34.Mockus MB, Rutherford RB, et al. Sympathectomy for causalgia: patient selection and long-term results. Arch Surg 1987; 122: 668–672.
35.Manart FD, Sadler TR Jr, et al. Upper dorsal sympathectomy. Am J Surg 1985; 150: 762–766.
36.Varennes L, Violet F, et al. Indications et resultats de la sympathectomie thoracique dans les syndromes vasculaires de membre superieur. Lyon Chir 1985; 3: 181–183.
37.van de Wal HJ, Skotnicki SH, et al. Thoracic sympathectomy as a therapy for upper extremity ischemia: a long-term follow-up study. Thorac Cardio Vasc Surg 1985; 33: 181–187.
38.Kux M, Fritsch A., et al. Endoscopic thoracic sympathectomy for the treatment of Raynaud’s phenomenon and disease. Eur Surg Res 1976; 8: 32–33.
39.Bardaxoglou E, Reigner B, et al. Transthoracic endoscopy for upper thoracic chemical sympathectomy. Am Vasc Surg 1992; 6: 390–392.
40.de Takats G. Analysis of results following sympathectomy for peripheral vascular disease Am J Surg 1940; 47(1): 78–86.
41.Landreneau RJ, Hazelrigg SR, et al. Postoperative pain-related morbidity: video-assisted thoracic surgery versus thoracotomy. Ann Thorac Surg 1993; 56: 1285–1289.
https://t.me/medicina_free

Раздел XI
Артерио-венозные мальформации
https://t.me/medicina_free

Глава 83
Артерио-венозные свищи и мальформации
Петер Гловицкий, Одра А. Ноэль и Ларри Х. Холлиэр
Процесс появления патологических сообщений между артериальной и венозной системой остается в центре внимания хирургов уже более двух столетий. В зависимости от выраженности шунтирования крови через капиллярную сеть такие поражения могут быть клинически асимптомными или вызывать локальные эффекты в окружающих тканях. Артерио-венозные фистулы могут иметь наиболее выраженные последствия для циркуляции в дистальных отделах конечностей, могут провоцировать появление необратимых патологических изменений в кровеносных сосудах проксимальной локализации, в редких случаях крупные фистулы центральной локализации являются причиной выраженных циркуляторных и метаболических нарушений. Артерио-венозные фистулы подразделяются на врожденные и приобретенные. При использовании термина артериовенозные мальформации (АВМ) чаще всего подразумевают все врожденные сосудистые мальформации (дисплазии), хотя само употребление данного термина в таком значении является не совсем приемлемым — не при всех дисплазиях может иметь место артериовенозное шунтирование. Поэтому в этой главе аномалии сосудистой системы описываются под термином сосудистые мальформации (СМ). При наличии клинических или ангиографических признаков артериовенозного шунтирования мы считаем целесообразным употребление термина АВМ.
Исторический обзор
Впервые пациента с АВМ, проявлявшейся наличием пульсирующего варикоза на голове (так называемая «циркоидная аневризма»), описал Guido Guidi (1500–1559), личный хирург императора Франциска I [1].
В 1757 г. William Hunter описал пациента с травматической артериовенозной фистулой [2] и в 1764 г. детально проанализиро-
вал два подобных клинических случая [3]. Он отметил характерные клинические признаки данной патологии — дрожание и шум, которые исчезали при проксимальной компрессии артерии или в проекции самой фистулы. В работе W. Hunter приводилось описание извитости и дилатации проксимальной артерии (так называемые «аневризмы анастомоза»), а также пульсация, перерастяжение проксимальных вен и уменьшение выраженности пульсации дистально расположенных артерий. Предпринимавшиеся попытки по ликвидации фистулы при лигировании проксимальной артерии достаточно часто приводили к гангрене конечности [4], но уже в 1843 г. Norris сособщил об удачном исходе лечения артерио-ве- нозной фистулы при двойном лигировании артерии [5]. Типичный при АВ-фистуле «симптом брадикардии», заключавшийся в замедлении частоты сердечных сокращений после компрессии зоны АВсвища у пациента с АВМ, был впервые описан Nicoladoni [6]. 15 лет спустя, в 1890 г., Branham сообщил об аналогичном симптоме у пациента с приобретенной артерио-венозной фистулой [7]. Патофизиология артерио-венозных свищей была подробно освещена в 1937 г. в работах Emile Holman [8]. Важнейшую информацию о тактике лечения артерио-венозных свищей травматического генеза дал нам большой практический опыт военных медиков, приобретенный во время Второй мировой войны [9], конфликта в Корее [10] и, особенно, во время войны во Вьетнаме [11].
Наши знания о СМ с или без артерио-венозных свищей (рис. 83.1) первоначально базировались на работах Reid [12], Holman [8], de Takats [13], Coursley с соавторами [14]. В монографии Malan и Puglionisi были обобщены данные о проблеме врожденных арте- рио-венозных свищей конечностей [15]. Szilagyi с соавторами предложили рабочую клиническую классификацию и основные положения по хирургическому лечению данной патологии [16, 17]. Большим шагом вперед стало внедрение в клинику суперселективной артериальной катетеризации; это внесло определенные корре-
https://t.me/medicina_free

Глава 83. Артерио-венозные свищи и мальформации 321
ктивы в классификацию и лечебную стратегию при заболевании [18, 19]. На основании клинических и ангиографических критериев Belov предложил достаточно практичную классификацию СМ. Она послужила основой для достижения консенсуса по данной проблематике в 1988 г. на 7-й конференции Международного совещания по сосудистым мальформациям в Гамбурге [20].
Этиология
Различают врожденные и приобретенные артерио-венозные свищи. Как показано выше, термин «сосудистые мальформации» (СМ) используется по отношению ко всем сосудистым дисплазиям вне зависимости от объема шунтируемой крови через патологические соустья. Данные СМ являются не истинными опухолями, а лишь «аномалиями развития примитивной сосудистой системы» [13].
Приобретенные артерио-венозные свищи наиболее часто обусловлены проникающими ранениями и повреждениями сосудов. Основные причины их возникновения во время военных конфликтов — огнестрельные или осколочные ранения [9–11], в мирное время — огнестрельные, колото-резаные ранения и переломы [21, 22]. Ятрогенные артерио-венозные фистулы описаны после проведения диагностических и лечебных манипуляций (катетеризация сосудов), люмбальной ламинэктомии, ортопедических процедур, чрескожной биопсии органов (например, печени, почек), эмболэктомии с использованием катетера Фогарти, а также при проведении оперативных вмешательств (спленэктомия, нефрэктомия) с лигированием an mass артерий и вен [23–40]. Артерио-венозные фистулы могут содержать в своей структуре такие опухоли, как гипернефрома или метастазы рака щитовидной железы.
Спонтанно возникающие интраабдоминальные артерио-ве- нозные свищи могут наблюдаться у пациентов с атеросклеротическими или микотическими аневризмами аорто-подвздошной локализации [41, 42]. Аорто-кавальные фистулы, обусловленые, как правило, аневризмами брюшного отдела аорты, АВ-фистулы, накладываемые при гемодиализе, а также после дистальных реконструкций или выполнения венозных тромбэктомий с целью улучшения проходимости в зоне операции, рассмотрены в других разделах данного руководства.
Патофизиология
Следуя утверждениям Holman [43], все циркуляторные изменения, которые наблюдаются при врожденных или приобретенных АВ-фистулах, базируются на основном гемодинамическом принципе: «Кровь, подобно любой жидкости, обладает неотъемлемым свойством находить путь наименьшего сопротивления». Артериовенозное соустье представляет собой патологическое сообщение между артериальной системой с высоким давлением и сопротивлением и высокоемкостной венозной системой, характеризующейся низкими показателями давления и сопротивления. Вследствие низкого сопротивления, больший поток крови шунтируется через АВ-фистулу вместо нормальной капиллярной сети. Давление в дистальном отделе артериального русла при этом снижается, в дистальном отрезке венозного русла повышается. Такие гемодинамические изменения ведут к развитию усиленного артериального и коллатерального венозного кровотока в окружности свища (рис. 83.2). Как результат повышения объема цирку-
Рис. 83.1. Концепция художника в выражении артерио-веноз- ной мальформации («циркоидная аневризма«) верхней конечности. (С разрешения из Breschet G. Memoire sur les aneurysms. Mem Acad Med (Paris) 1833; 3: 101.)
|
Усиление |
Уменьшение |
|
артериаль- |
|
|
среднего |
|
|
ного и |
|
|
и диастолического |
|
|
венозного |
|
|
давления |
|
|
кровотока |
|
|
|
|
Усиление |
|
Усиление |
венозного |
|
артериального |
коллатерального |
|
коллатерального |
кровотока |
|
кровотока |
|
АВ-фистула |
|
Повышение |
Снижение |
|
венозного |
||
систолического |
||
давления |
||
давления |
||
|
Рис. 83.2. Анатомические и гемодинамические изменения, вызванные артерио-венозным шунтированием.
https://t.me/medicina_free

322 Раздел XI. Артерио-венозные мальформации
лирующей крови отмечается прогрессивная дилатация всей системы циркуляции, расположенной проксимально по отношению к фистуле. В то время как расширение полостей сердца и венозных сосудов может уменьшаться после закрытия фистулы, эктазия проксимальных по отношению к фистуле артерий с формированием аневризматических расширений остается, как правило, необратимой. Количество шунтируемой крови определяется диаметром и типом свища и его месторасположением по отношению к сердцу.
В то время, как многие СМ являются асимптомными или вызывают косметические или локальные проблемы, большинство посттравматических АВ-фистул имеют тенденцию к прогрессированию в размерах и по количеству шунтируемой крови. Вследствие этого прогрессивно возрастают такие показатели, как сердечный выброс, частота сердечных сокращений (ЧСС), сердечный индекс (СИ), ударный объем (УО), повышается давление в левых отделах сердца с развитием сердечной недостаточности. Клиническое течение ятрогенных АВ-фистул вследствие катетеризации бедренных сосудов более доброкачественное, определенная часть фистул при данной локализации может закрываться спонтанно [25, 27].
Если выполнить наружную компрессию длительно существующего свища, можно отметить немедленное повышение систолического артериального давления и вследствие вагального ответа на стимуляцию барорецепторов в аорте и каротидных артериях почти всегда регистрируется брадикардия. Сердечный выброс снижается и если сброс по шунту не возобновляется, объем крови возвращается к нормальным показателям в течение нескольких дней.
Метаболические расстройства вследствие повышенного шунтирования крови были описаны Davis с соавторами [44], Epstein и Ferguson [45]. Доказано, что повышение венозного давления и снижение среднего показателя артериального давления ведет в конечном результате к уменьшению почечного кровотока и снижению гломерулярной фильтрации. Вследствие этого юкстрагломерулярный аппарат посредством активизации ренин-ангиотен- зиновой системы усиливает продукцию альдостерона, что повышает содержание натрия и реабсорбцию жидкости с повышением общего объема плазмы. Олигурия или анурия, которые иногда наблюдаются при больших свищах центральной локализации, могут быть устранены после ликвидации свища. Ликвидация патологического сброса сразу ведет к нормализации диуреза, снижению секреции альдостерона и нормализации в течение нескольких дней объемных показателей плазмы.
Приобретенные артерио-венозные фистулы
Встречаемость и локализация
Учитывая тот факт, что очень часто посттравматический артериовенозный свищ диагностируется спустя несколько лет после травмы, достаточно трудно оценить истинную распространенность данной патологии. Анализируя литературу, опубликованную с 1914 г., Callander нашел сообщения о 447 АВ-фистулах и только 3 из них имели врожденный характер [46]. По данным вьетнамского сосудистого регистра, на 7500 повреждений сосудов 262 пациента имели АВ-свищи, что дает среднюю частоту встречаемости 3,5% [11]. Почти такое же количество пациентов имели ложные артериальные аневризмы (3,9%). Частота встречаемости АВ-фи-
стул при травматических повреждениях мирного времени примерно такая же: 6 (2,3%) из 256 пациентов по данным обзора Patman с соавторами [21] и 7 (3,6%) из 172 пациентов по данным работы Sirinek с соавторами [47].
Наиболее частая локализация посттравматических свищей — нижние конечности. В пяти крупных работах, посвященных приобретенным АВ-свищам, более 50% из них имели посттравматическое происхождение [9–11, 21, 48] (рис. 83.3). Из 70 АВ-свищей вследствие травмы мирного времени 13% свищей локализовалось на шее между сонными артериями и яремной веной, в 12% случаев это были каротидно-кавернозные фистулы и в 17% наблюдений они локализовались в проекции бедренных сосудов [22]. При интраабдоминальной локализации наиболее часто мы имеем дело с АВ-свищами почечных сосудов как следствием повреждения данных сосудов при травме печени.
Частота возникновения АВ-фистул после катетерной травмы варьирует в зависимости от диаметра катетера и применения антикоагулянтной или тромболитической терапии после завершения данной процедуры. В работе Oweida с соавторами из университетского госпиталя Emory сообщается о 8 АВ-фистулах, возникших при выполнении 4988 чрескожных баллонных ангиопластик коронарных артерий с частотой данного осложнения 0,16% [24]. Примерно такая же частота (0,11%) приводится в работе Kim с соавторами при анализе 13 203 трансфеморальных диагностических и лечебных процедур [26].
Наружная сонная |
Общая сонная артерия |
|||
артерия 1,8% |
||||
4,5% |
||||
Внутренняя сонная |
|
|
||
|
|
|
||
|
|
|||
артерия 2,0% |
|
|
Подмышечная артерия 4,5% |
|
Подключичная артерия 3,2% |
||||
Безымянная артерия |
Плечевая артерия 4,5% |
|||
|
||||
0,3% |
|
|
|
|
|
|
|
Аорта 1,7% |
|
|
|
|
Лучевая артерия 0,8% |
|
Лучевая артерия |
|
|||
2,0% |
|
|
Подвздошные |
|
|
|
|
артерии 0,7% |
|
|
|
|
Бедренные |
|
|
|
|
артерии 29% |
|
|
|
|
Подколенная артерия |
|
|
|
|
16% |
|
Задняя
большеберцовая артерия 8,5%
Рис. 83.3. Локализация посттравматических АВ-свищей.
https://t.me/medicina_free
Глава 83. Артерио-венозные свищи и мальформации 323
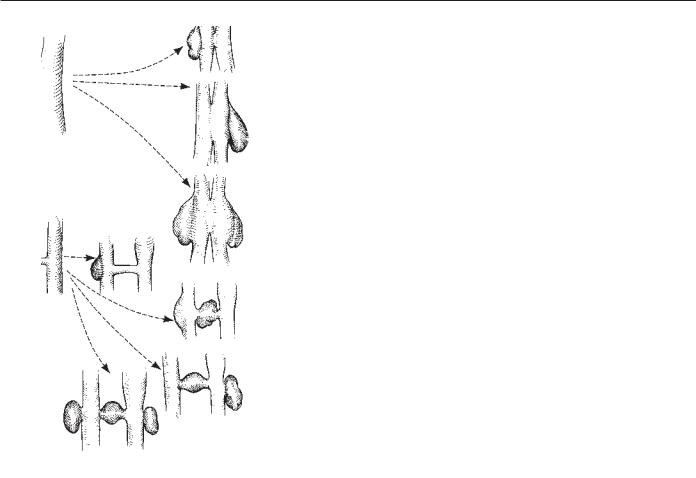
Рис. 83.4. Различные анатомические варианты приобретенных АВ-фистул.
Анатомические особенности строения АВ-фистул определяются объемом повреждения артерии и вены и длительностью течения данного патологического процессса (рис. 83.4). После травмы достаточно быстро формируется ложная аневризма вследствие наличия персистирующей пульсирующей гематомы с артериовенозным сообщением или в результате повреждения стенки сосуда, расположенного проксимальнее АВ-фистулы. Хронические истинные артериальные и венозные аневризмы являются следствием локальной или системной гемодинамической травмы, которая включает в себя повышение объема циркулирующей крови, повышение потока крови через фистулу, повышение внутрисосудистого давления, что обсуждалось выше. Частота ассоциированных артериальных и венозных аневризм варьирует от 20% до 60% [49, 50].
Клиническая картина
Клиническая картина у пациентов с приобретенными АВ-свища- ми типична. Наиболее важными симптомами являются определяемое при пальпации дрожание и систоло-диастолический шум, а также наличие пульсирующего объемного образования. Поверхностные вены при этом, как правило, расширены, пульсация периферических артерий может быть ослаблена. Анамнестически и клинически определяются признаки проникающего ранения или перелома костей в проекции крупных кровеносных сосудов.
В случае остро-возникших АВ-фистул клиника не всегда характерна, и шум может отсутствовать почти в 45% случаев. Дистальнее пульсация может быть ослаблена в 11% случаев (по данным анализа 70 пациентов в работе Kollmeyer с соавторами [22]), и ни в одном случае не зарегистрирован положительный симптом Branham–Nicoladoni. Хотя проникающие ранения являются основным этиологическим фактором возникновения АВ-фистул, определенную роль в мирное время играет и тупая травма. Шумовая симптоматика в проекции черепа после перелома основания черепа является патогномоничным симптомом каротидно-кавернозной фистулы. Такие пациенты отмечают пульсирующие головные боли, нарушения зрения, пульсирующий экзофтальм и проявления коньюнктивального застоя [51].
Диагностика
В случае наличия длительно существующей (хронической) АВфистулы диагноз, как правило, может быть поставлен уже на основании анамнеза и физикального обследования пациента. Помимо шумовой симтоматики и дрожания, в клинической картине отмечается симптоматика хронической венозной недостаточности — отечность, пигментация, индурация, варикозное расширение поверхностных вен, трофические язвы. Регистрируется повышение кожной температуры на уровне фистулы и проксимальнее последней. Данный диагноз подтверждают симптомы, свидетельствующие о нарушении функции сердца. При длительном существовании АВ-фистул в случае, если они существуют до окончания роста эпифизиального хряща, описано наличие гипертрофии костей с удлинением конечности [52]. У ряда пациентов с хроническими фистулами отмечается аневризматическая трансформация сегмента артерии, расположенного проксимальнее фистулы. В качестве редкого осложнения хронического АВ-свища описано возникновение подострого бактериального эндокардита.
У пациентов с АВ-свищом центральной локализации (например аорто-кавальной фистулой) в клинической картине отмечается острое течение с острым возникновением сердечной недостаточности, шумовой симтоматики в животе, сочетающейся с ишемией и отеком конечностей [41]. При спонтанных АВфистулах подвздошной локализации картина венозного стаза и/или артериальной ишемии отмечается только на пораженной конечности [42].
Для подтверждения диагноза малых АВ-свищей, определения объема шунтирования и степени ишемии конечности в результате дистального «стил-синдрома» необходимо использование неинвазивных диагностических методик. Наиболее значимыми диагностическими тестами являются измерение сегментарного систолического давления, запись пульс–объемная кривая, ультразвуковая допплерография и дуплексное сканирование. Такие методики были подробно описаны Sumner [53] и Rutherford [54] и детально рассмотрены в других главах руководства.
При измерении сегментарного систолического давления отмечается повышение систолического давления проксимальнее гемодинамически значимой АВ-фистулы. При этом дистальнее локализации свища давление нормализуется или даже снижается по сравнению с противоположной конечностью.
Запись пульс–объемная кривая повышена проксимальнее фистулы и показывает заостренный систолический пик со снижением или отсутствием анакроты. В ряде случаев снижение пуль-
https://t.me/medicina_free
