
2 курс / Микробиология 1 кафедра / Доп. материалы / Общая_микробиология_Иллюстрированное_учебное_пособие_Н_В_Литусов
.pdf
|
|
|
|
|
|
401 |
2. |
Амоксициклин |
АКК |
10 |
≤10 |
11-12 |
≥13 |
|
(амоксиклав) |
(Ас) |
|
|
|
|
3. |
Ампициллин |
АМП |
10 |
≤9 |
10-13 |
≥14 |
|
|
(А) |
|
|
|
|
4 |
Бензилпенициллин |
ПЕН |
6 |
≤11 |
12-21 |
≥22 |
|
|
(Р) |
|
|
|
|
5. |
Ванкомицин |
ВА |
30 |
≤14 |
15-16 |
≥17 |
|
|
(Va) |
|
|
|
|
6. |
Гентамицин |
ГЕН |
10 |
≤13 |
- |
≥14 |
|
|
(G) |
|
|
|
|
7. |
Доксициклин |
ДОК |
10 |
≤12 |
13-19 |
≥20 |
|
|
(Do) |
|
|
|
|
8. |
Канамицин |
КАН |
30 |
≤14 |
15-18 |
≥19 |
|
|
(К) |
|
|
|
|
9 |
Карбенициллин |
КАР |
25 |
≤14 |
15-18 |
≥19 |
|
|
(Cb) |
|
|
|
|
10. |
Клиндамицин |
КЛ |
2 |
≤14 |
15-20 |
≥21 |
|
|
(Cd) |
|
|
|
|
11. |
Левомицетин |
ЛЕВ |
30 |
≤14 |
15-18 |
≥19 |
12. |
Линкомицин |
ЛИН |
15 |
≤19 |
20-23 |
≥24 |
|
|
(L) |
|
|
|
|
13. |
Линезолид |
(Lz) |
30 |
≤20 |
21-22 |
≥23 |
14. |
Меропенем |
МПН |
25 |
≤13 |
14-15 |
≥16 |
|
|
(Mr) |
|
|
|
|
15 |
Метициллин |
МЕТ |
10 |
≤13 |
14-17 |
≥18 |
|
|
(М) |
|
|
|
|
16. |
Мономицин |
МОН |
30 |
≤13 |
14-17 |
≥18 |
17. |
Неомицин |
НЕО |
30 |
≤13 |
14-17 |
≥18 |
|
|
(N) |
|
|
|
|
18. |
Нетилмицин |
НИЦ |
30 |
≤12 |
13-14 |
≥15 |
|
|
(Nt) |
|
|
|
|
19. |
Нитрофурантоин |
(Nf) |
300 |
≤14 |
15-16 |
≥17 |
20. |
Оксациллин |
ОКС |
10 |
≤19 |
20-23 |
≥24 |
|
|
(Ox) |
|
|
|
|
21. |
Олеандомицин |
ОЛЕ |
15 |
≤12 |
13-17 |
≥18 |
|
|
(Ol) |
|
|
|
|
22. |
Офлоксацин |
(Of) |
5 |
≤12 |
13-16 |
≥17 |
23. |
Полимиксин - В |
ПОЛ |
300 ЕД |
≤8 |
9-12 |
≥13 |
|
|
(Pb) |
|
|
|
|
24. |
Ристомицин |
РИС |
30 |
≤9 |
10-11 |
≥12 |
25. |
Рифампицин |
РИФ |
5 |
≤9 |
10-12 |
≥13 |
|
|
(R) |
|
|
|
|
26. |
Стрептомицин |
СТР |
30 |
≤13 |
14-16 |
≥17 |
|
|
(S) |
|
|
|
|
27. |
Тетрациклин |
ТЕТ |
30 |
≤15 |
16-19 |
≥20 |

403
Е-тест |
соответствует тот |
|
исследуемой культуры |
||
|
||
( |
Вариант постановки Е-теста |
|
|
Зона
Зона
МПК 2
|
|
86 |
|
85 |
|
Рисунок 13.22 – Схема интерпретации результатов опыта и определение МПК с |
||
|
помощью Е-теста. |
|
Автоматические |
|
|
представляют |
Vitek 2. Автоматическая система для иденти |
|
регистрирующими |
микроорганизмов и определения чувствител |
|
|
|
|
Например, устройс |
АМП |
|
часов, при этом |
|
|
антимикробных |
|
|
|
• |
Обеспечивают по |
|
|
результата вмест |
|
|
антибиотикограм |
|
|
день получения ч |
|
|
культуры |
|
• |
Идентификация |
|
|
таксонов |
|
• |
Определение |
|
|
чувствительност |
Рисунок 13.23 – Устройство VITEK 2 для автоматической идентификации и |
||
|
|
(минимальных |
определения чувствительности бактерий к антимикробным препаратам. |
||
|
|
ингибирующих |
|
|
концентраций) к |
На практике величина МПК позволяет отнести исследуемый штамм |
||
микроорганизма к одной из трех общепринятых категорий: |
антимикробных |
|
- чувствительный микроб; |
препаратов |
|
-умеренно-устойчивый микроб;
-устойчивый микроб.
Микроорганизм считается чувствительным, если у него нет устойчивости к данному лекарственному средству, и при лечении стандартными дозами этого препарата отмечается хорошая терапевтическая эффективность.
Устойчивым к антимикробному средству считают микроорганизм, если он
405
развивающаяся после контакта с химиотерапевтическим препаратом.
Генетические основы приобретенной резистентности:
1.Мутации в бактериальной хромосоме с последующей селекцией мутантов. Такой путь приобретения устойчивости наблюдается в присутствии антибиотиков, так как в этом случае мутанты приобретают селективные преимущества.
2.Перенос хромосомных генов антибиотикорезистентности от устойчивых клеток к чувствительным.
3.Перенос R-плазмид (плазмид резистентности). При этом плазмиды могут кодировать устойчивость сразу к нескольким антибиотикам (множественная устойчивость).
4.Перенос транспозонов (мигрирующих генетических последовательностей), несущих гены резистентности к антибиотикам (r-гены). Транспозоны способны мигрировать с хромосомы на плазмиду и обратно, что увеличивает вероятность возникновения антибиотикорезистентных бактерий.
Резистентность, обусловленная мутациями, связана с изменением в структуре гена, кодирующего чувствительность к антибиотику. При этом возникают
как спонтанные, так и индуцированные мутации. Спонтанные мутации, наблюдаемые с частотой от 10-7 до 10-12, играют очень незначительную роль в формировании резистентности. На фоне применения антибактериального средства часто возникают индуцированные мутации. В этом случае имеет место естественная селекция антибиотикоустойчивых штаммов. Подобным путем у штаммов Staphylococcus aureus выработалась устойчивость к метициллину.
Мутации могут быть единичными, при которых возникают бактерии, устойчивые к одному какому-нибудь антибиотику, а также множественными, при которых возникает потомство, обладающее устойчивостью к нескольким антибиотикам.
Наиболее часто резистентность к антибиотикам обусловлена переносом плазмид. Плазмиды резистентности (R-плазмиды) - внехромосомные молекулы ДНК. Они способны к автономной репродукции и кодируют антибиотикоустойчивость у различных бактерий. Плазмиды могут включать один и более генов, кодирующих синтез ферментов, обусловливающих инактивацию или модификацию лекарственных препаратов (например, β-лактамазы, инактивирующие пенициллины и цефалоспорины, или ацетилтрансферазы, нарушающие структуру хлорамфеникола), а также опосредующих быструю элиминацию препаратов (например, тетрациклинов) из клетки. Гены множественной устойчивости могут кодировать транспозоны, которые у одних бактерий интегрируются в плазмиды, а у других микробов встраиваются в бактериальную хромосому. R-плазмиды способны
кширокому распространению в популяциях бактерий в результате генетического переноса (конъюгации, трансдукции, трансформации).
Механизмы формирования резистентности микроорганизмов к антибиотикам (рисунок 13.24):
1.Превращение активной формы антибиотика в неактивную форму путем ферментативной инактивации (разрушения). Например, многие бактерии
продуцируют фермент -лактамазу, разрушающую -лактамные антибиотики (пенициллины и цефалоспорины).

407
метаболизма). Например, такой механизм резистентности характерен для сульфаниламидных препаратов.
Пути борьбы с антибиотикоустойчивыми бактериями:
-систематическое получение новых антимикробных препаратов (обновление рынка антибиотиков);
-химическая модификация известных антибиотиков с защищенными активными группами, устойчивыми к бактериальным ферментам;
-изыскание ингибиторов, подавляющих активность бактериальных ферментов, а также препаратов, препятствующих адгезии бактерий на клетках макроорганизма;
-систематическое изучение типов лекарственной устойчивости патогенных и условно-патогенных бактерий, циркулирующих в пределах отдельных регионов;
-своевременная информация врачей о циркулирующих в регионе лекарственно-устойчивых бактериях;
-определение чувствительности выделенных бактерий к антибиотикам.
С целью предотвращения возникновения резистентных микроорганизмов при лечении необходимо комбинировать антибиотики или использовать их в сочетании с другими химиотерапевтическими средствами (сульфаниламидами, нитрофуранами, производными оксихинолина) и применять препараты, повышающие иммунологическую реактивность организма.
13.8. Характеристика антимикробных препаратов
В настоящее время все антимикробные препараты с учетом комплекса характеристик подразделяются на следующие группы:
А. Антибактериальные препараты: 1. Пенициллины:
1.1.Природные пенициллины (пенициллин).
1.2.Полусинтетические пенициллины:
-устойчивые к пенициллиназам - клоксациллин, оксациллин, метициллин;
-карбоксипенициллины - карбенициллин, тикарциллин;
-уреидопенициллины (антисинегнойные препараты) – мезлоциллин, азлоциллин, пиперациллин;
-аминопенициллины - ампициллин, амоксициллин;
-амидопенициллины – мециллам;
-комбинированные препараты, содержащие ингибиторы бета-лактамаз – амоксициллин + клавулановая кислота, ампициллин + сульбактам, пиперациллин + тазобактам, тикарциллин + клавулановая кислота.
Общая структура и готовая лекарственная форма одного из пенициллинов представлены на рисунке 13.26.
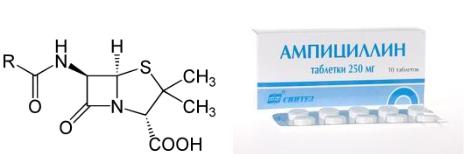
409
антибиотики применяются для лечения пневмонии, сепсиса, менингита и других инфекций. Цефалоспорины подразделяются на 5 групп, отличающихся между собой по спектру антимикробного действия:
-цефалоспорины первого поколения: цефалотин, цефазолин, цефалексин,
цефаклор, цефадроксил;
-цефалоспорины второго поколения: цефуроксим, цефаклор, цефметазол,
цефотиам, цефамандол, цефокситин;
-цефалоспорины третьего поколения: цефотаксим, цефтриаксон,
цефтазидим, цефтизоксим, цефиксим;
-цефалоспорины четвертого поколения: цефпиром, цефепим;
-цефалоспорины пятого поколения – цефтобипрол, цефтаролин.
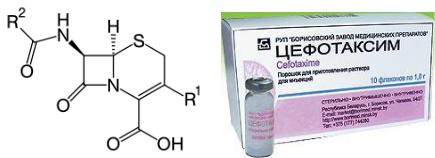
Общая структура и один из цефалоспоринов представлены на рисунке 13.27.
Рисунок 13.27 - Общая структура цефалоспоринов и готовая лекарственная форма цефотаксима.
Цефалоспорины I поколения проявляют активность преимущественно в отношении грамположительных микроорганизмов: Streptococcus spp. и метициллиночувствительных Staphylococcus spp. Обладают невысокой активностью в отношении грамотрицательных бактерий. К цефалоспоринам I поколения чувствительны большинство анаэробов, за исключением B. fragilis. Эти антибиотики применяют преимущественно для лечения инфекций кожи и мягких тканей легкой и средней степени тяжести.
Цефалоспорины II поколения несколько уступают препаратам I поколения по активности в отношении грамположительных кокков, но превосходят в отношении грамотрицательных микроорганизмов. К препаратам II поколения чувствительны Е. coli, Salmonella spp., Proteus mirabilis, Klebsiella spp., Proteus vulgaris, Citrobacter diversus.
Цефалоспорины III поколения проявляют высокую устойчивость к β- лактамазам грамотрицательных микроорганизмов. Они активны в отношении менингококков, гонококков, Н. influenzae и М. catarrhalis, а также всех представителей семейства Enterobacteriaceae. Цефотаксим, цефтриаксон и цефтазидим хорошо проникают через гематоэнцефалический барьер, обеспечивая терапевтические концентрации в ликворе.
Цефалоспорины IV поколения близки к цефалоспоринам III поколения. Однако они лучше проникают через цитоплазматическую мембрану грамотрицательных бактерий и обладают высокой устойчивостью к гидролизу

