
- •О книге
- •Предисловие
- •Введение - Л. Б. Богоявленская
- •Краткий очерк истории микробиологии - Л. Б. Богоявленская
- •Часть I. Общая микробиология
- •Глава 1. Микробиологическая лаборатория - Л. Б. Богоявленская
- •Правила поведения и работы в микробиологической лаборатории
- •Методы микробиологического исследования
- •Контрольные вопросы
- •Глава 2. Микроскоп и микроскопические методы исследования - М. Я. Корн
- •Фазово-контрастная микроскопия
- •Темнопольная микроскопия
- •Люминесцентная (флюоресцентная) микроскопия
- •Электронная микроскопия
- •Контрольные вопросы
- •Глава 3. Основы классификации и морфология микроорганизмов - О. Б. Орлеанская
- •Бактерии
- •Строение бактериальной клетки
- •Микоплазмы
- •Спирохеты
- •Риккетсии
- •Вирусы
- •Контрольные вопросы
- •Изучение морфологии микроорганизмов
- •Техника приготовления мазка
- •Высушивание мазка
- •Фиксация мазка
- •Окраска препаратов
- •Рецепты красителей
- •Простой метод окраски
- •Сложные методы окраски
- •Прижизненная окраска микроорганизмов
- •Изучение подвижности микроорганизмов
- •Контрольные вопросы
- •Задание
- •Глава 4. Физиология микроорганизмов
- •Химический состав бактерий
- •Питание бактерий
- •Ферменты и их роль в обмене веществ
- •Дыхание бактерий
- •Пигменты микроорганизмов
- •Светящиеся и ароматообразующие микроорганизмы
- •Рост и размножение бактерий
- •Контрольные вопросы
- •Глава 5. Влияние факторов окружающей среды на микроорганизмы - Н. А. Бельская
- •Физические факторы
- •Химические факторы
- •Биологические факторы
- •Контрольные вопросы
- •Стерилизация
- •Физические способы
- •Сухожаровая стерилизация
- •Контрольные вопросы
- •Задание
- •Стерилизация кипячением
- •Контрольные вопросы
- •Задание
- •Контрольные вопросы
- •Стерилизация ультрафиолетовым облучением
- •Контрольные вопросы
- •Механическая стерилизация при помощи бактериальных фильтров
- •Контрольные вопросы
- •Химические способы
- •Биологическая стерилизация
- •Контрольные вопросы
- •Дезинфекция
- •Контрольные вопросы
- •Задание
- •Глава 6. Распространение микроорганизмов в природе - Л. Б. Богоявленская
- •Микрофлора почвы
- •Микрофлора воды
- •Микрофлора воздуха
- •Микрофлора организма человека
- •Контрольные вопросы
- •Глава 7. Питательные среды и микробиологическое исследование - Г. И. Кац
- •Питательные среды
- •Требования, предъявляемые к средам
- •Классификация сред
- •Контрольные вопросы
- •Задание
- •Приготовление сред
- •Рецепты приготовления простых (основных) сред и изотонического раствора натрия хлорида
- •Рецепты приготовления сложных сред
- •Сухие среды
- •Контрольные вопросы
- •Задание
- •Методы посевов
- •Контрольные вопросы
- •Методы культивирования
- •Методы выделения чистых культур микроорганизмов
- •Изучение выделенных культур
- •Культуральные свойства
- •Морфологические свойства
- •Ферментативная активность
- •Сохранение культур
- •Контрольные вопросы
- •Задание
- •Глава 8. Фаги - Г. И. Кац
- •Свойства фагов
- •Контрольные вопросы
- •Методы изучения вирулентных фагов
- •Подготовка материала
- •Качественные методы
- •Количественные методы
- •Методы выделения фагов
- •Практическое применение фагов
- •Препараты фагов
- •Контрольные вопросы
- •Задание
- •Глава 9. Антибиотики. Химиопрофилактика и химиотерапия
- •Общая характеристика - Н. А. Бельская
- •Контрольные вопросы
- •Чувствительность микроорганизмов к антибиотикам - Н. А. Бельская
- •Методы определения
- •Методика работы с оптическим стандартом мутности
- •Контрольные вопросы
- •Задание
- •Химиопрофилактика и химиотерапия
- •Глава 10. Генетика микроорганизмов - Ф. К. Черкес
- •Фенотипическая изменчивость (модификация)
- •Генотипическая (наследуемая) изменчивость
- •Плазмиды
- •Практическое значение изменчивости
- •Контрольные вопросы
- •Глава 11. Учение об инфекции - Ф. К. Черкес
- •Патогенность и вирулентность микроорганизмов
- •Роль макроорганизма в инфекционном процессе
- •Влияние окружающей среды на возникновение и развитие инфекционного процесса
- •Механизм передачи инфекции
- •Формы инфекционного процесса
- •Динамика развития инфекционного заболевания
- •Контрольные вопросы
- •Биологические методы исследования
- •Виды лабораторных животных
- •Содержание лабораторных животных
- •Отбор животных и подготовка их к опыту
- •Экспериментальное заражение животных
- •Контрольные вопросы
- •Задание
- •Способы заражения
- •Контрольные вопросы
- •Задание
- •Вскрытие и микробиологическое исследование погибших животных
- •Контрольные вопросы
- •Техника взятия крови у животных
- •Обработка и выделение составных частей крови
- •Контрольные вопросы
- •Задание
- •Глава 12. Учение об иммунитете. Реакции иммунитета. Иммунопрофилактика и иммунотерапия инфекционных болезней - Л. Б. Богоявленская, Г. И. Кац
- •Наследственный (видовой) иммунитет
- •Приобретенный иммунитет
- •Неспецифические факторы защиты организма
- •Клеточные факторы неспецифической защиты
- •Фагоцитоз
- •Клеточная реактивность
- •Контрольные вопросы
- •Гуморальные факторы неспецифической защиты
- •Контрольные вопросы
- •Специфические факторы защиты организма (иммунитет)
- •Антигены
- •Контрольные вопросы
- •Антитела
- •Контрольные вопросы
- •Клеточные механизмы иммунного ответа
- •Контрольные вопросы
- •Серологические реакции
- •Реакция агглютинации
- •Контрольные вопросы
- •Задание
- •Реакция гемагглютинации
- •Реакция торможения гемагглютинации
- •Реакция непрямой гемагглютинации
- •Контрольные вопросы
- •Задание
- •Реакция преципитации
- •Контрольные вопросы
- •Задание
- •Реакция лизиса (иммунный цитолиз)
- •Контрольные вопросы
- •Задание
- •Реакция связывания комплемента
- •Подготовка ингредиентов
- •Проведение основного опыта
- •Контрольные вопросы
- •Задание
- •Peaкция иммунофлюоресценции
- •Опсонофагоцитарная реакция
- •Контрольные вопросы
- •Задание
- •Реакции иммунитета in vivo (кожаные пробы)
- •Контрольные вопросы
- •Иммунопрофилактика и иммунотерапия инфекционных болезней
- •Контрольные вопросы
- •Глава 13. Аллергия - Л. Б. Богоявленская
- •Реакции гиперчувствительности немедленного типа
- •Реакции гиперчувствительности замедленного типа
- •Контрольные вопросы
- •Часть II. Частная микробиология
- •Патогенные кокки - Ф. К. Черкес
- •Глава 14. Стафилококки
- •Контрольные вопросы
- •Микробиологическое исследование
- •Контрольные вопросы
- •Задание
- •Глава 15. Стрептококки
- •Streptococcus pyogenes (гемолитический)
- •Микробиологическое исследование
- •Streptococcus pneumoniae (пневмококк)
- •Контрольные вопросы
- •Микробиологическое исследование
- •Контрольные вопросы
- •Задание
- •Глава 16. Менингококки
- •Контрольные вопросы
- •Микробиологическое исследование
- •Глава 17. Гонококки
- •Контрольные вопросы
- •Микробиологическое исследование
- •Семейство кишечных бактерий
- •Глава 18. Эшерихии - Л. Б. Богоявленская, Ф. К. Черкес
- •Контрольные вопросы
- •Микробиологическое исследование
- •Глава 19. Сальмонеллы - Л. Б. Богоявленская, Ф. К. Черкес
- •Брюшной тиф, паратифы А и В
- •Пищевые токсикоинфекции
- •Внутрибольничная сальмонеллезная инфекция
- •Контрольные вопросы
- •Микробиологическое исследование
- •Глава 20. Шигеллы - Ф. К. Черкес
- •Контрольные вопросы
- •Микробиологическое исследование
- •Условно-патогенные бактерии - Л. Б. Богоявленская
- •Глава 21. Клебсиеллы
- •Микробиологическое исследование
- •Контрольные вопросы
- •Глава 22. Протей
- •Микробиологическое исследование
- •Контрольные вопросы
- •Глава 23. Иерсинии энтероколитика
- •Микробиологическое исследование
- •Контрольные вопросы
- •Микробиологическое исследование
- •Контрольные вопросы
- •Возбудители особо опасных инфекций - Ф. К. Черкес
- •Глава 25. Возбудители холеры
- •Контрольные вопросы
- •Микробиологическое исследование
- •Глава 26. Возбудитель чумы
- •Контрольные вопросы
- •Микробиологическое исследование
- •Контрольные вопросы
- •Глава 27. Возбудитель псевдотуберкулеза
- •Микробиологическое исследование
- •Глава 28. Возбудитель туляремии
- •Контрольные вопросы
- •Микробиологическое исследование
- •Глава 29. Возбудители бруцеллеза
- •Контрольные вопросы
- •Микробиологическое исследование
- •Глава 30. Возбудитель сибирской язвы
- •Контрольные вопросы
- •Микробиологическое исследование
- •Контрольные вопросы
- •Задание
- •Глава 31. Возбудители коклюша и паракоклюша
- •Контрольные вопросы
- •Микробиологическое исследование
- •Контрольные вопросы
- •Микробиологическое исследование
- •Глава 33. Возбудители туберкулеза
- •Контрольные вопросы
- •Микробиологическое исследование
- •Патогенные анаэробы - Ф. К. Черкес
- •Контрольные вопросы
- •Глава 34. Возбудитель столбняка
- •Микробиологическое исследование
- •Контрольные вопросы
- •Глава 35. Возбудители газовой гангрены
- •Clostridium perfringens
- •Clostridium novyi
- •Clostridium septicum
- •Clostridium histolyticum
- •Clostridium sordellii
- •Микробиологическое исследование
- •Контрольные вопросы
- •Глава 36. Возбудитель ботулизма
- •Микробиологическое исследование
- •Контрольные вопросы
- •Патогенные спирохеты - Ф. К. Черкес
- •Глава 37. Возбудитель сифилиса
- •Контрольные вопросы
- •Микробиологическое исследование
- •Контрольные вопросы
- •Глава 38. Возбудители возвратного тифа
- •Эпидемический возвратный тиф
- •Контрольные вопросы
- •Эндемический возвратный тиф
- •Микробиологическое исследование
- •Контрольные вопросы
- •Задание
- •Глава 39. Спирохеты Венсана
- •Глава 40. Возбудители лептоспирозов
- •Контрольные вопросы
- •Микробиологическое исследование
- •Риккетсии - Ф. К. Черкес
- •Глава 41. Возбудители сыпного тифа
- •Сыпной тиф
- •Болезнь Брилла
- •Контрольные вопросы
- •Эндемический блошиный тиф
- •Контрольные вопросы
- •Микробиологическое исследование
- •Контрольные вопросы
- •Глава 42. Возбудитель Ку-лихорадки
- •Контрольные вопросы
- •Микробиологическое исследование
- •Контрольные вопросы
- •Вирусы
- •Вирусологическая диагностика
- •Контрольные вопросы
- •Глава 44. Возбудитель бешенства
- •Вирусологическая диагностика
- •Контрольные вопросы
- •Глава 45. Возбудители полиомиелита
- •Вирусы полиомиелита
- •Вирусологическая диагностика
- •Вирусы Коксаки
- •Вирусологическая диагностика
- •Вирусы ECHO
- •Вирусологическая диагностика
- •Контрольные вопросы
- •Вирусологическая диагностика
- •Контрольные вопросы
- •Вирус гепатита А
- •Вирус гепатита В
- •Вирусологическая диагностика
- •Контрольные вопросы
- •Онкогенные вирусы
- •Часть III. Санитарная микробиология
- •Санитарно-бактериологическое исследование воды - Ф. К. Черкес
- •Определение общего числа бактерий
- •Определение БГКП
- •Выявление свежего фекального загрязнения
- •Санитарно-бактериологическое исследование почвы - Н. А. Бельская
- •Контрольные вопросы
- •Задания
- •Санитарно-бактериологическое исследование воздуха - Ф. К. Черкес
- •Методы отбора проб воздуха
- •Контрольные вопросы
- •Задача
- •Задание
- •Санитарно-бактериологическое исследование молока и молочных продуктов Ф. К. Черкес, Н. А. Бельская
- •Определение общего числа бактерий
- •Определение БГКП
- •Санитарно-бактериологическое исследование крема и изделий из крема - Ф. К. Черкес
- •Определение титра кишечной палочки
- •Выявление коагулазоположительных стафилококков
- •Контрольные вопросы
- •Санитарно-бактериологическое исследование колбасных и мясных продуктов промышленного производства - Ф. К. Черкес
- •Определение количества микробов в 1 г продукта
- •Определение БГКП в 1 г продукта
- •Выявление сальмонелл
- •Определение протея
- •Санитарно-бактериологическое исследование баночных консервов - Ф. К. Черкес
- •Контрольные вопросы
- •Санитарно-бактериологическое исследование смывов - Ф. К. Черкес
- •Исследование на БГКП
- •Выявление S. aureus
- •Определение общего числа бактерий
- •Контрольные вопросы
- •Задания
- •Санитарно-бактериологическое исследование перевязочного и хирургического материала на стерильность - Ф. К. Черкес
- •Контрольные вопросы
- •Санитарно-бактериологическое исследование безалкогольных напитков - Ф. К. Черкес
- •Краткий словарь микробиологических терминов - Г. И. Кац
3.Устойчивость возбудителей коклюша и паракоклюша во внешней среде.
4.Дифференциальные признаки возбудителей коклюша и паракоклюша.
5.Источники заражения, пути передачи, патогенез коклюша.
Микробиологическое исследование
Цель исследования: выявление возбудителя и дифференциация возбудителей коклюша от паракоклюша.
Материалдля исследования
Отделяемое слизистой оболочки носоглотки.
Способысбора материала


Способы сбора материала
Основной метод исследования
Микробиологический
Ход исследования
Первый день исследования
Первый день исследования
Второй - третий дниисследования
Посевы вынимают из термостата и просматривают, пользуясь лупой или стереоскопическим бинокулярным микроскопом. При наличии подозрительных колоний их выделяют на КУА: в чашках Петри, разделенных на сектора, или в пробирках. Посевы ставят в термостат. Если колоний много, из части их можно сделать мазки, покрасить и посмотреть под микроскопом. При наличии мелких грамотрицательных палочек ставят пробную реакцию агглютинации с моноспецифической родовой сывороткой 7. Положительная реакция агглютинации свидетельствует о принадлежности выделенной культуры к роду Bordetella. Для определения вида бордетелл ставят реакцию агглютинации с моноспецифическими видовыми сыворотками 1 и 14. Реакции ставят на предметном стекле. Положительный результат реакции агглютинации позволяет дать предварительный ответ.
Четвертый день исследования
Посевывынимаютизтермостатаипросматривают:сначаланевооруженным глазом, обращая внимание на Цвет среды (нет ли коричневого окрашивания), затем изучают рост при помощи стереоскопического микроскопа.
При наличии подозрительных колоний из выделенной культуры делают мазки, окрашивают по Граму и изучают под микроскопом. Затем повторно (из
чистой культуры) ставят реакцию агглютинации на стекле с моноспецифическими сыворотками 1,2,3 и 14. Результаты агглютинации дают возможность отдифференцировать В. pertussis от В. parapertussis, и если это - В. pertussis, то определить серовар: 1-й серовар - (1,2,3), 2-й серовар - (1,2,0), 3-й серовар - (1,0,3). Определение серовара имеет эпидемиологическое значение.
Для окончательной идентификации выделенной культуры (при положительной агглютинации с моноспецифическими сыворотками) ставят пробу на наличие уреазы и производят посев на скошенный агар, содержащий 0,1% тирозина (см. рис. 49).
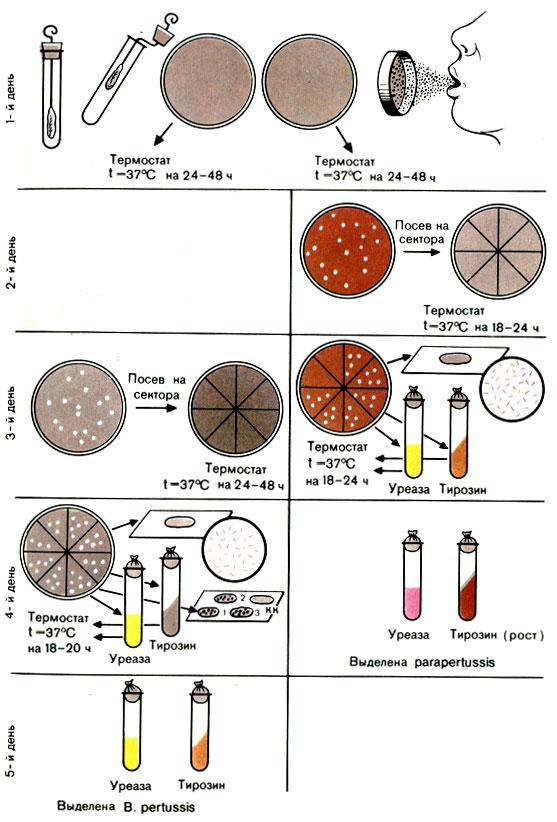
Рис. 49. Схема выделения и идентификации возбудителей коклюша и паракоклюша (Bordetella pertussis и Bordetella parapertussis)
Проба на уреазу. В маленькую пробирку наливают 0,3-0,4 мл 2% раствора мочевины, вносят петлю культуры и добавляют 2-3 капли фенолфталеина. Пробирку встряхивают и ставят в термостат. Учитывают реакцию через 2 и 24
ч. Бактерии коклюша не изменяют цвет среды. Бактерии паракоклюша обладают ферментом уреазой, который расщепляют мочевину с образованием аммиака. Аммиак изменяет индикатор и среда окрашивается в красный цвет.
Проба с тирозином. На скошенный МПА в пробирках с 0,1% тирозином засевают выделенную культуру и ставят в термостат. На следующий день вынимают пробирку из термостата и просматривают ее. Наличие роста в пробирке и окрашивание среды в коричневый цвет свидетельствуют о росте возбудителей паракоклюша. Возбудители коклюша на этой среде не растут.
Пятый день исследования
При отсутствии подозрительных колоний дают отрицательный ответ.
Ускоренная диагностика
При бактериологическом методе исследования ответ можно получить через 3-4 дня.
1.Применение иммунно-люминесцентного метода позволяет дать ответ через несколько часов после взятия материала путем непосредственного выявления микробов в мазках, сделанных с тампонов.
2.Из посевов на среде КУА при отсутствии видимого роста можно сделать мазок-отпечаток: для этого стерильной резиновой пробкой дотрагиваются до места посева и переносят отпечаток на предметное стекло. Мазок-отпечаток изучаютметодомиммунофлюоресценции.Вмазкахобнаруживаютсябактерии В. pertussis или В. parapertussis.
Контрольные вопросы
1.Что служит материалом для исследования при подозрении на коклюш?
2.Какие методы сбора материала применяют для выявления возбудителя при подозрении на коклюш?
3.Что прибавляют к среде для подавления роста посторонней микрофлоры?
Задание
1.Возьмите 10 чашек со средой КУА, флакон пенициллина, содержащий 300000 ЕД. Сделайте разведение пенициллина таким образом, чтобы в 0,1 мл содержалось 7,5 ЕД. Сделайте расчет на общее количество среды.
2.Соберите отделяемое носоглотки друг у друга и сделайте посев на среду КУА.
3.Возьмите у преподавателя чашку с культурой бактерий коклюша или паракоклюша, изучите характер колоний с помощью стереоскопического микроскопа. Подозрительные колонии посейте на сектор среды КУА (выделение чистой культуры).
4.Возьмите у преподавателя чистую культуру возбудителей коклюша или паракоклюша, выросшую на секторе среды КУА, и поставьте реакцию агглютинации с диагностической коклюшной сывороткой.
При наличии положительной реакции агглютинации поставьте пробу на уреазу и сделайте посев на среду с тирозином (0,1%).
Питательные среды
КУА. Среду готовит Институт эпидемиологии и микробиологии им. Н. Ф. Гамалея. Готовая среда КУА черного цвета, конденсационная вода не должна содержать частиц угля. В готовом виде среду можно сохранять продолжительное время (до месяца и более), предохраняя ее от высыхания.
Патогенные коринебактерии - Ф. К. Черкес Глава 32. Возбудитель дифтерии
Возбудитель дифтерии относится к роду Corynebacterium (от лат. coryna - булава, diphthera - пленка). Бактерии имеют булавовидные утолщения на концах. К этому роду относятся патогенные для человека дифтерийные палочки и непатогенные виды - ложнодифтерийные палочки и дифтероиды, обнаруживаемые на слизистых оболочках и кожных покровах.
Возбудители дифтерии - Corynebacterium diphtheriae - были обнаружены Т. Клебсом (1883) и выделены в чистом виде Ф. Леффлером (1884).
Морфология. Возбудители дифтерии слегка изогнутые, тонкие палочки, размером 3-6 × 0,3-0,5 мкм, на концах которых имеются утолщения. В этих утолщениях имеются зерна волютина (зерна Бабеша - Эрнста). Бактерии дифтерии неподвижны, не имеют спор и капсул. Грамположительны. Они хорошо окрашиваются основными анилиновыми красителями, при этом волютиновые зерна окрашиваются интенсивнее. Для окраски обычно применяют щелочной метиленовый синий или кристаллический фиолетовый. Особенностью коринебактерий дифтерии является их полиморфность; водной кулатуре встречаются различные по форме и размерам палочки: изогнутые, прямые, длинные, короткие, толстые, иногда коккобактерии. Характерно расположение бактерий в мазках - они обычно располагаются попарно под острым или тупым углом, в виде растопыренных пальцев и т. д. Расположение в мазках и наличие зерен волютина является дифференциальнодиагностическим признаком при микроскопическом исследовании. Непатогенные представители рода коринебактерий - ложнодифтерийные
палочки и дифтериоды чаще располагаются в виде частокола, зерна волютина у них могут отсутствовать либо быть на одном конце (см. рис. 4).
Культивирование. Коринебактерий дифтерии - факультативные анаэробы. Растут при температуре 35-37° С, рН среды 7,4-7,8. Они не размножаются на обычных питательных средах. Культивируют их на средах, содержащих кровь или сыворотку.
Вконце XIX века французский ученый Э. Ру для культивирования бактерий дифтерии предложил использовать свернутую бычью или лошадиную сыворотку, а Ф. Леффлер рекомендовал добавлять к ней бульон (25%) и 1% глюкозу. На этих средах коринебактерий растут быстро, в течение 14-18 ч образуют несливающиеся выпуклые колонии кремового цвета (рост на скошенной среде напоминает шагреневую кожу). Однако отдифференцировать на этих средах дифтерийные палочки от ложнодифтерийных невозможно.
Внастоящее время основными средами для выращивания являются среда Клауберга (содержащая сыворотку крови и теллурит калия), хинозольная среда Бунина, среда Тинсдаля и др. На основании культуральных и ферментативных свойств коринебактерий дифтерии делят на три биовара: гравис (gravis), ми тис (mitis), интермедиус (intermedins). Биовар гравис обычно находится в R-форме. На среде Клауберга бактерии этого биовара растут в виде крупных колоний 2-3 мм, серовато-черного цвета (так как восстанавливают теллурит в теллур), имеют изрезанные края, что придает им вид розетки. При прикосновении к колонии петлей она как бы рассыпается. На бульоне бактерии этого биовара образуют крошащуюся пленку и зернистый осадок.
Коринебактерии биовара митис (mitis) на среде Клауберга растут в виде небольших, гладких колоний (S-форма) черного цвета. На бульоне они дают равномерное помутнение.
Коринебактерии биовара интермедиус (intermedins) являются промежуточными. На среде Клауберга бактерии этого биовара чаще растут в виде блестящих, мелких, черных колоний (этот биовар встречается редко).
Ферментативные свойства. Все три биовара дифтерийных бактерий обладают ферментом цистиназой, расщепляющим цистин с образованием сероводорода. Эти свойства используются для дифференциации возбудителей дифтерии от непатогенных представителей этого рода (табл. 49).
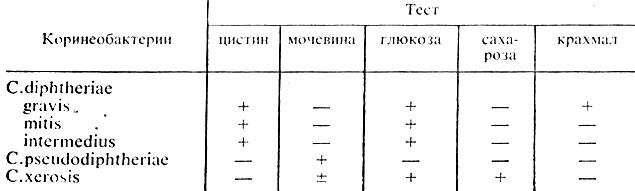
Таблица 49. Свойства возбудителей дифтерии и близких к ним коринебактерий
Примечание. + положительная реакция (расщепляет); - отрицательная реакция (не расщепляет).
Возбудители всех трех биоваров расщепляют глюкозу и мальтозу до образования кислоты. С. gravis расщепляют крахмал. Это свойство отличает его от двух других биоваров. Коринебактерий дифтерии восстанавливают нитраты в нитриты, не образуют индол, не разлагают мочевину.
Коринебактерии дифтерии образуют нейраминидазу, гиалуронидазу и другие ферменты патогенности.
Токсинообразование. Вирулентные штаммы возбудителей дифтерии продуцируют экзотоксин. Химически он представляет собой термолабильный белок, состоящий из Двух фракций. Фракция В фиксирует токсин на чувствительных к нему тканях организма. Фракция А ответственна за токсическое действие. Силу токсина дифтерийных культур можно устанавливать "in vivo" на чувствительных к этому токсину морских свинках. Dim дифтерийного экзотоксина - минимальная смертельная доза, это минимальное количество яда, убивающее морскую свинку массой 250 г на 4-й день.
Наличие экзотоксина можно обнаружить также "in vitro" - на плотной питательной среде. Этот метод широко используется в практической работе. Дифтерийный экзотоксин малоустойчив. Он быстро разрушается под влиянием температуры, света и кислорода воздуха. После добавления к токсину формалина (0,3-0,4%) и выдерживания его при температуре 37-38° С в течение нескольких недель он переходит в анатоксин, который теряет ядовитость, но сохраняет антигенные свойства токсина. Токсины, образуемые различными штаммами, не различаются между собой и могут быть нейтрализованы дифтерийным антитоксином*.
* (В настоящее время установлено, что все биовары коринебактерий могут быть токсигенными и нетоксигенными.)
Антигенная структура. У бактерий дифтерии имеется поверхностный термолабильный белковый антиген и типоспецифический полисахаридный О- антиген. Кроме этого, среди коринебактерий различают19 фаговаров,которые учитываются при идентификации культур. С помощью фаговаров выявляют источник заболевания.
Устойчивость к факторам окружающей среды. Возбудители дифтериии сравнительно устойчивы. Температура 60° С убивает их через 10-15 мин, 100° С - через минуту. В пленке они выдерживают нагревание до 90° С. На свернутой сыворотке при комнатной температуре сохраняются до 2 мес, на детских игрушках - несколько суток. Низкие температуры коринебактерий переносят хорошо. К высушиванию возбудители дифтерии довольно устойчивы. Дезинфицирующие вещества (3% раствор фенола, 1% раствор сулемы, 10% раствор перекиси водорода) убивают эти бактерии в течение нескольких минут.
Восприимчивость животных. В естественных условиях животные дифтерией не болеют. Из экспериментальных животных наиболее восприимчивы морские свинки и кролики. При внутрикожном или подкожном заражении у них развивается картина токсикоинфекции с образованием на месте введения воспаления, отека, некроза. В надпочечниках наблюдаются кровоизлияния.
Источники заболевания. Больные люди и бактерионосители.
Пути передачи. Воздушно-капельный путь, контактно-бытовой (через посуду, игрушки, книги, полотенца и т. д.).
Заболевание у человека: 1) дифтерия зева; 2) дифтерия носа.
Реже возникает дифтерия трахеи, бронхов, глаз, уха, влагалища и дифтерия поврежденной кожи.
Патогенез. Входными воротами являются слизистые оболочки дыхательных путей и поврежденная кожа. Попав на слизистую оболочку, возбудители дифтерии размножаются в месте внедрения и вызывают некроз ткани. Образуется пленка, тесно связанная с подлежащими тканями. На поверхности слизистой появляются грязно-серые или желтоватые налеты, состоящие из разрушенного эпителия, фибрина, лейкоцитов и коринебактерий дифтерии. При снятии пленки ватным тампоном или шпателем поверхность слизистой может кровоточить.
В процессе размножения коринебактерий дифтерии в некротических участках накапливается экзотоксин, который может привести к отеку слизистой оболочки и клетчатки. Со слизистой оболочки отек может распространяться на гортань, бронхи и вызвать явления асфиксии. Токсин,
