лучше выводится с мочой, чем фракция слюнных желез. Увеличение слюнной амилазы отмечается при стоматитах, невралгии лицевого нерва, паркинсонизме, уменьшение — при психическом возбуждении или депрессии, при анацидном состоянии желудочной секреции.
Основная ценность определения р-типа альфа-амилазы заключается в том, что увеличение ее активности высокоспецифично для заболеваний поджелудочной железы. Панкреати - ческая альфа-амилаза повышается при остром панкреатите. Активность общей амилазы в этом случае повышена за счет панкреатической фракции [Бэнкс П., 1982]. Диагностическая чувствительность панкреатической фракции амилазы в сыворотке крови для острого панкре -
атита составляет 92 %, специфичность — 85 % [Wallach J.M.D. et al., 1996].
Определение активности панкреатической фракции амилазы особенно важно при хроническом панкреатите у больных с нормальным уровнем общей амилазы. У больных с хро - ническим панкреатитом панкреатическая амилаза составляет 75 —80 % общей амилазы крови. Повышение панкреатической амилазы указывает на атаку хронического па нкреатита, а снижение — на экзокринную недостаточность поджелудочной железы при атрофии ацинарной ткани и фиброзе органа у больных, длительно страдающих данным заболеванием.
Активность панкреатической альфа-амилазы определяют, помимо диагностики острого панкреатита, также после операции на органах брюшной полости с целью ранней диагности - ки развития осложнения — послеоперационного панкреатита. Панкреатическая альфа-ами- лаза в моче повышается при остром панкреатите, причем составляет основную часть общей амилазы, так как выводится с мочой лучше, чем слюнная фракция.
Активность панкреатической фракции амилазы в отличие от общей не повышается при паротите, диабетическом кетоацидозе, раке легкого, острых гинекологических заболе - ваниях. Вместе с тем тест может быть ложноположительным при других панкреатических заболеваниях.
Липаза в сыворотке
Уровень активности липазы в норме 0—190 МЕ/л.
Липаза — фермент, катализирующий расщепление глицеридов на глицерин и высшие жирные кислоты. Этот энзим в организме человека вырабатывается рядом органов и тканей, что позволяет различать липазу желудочного происхождения, поджелудочной железы, липазу легких, кишечного сока, лейкоцитов и др. Наиболее важной с клинической точки зрения яв - ляется липаза поджелудочной железы. Панкреатическая липаза играет главную роль в переваривании жиров. Поскольку основным источником липазы является поджелудочная желе - за, при ее заболеваниях происходит значительный выброс фермента в циркулирующую кровь. Определение активности липазы в крови является наиболее информативным критерием диагностики острого панкреатита [Lasson A., Ohlson К., 1984]. Существует ошибочное представление, что при остром панкреатите содержание липазы в крови увеличивается позже, чем амилазы, но остается повышенным более продолжительное время. На самом деле содержание липазы увеличивается и снижается параллельно повышению и снижению актив - ности амилазы, но нормализация ее уровня происходит позже нормализации амилазы. Иног да уровень липазы в крови повышается раньше, чем увеличивается активность амилазы, и остается повышенным длительное время.
При остром панкреатите активность липазы в крови увеличивается в течение несколь - ких часов после острого приступа, достигая максимума через 12—24 ч (увеличивается до 200 раз), и остается повышенной в течение 10—12 дней. Прогноз заболевания является плохим, если уровень липазы в крови повышается в 10 раз и более и не снижается до 3 -кратного превышения нормы в течение ближайших нескольких дней [Савельев B.C., 1986]. Диагностическая чувствительность липазы в сыворотке крови для острого панкреатита составляет 86 %, специфичность — 99 % [Wallach J.M.D. et al., 1996]. Одновременное определение уровня альфа-амилазы (кровь и моча) и липазы — основа диагностики острого панкреатита. Повышение обоих или одного из ферментов выявляется у 98 % больных с острым панкреатитом. На рис. 4.4. представлена динамика изменения активности альфа -амилазы и липазы в крови при неосложненном панкреатите [Dr. Junge Kiel, 1982].
В отличие от амилазы активность липазы не повышается при паротите, внематочной беременности и раке легких. Отечная форма острого панкреатита, как правило, не сопровож - дается повышением активности липазы; жировой панкреонекроз характеризуется выражен - ным повышением активности липазы, сохраняемым до 2 нед; геморрагический панкреонекроз сопровождается лишь кратковременным повышением активности липазы в 3,5 раза по

День
Рис. 4.4. Динамика изменении активности альфа-амилазы и липазы в крови при неосложненном панкре-
атите.
На абсциссе указана кратность повышения активности ферментов, на ординате — день от начала заболевания. Нормальные величины активности ферментов (1); динамика активности: альфа-амилазы (2); липазы (3).
сравнению с нормальным уровнем на 3—5-и сутки заболевания. При гнойном панкреатите повышения активности липазы в крови обычно не выявляется. Иногда повышение актив - ности липазы отмечается у больных раком поджелудочной железы, хроническим панкреати - том, при наличии кисты в поджелудочной железе.
Активность липазы в крови повышается при инфаркте кишки, перитоните, желчной колике, при разрушении жировой ткани — костных переломах, ранении мягких тканей, после операций, при раке молочной железы.
Гиперлипаземия при уремии и острой почечной недостаточности является следствием застоя в поджелудочной железе.
Трипсин в сыворотке
Содержание трипсина в сыворотке в норме составляет 25,0 ± 5,3 мг/л (РИА).
Трипсин секретируется поджелудочной железой в виде неактивного предшественника — трипсиногена, который активируется энтерокиназой. Поджелудочная железа является единственным источником образования трипсина, и поэтому определение его активности дает более ценные сведения о состоянии поджелудочной железы, чем исследование других фер - ментов. Исследование активности трипсина представляет большой интерес для диагностики острого панкреатита, а также для разрешения ряда спорных вопросов патогенеза заболева - ния, и для обоснования целесообразности применения антиферментов в комплексном лече - нии этого заболевания.
Клиническую оценку уровня активности трипсина в сыворотке крови необходимо проводить в комплексе с уровнем ингибиторов трипсина, где 90 % трипсинингибирующей ак - тивности сыворотки крови приходится на альфа-1-антитрипсин.
Для острого панкреатита характерно кратковременное повышение в 10—40 раз активности трипсина в начале заболевания. Под воздействием различных причин, приводящих к повреждению ткани поджелудочной железы при остром панкреатите, нарушается динами - ческое равновесие в системе трипсин—альфа-1-антитрипсин. Начало заболевания связано с активацией трипсина в поджелудочной железе. В первые часы заболевания в ответ на мас - сивное поступление в тканевую жидкость, лимфу и кровь активного трипсина происходит увеличение активности альфа-1-антитрипсина. Однако постепенно при остром панкреатите происходит истощение альфа-1-антитрипсина, что свидетельствует о переходе процесса в
174
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

некротическую стадию. Повышение активности альфа-1-антитрипсина при остром панкреатите наблюдается на 2—3-й день заболевания, а после 3-го дня выявляется его снижение [Трунин М.А., Хватова Е.А., 1985]. При быстром развитии панкреонекроза повышение альфа-1-антитрипсина в крови очень незначительно, что является прямым показанием к применению в комплексном лечении антиферментов.
При хроническом рецидивирующем панкреатите у 25—50 % больных в период обострения повышение трипсина в сыворотке не выявляется (особенно при наличии стеатореи). Отсутствие повышения активности трипсина в таких случаях обусловлено недостаточностью функции поджелудочной железы. У 20 % больных с хроническим панкреатитом показатели трипсина в крови возрастают. Клиническая картина заболевания обычно не коррелирует с уровнем повышения трипсина. При переходе хронического рецидивирующего панкреатита в стадию ремиссии нормализация содержания альфа-1-антитрипсина наблюдается существенно реже, чем снижение активности трипсина. В этом отражается один из механизмов купирования обострения процесса, т.е. повышение содержания альфа-1-антитрипсина способствует ремиссии.
Повышение активности трипсина в крови иногда обнаруживается у больных при раке поджелудочной железы; у новорожденных оно является специфичным тестом на муковисци - доз; у больных с ХПН является следствием избыточного накопления его ингибиторов; при вирусных инфекциях, при «немом» поражении поджелудочной железы.
В связи с тем что в крови циркулируют ферметативно неактивные трипсиноген, ком - плексы трипсина с альфа-1-антитрипсином и ферментативно активные комплексы трипсины с альфа-2-макроглобулином, биохимические методы определения трипсина, основан ные на расщеплении различных субстратов, недостоверны. Они отражают суммарную активность перечисленных комплексов. Наиболее достоверным является радиоиммунологический метод определения трипсина в крови.
Активность трипсина в сыворотке снижена у больных сахарным диабетом, муковисцидозом (в поздней стадии), иногда у больных хроническим панкреатитом и раком поджелу - дочной железы.
Химотрипсин в кале
Уровень активности химотрипсина в норме менее 13 Ед/г кала.
Химотрипсин вырабатывается поджелудочной железой и секретируется в двенадцатиперстную кишку. Определение химотрипсина в кале — простой скрининг-тест для выявления заболеваний поджелудочной железы и оценки состояния кишечного пищеварения.
Измерение содержания химотрипсина в кале является более достоверным тестом для оценки функции поджелудочной железы, чем определение трипсина, потому что трипсин значи - тельно разрушается при прохождении по желудочно-кишечному тракту. Определение химотрипсина в кале в настоящее время рассматривают как самый важный скрининг овый тест при подозрении на хронический панкреатит с недостаточностью поджелудочной железы [Бит - ти А.Д., 1995]. Цель исследования — определить степень уменьшения экскреции химотрипсина.
Причины, приводящие к снижению экскреции химотрипсина:
1.хроническое воспалительное поражение поджелудочной железы;
2.деструкция экзокринной паренхимы железы;
3.врожденная дисфункция панкреатической секреции со вторичной фиброзной дегене рацией;
4.нарушение оттока секрета в двенадцатиперстной кишке по различным причинам.
Скрининг эндокринной панкреатической недостаточности показан, когда подозревают хронический панкреатит или кистозный фиброз, а также при длительном мониторировании уже выявленной недостаточности поджелудочной железы при хроническом панкреатите. Диагностическая специфичность теста при оценке экзокринной функции поджелудочной желе зы
— около 90 %, диагностическая чувствительность составляет 75—96 % [Stein J. et al., 1996]. Могут отмечаться ложноположительные результаты (около 10 %), а также нормальные значения у больных с доказанным поражением поджелудочной железы. Для дифференциальной диагностики необходимо применять панкреозимин-секретиновый тест. Сущность теста состоит в том, что у больного определяют активность химотрипсина в дуоденальном содержимом до введения секретина и панкреозимина, которые стимулируют выделение химотрипсина поджелудочной железой, и после их введения. При недостаточности поджелудочной железы в ответ на введение секретина и панкреозимина активность химотрипсина не повышается.
Активность
фермента
Годы с начала заболевания
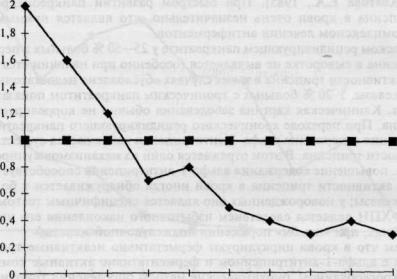
Рис. 4.5. Динамика изменения активности химотрипсина в кале у больных хроническим панкреатитом.
Нижняя граница нормы химотрипсина ( I ) ; динамика химотрипсина (2) .
Медленное, но неуклонное снижение активности химотрипсина в кале до патологических цифр в течение 3—5 лет с начала заболевания является основным и постоянным лабора - торным симптомом хронического панкреатита. На рис. 4.5 представлена динамика измене - ния активности химотрипсина в кале у больных хроническим панкреатитом (по R.W. Ammann et al., 1977).
При оценке результатов определения химотрипсина в кале необходимо руководство - ваться следующими параметрами: менее 9 Ед/г — патология; 9—13 Ед/г — пограничные зна-
чения [Goebell H. et al., 1985].
Снижение содержания химотрипсина в кале является прямым показанием к назначе - нию ферментативных препаратов в лечении таких больных.
Большое значение определение химотрипсина в кале или содержимом кишечника имеет у больных, находящихся на зондовом питании, так как позволяет адекватно оценивать состояние кишечного пищеварения и эффективность зондового питания. Информативно оп - ределение химотрипсина в кале при стеаторее и муковисцидозе.
Панкреатическая эластаза-1 в сыворотке
Содержание панкреатической эластазы-1 в сыворотке в норме менее 3,5 нг/мл.
Панкреатическая эластаза-1 продуцируется ацинарными клетками поджелудочной железы и появляется в панкреатическом соке в виде предшественника — проэластазы, которая активируется трипсином. В сыворотку крови фермент попадает только из поджелудочной железы, поэтому определение панкреатической эластазы-1 является важным для диагностики заболеваний железы. В крови здоровых людей активность панкреатической эластазы -1 почти не определяется или очень низкая. В сыворотке крови человека содержатся высокоактивные ингибиторы эластазы: альфа-1-антитрипсин и альфа-2-макроглобулин. Ингибиторы регулируют уровень активности эластазы в соответствии с физиологическими потребностя - ми. Панкреатическая эластаза-1 играет важную роль в патогенезе острого панкреатита. Ее активность повышается в первые 48 ч после начала приступа острого панкреатита почти у 100 % больных, а затем постепенно снижается и выявляется у 93 % больных через 48—96 ч, у
87 % — 96—114 ч, у 75 % — 144-240 ч [Buchler M. et al., 1986]. Активность эластазы-1 повы-
шается в крови при остром и атаках хронического панкреатита раньше, чем уровень других ферментов, на субклинической стадии. Уровень повышения активности фермента не зави -
176
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

сит от формы панкреатита и не соответствует степени деструкции ткани железы. Так как период полужизни панкреатической эластазы-1 дольше, чем амилазы и липазы, то и период выявления повышенной ее активности в крови длиннее. В настоящее время разработан ме - тод иммуноферментного анализа для определения активности панкреатической эластазы-1 [Stein J. et al., 1996], который обладает высокой чувствительностью и специфичностью (97 и 96 % соответственно).
Панкреатическая эластаза-1 в кале
Содержание панкреатической эластазы-1 в кале в норме более 200 мкг/г кала.
Человеческая панкреатическая эластаза 1 — это эластаза из семейства кислых эластаз, обнаруженная A. Sziegoleit (1984). Она присутствует в человеческом панкреатическом соке и кале. Фермент не подвергается воздействию при прохождении по кишечному тракту. Концентрация панкреатической эластазы-1 в кале в 5—6 раз выше, чем в панкреатическом соке. Определение панкреатической эластазы-1 в кале — новый неинвазивный тест для оценки экзокринной функции поджелудочной железы. Для определения фермента кал собирают в течение 72 ч и анализируют в тот же день; при необходимости он может быть заморожен при —20 "С. В отличие от фекального химотрипсина результаты определения панкреатической эластазы-1 в кале не зависят от заместительной терапии при хронических панкреатита х с недостаточностью функции поджелудочной железы. Заместительная терапия повышает актив - ность химотрипсина в кале и не оказывает действия на эластазу. При развитии недостаточ - ности экзокринной функции поджелудочной железы содержание панкреатической эластазы- 1 в кале снижается. Специфичность теста при исследовании кала составляет 94 %, чувствительность — 93 % [Stein J. et al., 1996]. Снижение активности панкреатической эластазы-1 в кале выявляется у больных с хроническим панкреатитом, раком поджелудочной железы, у детей с муковисцидозом.
Кислая фосфатаза в сыворотке
Уровень активности кислой фосфатазы в норме 0—6,5 МЕ/л.
Кислая фосфатаза содержится почти во всех органах и тканях человека, особенно в клетках крови, предстательной железе, печени, почах, костях. Фермент обнаружен также в женском молоке. Активность кислой фосфатазы в предстательной железе в 100 раз выше, чем в других тканях. У мужчин половину содержащейся в сыворотке кислой фосфатазы вырабатывает предстательная железа, остальную часть — печень и разрушающиеся тромбоциты
иэритроциты. У женщин фермент вырабатывается печенью, эритроцитами и тромбоцитами. Кислая фосфатаза не является гомогенным ферментом. Большинство тканей содержит два или более изоферментов, отличающихся по своим свойствам.
Определение активности кислой фосфатазы в клинической практике обычно проводит ся для диагностики рака предстательной железы. Активность кислой фосфатазы повышается при раке предстательной железы далеко не всегда: только у 20—25 % больных без метастазов
иу 60 % больных с метастазами [Vihko P. et al., 1985]. Степень повышения активности кислой фосфатазы особенно велика у больных при наличии костных метастазов рака предста - тельной железы.
Определение активности кислой фосфатазы может быть использовано для дифференциальной диагностики метастазов рака предстательной железы в кости и заболеваний костной ткани, в частности, остеодистрофий, при которых обычно повышена активность щелочной фосфатазы, в то время как при метастазах рака предстательной железы в кости повышается активность в крови как щелочной, так и кислой фосфатазы.
Следует иметь в виду, что массаж предстательной железы, катетеризация, цистоскопия, ректальные исследования повышают активность кислой фосфатазы, поэтому кровь на иссле - дования надо брать не раньше, чем через 48 ч после перечисленных процедур.
Активность кислой фосфатазы повышается при массивном разрушении тромбоцитов (тробоцитопения, тромбоэмболии и др.), гемолитической болезни, прогрессирующей болез - ни Педжета, метастатическом поражении костей, миеломной болезни (не всегда), болезни Гоше и Нимана—Пика, через 1—2 дня после операции на предстательной железе или после биопсии.
Простатическая фракция кислой фосфатазы в сыворотке
Уровень активности простатической фракции кислой фосфат азы в норме 0,05—2,6 МЕ/л.
Ткань предстательной железы содержит два основных изофермента, которые имеют одинаковый оптимум рН, но различаются по действию на них ряда веществ (ингибиторов), в частности тартрата (солей винной кислоты). Активность простатической фракции кислой фосфатазы ингибируется тартратом.
Определение простатической фракции кислой фосфатазы — более специфический тест для диагностики рака предстательной железы, чем определение общей активности кислой фосфатазы. Повышение ее активности характерно для рака предстательной железы, особенно с метастазами; наблюдается также при инфаркте простаты после катетеризации мочевого пузыря. При болезни Гоше и Нимана—Пика повышения активности фермента не наблюдается, если отсутствует кистозное изменение предстательной железы.
Непростатическая фракция кислой фосфатазы в сыворотке
Уровень активности непростатической фракции кислой фосфатазы в норме не более 50 % от общей активности.
Непростатическая фракция кислой фосфатазы представлена в сыворотке крови час тью общей кислой фосфатазы, продуцируемой печенью, разрушающимися тромбоцитами и эритроцитами, а также костной тканью. Определение активности непростатической фракции кислой фосфатазы самостоятельного диагностического значения не имеет и исследуется в комплексе с общей кислой фосфатазой и ее простатической фракцией. Повышение актив - ности непростатической фракции кислой фосфатазы наблюдается при гиперфункции пара - щитовидной железы, новообразованиях костей, остеопорозе, раке легкого, тромбозах.
Общая антиоксидантная активность плазмы крови
Уровень общей антиоксидантной активности плазмы в норме 1,30 —1,77 ммоль/л.
Свободные радикалы участвуют в патогенезе более чем 100 заболеваний человека — от ревматоидного артрита, гепатита, инфаркта миокарда и др. до СПИДа. Свободным радикалом является любая молекула, содержащая один или более неспаренных электрона, например супероксид (O^), гидроксил (~ОН). Свободные радикалы — крайне активные молекулы, способные вызвать повреждение и гибель клеток. К типичным клеточным компонентам, повреждаемым свободными радикалами, относятся полиненасыщенные жирные кислоты клеточных мембран, энзимы, белки мембраны клетки, транспортирующие ионы, и ДНК. Свободные ра - дикалы постоянно образуются в тканях, главным образом при биохимических редокс-реакци- ях с участием кислорода. Эти реакции являются частью нормального метаболизма клеток: при фагоцитозе, как часть контролируемой воспалительной реакции; при воздействии на организм радиации, ультрафиолетового излучения, загрязнений окружающей среды, сигаретного дыма, гипероксии, при избыточной физической нагрузке и при ишемии. Каждый свободный ради - кал, образовавшийся в организме, может инициировать серию цепных реакций, которые идут до тех пор, пока не будут удалены свободные радикалы. Свободные радикалы исчезают из организма при реакциях с другими радикалами, или, что наиболее важно, под действием антиоксидантной системы. Антиоксидантная система защищает ткани от губительного действия свободных радикалов. Три большие группы антиоксидантов входят в антиоксидантную систему.
Первичные антиоксиданты действуют путем предотвращения образования новых свободных радикалов. Например, супероксиддисмутаза (СОД) превращает супероксид (O^) в перекись водорода, которая реакционно менее активна; глютатионпероксидаза (ГП) превращает перекись водорода и липидные пероксиды в безвредные молекулы до того, как они образуют свободные радикалы; металлосвязывающие белки (ферритин и церулоплазмин) ограничива - ют доступность Fe2+, необходимого для образования гидроксила (~ОН).
Вторичные антиоксиданты захватывают свободные радикалы, предотвращая цепные реакции (витамины Е, С, бета-каротин, мочевая кислота, билирубин и альбумин).
Третичные антиоксиданты восстанавливают молекулы, поврежденные свободными радикалами (энзимы, восстанавливающие ДНК, и метионин-сульфоксидредуктаза).
При развитии недостаточности одного или нескольких звеньев антиоксидантной систе - мы ткани утрачивают защиту от действия свободных радикалов, что приводит к поврежде -
178
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
нию тканей и органов и развитию заболевания. Для оценки состояния антиоксидантной сис - темы или общего антиоксидантного статуса организма определяют общую антиоксидантную активность (ОАА) плазмы крови. Определение ОАА сыворотки крови помогает врачу решать следующие задачи:
1)выявлять лиц с повышенным риском развития таких заболеваний как рак, заболева ния сердца, ревматоидный артрит, сахарный диабет, ретинопатия и старение. У таких людей обычно выявляют снижение ОАА плазмы. Профилактическое длительное при менение у таких лиц антиоксидантов приводит к значительному снижению риска раз вития заболевания. В частности, применение в течение 2 лет витамина Е в профилак тических целях приводит к снижению риска развития заболеваний сердечно -сосуди стой системы у мужчин на 37 %, у женщин на 41 %;
2)обосновывать применение в комплексном лечении больного антиоксидантов. Сниже ние ОАА служит прямым показанием к назначению больному витамина Е, бета -каро тина и др. У недоношенных детей снижена ОАА по сравнению с нормальными ново рожденными, из-за чего они более чувствительны к повреждениям свободными ради калами. Это обусловливает развитие у них такой патологии, как ретинопатия, бронхо - пульмональная дисплазия, внутрижелудочные кровотечения, некротизирующий энтеро колит. Назначение таким детям антиоксидантов позволяет предотвратить развитие мно гих из перечисленных осложнений, при этом следует воздержаться от применения в лечении кислородотерапии, которая способствует образованию свободных радикалов;
3)проводить мониторинг за течением заболевания и эффективностью применяемой те рапии. ОАА снижена у больных с заболеваниями печени, бронхиальной астмой, хро ническими обструктивными заболеваниями легких, ИБС, онкологическими заболе ваниями и др. Эффективное лечение приводит к повышению или нормализации ОАА;
4)оценивать эффективность лечебного диетического, парентерального и зондового пи тания для выяснения того, какая пища наиболее полезна для повышения антиокси дантного статуса больного.
Глютатионпероксидаза (ГП) в крови
Уровень активности ГП в норме в эритроцитах 29,6—82,9 ЕД/г НЬ.
Глютатионпероксидаза является одним из важнейших элементов антиоксидантной сис - темы организма. Она превращает перекись водорода и липидные пероксиды в безвредные молекулы до того, как они образуют свободные радикалы. Этот фермент является селензависимым. Изменения концентрации селена в крови хорошо коррелируют с уровнем активнос - ти глютатионпероксидазы. Дефицит селена в организме снижает активность ГП, а введение селена активирует ее. Снижение уровня этого фермента при некоторых заболеваниях во многом определяет динамику патологического процесса.
Активность ГП определяют в следующих случаях:
1)у больных, страдающих заболеваниями, связанными с недостаточностью ГП и селена;
2)у людей с повышенным риском селенового дефицита: в старческом возрасте, при плохом питании, курении, алкоголизме, стрессе, почечной недостаточности, болезни Крона, муковисцидозе, аутоиммунных заболеваниях, химиотерапии;
3)для определения антиоксидантного потенциала в целях оценки эффективности лечения;
4)в научных целях при изучении роли свободных радикалов в патогенезе заболеваний.
Активность ГП снижена у больных алкоголизмом, в результате чего снижается защита печеночных клеток от повреждающего действия алкоголя. Уровень ГП и селена в крови у таких больных возвращается к норме после абстиненции. Поэтому мониторинг активности ГП позволяет контролировать течение заболевания, вовремя назначать в комплексное лече - ние больного препараты селена.
Снижение активности ГП значительно повышает риск возникновения раковых заболеваний. У больных муковисцидозом плохо абсорбируется селен, что приводит к снижению активности ГП. Мониторинг активности ГП у таких больных позволяет вовремя принять ре - шение о проведении заместительной терапии.
Низкая активность ГП и низкий уровень селена могут быть причиной бесплодия. Свободные радикалы участвуют в патогенезе ревматоидного артрита, поэтому у таких
больных очень часто снижены активность ГП и содержание селена.
Ахтивность ГП понижена у больных, находящихся на программном гемодиализе, что вызвано связанным с гемодиализом недостатком микроэлементов, в частности, селена.
С возрастом уровень активности ГП снижается. Этим можно объяснить увеличение частоты онкологических заболеваний и развитие атеросклероза. Мониторинг активност и ГП через 1—5 лет позволяет эффективно проводить профилактическое лечение антиоксидантами.
Снижение активности ГП выявляется у больных шизофренией, маниакально-депрессив- ным психозом, где свободным радикалам отводится ведущая роль в патогенезе их развития.
Супероксиддисмутаза (СОД) в эритроцитах
Уровень активности СОД в норме в эритроцитах 1092 —1817 ЕД/г НЬ.
Супероксиддисмутаза превращает супероксид в перекись водорода, т.е. является одним из первичных антиоксидантов. Наличие СОД в организме человека позволяет поддерживать физиологическую концентрацию супероксидных радикалов в тканях, что обеспечивает воз - можность существования организма человека в кислородной атмосфере и использование им кислорода в качестве конечного акцептора электронов.
При инфаркте миокарда фермент защищает сердечную мышцу от действия свободных радикалов при ишемии; уровень СОД в сыворотке крови при инфаркте миокарда высокий. Степень повышения СОД обратно пропорциональна деятельности левого желудочка, что ис - пользуется как маркер для оценки повреждения миокарда и при мышечной дистрофии.
Уровень эритроцитарной СОД повышен у больных гепатитом, очень высок у больных с различными формами лейкемии. При анемии Фанкони уровень СОД в эритроцитах снижен, в то же время уровень СОД повышен при железодефицитной анемии и р-талассемии.
При синдроме Дауна избыток супероксиддисмутазы приводит к накоплению перекиси водорода в мозговой ткани. Подобное явление имеет место при старении, особенно раннем у больных с синдромом Дауна.
Высокий уровень СОД у септических больных является ранним маркером развития у них респираторного дистресс-синдрома.
При заболеваниях почек уровень СОД возрастает в ответ на усиленное образование свободных радикалов. После гемодиализа активность СОД нормализуется или снижается отно - сительно нормы вследствие развития дефицита микроэлементов.
Уровень фермента в сперме связан с подвижностью сперматозоидов; снижение актив - ности СОД приводит к нарушению подвижности сперматозоидов.
Эритроцитарная СОД бывает низкой при ревматоидном артрите; по ее уровню можно оценивать эффективность проводимого лечения. Назначение больным с ревматоидным арт - ритом препаратов СОД приводит к ремиссии заболевания.
Уровень СОД снижен у больных с ослабленной иммунной системой, что делает таких больных более чувствительными к респираторным инфекциям с развитием пневмонии.
Ангиотензинпревращающий фермент (АПФ) в сыворотке
Уровень активности АПФ в норме в сыворотке 8—52 МЕ/л.
Ангиотензинпревращающий фермент представляет собой гликопротеид, который при - сутствует в основном в легких и в небольших количествах в щеточной каемке эпителия проксимальных канальцев почек, эндотелии кровеносных сосудов и плазме крови. АПФ, с одной стороны, катализирует превращение ангиотензина I в один из наиболее мощных вазоконстрикторов — ангиотензин II, с другой стороны, гидролизует вазодилататор брадикинин до неактивного пептида. Поэтому лекарственные препараты — ингибиторы ангиотензинпревращающего фермента — являются эффективными для понижения давления у больных гипертензией, используются для предупреждения развития почечной недостаточности у больных сахарным диабетом, улучшения исходов больных инфарктом миокарда.
Повышение активности АПФ в сыворотке крови выявляется при саркоидозе, остром и хроническом бронхитах, легочном фиброзе туберкулезной этиологии, профессиональных пневмокониозах, ревматоидном артрите, болезнях соединительной ткани, шейном лимфаде - ните, болезни Гоше. Снижение активности может быть выявлено при хронических обструк - тивных заболеваниях легких, поздних стадиях рака легких и туберкулезе.
Активность АПФ исследуется главным образом для диагностики саркоидоза и оценки эффективности действия лекарственных препаратов — ингибиторов ангиотензинпревращающего фермента.
180
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Маркеры повреждения миокарда
В настоящее время инфаркт миокарда (ИМ) представляется как динамический процесс, развитие которого происходит как во времени, так и в пространстве. В результате дефектов, возникающих в цитоплазматических мембранах миокардиоцитов, белки и ферменты, лока - лизующиеся в цитоплазме, поступают в кровь больного ИМ со скоростью, зависящей в первую очередь от размера молекул этих белков и ферментов. Изменение концентрации белков миокарда в сыворотке крови зависит также от скорости их элиминации из кровотока. Не - большие молекулы, например миоглобин, выводятся очень быстро, а большие, такие как ЛДГ, медленно. Поэтому содержание каждого белка при ИМ имеет свою кинетику.
Диагностика ИМ по-прежнему является сложной задачей. Особенно большие трудности вызывает диагностика инфаркта у пожилых пациентов, при повторных инфарктах, у лиц с сопутствующими заболеваниями. В настоящее время диагностика ИМ базируется на трех со - ставляющих: 1) клинической картине; 2) изменениях на ЭКГ; 3) повышении уровня фер - ментов в крови (КК, ЛДГ и их изоферменты) [Алперт Дж., Френсис Г., 1994]. В случае трансмурального ИМ его диагностика обычно не вызывает больших затруднений (клиника, ЭКГ, гиперферментемия). Диагностика микроинфарктов миокарда, которые с терапевтичес - кой и прогностической точки зрения сравнимы по важности с трансмуральными, значительно затруднена. Чувствительность традиционных лабораторных тестов — определение ACT, АЛТ, ЛДГ, КК, КК-МВ недостаточна из-за значительной вариации нормальных (референтных) величин и из-за короткого времени появления этих ферментов в крови и небольшого повышения их уровня. Аналогична ситуация с диагностикой нестабильной стенокардии. Диагностика ИМ по повышению уровня ферментов усложняется из-за сопутствующих заболеваний или повреждений скелетных мышц. Однако лабораторной диагност ике — динамично развивающейся дисциплине медицины — с введением в клиническую практику таких маркеров ИМ, как тропонин Т и I удалось преодолеть эти трудности. В настоящее время лабораторным исследованиям отводится ведущая роль в диагностике ИМ. По измене ниям уровня маркеров ИМ можно получить значительно более информативные данные для диа - гностики и для оценки эффективности проводимого лечения, чем с использованием других методов [Чазов Е.И., 1992].
Общая креатинкиназа (КК) в сыворотке
Уровень активности КК в норме 10—195 МЕ/л.
КК обратимо катализирует фосфорилирование креатина с помощью АДФ. Наиболее богата КК скелетная мускулатура, сердечная мышца, меньше ее в мозге, щитовидной железе, матке, легких. Наибольшее диагностическое значение имеют следующие изоферменты КК: КК-ММ (мышечный), КК-МВ (сердечный), КК-ВВ (мозговой). Повышение активности КК в сыворотке крови наблюдается из-за выхода фермента из клеток при их повреждении.
При ИМ поступление КК из сердечной мышцы в сыворотку опережает другие фермен - ты, поэтому определение КК нашло наиболее широкое применение в ранней диагностике инфаркта миокарда. Увеличение активности КК находят у 95—99 % больных ИМ [Захария Е.А. и др., 1989]. КК повышается уже через 2—4 ч после острого приступа, достигая максимума через 24—36 ч, превышая нормальные величины в 5—20 раз. Следует подчеркнуть, что уровень КК сравнительно быстро возвращается к норме (на 3—6-е сутки). Поэтому в случаях, когда определение КК не было выполнено в этот период после развития инфаркта, труд - но рассчитывать на помощь этого показателя в диагностике. В то же время именно быстрота динамики КК делает определение этого фермента особенно ценным для распознавания по - вторных инфарктов, которые, не давая четких электрокардиографических изменений, могут вызывать повторный подъем активности КК (для выявления их рекомендуют повторные ре - гулярные исследования). Исследование активности КК существенно важно при атипичном течении ИМ и отсутствии типичных электрокардиографических изменений, что наблюдает ся при блокаде пучка Гиса, при аритмиях, после терапии дигиталисом и в тех случаях, когда у больного уже был инфаркт. Изменения активности ферментов при остром инфаркте мио - карда представлены в табл. 4.34.
Известно, что процесс некротизации сердечной мышцы является д инамическим, и у 70—80 % больных инфарктом миокарда происходит распространение зоны инфаркта в пер - вые 3—5 дней заболевания. Поэтому практически важной является возможность определе -
Т а б л и ц а 4.34. Изменение активности ферментов при остром инфаркте миокарда
|
Начало |
Максимум |
Возвращение к |
Кратность |
|
увеличения |
увеличения |
норме, сут |
увеличения, |
Фермент |
активности, ч |
активности, ч |
|
раз |
|
|
|
|
|
ACT |
4-6 |
24-48 |
4-7 |
в 2-20 |
КК |
2-4 |
24-36 |
3-6 |
в 3-30 |
лдг |
8-10 |
48-72 |
8-9 |
в 2-4 |
|
|
|
|
|
ния динамики процесса некротизации при инфаркте миокарда или его прекращения. А.И. Грицюк с соавт. (1989) предложили способ оценки процессов некротизации при ин - фаркте миокарда, который основан на серийном исследовании активности КК через равные промежутки времени. Затем определяют изменение активности КК в единицу времени и рассчитывают коэффициент скорости изменения активности КК (Кт) по формуле:
Кт_ Е„-Е|
E,(tn-ti)'
где Е, — исходная активность фермента; Ем — активность фермента в динамике; tn — исходное время; t, — время исследования активности КК в динамике.
Известно, что граница коэффициента выведения КК из кровотока для больных инфарк - том миокарда составляет 0,072±0,03б час"1. Следовательно, при значениях Кт большем, чем 0,036 час~',определяют продолжающийся процесс некротизации при инфаркте миокарда, несмотря даже на снижение активности КК.
Исследование активности КК у больных с инфарктом миокарда надо проводить, как только появится такая возможность. Периодичность исследования КК в сыворотке в первые сутки — каждые 4 ч, на вторые сутки — через 6—8 ч, далее с более длительным интервалом [Яблучанский Н.И., Рудинский Н.Ф., 1986].
Повышение активности КК в крови не является специфическим для инфаркта миокар - да. КК повышается в отдельных случаях при миокардитах, миокардиодистрофиях различно - го происхождения. Но ферментемия у этих больных умеренная и более длительная и обычно соответствует фазе максимальной активности процесса. Значительное повышение активнос - ти КК в сыворотке крови наблюдается при травматических повреждениях скелетной муску - латуры и заболеваниях мышечной системы. Так, при прогрессирующей мышечной дистро - фии (миопатия) активность КК может увеличиваться в 50 и более раз по сравнению с нор - мой, что используется в качестве диагностического теста. Следует заметить, что при нейрогенных дистрофиях (миастения, нейральная мышечная атрофия, атаксия Фридрейха и др.) активность КК в крови чаще остается в пределах нормы. Для того чтобы отдифференциро - вать ИМ от повреждения мышц, определяют отношение КК/АСТ. При ИМ это отношение меньше 10; если оно больше 10, то можно говорить о повреждении скелетной мускулатуры.
Высокая активность КК наблюдается при самых различных нарушениях ЦНС: шизо - френии, маниакально-депрессивном психозе, синдромах, вызываемых психотропными лекарствами. Активность КК возрастает после хирургических операций, причем способ и продолжительность анестезии отражается на послеоперационном уровне активности КК.
Необходимо учитывать, что повышение активности КК возможно при приеме алкоголя и после назначения препаратов, активирующих фермент (например, преднизолон).
Активность КК повышается при гипотиреозе; при тиреотоксикозе наблюдаются необы - чайно низкие значения активности КК.
MB -фракция креатинкиназы (КК) в сыворотке
Уровень активности MB-фракции КК в норме составляет 6 % от общей активности КК,
или 0—24 МЕ/л.
Общая КК в сердечной мышце состоит из двух изоферментов: КК -ММ (около 60 % общей активности) и КК-МВ (около 40 % общей активности), КК-ВВ отсутствует. КК-МВ — димер, состоит из двух субъединиц: М (мышечная) и В (мозговая). Тем не менее МВ-фракция
182
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/