
Фармакологическая кардиоверсия (фкв). Варианты.
Целесообразна при плохой переносимости ФП, но без критического ухудшения состояния больного . Эффективность медикаментозного купирования ФП составляет 40–80% [28 ]. В этом случае иногда можно ограничиться только урежением ЧСС . Кроме того, блокада проведения в АВ-узле необходима, когда ФКВ ФП, протекающей с высокой ЧСС, проводится антиаритмиками IA и IС классов, потому что они способны значительно увеличить частоту сокращений желудочков.
Две стратегии в лечении больных с ФП:
восстановление синусового ритма с помощью медикаментозной, либо электрической кардиоверсии и последующая профилактика рецидива ФП (rhythm control).
контроль ЧЖС в сочетании с антикоагулянтной или антиагрегантной терапией при сохраняющейся ФП (rate control). Выбор наиболее рациональной стратегии у каждого конкретного пациента зависит от многих факторов, и далеко не последнюю роль в этом играет форма ФП.
Nota bene. У больных ОИМ., либо при наличии брадикардии, резких нарушений ЦГД – ОЛЖН, падении АД, - антиаритмические препараты могут проявить проаритмогенный и кардиодепрессивный эффект. Лучшим методом является ЭИТ. При значительной тахиаритмии, частоте сокращений желудочков 200 и более в 1 мин., появляется высокий риск фибрилляции желудочков. Необходима срочная ЭИТ.
Таблица 5. Препараты для в/в купирования ФП (Jung F. et al, 1998; ACC/AHA/ESC , 2006; ICSI, 2007).
__________________________________________________________
Препарат Кол. 1 амп. Ср.доза Скорость % эфф.
_______________мг_________________________________________
Новокаинамид 1000 1000-1500 мг 20-50 18-65
Пропафенон 150 1,5-2 мг \кг 10-20 43-66
Изоптин 5 5-10 мг 1-3 20
Кордарон 150 5-7 мг \кг 60 37-77
__________________________________________________________
Врач практически любой специальности может столкнуться с нарушениями ритмсердца, но чаще всего это проблема кардиологов и терапевтов. Выбор антиаритмического препарата весьма сложная задача как для врача, так и для пациента. Много времени уходит для подбора препарата, коррекции дозы, в результате чего теряется «нить доверия» между пациентом и врачом, что негативно отражается на результатах дальнейшего лечения.
Правило 1.
Сложность купирования ФП пропорциональна ее продолжительности [ 29 ] .
Правило 2. До назначения ААП следует устранить обратимые сердечно-сосудистые и не сердечно-сосудистые факторы, способствующие возникновению ФП .
Правило 3. Когда лечение одним препаратом оказалось безуспешным, необходимо использовать комбинацию ААП.
Правило 4.
Впервые в жизни возникший пароксизм должен быть купирован в стационаре. Пациенты с впервые возникшим неосложненным нарушением ритма нуждаются в оказании неотложной помощи, препараты следует вводить парентерально в связи с ограничением временных рамок и трудной прогнозируемостью состояния.
До назначения ААП необходимо: - измерить на ЭКГ и зафиксировать в истории болезни интервалы PQ, QRS, QT и осуществлять контроль в процессе лечения за величиной этих интервалов, поскольку они имеют решающее значение как для выбора препарата, так и для тактики лечения; - по возможности анализировать «старые» и исходную ЭКГ на предмет выявления преходящих, нестойких нарушений внутрипредсердной, атриовентрикулярной и внутрижелудочковой проводимости. Учитывать возникли ли они спонтанно или на фоне приема антиаритмического препарата; - проанализировать предшествующее лечение, особенно по купированию пароксизмальных форм нарушений ритма сердца; - всегда следует учитывать уровень артериального давления, состояние хроно-, дро-, и инотропной функции сердца, состояние электролитного баланса.
Больные с впервые возникшим нарушением ритма нуждаются в госпитализации для решения следующих задач: установление причины (учитывать возможность маскирования острого заболевания сердца - инфаркт миокарда, миокардит и др.), подбора адекватной терапии и при необходимости хирургических методов коррекции.
Для успешной терапии нарушений ритма врач должен знать, что: • все препараты, применяемые для лечения (купирования) нарушения ритма, снижают артериальное давление. Несмотря на это, вводить симпатомиметические средства (мезатон, норадреналин) одновременно с ними противопоказано, так как они повышают желудочковую эктопическую активность; • из ААП до ЭКГ диагностики нельзя вводить строфантин; • терапия должна быть управляемой: а\ одновременно с введением препаратов необходимо постоянно контролировать АД на другой руке, чтобы избежать резкой гипотонии; б\ четко знать фармакокинетику ААП; в\ на высоте максимального эффекта в соответствии с фармако-кинетикой препарата контролировать ЭКГ; • назначение препаратов строго показаниям с учетом их побочного действия; при наличии оснований опасаться побочных действий, целесообразно начать лечение с малых доз, и, при хорошей переносимости, переходить к терапевтическим дозам; •вначале предпочтение следует отдавать монотерапии; • учитывать эффекты лекарственного взаимодействия, поскольку сочетанное применение нескольких антиаритмических препаратов является достаточно сложной и опасной мерой; • после купирования пароксизма аритмии обязательно должен быть рассмотрен вопрос о продолжении антиаритмической противорецидивной терапии.
Важный вопрос, стоящий перед врачом, - определить продолжительность приступа фибрилляции предсердий. Если приступ фибрилляции продолжается более 2-х суток резко увеличивается риск тромбоэмболии, в связи с чем необходимо проведение предварительной антикоагулянтной терапии.
Табл.6. Алгоритм действий на догоспитальном этапе при пароксизмальной форме фибрилляции предсердий длительностью менее 48 часов [3 ]
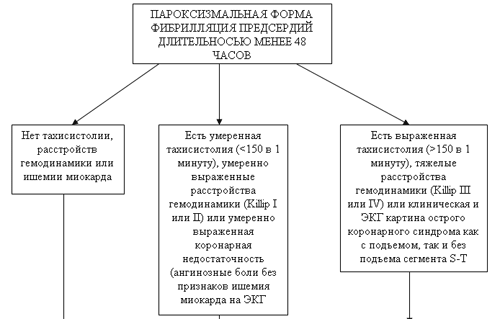
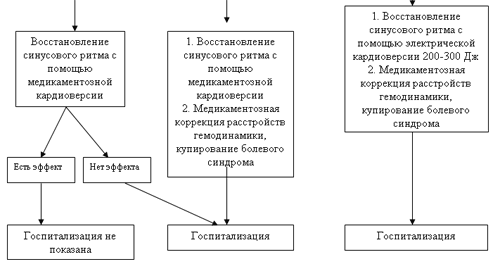
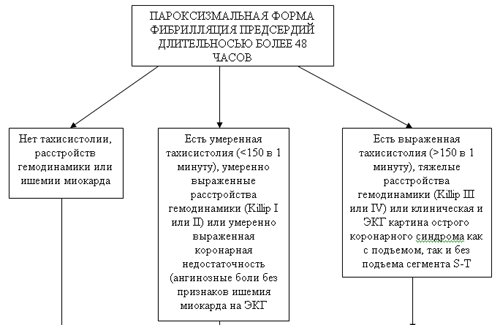
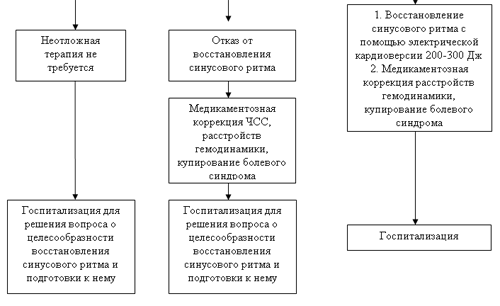
Табл.7. Алгоритм действий на догоспитальном этапе при пароксизмальной форме фибрилляции предсердий длительностью более 48 часов [2 ]
При частых рецидивах , спонтанно купирущихся, не изменяющих ЦГД и общее состояние пациента – нет смысла купировать каждый приступ - надо заниматься профилактикой. Бороться за восстановление синусового ритма любой ценой уже нецелесообразно при выраженной кардиомегалии, нарушениях АВ проводимости с редким ритмом желудочковых сокращений. У больных СССУ , в связи высоким риском остановки синусового узла под влиянием антиаримических средств, предполагается установка ИВР.
Если ПФФП возникла до 48 часов, либо впервые, либо повторно и сопровождается выраженной тахикардией, умеренным нарушением ЦГД, субъективно плохо переносится пациентом - ААП вводятся парентерально. При неэффективности ОДНОГО ААП медикаментозная терапия на догоспитальном этапе прекращается .
Важно. У больных АГ необходима адекватная антигипертензивная терапия с применением средств с антифибрилляторным эффектом - ИАПФ, БРА, БАБ.
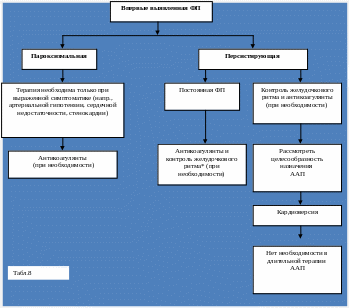
Фармакотерапия при впервые выявленной ФП.
Чаще всего при впервые выявленной ФП применяется следующая тактика:
1. Контроль ЧЖС по мере необходимости, чаще всего, с помощью в-адреноблокаторов и/или дигоксина.
2. Антикоагулянты (варфарин) или дезагреганты (ацетилсалициловая кислота) для профилактики тромбоэмболических осложнений.
3. Обсуждение вопроса об антиаритмической терапии.
4. Обсуждение вопроса о целесообразности восстановления синусового ритма .
5. После восстановления синусового ритма на 1 месяц назначается ААП с целью
предупреждения рецидива ФП (длительная терапия не требуется) и антикоагулянт или дезагрегант.
Противопоказания к восстановлению синусового ритма на догоспитальном этапе:
•Длительность ФП более двух суток.
•Доказанная дилатация левого предсердия (передне-задний размер 4,5 см по ЭхоКГ).
•Наличие тромбов в предсердиях или тромбоэмболические осложнений в анамнезе.
•Развитие пароксизма на фоне острого коронарного синдрома (при наличии стабильной гемодинамики).
•Развитие пароксизма на фоне выраженных электролитных нарушений.
•Декомпенсация тиреотоксикоза.
Показания к госпитализации:
-впервые выявленная ФП; - ПФФП, не поддающаяся медикаментозной кардиоверсии; - ПФФП, сопровождавшаяся расстройствами гемодинамики или ишемии миокарда, которую удалось купировать медикаментозно либо с помощью электрической кардиоверсии; -устойчивая форма ФП , для решения вопроса о целесообразности восстановления синусового ритма; -ФП с высокой частотой желудочковых сокращений и развитиием осложненной аритмии, -развитие осложнений антаритмической терапии; -часто рецидивирующие пароксизмы ФП (для подбора антиаритмической терапии). -при постоянной форме ФП госпитализация показана при высокой тахикардии, нарастании сердечной недостаточности (для коррекции медикаментозной терапии).
Применение ААП может сопровождаться возникновением различного рода проаритмий и блокад сердца. Поэтому хотя проаритмия редко возникает у больных с нормальной функцией желудочков сердца и нормальных исходных интервалах QT, не имеющих выраженной брадикардии, в большинстве случаев медикаментозное лечение ФП следует начинать в стационаре. Это особенно касается фармакологической кардиоверсии. При использовании препаратов, удлиняющих интервал QT, необходимо наблюдение в стационаре в течение 24-48 ч после кардиоверсии для оценки влияния лечения на ЧСС (степени ее уменьшения) и своевременного вмешательства в случае возникновения желудочковой тахикардии типа “пируэт”. В связи с опасностью возникновения быстрого проведения через атрио-вентрикулярный узел узел или атрио-вентрикулярного проведения 1:1 при появлении трепетания предсердий, до начала лечения антиаритмиками класса I следует назначить бета-блокатор или урежающий ритм антагонист кальция.
Рекомендации по фармакологической или электрической кардиоверсии ФП [2 ].
Класс I
Немедленно выполнить электрическую кардиоверсию у пациентов с пароксизмальной ФП и частым желудочковым ритмом, тем, кто имеет доказанный на ЭКГ острый ИМ или гипотонию с симптомами, стенокардию или ХНК, если ФП не отвечает быстро на фармакологические меры. ( Уровень доказательств: C)
Провести кардиоверсию у пациентов без гемодинамической неустойчивости, когда симптомы ФП недопустимы. (Уровень доказательств: C)
Класс IIa
Фармакологическая или электрическая кардиоверсия, чтобы ускорить самопроизвольное восстановление синусового ритма у пациентов с впервые выявленным эпизодом ФП. ( Уровень доказательств: C)
Электрическая кардиоверсия у пациентов с упорствующей ФП, если ранний рецидив маловероятен. ( Уровень доказательств: C)
Повторная кардиоверсия после профилактической терапии у пациентов, которые вновь срываются на ФП без антиаритмического лечения после успешной кардиоверсии. ( Уровень доказательств: C)
Класс IIb
Фармакологическая кардиоверсия до синусового ритма у пациентов с упорствующей ФП. ( Уровень доказательств: C)
Назначение вне стационара фармакологических препаратов для кардиоверсии впервые выявленной, пароксизмальной или упорствующей ФП у пациентов без сердечного заболевания, или когда безопасность препарата у этого пациента была проверена. ( Уровень доказательств: C)
Класс III
Электрическая кардиоверсия у пациентов со спонтанным чередованием ФП и синусового ритма в течение коротких периодов времени. (Уровень доказательств: C)
Повторная кардиоверсия у пациентов с короткими периодами синусового ритма, которые вновь срываются на ФП, несмотря на многократные процедуры кардиоверсии и профилактическую антиаритмическую терапию. (Уровень доказательств: C)
Nota bene. При ПФФП следует считать чрезвычайно важным быстрое - в пределах 1-2 сут - купирование первого в жизни больного приступа ФП, особенно при тяжелой патологии миокарда. Не следует останавливаться перед быстрым применением у таких больных электроимпульсной терапии (ЭИТ), не тратя время на длительные попытки медикаментозного восстановления ритма, чреватые нарастанием угрозы остро возникшего внутрисердечного тромбоза (и последующих тромбоэмболий, в том числе и "нормализационных"). При ТП с частым желудочковым ритмом (при проведении 2:1, тем более 1:1) наиболее оправдана также немедленная кардиоверсия.
Таблица 9. Рекомендации по фармакологической кардиоверсии при ФП , длящейся менее 7 суток . Эффективность ААП [2 ].
Препарат* |
Способ назначения |
Класс рекомендации |
Уровень доказанности |
Агенты с доказанной эффективностью ---------------------------------
Пропафенон Флекаинид Амиодарон Хинидин
------------------------------- Менее эффективные или недостаточно изученные агенты -------------------------------- Прокаинамид Дигоксин Соталол |
Внутрь или в/в Внутрь или в/в Внутрь или в/в Внутрь
----------------------------
В/в Внутрь или в/в Внутрь или в/в |
I I IIa IIb
--------
IIb III III |
A A A B
---------------
C A A |
Для профилактики тромбоэмболических осложнений, если продолжительность эпизода ФП превышает 4 часа или она неизвестна, необходимо назначить АВК- варфарин, поддерживая МНО на уровне 2-3. Иногда титрование препарата занимает длительное время. Больному необходимо соблюдать специальную диету. Следует учитывать, что при значениях МНО меньше 2- эффективность профилактики ишемического инсульта снижается . С помощью БАБ контролируется ЧСС.
Если от начала приступа прошло более 2 суток, восстановление нормального ритма может быть опасным — резко возрастает риск так называемых нормализационных тромбоэмболии (чаще всего в сосуды мозга с развитием инсульта). При неревматической мерцательной аритмии риск нормализационных тромбоэмболии составляет от 1 до 5% (в среднем около 2%). Таким образом, попытки восстановления синусового ритма можно предпринимать в течение первых двух суток ФП или после 3-недельного приема антикоагулянтов. При этом необходимо понимать, что у больных с ПФФП, длящейся более 48 часов, восстановление синусового ритма может произойти спонтанно (что является характерной чертой для этой формы ФП) в течение первой недели начатой антикоагулянтной терапии.
Электрическое ремоделирование предсердий.
Фармакологическая или электрическая кардиоверсия ФП чаще завершается успешно, когда длительность ФП составляет менее 24 часов, тогда как большая длительность ФП снижает вероятность восстановления и поддержания СР. Эти наблюдения дали основание для появления крылатого выражения ≪ ФП порождает ФП ≫.
Повышенная склонность к ФП связана с постепенным укорочением эффективного рефрактерного периода по мере увеличения продолжительности приступа. Такое
явление получило название ≪электрическое ремоделирование≫.
Эксперты [2 ]отмечают, что у больных с ФП продолжительностью более 7 дней доказана возможность ее конверсии амиодароном и ибутилидом , дофетилидом. С другой стороны, назначение им новокаинамида, дизопирамида, пропафенона, флекаинида малоэффективно.
Таблица 10. Рекомендации по фармакологической кардиоверсии при ФП, длящейся более 7 суток [2 ] . Эффективные ААП.
Препарат |
Способ назначения |
Класс рекомендации |
Уровень доказанности |
Агенты с доказанной эффективностью --------------------------- Амиодарон
Пропафенон Флекаинид Хинидин
------------------------- Менее эффективные или недостаточно изученные агенты - ----------------------- Прокаинамид Соталол Дигоксин |
------------------------------------- Внутрь или в/в
Внутрь или в/в Внутрь Внутрь
-------------------------------------
----------------------------------- В/в Внутрь или в/в Внутрь или в/в |
--------------------- IIa
IIb IIb IIb ---------------
------------------------ IIb III III |
------------------ A
B B B ---------------
-----------------------C A C |
Комментарии:
1. Если обобщить табличные данные по классу рекомендаций и уровню
доказательств, оценить наличие ААП на фармацевтическом рынке,
то будет понятно, что из имеющихся в арсенале лекарственных средств, при
пароксизмальной ФП следует чаще использовать пропафенон и/или амиодарон.
2. С другой стороны, не надо упорствовать, если в анамнезе пациент указывает на то, что именно новокаинамид, вводимый в/в , купирует эпизоды ФП.
В последние годы активно подвергаются сравнительному анализу два основных направления в лечении больных с рецидивирующей ФП: восстановление синусового ритма и контроль частоты желудочковых сокращений (ЧЖС) при сохраняющейся ФП.
Результаты многоцентровых исследований RACE и AFFIRM не обнаружили достоверных отличий в прогнозе больных при сравнении стратегий контроля ритма и контроля ЧЖС при ФП, а также пациенты не отличались по риску госпитализаций в связи с ухудшением сердечной недостаточности. Предположительный характер большинства известных механизмов запуска ФП лежит в основе недостаточно четких и конкретных критериев клинического выбора ААП, для фармакологического испытания которых используются всевозможные эмпирические способы моделирования тахиаритмий сердца.
Рекомендации по лечению пациентов с ФП и острым ИМ [2].
Класс I.
Выполнить электрическую кардиоверсию пациентам с серьезными гемодинамическими расстройствами или тяжелой ишемией. (Уровень доказательств: C)
Внутривенное назначение сердечных гликозидов или амиодарона, чтобы замедлить частый желудочковый ответ и улучшить функцию ЛЖ. (Уровень доказательств: C)
Внутривенное введение бета-блокаторов для замедления частого желудочкового ответа у пациентов без клинической дисфункции ЛЖ, бронхоспастических заболеваний или AV блокад. (Уровень доказательств: C)
Назначить гепарин пациентам с ФП и острым ИМ, если нет противопоказаний к антикоагуляции. (Уровень доказательств: C)
Наибольшую опасность ФП представляет при наличии дополнительных предсердно-желудочковых путей (WPW), которые, обладая коротким рефрактерным периодом, проводят на желудочки значительно большее количество импульсов, чем AV узел. При этом сочетании чрезвычайно высок риск быстрой декомпенсации и трансформации в фибрилляцию желудочков. Клинически и электрокардиографически состояние похоже на желудочковую тахикардию: с высокой ЧСС более 200 в 1 мин., с деформацией и расширением комплексов QRS по типу синдрома WPW . Требует проведения экстренной кардиоверсии. При частоте сердечных сокращений менее 200 в мин. можно применить препараты, блокирующие дополнительный путь, или увеличивающие его рефрактерный период (например, аймалин, дизопирамид). Категорически противопоказаны: сердечные гликозиды и антагонисты кальция, нельзя применять и БАБ.
Рекомендации по лечению ФП и предвозбуждения желудочков [ 2].
Класс I.
Катетерная аблация дополнительного пути у пациентов с симптомами с ФП, у которых имеется WPW синдром, особенно с обмороками из-за частого сердечного ритма или с коротким рефрактерным периодом ДПП. ( Уровень доказательств: B)
Немедленно выполнить электрическую кардиоверсию для профилактики фибрилляции желудочков у пациентов с WPW, у которых ФП протекает с частым желудочковым ответом, связанным с гемодинамической нестабильностью. (Уровень доказательств: B)
Назначить внутривенно прокаинамид или ибутилид для восстановления синусового ритма у пациентов с WPW, у которых ФП происходит без гемодинамической нестабильности при широких QRS комплексах на кардиограмме (больше или равные 120 мс). ( Уровень доказательств: C).
Класс II b.
Назначение внутривенно хинидина, прокаинамида, дизопирамида, ибутилида или амиодарона гемодинамически устойчивым пациентам с ФП с вовлечением проведения по дополнительному пути. (Уровень доказательств: B)
Требуется немедленная кардиоверсия, если развиваются очень частая тахикардия или гемодинамическая нестабильность у пациентов с ФП с вовлечением проведения по дополнительному пути. (Уровень доказательств: B)
Класс III
Внутривенное назначение бета-блокаторов, сердечных гликозидов, ДИЛТИАЗЕМА или верапамила у пациентов с WPW синдромом, у которых имеется предвозбуждение желудочков при ФП ( Уровень доказательств: B ).
Синдром слабости синусового узла. Для безопасного проведения купирующей и профилактической терапии больным с СССУ и ФП показана имплантация ЭКС [30]. У некоторых больных учащение ритма имплантированным ЭКС (предпочтение отдается предсердной или двухкамерной стимуляции) уменьшает частоту приступов ФП. При наличии постоянной электрокардиостимуляции неотложная терапия тахиаритмий проводится по общим принципам. Однако после электрической кардиоверсии необходимо проверить качество функционирования ЭКС. У больных без имплантированного ЭКС, если отсутствуют экстренные показания, следует наблюдать за течением аритмии до ее спонтанного прекращения, так как использование любых ААП или ЭИТ увеличивает риск появления выраженной симптомной брадикардии после купирования приступа, или восстанавливать синусовый ритм в стационаре на фоне временной трансвенозной ЭКС [ 31 ] .
Когда нет возможности проведения временной ЭКС, наиболее безопасно применение ААП, обладающих холинолитическим действием ( дизопирамид, новокаинамид, хинидин). Гипертиреоз. ФП развивается у 10–20% больных с тиреотоксикозом. Она чаще регистрируется у мужчин и пожилых пациентов, чем у женщин или лиц моложе 75 лет. В основе ведения данных больных лежит медикаментозное или хирургическое лечение, направленное на нормализацию функций щитовидной железы, которое может привести к восстановлению синусового ритма. Купирующая и профилактическая антиаритмическая терапия, а также ЭИТ мало эффективны при гипертиреозе. Для урежения высокой ЧСС, часто встречающейся при ФП и гиперфункции щитовидной железы, препаратами выбора являются БАБ [3]. Когда они противопоказаны, рекомендуется применение антагонистов кальция (верапамил, ДИЛТИАЗЕМ ). Если тахиаритмия остается после эффективного лечения тиреотоксикоза, для восстановления синусового ритма и профилактики рецидива аритмии используют обычные методы лечения (противопоказана длительная противорецидивная терапия амиодароном). Рекомендации по лечению ФП у пациентов с гипертиреозом [2]. Класс I.
1.Требуется немедленная кардиоверсия, если развиваются очень частая тахикардия или гемодинамическая нестабильность у пациентов с ФП с вовлечением проведения по дополнительному пути. ( Уровень доказательств: B)
Назначить бета-блокаторы при необходимости контролировать частоту желудочкового ответа у пациентов с ФП, осложненной тиреотоксикозом, если это не противопоказано. ( Уровень доказательств: B)
При обстоятельствах, когда бета-блокаторы не могут использоваться, назначайте антагонисты кальция (дилтиазем или верапамил) для контроля частоты желудочкового ответа. ( Уровень доказательств: B)
У пациентов с ФП связанной с тиреотоксикозом, применить пероральные антикоагулянты (МНО 2 - 3) для профилактики тромбоэмболий, как это рекомендовано для пациентов ФП с другими факторами риска инсульта. ( Уровень доказательств: C)
Как только эутиреоидное состояние восстановлено, рекомендации по антитромботической профилактике остаются теми же самыми, что и у пациентов без гипертиреоза. (Уровень доказательств: C )
Предупреждение и лечение ПФФП после хирургических вмешательств [2].
Класс I. Для предупреждения ФП после хирургических вмешательств использовать БАБ, если нет противопоказаний (уровень доказанности А).
У больных с ФП, развившейся после хирургического вмешательства, добиться контроля ЧСС с помощью назначения препаратов, замедляющих атриовентрикулярное проведение (уровень доказанности В).
Класс IIa. Профилактически назначить соталол или амиодарон у больных с повышенным риском возникновения ФП после хирургического вмешательства (уровень доказанности В).
При возникновении ФП после хирургического вмешательства восстановить синусовый ритм медикаментозно с помощью ибутилида или электрической кардиоверсией так же, как это рекомендуется у нехирургических больных (уровень доказанности В).
У больных с рецидивирующей или рефрактерной ФП после хирургического вмешательства пытаться удержать синусовый ритм с помощью назначения ААП ( уровень доказанности В).
Назначить антитромботический препарат согласно рекомендациям для нехирургических больных (уровень доказанности В).
Кардиохирургия.
ФП развивается у 20–50% больных, перенесших операцию на открытом сердце (в 20–30% случаев после операции коронарного шунтирования – КШ, и, приблизительно, в 40–50% случаев после хирургических вмешательств на клапанах сердца) [32]. Она, как правило, регистрируется в течение первых 5 сут после операции (чаще на 2 или 3-й день). В последние годы отмечена тенденция к увеличению ФП в связи с возрастанием кардиохирургических вмешательств у больных пожилого возраста. Анализ исследования, включавшего 4657 больных, подвергшихся операции КШ, показал, что факторами риска развития ФП являются пожилой возраст, увеличение размеров предсердий, послеоперационная сердечная недостаточность, ожирение, перикардит и повышение активности симпатико-адреналовой системы {33}. Для профилактики послеоперационной ФП эксперты АСС/АНА/ESC [2] рекомендуют использовать амиодарон или b-блокаторы. Эффективность амиодарона в предупреждении ФП доказана в ряде контролируемых исследований. Так, в исследовании ARCH (Amiodarone Reduction in Coronary Heart) [14], включавшем 300 больных, внутривенное введение амиодарона (1 г/сут) в течение 2 дней после операции уменьшило количество случаев ФП по сравнению с группой плацебо с 47 до 35% (р=0,01). В другом исследовании пероральное применение амиодарона (600 мг/сут) в течение 7 дней до операции на сердце позволило на 50% (р=0,003) снизить риск развития данной аритмии [34]. После операции на коронарных артериях назначается клопидогрель в течение 12 месяцев, при рецидивирующей ФП - параллельный прием ОАК.
Беременность. При беременности ФП встречается редко и обычно связана с каким-либо заболеванием
сердца, например, митральным стенозом, врожденным пороком сердца или гипертиреозом. Высокая ЧЖС может вызвать серьезные гемодинамические нарушения
как у матери, так и у плода. По классификации Управления по контролю качества пищевых продуктов и лекарственных препаратов США ( FDA ) дигидропиридиновые АКК и БАБ относятся к категории С , их прием связан с риском для плода [77]. .Атенолол отнесен к категории D. Согласно рекомендациям ВНОК-ESH-ESC кардиоселективные БАБ разрешены со второго триместра беременности, АКК разрешены с первого триместра.
Рекомендации по лечению ФП во время беременности [ 34 ] .
Класс I. Контроль ЧСС с помощью дигоксина, бета-блокатора или антагониста кальцая (уровень доказанности С). Электрическая кардиоверсия у больных с гемодинамической нестабильностью, возникшей вследствие аритмии (уровень доказанности С). Антитромботическая терапия (антикоагулянт или аспирин) на всем протяжении беременности у всех больных с ФП (за исключением изолированной ФП ) (уровень доказанности С).
Класс IIb. Попытка фармакологической кардиоверсии с использованием хинидина, прокаинамида или соталола у гемодинамически стабильных больных, у которых ФП развилась во время беременности (уровень доказанности С).
Назначение гепарина больным с факторами риска ТЭ во время первого триместра и последнего месяца беременности. Нефракционированный гепарин можно назначить как в виде постоянной внутривенной инфузии в дозе, достаточной для удлинения активированного частичного тромбопластинового времени в 1,5-2 раза выше контрольного, или в виде периодических подкожных инъекций в дозе от 10 тыс. до 20 тыс. ЕД каждые 12 ч, подобранных таким образом, чтобы достичь удлинения активированного частичного тромбопластинового времени в промежутках между инъекциями (6 ч после инъекции) в 1,5 раза выше контрольного (уровень доказанности В).
А. Данные в поддержку использования в этой ситуации подкожных инъекций низкомолекулярного гепарина, ограничены (уровень доказанности С). Назначение непрямого антикоагулянта во втором триместре беременности у больных с высоким риском ТЭ (уровень доказанности С).
Гипертрофическая кардиомиопатия.
Существуют различные мнения относительно клинической важности ФП в рамках гипертрофической кардиомиопатии (ГКМП). Систематические исследования по терапии ФП у больных с ГКМП отсутствуют, в лечении ФП при ГКМП используются различные ААП такие как дизопирамид, пропафенон и амиодарон.
Развитие ПФФП при гипертрофической кардиомиопатии (ГКМП) часто приводит к появлению или нарастанию симптомов застойной сердечной недостаточности из-за потери вклада предсердий во внутрисердечную гемодинамику и укорочения диастолы. Поэтому урежение ЧСС и/или восстановление синусового ритма у большинства из этих больных является целесообразным [2]. Для урежения частоты желудочковых сокращений при ФП основными препаратами являются БАБ . Применение сердечных гликозидов (дигоксин) с этой целью возможно, но гемодинамически менее выгодно. Назначение верапамила и дилтиазема у больных с обструктивной ГКМП может вызывать серьезные осложнения (увеличение градиента давления в выносящем тракте ЛЖ, гипотензию и даже отек легких), поэтому их не следует применять или использовать крайне осторожно (начинать с небольших доз) при тщательном контроле за состоянием пациента. Некоторые исследователи применяют амиодарон как для профилактики приступов ФП,
так и для контроля ЧЖС. Применение электрической стимуляции для профилактики ФП не исследовалось, однако высокая частота ишемических инсультов у больных с ГКМП и ФП оправдывает попытки восстановления и поддержания СР и применение антикоагулянтов. Из-за высокого риска аритмогенного действия некоторых ААП у больных с выраженной гипертрофией миокарда (мономорфная ЖТ, полиморфная ЖТ "torsades de pointes" ) купировать ФП при ГКМП надо амиодароном или ЭИТ.
Рекомендации по лечению ФП у пациентов с гипертрофической кардиомиопатией [ 2].
Класс I
Лечить пациентов с гипертрофической кардиомиопатией, у которых развивается ФП пероральными антикоагулянтами ( МНО 2-3) как рекомендовано другим пациентам высокого риска для профилактики тромбоэмболий. ( Уровень доказательств: B)
Класс II a.
Назначить антиаритмическое лечение для профилактики рецидивов ФП. Доступные данные недостаточны, чтобы рекомендовать какой-то один препарат в этой ситуации, но дизопирамид и амиодарон обычно предпочитаются ( Уровень доказательств: C).
Применение электрической стимуляции для профилактики ФП не исследовалось,
однако высокая частота ишемических инсультов у больных с ГКМП и ФП оправдывает попытки восстановления и поддержания СР и применение антикоагулянтов.
Рекомендации по лечению ФП у больных с заболеваниями легких. Класс I. При возникновении ФП во время острого или обострения хронического легочного заболевания первоначальные терапевтические усилия должны быть направлены на коррекцию гипоксемии и ацидоза (уровень доказанности С).
У больных с обструктивным заболеванием легких при возникновении ПФФП для контроля ЧСС предпочтительнее антагонисты кальция ( АЛТИАЗЕМ-Берлинхимия или верапамил) (уровень доказанности С).
Попытка электрической кардиоверсии у больных с заболеванием легких и появившейся гемодинамической нестабильностью вследствие ФП (уровень доказанности С).
Класс III
Использование теофиллина и агонистов бета-адренорецепторов у больных с бронхоспазмом и развившейся ФП (уровень доказанности С).
Использование бета-блокаторов, соталола, пропафенона и аденозина у больных с обструктивным заболеванием легких и развившейся ФП (уровень доказанности С).
Лечение ПФФП у пожилых.
Известно, что в пожилом и старческом возрасте вероятность побочного и проаритмогенного эффекта ААП значительно выше, чем у лиц молодого возраста. Это объясняется возрастными изменениями электролитного баланса - дефицита ионов калия и магния, изменениями регуляции нейро-эндокринной системы, замедления проводимости, снижения коронарного кровотока и развития ИБС. Все это может приводить к формированию электрической нестабильности миокарда. Возрастные изменения фармакокинетики ААП, удлинение периода полураспада, могут приводить к повышению концентрации ААП в миокарде, повышать вероятность проаритмий. При ФП у пожилых больных с органическими поражениями сердца ( клапанный стеноз , постинфарктный кардиосклероз ) лечение начинают с медленного внутривенного введения 0,5 мл 0,05% раствора строфантина или 1 мл 0,025% раствора дигоксина, если, конечно, больные не находятся в состоянии дигиталисной интоксикации. При отсутствии эффекта через 30 мин. внутривенно вводят от 5 до 10 мл 10% раствора новокаинамида до получения эффекта (или до достижения суммарной дозы 1 г). При отсутствии эффекта от медикаментозной терапии, ухудшении состояния больного - ЭИТ.
Для купирования ФП у больных с систолической дисфункцией левого желудочка (ЛЖ застойная сердечная недостаточность или ФВ<40%) не рекомендуется большинство ААП (высокий риск побочных эффектов). Исключение составляет амиодарон, который является безопасным даже для больных с выраженным структурным поражением миокарда [2 ]. Метаанализ 18 исследований показал, что его эффективность в восстановлении синусового ритма при внутривенном введении больным с ФП составляет 55–85% [36]. Кроме того, длительное пероральное применение амиодарона (в течение 28 дней) ассоциируется с конверсией ФП у 15–40% больных [2 ]. Имеется довольно большое количество публикаций, в которых указывается на достаточно высокую эффективность купирования ФП антиаритмиком IС класса пропафеноном как при внутривенном, так и пероральном применении. В 12 –ти плацебо-контролируемых исследованиях, в которых больным с ФП пропафенон назначали перорально однократно (600 мг) , но не позднее чем через 48 ч от начала приступа, отмечено, что он восстанавливал синусовый ритм в 56–80% случаев [36].
Эффективность пропафенона при ФП (однократный пероральный прием 600 мг, наблюдение 8 ч) составляет около 75% [37]. Важно отметить, что применение антиаритмических препаратов IC класса нецелесообразно для купирования тахиаритмий при хронической ИБС и противопоказано больным с острой ишемией миокарда (нестабильная стенокардия, инфаркт миокарда).
Эффективность ААП III класса нибентана в ФКВ фибрилляции и трепетания предсердий составляет более 80%, а аритмогенные эффекты – 2,9% при желудочковых тахикардиях "torsades de pointes" и 7,8% брадикардиях [38]. Поэтому нибентан следует применять только в отделениях кардиологии под электрокардиографическим контролем. Противопоказаниями для его назначения являются: удлинение интервала QT, синдром слабости синусового узла (СССУ), сердечная недостаточность [ 39].
Следует отметить, что на фоне приема ААП класса I при ФП у больных с органическим поражением сердца отмечено увеличение смертности, например, при лечении хинидином — примерно в 3 раза (а при сопутствующей сердечной недостаточности — в 5 раз!). Поэтому у больных с органическим поражением сердца целесообразно назначение амиодарона.
Прочие варианты.
При ФП алкогольно-токсического генеза высокой противоаритмической активностью обладают внутривенные вливания хлорида калия: 20 мл 4 % раствора хлорида калия в 150 мл 5 % раствора глюкозы вводят со скоростью 20-30 капель / мин.; у 2/3 больных оказываются достаточными 1-3 таких вливаний (Узилевская Р.А., Гришкин Ю.Н. 1982). При выраженной тахикардии добавляют 0,25 мг дигоксина. Внутрь можно применить 40 мг анаприлина (обзидана).
При магнийзависимой ФП (доказанная гипомагниемия или наличие удлиненного интервала QT) препаратом выбора служит кормагнезин (магния сульфат ), являющийся в остальных случаях дополнительным средством для урежения ритма , вводимый в/в в течение 10-15 мин. в дозе 400-800 мг магния ( 20-40 мл 10% или 10-20 мл 20 % раствора ).
У здоровых людей, возбудимых, с неустойчивой нервно-вегетативной регуляцией, короткие приступы ФП проходят спонтанно. Можно рекомендовать прием 40 мг анаприлина (обзидана) под язык и повторение той же дозы через 1,5-2 часа; назначение седативных препаратов.
После восстановления синусового ритма при рецидивирующей ФП назначаются ААП, варфарин на 4 недели.
Факторы, предрасполагающие к рецидиву ФП после восстановления СР. У большинства больных с ФП (за исключением пациентов с послеоперационной ФП) рано или поздно происходит рецидив. Уже в течение 1 года после восстановления синусового ритма рецидивы ФП имеются не менее чем у половины больных [91].
Среди факторов риска частого рецидивирования пароксизмов ФП - женский пол и органическое заболевание сердца.
Другие факторы риска рецидивирования ФП: увеличение предсердий и ревматизм, причем некоторые из вышеуказанных факторов взаимосвязаны (например, длительность ФП и размер предсердий).
Лечение рецидивирующей ПФФП.
При коротких ФП с минимальными симптомами разумно не использовать антиаритмическую терапию. Она обычно требуется, если появление ФП сопровождается тяжелыми симптомами. В обеих ситуациях необходимы меры по контролю ЧСС и предупреждению тромбоэмболических осложнений. У многих больных могут быть эффективными различные ААП , и первоначальный выбор препарата должен основываться на соображениях безопасности . Надо подчеркнуть , что данные рандомизированных исследований ААП при ФП немногочисленны, рекомендации по выбору конкретного препарата основаны преимущественно на соглашении\ консенсусе экспертов и при появлении новых фактов в будущем могут подвергнуты изменениям.
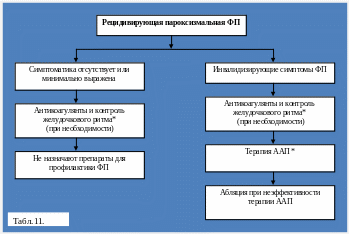
При повторно возникающих ФП, обычно у больных, знающих о своем основном заболевании и виде нарушения ритма, лечение возможно на дому, как правило, с препарата, который ранее помогал больному. Mudge G.H. с соавт. (2001) .
Рекомендуют использовать, например, такой «коктейль внутрь» : пропафенон (или
новокаинамид) в сочетании с атенололом и реланиумом. При этом рекомендуется отдых в положении лежа в течение 4 – 6 ч.
При появлении осложнения для проведения патогенетически обоснованной терапии показана госпитализация. В любом клиническом варианте в связи с трудностью прогноза (переход в осложненные нарушения ритма) состояния - должна быть готовность к проведению электрической дефибрилляции сердца.
Спонтанное восстановление СР и возобновление ФП после кардиоверсии
О частоте спонтанного восстановления СР во многих исследованиях отдельно не сообщалось, тем не менее судить о ней можно по частоте восстановления СР в группе плацебо. В работах по медикаментозной кардиоверсии частота спонтанного восстановления СР в группе плацебо колебалась от 0% до 76%. Из 21 плацебо-контролируемого исследования в 5 частота спонтанного восстановления СР была равна 0%, в 10—от 1 до 33%, а в 6- превышала 33%. Частоту возобновления ФП после успешной кардиоверсии можно оценить по ряду работ, посвященных медикаментозной кардиоверсии. По данным многих исследований через три месяца после кардиоверсии СР сохранялся менее чем у 50% больных. Столь разные результаты скорее всего объясняются различиями между больными в разных исследованиях. В некоторых исследованиях участвовали больные с увеличением левого предсердия, ИБС, артериальной гипертонией, пороками сердца, при этом не ограничивалась давность пароксизма ФП. Немалую роль играет также возраст больных. Однако сказать, какие именно параметры в наибольшей мере влияют на частоту спонтанного восстановления СР и возобновления ФП, по этим исследованиям невозможно [65 ].
Рецидивирующая персистирующая ФП.
Больные с минимальными симптомами, подвергнутые по крайней мере одной попытке восстановления синусового ритма, могут быть оставлены с ФП после подбора терапии по контролю ЧЖС и предупреждению ТЭ. Если симптомы, возникающие при ФП, свидетельствуют о предпочтительности удержания синусового ритма, до кардиоверсии в дополнение к препаратам для контроля ЧЖС и антикоагулянтам следует назначить ААП. В дальнейшем для удержания синусового ритма целесообразно продолжить прием антиаритмика. Больным с частыми рецидивами ФП (более одного эпизода в месяц) показан длительный, практически постоянный прием ААП из-за истощения СУ . Имеются данные о высокой эффективности и хорошей переносимости комбинированной терапии уменьшенными дозами пропафенона и блокаторами в-адренорецепторов или блокаторами кальциевых каналов недигидропиридинового ряда. В отдельных случаях также может использоваться комбинация пропафенона с амиодароном [ 67 ].
Сино-атриальная диссоциация.
Ndrepepa G. (2000 ) зарегистрировал фибрилляцию левого предсердия и трепетание правого предсердия. Макаров Л.М. [ 62 ] регистрировал в нижних отведениях ( II,II, AVF ) трепетание предсердий, и одновременно в грудных отведениях - фибрилляцию предсердий. Martinez (1991 ) на ЭКГ в отведениях III, AVL записал фибрилляцию предсердий , а в остальных отведениях - синусовый ритм . Gomes J.A. (1981 ) регистрировал на поверхностной ЭКГ трепетание предсердий , а на интракардиальной электрограмме - фибрилляцию и трепетание предсердий , синусовый ритм. Rakovec P. (1982 ) на поверхностной ЭКГ записывал синусовый ритм , и одновременно, при проведении ЭФИ , индуцировал трепетание предсердий.
Пароксизм трепетания предсердий ( ТП ).
В основе ТП лежит механизм macrore-entry. При выраженном нарушении гемодинамики показана ЭИТ разрядом 100 Дж.. Риск развития эмболических осложнений после ЭИТ составляет 2,2%. [80 ] . Эффект чрезпищеводной ЭКС достигает 82%. Результативность РЧА нижнего перешейка достигает 90% при наблюдении в течении трех лет. Paydak H. (1998) при наблюдении через 20 месяцев после РЧА регистрировал ПФФП у 25% пациентов. Ряд препаратов (ибутилид, флекаинид) эффективно восстанавливают синусовый ритм при ТП, однако значительно повышают риск развития веретенообразной желудочковой тахикардии. Ни препараты, замедляющие АВ-проведение, ни кордарон не оказались эффективными при восстановлении синусового ритма, хотя они могут эффективно контролировать частоту сердечных сокращений.В большинстве случаев при АВ-проведении 2:1 и выше (АВБ II ст. Тип III ) пациенты не имеют гемодинамических нарушений. В такой ситуации клиницист может остановить свой выбор на препаратах, замедляющих АВ-проводимость. Препаратами выбора следует считать антагонисты кальция (недигидроперидинового ряда) и адреноблокаторы. Адекватный, хотя и труднодостижимый, контроль частоты ритма особенно важен, если восстановление синусового ритма отсрочено (например, при необходимости проведения антикоагулянтной терапии). Более того, если планируется медикаментозная кардиоверсия, то необходим контроль тахисистолии, поскольку ААП, такие как препараты класса Ic, могут уменьшать частоту сокращения предсердий и вызывать парадоксальное увеличение частоты сокращения желудочков вследствие замедления скрытой АВ-проводимости, что ухудшит клинический статус больного. Если ТП длится более 48 ч, пациентам показано проведение антикоагулянтной терапии варфарином перед электрической или медикаментозной кардиоверсией. Вероятность развития эмболических осложнений в 2-3 раза ниже, чем у больных с ПФФП.
Подбор ААП по данным ВРС.
Анализ ВРС у пациентов с ПФФП проводится на фоне синусового ритма и не имеет принципиальных отличий от общепринятого при ИБС. Увеличение показателей ВРС (SDNN, SDANN, SDNNi, RMSSfl, NN 50) можно рассматривать как благоприятный прогностический признак [39 ] .
В группе пациентов, получавших β-адреноблокаторы, одновременно с антиаритмическим действием отмечается рост ВРС, что свидетельствует о положительном влиянии на ВНС. Достижение эффекта при пароксизмальной ФП с помощью препаратов 3-го класса сопровождается менее выраженным увеличением показателей. При этом прирост на 20% и более на фоне положительного результата свидетельствует о стойкости клинического ответа. Снижение вариабельности в процессе дальнейшего наблюдения до исходных величин или менее, в первую очередь, SDNNi, RMSSD NN 50, предшествует утрате эффекта при лечении как β-адреноблокаторами, так и препаратами 3-го класса.
Влияние средств 1-го класса (этацизин, пропафенон ) на ВРС неоднородно. Прием этацизина не сопровождается изменением ВРС по сравнению с исходными данными. На фоне применения пропафенона отмечается тенденция к повышению ВРС, при этом имеет место снижение показателей до исходных или даже ниже за 1-1,5 месяца до утраты антиаритмического эффекта.
Таким образом, на фоне ИБС с ПФФП при снижении исходных значений ВРС по сравнению с нормой лечение целесообразно начинать препаратами 2 или 3-го класса. Увеличение RMSSD,SDNNi и NN50 является прогностическим критерием стойкости положительного ответа. Выявляемое в процессе терапии снижение показателей является предиктором утраты эффекта, что требует своевременной коррекции схемы лечения. При отсутствии положительного результата возможно назначение препаратов 1-го класса. Если нет брадикардии, желательно их сочетание (особенно этацизина) с β-адреноблокаторами, доза которых подбирается с учетом ЧСС. При нормальных исходных данных ВРС анализируют другие факторы (состояние проводящей системы сердца, ионный баланс, результаты ЭхоКГ). У больных с частыми пароксизмами ФП наблюдались более низкие показатели активности парасимпатического отдела вегетативной нервной системы ( RMSSD, NN50, pNN50% ) по сравнению с больными с редкими пароксизмами ФП по данным 48-часового мониторирования ЭКГ по Холтеру ( Абрамова А.А., Матвеев В.В., Подзолков В.И. ). Townend установил [58 ] , что пропафенон и флекаинид (но не амиодарон) уменьшают временные характеристики ВСР у пациентов с хроническими желудочковыми аритмиями. В другом исследовании [59] пропафенон уменьшал ВСР и подавлял НЧ компонент в большей степени, чем ВЧ, приводя к существенному уменьшению отношения НЧ/ВЧ компонентов. Флекаинид, а также энкаинид и морицизин, снижали ВСР у постинфарктных больных, однако наблюдение не выявило корреляции между этими изменениями и смертностью. Таким образом, ряд ААП , ассоциируемых с увеличением смертности, способны снижать ВСР. Однако неизвестно, имеют ли эти изменения ВСР какое-либо прямое прогностическое значение.
Проаритмический эффект ААП.
Как известно, фармакологический подход к лечению ФП должен осуществляться не только с учетом предполагаемого положительного исхода кардиоверсии, но и на основании грамотной оценки потенциального риска (L.L.Mackstaller, J.S.Alpert, 1997), обусловленного применением ААП. Возможное развитие нежелательных побочных реакций наряду с потенциальным проаритмогенным действием ААП может поставить под сомнение безопасность лечения, являющуюся одним из ключевых принципов фармакологического купирования ФП.
Выделяют два основных варианта аритмогенного эффекта: возникновение новой формы нарушения ритма и усиление (аггравация) исходной аритмии. Вероятность развития аритмогенного эффекта составляет в среднем примерно 10% для каждого препарата и наиболее высока у больных с тяжелыми, опасными для жизни желудочковыми аритмиями, особенно при наличии признаков органического поражения миокарда с нарушением функции левого желудочка. Аритмогенный эффект препаратов нередко представляет опасность для жизни. Действие препаратов расценивается как проаритмическое в случаях появления блокад, ухудшения исходной аритмии или возникновения новой, уширения QRS на 50%, удлинения интервала QT . Исследование и клинический опыт показывают, что при длительной антиаритмической терапии примерно в 10% случаев встречаются угрожающие жизни проаритмические эффекты. При этом проаритмическое действие выражается в инициировании нового, до сих пор не наблюдаемого у данного пациента нарушения ритма. В некоторых случаях развиваются даже мерцание и трепетание желудочков сердца. Следовательно, противоаритмический или аритмогенный эффекты могут обусловить непосредственную угрозу для жизни пациента .
Правило 1.
Чем выше эффективность ААП, тем выше вероятность аритмогенного действия.
Правило 2. Опасность антиаритмической терапии возрастает с увеличением выраженности аритмии и степени нарушения функции миокарда. Особенно велик риск для пациентов, у которых уже имеются сердечно-сосудистые заболевания. К ним относятся: больные с низкой фракцией выброса, с сердечной недостаточностью, с прогрессирующей ИБС , кардиомиопатиями. В группу риска входят также пациенты с нарушениями электролитного обмена или люди, потребляющие постоянно алкоголь. Правда, проаритмические эффекты ААП не всегда жизнеугрожающи. Иногда они выражаются в умеренных экстрасистолах или нарушениях проводимости.
Наиболее известным классическим вариантом аритмогенного эффекта является возникновение желудочковой тахикардии типа «пируэт» у больных, принимающих хинидин. Частота возникновения этой аритмии достигает 3%. Случаи развития опасных желудочковых тахиаритмий вплоть до фибрилляции желудочков были описаны на фоне приема практически любого антиаритмического препарата. Макаров И.М. установил, что этацизин может провоцировать ЭКГ- признаки синдрома Бругада [ 62] . ААП могут модифицировать маркеры риска внезапной смерти. Так, прокаинамид, амиодорон и БАБ снижают амплитуду альтернации зубца Т, прием флекаинида может ее увеличить.
ВЫВОД: пациенты , длительное время принимающие ААП , требуют постоянного и тщательного наблюдения и контроля.
Таблица 13. Типы проаритмий и блокад проведения во время лечения ФП различными ААП в соответствии с классификацией E.M.Vaughan Williams - B.N. Singh - D.C. Harrison ( http://www.torsades.org) .
А. Желудочковая проаритмия Тахикардия типа “пируэт (препараты VW классов IA и III) Устойчивая мономорфная желудочковая тахикардия (обычно препараты VW класса IС) Устойчивая полиморфная желудочковая тахикардия/ФЖ без удлинения интервалов QT (препараты VW классов IA, IC и III) Б. Предсердные проаритмии Стимул для возобновления МА (препараты VW классов IA, IC и III) Перевод МА в трепетание предсердий (обычно препараты VW класса IC) Увеличение порога дефибрилляции (потенциальная проблема с препаратами VW класса IC) В. Нарушения проведения и формирования импульса Увеличение частоты сокращений желудочков во время ФП (препараты VW класса IA и IC) Улучшение проведения по дополнительному проводящему пути (дигоксин, внутривенный верапамил или дилтиазем) Дисфункция синусового узла и атриовентрикулярная блокада (почти все препараты) |
Таблица 14.
ПЕРЕЧЕНЬ ПРЕПАРАТОВ, ОБЛАДАЮЩИХ ПРОАРИТМОГЕННЫМ ПОТЕНЦИАЛОМ
|
Nota bene. Антиковульсанты , при применении у больных судорожным синдромом, могут угнетать АВ- проводимость и спровоцировать синкопальные состояния, асистолию ( приступы Морганьи-Эдемса-Стокса ).
Итак, любое применение ААП сопряжено с повышенным риском осложнений- проаритмическое действие, появление или усугубление дисфункции синусового узла, блокад проведения, сердечной недостаточности . Для повышения безопасности лечения необходимо:
При использовании ААП класса IA и III не допускать увеличения корригированного интервала QT более 520 с (с возможным исключением для амиодарона);
при использовании ААП класса IC не допускать увеличения длительности комплекса QRS более чем на 150% от измеренного до начала лечения;
не допускать возникновения гипокалиемии и гипомагниемии;
поскольку первоначально безопасный препарат может стать проаритмическим, если у больного разовьется ИБС или сердечная недостаточность, или он начнет принимать другие лекарственные средства, которые в комбинации могут быть аритмогенными, необходима настороженность не только в отношении потери сознания, но и в отношении появления стенокардии, одышки, а также одновременного приема других препаратов, удлиняющих интервал QT;
периодически оценивать функцию почек и левого желудочка.
В большинстве случаев прием ААП следует начинать в стационаре. Исключение может быть сделано только для лиц без серьезного заболевания сердца, с нормальным исходным интервалом QT, без выраженной брадикардии, дисфункции синусового узла и блокад проведения, при отсутствии гипокалиемии и гипомагниемии, а также других факторов риска проаритмии. Обычно речь идет о пропафеноне, соталоле и амиодароне, реже – о дизопирамиде; хинидин и прокаинамид вне стационара назначать не следует.
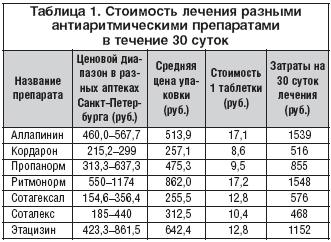 Таблица 15. Данные российских авторов.
Таблица 15. Данные российских авторов.
9. Профилактика тромбоэмболий при восстановлении синусового ритма.
Восстановление синусового ритма у больных ФП может сопровождаться системной эмболизацией в 1-3% случаев . Причиной тромбоэмболических осложнений при ФП без поражения клапанного аппарата сердца в большинстве случаев является тромбоз ЛП, а чаще - ушка левого предсердия . Методом выбора для диагностики тромбов в УЛП является чреспищеводная эхокардиография (ЧП ЭХОКГ), чувствительность и специфичность которой составляют соответственно 92 и 98% . Основные механизмы образования тромбов при ФП соответствуют постулатам теории тромбообразования Вирхова: 1) замедление тока крови, 2) дисфункция эндотелия, 3) гиперкоагуляция. Имеется ряд анатомических особенностей УЛП, способствующих тромбообразованию: его узкая конусовидная форма, а также неровность внутренней поверхности, обусловленная наличием гребенчатых мышц и мышечных трабекул [74]. Размеры и форма УЛП значительно варьируют. В 55% случаев УЛП имеет две лопасти. Средний объем составляет 5,2 мл , диаметр выходного отверстия от 15 до 27 мм. С помощью симпатической и парасимпатической иннервации УЛП регулируется давление крови в предсердиях, выделяется натрийуретический пептид ANP, BNP. При длительной ФП происходит сглаживание, фиброз и утолщение эндокарда УЛП, увеличивается объем. Тромбоэмболия из УЛП у больных ФП без клапанных пороков сердца вызывает 90% инсультов. Среди 50% больных пороками сердца диагностируются тромбы УЛП. Уменьшение сократимости УЛП может вызывать образование тромба даже у пациентов с синусовым ритмом. Эмболизация может возникнуть через несколько дней и даже недель после успешной кардиоверсии . В связи с этим при проведении этой процедуры рекомендуется терапия ОАК в течение 3-х недель до и 4-х недель после кардиоверсии. В тех случаях, когда синусовый ритм не удается восстановить, продолжительность терапии ОАК определяется возрастом и наличием факторов риска. В случае остро возникшей ФП ( 72 часа ) внутрисердечные тромбы выявлялись у 14% больных . Поэтому всем больным необходимо назначать гепарин на 4 суток . Если за это время синусовый ритм не удалось восстановить, и принято решение о кардиоверсии - необходимо начать терапию ОАК. При обнаружении тромбов в предсердии у больных ФП , системными эмболиями в анамнезе - терапия ОАК продолжается пожизненно. Тоже самое - для больных с механическим протезом клапанов, рекомендуется рациональный уровень МНО 4,0.
Риск эмболических осложнений при неревматической ФП в 5,6 раз больше, чем в контрольной группе, а при ФП ревматического генеза - в 17,6 раз больше. Общий риск эмболических осложнений в 7 раз выше, когда присутствует ФП. 15 - 20% всех ишемических инсультов возникают при ФП. Достоверных различий риска эмболических осложнений при пароксизмальной или хронической формах нет, хотя некоторые авторы указывают на то, что хроническая ФП несет несколько больший риск (6% в год), чем пароксизмальная (2 - 3% в год).
Наивысший риск эмболических осложнений при ФП в следующих ситуациях: недавно начавшаяся ФП, первый год существования ФП, ближайший период после восстановления синусового ритма. С возрастом риск инсульта при ФП увеличивается, так в возрастной группе от 50 до 59 лет 6,7% всех цереброваскулярных случаев связаны с ФП, а в возрастной группе от 80 до 89 лет - 36,2%.
Таблица 16. Относительные риски развития инсульта. Снижение риска под влиянием лечения [75].
Фактор риска |
Относительный риск |
Снижение риска после лечения |
Курение сигарет |
1.9 |
50% после 1 года и 100% через 5 лет |
АГ |
8 8 |
32% |
Диабет |
3.9 |
Никакой выгоды от жесткого гликемического контроля |
Гиперхолестеринемия |
1.5 |
19% |
ФП |
3.0 |
64% |
Риск- классификация эмболий при ФП: 1) высокий риск определяется при наличии хотя бы одного из следующих факторов: перенесенный инсульт, транзиторная ишемическая атака или системная эмболия; артериальная гипертензия; низкая фракция выброса левого желудочка; возраст > 75лет; ревматический порок сердца; протезированный сердечный клапан; 2) умеренный риск устанавливается при наличии не более одного из следующих факторов (в противном случае – высокий риск): возраст 65-75 лет; сахарный диабет; коронарная болезнь сердца с сохраненной фракцией выброса ЛЖ;
3) низкий риск выставляется при отсутствии указанный факторов (www.imithome.org, www.russiandoctors.org, www.medmir.com ).
Таблица 17. ESC 2010 . CHA2DS2VASc. Система подсчета очков. Оценка факторов риска: Застойная сердечная недостаточность / дисфункцией левого желудочка -1 Гипертония - 1 Возраст ≥ 75 - 2 Сахарный диабет - 1 Инсульт / TИА / - 2 Сосудистые заболевания - 1 Возраст 65 – 74 - 1 Женский пол - 1 Максимальный балл - 9 С Camm AJ и соавт. Eur Сердце J. 2010;. 31:2369-2429
На фактор тромбообразования влияют размеры сердца, показатели сократительной способности сердца и степень митральной регургитации. Митральная регургитации, препятствуя возникновению феномена замедления тока крови в левом предсердии, может уменьшить риск тромбообразования [104].
Антикоагулянтная терапия (АКТ).
АКТ- является основной стратегией профилактики эмболических осложнений. Она снижает их риск, в среднем, на 68%, но связана с риском серьезного кровотечения (примерно 1% в год). Несмотря на доказанный эффект, АКТ назначается только 30% нуждающимся больным. Другой аспект профилактики эмболических осложнений - восстановление и поддержание синусового ритма. Однако, многоцентровые корпоративные исследования, оценивающие коэффициент риск/ польза (особенно в отношении риска поддерживающей антиаритмической терапии) не закончены. При длительности ФП более 48 часов оральные антикоагулянты (ОАК) показаны не менее 3 недель до (можно амбулаторно) и 1 месяц после восстановления синусового ритма. Различают три класса ОАК: 1. Прямые селективные ингибиторы фактора IIа (тромбина) – дабигатран. 2. Прямые селективные ингибиторы фактора Ха – апиксабан. 3.Антагонисты витамина К - варфарин.
Варфарин. Наиболее широко в мире применяется производный монокумарина- варфарин, антикоагулянт непрямого действия ( в 2003 году в США было выписано 21 млн. рецептов на прием варфарина). Применяется для первичной и вторичной профилактики венозных и артериальных тромбоэмболий у больных с ФП, механическими протезами клапанов [72].
Варфарин подавляет синтез витамин К-зависимых факторов свертывания крови (II, VII, IX и X) и белков C и S в печени. Препарат содержит равную смесь R и S- изомеров. Из них S- изомер в 3-5 раз активнее R- изомера. Метаболизм варфарина определяется наличием S- изомера. Период полужизни варфарина 36 часов. Ударные дозы АВК не рекомендуются из-за угрозы как тромбообразования, так и кровотечения ( на фоне гепарина ). Терапию следует начинать с поддерживающих доз варфарина - 2,5 -10 мг / в сутки. Изменение МНО происходит уже после 3-х кратного приема препарата. Регулярный контроль МНО проводится один раз в 4 недели.
При неревматической ФП оптимальным компромиссом между эффективностью и риском кровотечения является поддержание МНО на уровне 2,0 – 3,0 (протромбиновый индекс - 55 - 65). Превышение МНО свыше 3,0 увеличивает риск внутричерепных геморрагий у лиц старше 75 лет до 1,9 % случаев.
Анализ величин средних поддерживающих доз варфарина, проведенный Berry D. в 2007 г., показал, что помимо больных, принимающих, так называемые ≪средние≫ дозы варфарина (2,5-7,5 мг в сутки), нередко встречаются пациенты, которым для поддержания терапевтического диапазона МНО, достаточно не более 1,0-2,0 мг (!) варфарина. Кроме того, существуют больные, у которых поддерживающая доза варфарина значительно превышает 7,5-10 мг [73].
На выбор дозы варфарина оказывают влияние многие факторы – возраст, пол, вес, курение, МНО , предыдущая доза варфарина, соматическое состояние (заболевания печени, почек, хроническая сердечная недостаточность, уровень белка крови, потеря крови при операциях ), лекарственные взаимодействия, пищевой рацион (содержание витамина К в продуктах питания), а также генетические особенности в виде полиморфизма генов цитохрома P450 печени - CYP2C*9, участвующего в метаболизме варфарина и молекулы мишени антагониста витамина К ( АВК ) — витамин-К-эпоксидредуктазы (VCORC1).
Пациентам, принимающим АВК, не следует менять пищевой рацион, а содержание витамин К1 в продуктах не должно превышать 250 мкг в сутки. Следует учитывать, что содержание витамина К1 в продуктах зависит от способа кулинарной обработки. Наибольшее количество витамина К1 содержится в сырой или отварной белокочанной капусте, шпинате, брокколи. Содержание витамина К1 в 100 граммах этих продуктов не менее или превышает 250 мкг.(!).
На поддерживающую дозу варфарина влияют и многие лекарственные препараты. Препаратами, ингибирующими изофермент CYP2C*9, и тем самым увеличивающим концентрацию варфарина в крови, являются многие антибиотики, нестероидные противовоспалительные средства, циметидин, ряд кардиологических препаратов, среди которых особо следует отметить амиодарон. Омепразол в дозировке 20 мг/сут. оказывает стереоселективный эффект на метаболизм в печени варфарина, препятствуя CYP2C19–опосредованной трансформации R (но не S)–энантиомера. Как следствие, в крови нарастает среднее содержание R–варфарина , достоверное увеличивается время свертывания на фоне сопутствующего применения омепразола [100].
Эти факторы, включая варианты генов VKORC1, CYP2C*9, CYP4F2, GGCX, учитывали при составлении бесплатной он-лайн программы расчета дозы варфарина, работающей на сайте www.WarfarinDosing.org. Программа рассчитывает терапевтическую дозу варфарина для достижения требуемого МНО (от 2 до 3) с самым высоким коэффициентом корреляции r2=81.5%. Итак, лечение варфарином требует периодического мониторинга коагуляции и частой корректировки дозы. Варфарин обладает узким терапевтическим окном [79], замедленным началом действия и в ряде случаев может вызвать серьезные осложнения ( до 5 %) [72]. В исследовании WATCH применение варфарина вызвало крупные кровотечения в 5,5 % случаев, клопидогреля - в 2,4 % [78].
Фармакогенетика варфарина.
Для достижения терапевтической дозы варфарина необходимо учитывать генотип. Более изученными являются полиморфизмы, обусловливающие повышенную чувствительность и, следовательно, малые (!) поддерживающие дозы варфарина. В первую очередь, это однонуклеотидные полиморфизмы гена CYP2C*9. Носительство ≪медленных≫ аллельных вариантов CYP2C9*2 и CYP2C9*3 приводит к снижению скорости биотрансформации варфарина и повышению его концентрации в плазме крови и ассоциируется с низкой поддерживающей дозой варфарина, явлениями чрезмерной (!) гипокоагуляции и более высоким риском кровотечений [73].
На основе полиморфизмов в промоторной зоне гена, кодирующего VKORС1, выделено две группы гаплотипов: низких и высоких доз варфарина . Показано, что у пациентов с генотипом АА, наблюдается снижение экспрессии гена, кодирующего VKORС1, что приводит к более низкому содержанию VKORС1 в гепатоцитах и объясняет достаточность низких (!) доз варфарина и у этой категории пациентов. Вклад каждого аллеля CYP2C9*3 в снижении дозы составляет 38%, CYP2C9*2 – 17%, каждой копии гаплотипа А VKORC1 – 11%. Одновременное носительство полиморфизмов в генах CYP2C*9 и VKORC1 (G3673A) требует минимальной поддерживающей дозы варфарина и является наиболее неблагоприятным в отношении риска кровотечений (!) и нестабильности МНО.
У больных с генотипом ВВ наблюдается обратная ситуация: повышение экспрессии гена,
кодирующего VKORС1, приводит к более высокому содержанию VKORС1 в гепатоцитах, поэтому эти пациенты нуждаются в высоких (!) поддерживающих дозах варфарина [73]. Пациенты, гомозиготные по аллелям CYP2C9*1 , не имеют отклонений в метаболизме АВК. На основании этих исследований FDA США приняла обновленный протокол использования варфарина с учетом влияния на дозу полиморфизмов генов VKORC1, Cyp2C*9 [77]. FDA отслеживает еще несколько десятков исследований « генетика- доза варфарина » (http://www.fda.gov/ bbs/topics/NEWS/2007/NEW01701.html ). В исследовании Lazo-Langner [72] установлено, что дорогостоящие генетические тесты не имеют преимуществ перед стандартным мониторированием МНО.
Резистентность к варфарину.
Пациент считается резистентным к варфарину, если для достижения стабильных значений МНО ему требуется более 20 мг варфарина в сутки. Резистентность может
наблюдаться при подборе поддерживающей дозы в начале лечения, а также следовать после короткого периода адекватных значений МНО. Среди возможных причин не достижения целевых значений МНО следует перечислить следующие:
• отсутствие приверженности к лечению;
• псевдорезистентность (прием высоких доз витамина К1);
• фармакокинетическая резистентность ( прием лекарств , являющихся индукторами изофермента CYP2C*9);
• фармакодинамическая резистентность. При генетической резистентности к АВК даже 20-кратное увеличение максимальной дозы препарата не вызывает гипокоагуляцию!
Отсутствие приверженности лечению или не соблюдение пациентом рекомендаций по приему варфарина — часто встречающаяся ситуация. Доказательством тому, что пациент не принимает препарат, является отсутствие варфарина в плазме крови [73].
Одновременно (параллельно ) применяют гепарин под контролем АЧТВ в течение 5 дней , после чего последний отменяют.
Дабигатран. Не метаболизируется цитохромами печени системы Р-450, поэтому не взаимодействует с другими лекарствами. В исследованиях PETRO , RE-LY у больных ФП дабигатран и варфарин в равной степени предупреждали развитие инсульта и системных эмболий. Частота больших кровотечений при лечении дабигатраном была ниже.
Апиксабан. Биодоступность 45%, период полувыведения 9-11 часов. В исследовании AVERROES при лечении больных ФП апиксабан в сравнении с аспирином показал явное превосходство по профилактике инсульта.
Рекомендации по антитромботической терапии у пациентов с ФП .
Класс I
Назначить антитромботическую терапию (пероральная антикоагуляция или аспирин) всем пациентам с ФП, кроме больных с одиночной ФП, для профилактики тромбоэмболий. ( Уровень доказательств: A)
Индивидуализировать выбор антитромботического препарата, по оценке абсолютного риска инсульта и кровотечения, а также отношения риска и пользы для каждого пациента. (Уровень доказательств: A)
Хроническая пероральная антикоагулянтная терапия в дозе, подобранной до достижения МНО 2-3 у пациентов с высоким риском инсульта, если нет противопоказаний. ( Уровень доказательств: A)
Потребность в антикоагулянтах должна регулярно повторно переоцениваться. ( Уровень доказательств: A).
МНО должен определяться по крайней мере еженедельно в течение начала антикоагуляции и ежемесячно, когда пациент стабилен. ( Уровень доказательств: A)
Назначить аспирин в дозе 325 мг ежедневно как альтернативу у пациентов с низким риском или у пациентов с противопоказаниями к пероральной антикоагуляции. ( Уровень доказательств: A)
Назначить пероральные антикоагулянты пациентам с ФП, которые имеют ревматический порок митрального клапана или протезы сердечных клапанов (механические или тканевые). ( Уровень доказательств: B )
Установить целевую интенсивность антикоагуляции по типу протеза, но не меньше чем МНО 2 - 3. ( Уровень доказательств: B)
У больных старше 75 лет для первичной профилактики ТЭ следует использовать менее интенсивную антикоагуляцию (МНО 1,6–2,5), учитывать повышенный риск геморрагий у данной категории больных и назначать препараты только в случае отсутствия явных противопоказаний. Антитромботическая терапия у больных с трепетанием предсердий проводится по принципам, аналогичным больным с ФП.
Таблица 17 . Антитромботическая терапия на основе уровня риска у пациентов с ФП [ 2] .
|
Факторы риска тромбоэмболий: ХСН, фракция выброса ЛЖ менее 35%, гипертензия в анамнезе.
Лечение аспирином и варфарином обходится дешево по сравнению с другими фармакологическими подходами к первичной профилактике ТЭ, даже с учетом необходимости анализов крови и мониторинга дозы при приеме варфарина. В исследование BAFTA были включены больные старше 75 лет с ФП. Эффект от применения варфарина и аспирина в профилактике фатальных и нефатальных нарушений мозгового кровообращения был в отношении 2:1. Разработаны методы самоконтроля и коррекции дозы для поддержания антикоагуляции, подобные методам, используемым пациентами-диабетиками, и они могут пригодиться в будущем. Лечение АВК имеет и существенные недостатки: 1. Частые побочные эффекты - кровотечения. 2. Взаимодействие с пищей и другими медикаментами. 3. Необходимость частых лабораторных измерений МНО. 4. Наличие противопоказаний для пожизненного приема АВК. Проблему составляют случаи с бессимптомными короткими ПФФП, таким больным рекомендуется имплантация записывающих устройств. На практике только 40-55% пациентов с ФП получают варфарин. При наличии противопоказаний к назначению АВК, у пожилых пациентов с высоким риском кровотечения, у больных после аблации с высоким риском развития инсульта альтернативой АВК выступают хирургические методы лечения . Методом ЧКВ в УЛП устанавливаются запирающие устройства- WATCHMAN device (Atritech Inc.) , Amplatzer Cardiac Plug (Aga Medical Corp.), выполняющие роль фильтра [96 ].
Если медикаментозно в стационаре не удалось восстановить синусовый ритм, но есть обстоятельства в пользу проведения плановой электрической кардиоверсии, то : 1. Пациент выписывается из клиники с последующим наблюдением участкового
терапевта или кардиолога.
2. Продолжается лечение основного заболевания и назначается ААП для контроля за ЧЖС.
3. Продолжается, начатое в стационаре, лечение Варфарином в течение 3-4 недель (МНО в пределах 2,0-3,0) до проведения кардиоверсии и затем 4-6 недель после ее проведения. При таком подходе частота тромбоэмболий составляет менее 0,1% (Grimm R.A., 2000).
4. Перед проведением плановой кардиоверсии или ЭИТ, обязательное ЧПЭхоКГ исследование.
Комбинированная фармакотерапия ФП.
Терапия больных с нарушениями ритма может осуществляться с помощью нескольких групп ААП, которые имеют различный механизм действия [61 ]. В ряде случаев врачу приходится прибегать к сочетанию ААП : это может быть обусловлено неэффективностью предшествующей терапии или. чаще всего поспешностью врача в желании быстрого купирования острого нарушения ритма. Напомним: прежде чем перейти к назначению комбинации ААП , необходимо тщательно оценить эффект каждого лекарственно средства в отдельности. Допустимыми и рациональными сочетаниями ААП считаются:
- амиодарон + препарат класса I «С» (этацизин, пропафенон)
-бета-блокатор + препарат класса I «С» (этацизин)
-БАБ и представители 1А или 1Б класса ; - препараты 1А и 1Б класса; - сердечные гликозиды и хлористый калий; - сердечные гликозиды и БАБ ; - препараты первой группы и транквилизаторы. -соталол + препарат класса I «С» (этацизин, пропафенон) -амиодарон + бета-блокатор + препарат класса I «С» (этацизин, пропафенон ) .
К опасным сочетаниям ААП относятся:
-амиодарон и БАБ, --амиодарон и сердечные гликозиды, -верапамил и препараты 1А и 1С классов, -верапамил и БАБ, -хинидин и амиодарон, -хинидин и сердечные гликозиды.
Для более успешного выбора ААП следует учитывать спектр действия в соответствии с формой аритмии: - к препаратам преимущественно эффективным у больных с наджелудочковыми аритмиями относятся: АТФ, изоптин, феноптин, верапамил; - к препаратам, оказывающим избирательное действие в отношении желудочковых аритмий, относятся: лидокаин, тримекаин, мекситил; - к препаратам, эффективным как в отношении желудочковой, так и при наджелудочковой аритмии, относятся: амиодарон, этмозин, обзидан, новокаинамид, ритмилен, этацизин, аллапинин.
Специфические показания существуют для: -дифенина (дигиталисная интоксикация), -препаратов калия (гипокалиемия), -сульфата магния (аритмогенные нарушения ритма, в частности, «пируэтная желудочковая тахикардия»), -адреностимуляторов (атриовентрикулярная блокада, резкая брадикардия) (http://meduniver.com/Medical/Neotlogka/528.html ).
Резистентность ФП к медикаментозному лечению.
С чем же связана резистентность к ААП , каковы ее механизмы? Исходная нечувствительность к препаратам может быть связана с характером и тяжестью основного заболевания. Попытки связать эффективность того или иного антиаритмика с этиологией нарушений ритма сердца в литературе не единичны. Однако этот вопрос требует дальнейшего изучения, так как данные различных авторов весьма противоречивы ( Антонченко И.В., Савенкова Г.М., Попов С.В. ).
Антиаритмическая терапия менее эффективна при больших органических изменениях миокарда. Показано, что независимыми предикторами рефрактерности ФП к лекарственной терапии являются : а \ снижение фракции выброса, б\ аневризма левого желудочка, в\ сопутствующая недостаточность аортального клапана . Поддержание синусового ритма значительно затрудняется при больших размерах (или объеме) левого предсердия [41,42 ,43] Однако для амиодарона четкой корреляции между эффективностью препарата и размерами ЛП не выявлено [ 44 ].
Барт Б.Я. и соавторы [45 ] отмечают, что такой связи не установлено у пациентов с положительным результатом лечения, но у 71% больных с отсутствием эффекта от приема кордарона размер ЛП превышал 5,5 см . Антонченко и соавт. [ 46 ] показано, что увеличение степени фиброза в расширенном левом предсердии у пациентов с ФП также сопровождается снижением эффективности долговременной профилактической терапии. Имеются указания на резистентность к терапии ФП у пациентов с гипертрофической обструктивной кардиомиопатией [ 47,48 ] .
При непрерывно рецидивирующем трепетании предсердий, резистентном к профилактической антиаритмической терапии, у ряда молодых больных без явных признаков органического заболевания сердца были выявлены дивертикулы и аритмогенные дисплазии правого предсердия [48 ] .
Выводы. 1.Среди факторов, формирующих рефрактерность к лекарственному антиаритмическому лечению , наиболее значимы те, которые характеризуют тяжесть поражения миокарда: обширные постинфарктные рубцы, хроническая аневризма левого желудочка, низкая фракция выброса, тяжелая симптоматика недостаточности кровообращения. 2. ФП составляет значительную часть сердечной патологии, требующей существенного расхода материальных и интеллектуальных ресурсов на лечение больных (М.С.Кушаковский, 1999; С.А.Бойцов, 2001; F.M.Turazza, M.G.Franzosi, 1997). Несмотря на активный поиск принципов купирования ФП, прогрессирующее распространение тахиаритмии свидетельствует о необходимости новых подходов к разработке средств лечения и профилактики этого нарушения ритма.
«Upstream» терапия.
На сегодняшний день не вызывает сомнения тот факт, что использование антиаритмической терапии имеет ограниченную эффективность и сопряжено со значимым риском возникновения проаритмических и органно-токсических эффектов. Эти ограничения в применении ААП послужили толчком к разработке новых специфических терапевтических стратегий. Одна из них - возможность подавления ФП с помощью препаратов, не относящихся к ААП, так называемая «upstream» терапия. Под этим термином понимают лечебную тактику, целью которой является лечение основного заболевания, приводящего к ФП путем дезорганизации гемодинамики или развития предсердной патологии (ингибиторы АПФ, блокаторы рецепторов ангиотензина II, ингибиторы HMG CoA редуктазы и ω-3-ПНЖК).
Назначение ингибиторов АПФ уменьшает риск возникновения желудочковых нарушений ритма сердца [49 ] за счет угнетения синтеза А II, сохранения электролитного баланса, снижения тонуса вегетативной части нервной системы , уменьшения гемодинамической перегрузки миокарда , коронаролитической активности, снижения уровней гидроперекисей . Так, рамиприл в суточной дозе 10 мг у больных АГ в течении 12 месяцев наблюдения уменьшил число пароксизмов ФП [ 102 ].
Таблица 18. Рекомендации для вторичной профилактики ФП ‘upstream’ терапия [75] . --------------------------------------------------------------------------------------------------------------- Форма ФП Препарат Класс рекомендацийУровеньдоказательств _____________________________________________________________________________
1.Рецидивирующая ФП: ИАПФ, IIb B б-е подвергнутые электрической БРА кардиоверсии, получающие ААП 2.Профилактика рецидивов ФП, тоже IIb B персистирующая ФП, отсутствие структурных поражений сердца,
необходимость лечения другого заболевания (АГ)
__________________________________________________________________________
Антиаритмический эффект статинов обусловлен подавлением воспалительных реакций, оксидативного стресса [ 105 ], увеличением эффективного рефрактерного периода, предупреждением фиброза предсердий[ 106 ].
В исследовании GISSI-HF применение розувастатина в дозе 10 мг/сутки у больных ХСН на 13% уменьшило число случаев новой ФП.
Диован уменьшал частоту новых случаев фибрилляции предсердий на 37 % . Применение диована в комбинации с амлодипином ( препарат ЭКСФОРЖ ) в течение одного года предупредило появление ФП на 14% у больных СД 2 типа с АГ [ 82 ]. Лозартан снизил риск развития фибрилляции предсердий у больных АГ и гипертрофией ЛЖ [ 52] на 29 %, по сравнению с атенололом. Бойцов С.А. с соавт. указывает на возможные механизмы применения БРА у больных АГ [ 69]. Под влиянием терапии происходит уменьшение ГТЛЖ, в результате ремоделирования миокарда улучшается диастолическая функция ЛЖ, снижается давление в устье легочных вен, влияющее на вероятность повыщения эктопической электрической активности сердца, уменьшается электрическая дисперсия [70,71] ,
Омега-3 ПНЖК .
Омега-3 ПНЖК блокирует запуск аритмий [53 ] , на 45% снижает смертность от аритмий [54 ] . В исследовании GISSI [55 ] Омакор оказывал достоверно выраженное антиаритмогенное действие . Представляется достаточно перспективным использование ω-3-ПНЖК для профилактики возникновения ФП. Несмотря на то, что предложено несколько механизмов антиаритмического эффекта ω-3-ПНЖК [56,57 ] , до настоящего времени точного определенного механизма не было установлено. Тем не менее, представляется, что ω-3-ПНЖК связываются с белками натриевых каналов, что ведет к пролонгированию инактивированного состояния ионных каналов, по которым передается быстрый, потенциал-зависимый входящий натриевый ток. Гипотеза, объясняющая подобный результат наблюдения, заключается в том, что при ориентации ω-3-ПНЖК внутри клеточных мембран отрицательно заряженной карбоксильный конец оказывается рядом с положительно заряженной областью альфа-блока ионного канала. Такое защитное действие вызывает гиперполяризацию клеточной мембраны кардиомиоцитов, приводя к увеличению примерно на 50% амплитуды электрического стимула, требуемого для генерации потенциала действия. Последовательность действия этих механизмов и возможное их взаимодействие также до конца не определены. Возможным объяснением антиаритмического действия ω-3-ПНЖК у пациентов с ПФФП является способность ω-3-ПНЖК модифицировать структуры мембраны клетки и их прямой эффект на кальциевые каналы кардиомиоцитов. Угнетение ω-3-ПНЖК притока кальция в клетки через потенциал-зависимые кальциевые каналы L-типа, предотвращает перегрузку кардиомиоцитов кальцием. Известно, что перегрузка клеток кальцием отрицательно сказывается на электрофизиологическом ремоделировании миокарда предсердий у пациентов с пароксизмальными тахикардиями и, как следствие, способствует изменению продолжительности потенциала действия в сторону укорочения, повышая чувствительность клеток миокарда к развитию ФП. Другие механизмы, которые в настоящее время исследуются, включают роль ω-3-ПНЖК в передаче сигналов клетки и их эффект на различные ферменты и рецепторы. ПНЖК и их производные являются лигандами для фактора транскрипции PPAR, модулируют экспрессию в миокарде белка коннексина-43, выступающего посредником межклеточных контактов миокарда [99]. Достаточно важным является способность ω-3-ПНЖК уменьшать вазоконстрикторную реакцию на активацию ангиотензина II и возможностью блокирования его местных электрофизиологических эффектов. Предоперационный прием омега-3 ПНЖК у пациентов, перенесших коронарное шунтирование , существенно снижал частоту ФП после операции и сроки пребывания в стационаре [98]. У больных ИБС-ХСН применение ω-3-ПНЖК совместно со стандартными ААП улучшает результаты электрической и медикаментозной кардиоверсии, уменьшает частоту рецидивов ФП и госпитализаций, снижает смертность. Высокий коэффициент омега-6 ПНЖК\ омега-3 ПНЖК увеличивает риск развития ССЗ. Понижение этого коэффициента до 4\1 при вторичной профилактике ССЗ ассоциируется с 70% снижением общей смертности [103]. Баланс этих ПНЖК играет ключевую роль в метаболизме простагландинов
Несмотря на широкий выбор антиаритмических препаратов, результаты медикаментозной терапии ФП остаются неудовлетворительными.
10. Немедикаментозные методы лечения ФП. Электрическая кардиоверсия.
ФП до сих пор остается серьёзной и нерешённой проблемой для практических врачей и исследователей. Несмотря на большие успехи в понимании многих электрофизиологических механизмов её формирования и поддержания, на сегодняшний день не существует универсального метода лечения ФП. Электрическая кардиоверсия - электрический разряд прямым током, синхронизированный с деятельностью сердца, обычно по R-волне кардиограммы. Это гарантирует, что электрическая стимуляция не произойдет в течение уязвимой стадии сердечного цикла: 60-80 мс до и 20-30 мс после вершины T-волны. Электрическая кардиоверсия используется для лечения всех патологических сердечных ритмов, кроме фибрилляции желудочков. Термин "дефибрилляция" подразумевает асинхронный разряд, который необходим для лечения фибрилляции желудочков, но не ФП.
В одном исследовании 64 пациента были рандомизированно подвергнуты электрической кардиоверсии с начальной энергией при монофазной форме волны 100, 200, или 360 Дж. Большая начальная энергия была значительно более эффективна, чем более низкая (процент непосредственного успеха составил 14% при 100 Дж, 39% - 200, и 95% - при 360 Дж, соответственно), приводя к меньшему количеству разрядов и меньшему количеству совокупной энергии, когда начинали проводить кардиоверсию с 360 Дж. Эти данные указывают, что начальный разряд 100 Дж зачастую слишком мал. Для электрической кардиоверсии при ФП рекомендуется начальная энергия 200 Дж или выше. Существуют устройства, которые вырабатывают ток с двухфазной формой волны; они достигают кардиоверсии при более низких уровнях энергии, чем те, которые используют монофазную форму волны.
Методика проведения дефибрилляции при ФП.
1. Энергия начального разряда при использовании синхронизированного дефибриллятора (электрическая кардиоверсия) составляет 120 Дж, при использовании несинхронизированного – 200 Дж.
2. При неэффективности первого разряда, мощность энергии увеличивается каждый раз на 100 Дж до достижения максимума (360 или 400 Дж).
3. Интервал между двумя последовательными разрядами не должен быть менее 1 минуты.
4. Непосредственно перед ЭИТ ввести фентанил 0,05 мг, либо анальгин 2,5 г в/в.
5. Ввести больного в медикаментозный сон (диазепам 5 мг в/в и по 2 мг каждые 1-2 мин до засыпания).
6. Проконтролировать сердечный ритм
7. Синхронизировать электрический разряд с зубцом R на ЭКГ (при относительно
стабильном состоянии больного).
8. Провести ЭИТ (при трепетании предсердий и монофазной форме импульса, мощность разряда - 50 Дж).
Уровень успешности наружной кардиоверсии колеблется от 65% до 90%. Риск электрической кардиоверсии ниже риска медикаментозной кардиоверсии. Осложнения достаточно редки, но встречаются и о них необходимо уведомлять пациента при получении согласия больного на процедуру. Основные осложнения наружной кардиоверсии: системная эмболия, желудочковые аритмии, синусовая брадикардия, гипотензия, отек легкого, элевация сегмента ST. Восстановление синусового ритма может вскрыть имеющийся синдром слабости синусового узла или АВ блокаду, поэтому при выполнении кардиоверсии надо быть готовым к проведению временной электрокардиостимуляции. Электрическая кардиоверсия противопоказана при интоксикации сердечными гликозидами (имеет смысл отсрочка минимум в 1 неделю, даже в случае обычного приема сердечных гликозидов - без интоксикации), гипокалиемии, острых инфекциях и некомпенсированной недостаточности кровообращения. Так как электрическая кардиоверсия требует общей анестезии, то любое противопоказание к общему обезболиванию является противопоказанием к электрической кардиоверсии. По некоторым наблюдениям, эффективность ЭИТ достигает 94%. Однако во время и после ЭИТ могут развиться серьезные нарушения ритма сердца (асистолия желудочков, синусовая брадикардия, миграция водителя ритма, синусовая аритмия), а также другие осложнения (тромбоэмболии, отек легких, артериальная гипотензия).
Противопоказания для ЭИТ:
1.Частые, кратковременные пароксизмы ФП , купирующиеся самостоятельно или медикаментозно.
2.Постоянная форма ФП :
а/ давность свыше трех лет,
б/ давность не известна.
в/ кардиомегалия,
г/ синдром Фредерика,
д/ гликозидная интоксикация,
е/ ТЭЛА до трех месяцев,
ж/ активный ревматический процесс.
Электрокардиостимуляция показана при бради- и тахи-бради- формах ФП (т.е. при СССУ и при АВ блокадах). Двухкамерная (DDD, при ПФФП) или предсердная (AAI, в том числе с положением электрода в межпредсердной перегородке) стимуляция могут уменьшать частоту возникновения рецидивов. Различные виды ЭКС (в том числе чреспищеводная) редко купируют ФП.
Имплантируемый предсердный кардиовертер-дефибриллятор осуществляет разряды прямого тока с энергией 6 Дж, в ранние сроки (почти сразу) после детекции ФП. С учетом феномена электрофизиологического ремоделирования, раннее купирование ФП не позволяет измениться рефрактерностям предсердий, что уменьшает предпосылки для частого рецидивирования и самоподдерживания ФП. Однако эффективность этого метода и его значение остаются до конца не изученными.
Последние 20 лет можно назвать электрофизиологическим периодом в клинической аритмологии. Благодаря электрофизиологическим исследованиям стало возможным изучение топографии дополнительных проводящих путей сердца у конкретного больного, что открыло новые перспективы для хирургического лечения нарушений ритма. Хирурги-аритмологи внесли значительный вклад в понимание патогенеза сердечных аритмий и открыли новую эру в лечении трудно курабельной мерцательной аритмии, которую не случайно раньше называли "arythmia absoluta".
Еще в начале 80-х годов Сох показал, что фибрилляцию предсердий можно лечить при помощи нескольких надрезов в предсердиях, прерывая таким образом развитие множественной циркуляции возбуждения по типу ре-ентри, являющейся причиной возникновения ФП .
Показаниями для хирургического лечения ФП являются:
а/выраженная клиническая симптоматика;
б/устойчивость к лекарственной терапии;
в/ побочные эффекты ААП .
г/ митральный стеноз.
Хирургические методы в лечении ФП сейчас используются не часто. Среди них выделяют операции хирургической изоляции предсердий, "коридор", "лабиринт". Все они направлены на разрушение множественных колец re-entry, и создание единственного пути ("коридора", "лабиринта") от предсердий к АВ узлу.
Применяются следующие хирургические методы лечения ФП :
"Лабиринтный" метод - в определенных участках предсердий делается несколько разрезов, которые останавливают проведение возбуждения, разрывая "порочный круг". Сократительная функция сердца обычно сохраняется. Эффективность операции достигает 60%.
"Коридорный" метод - изоляция правого и левого предсердия от межпредсердной перегородки . Образуется "коридор" из смежных тканей от синусового до атриовентрикулярного узла. Главный их недостаток то, что они выполняются на "открытом" сердце (общая анестезия, аппарат искусственного кровообращения, холодовая кардиоплегия и вытекающие из этого осложнения и последствия). При необходимости выполнения операции на "открытом" сердце (протезирование клапана или аневризмэктомия) можно одновременно выполнить операцию по поводу ФП. Новая система криоабляции легочных вен (Freezor Cardiac CryoAblation Catheter) показала высокую эффективность при лечении пароксизмальной ФП, устойчивой к медикаментам , и лишена традиционных осложнений радиочастотной катетерной абляции.
По днным исследования STOP AF в течение года синусовый ритм сохранялся у 70% пациентов, против 7,3% при медикаментозном лечении.
Радиочастотная катетерная деструкция (аблация) - прерывается проведение возбуждения по "порочному кругу". По эффективности метод не отличается от "лабиринтного" , но более доступен, поэтому ему отдается предпочтение в последние годы. Радиочастотная абляция мало эффективна или не эффективна при вагусном варианте ПФФП. Однако при вагусном варианте применяют абляцию нервных окончаний парасимпатических нервов.
Интервенционные методы в лечении ФП (трансвенозные катетерные радиочастотные абляции) в настоящее время находят все больше сторонников. Самый простой способ при ФП (широко распространенный еще 3 - 5 лет назад) - это деструкция АВ соединения (создание искусственной АВ блокады и имплантация ЭКС в режиме VVI(R). При этом нарушается физиология сердца, не уменьшается эмболический риск, часто возникает зависимость от ЭКС и проявляются все недостатки VVI режима. Сейчас с целью контроля частоты сокращений желудочков все чаще выполняется модификация АВ проведения без имплантации ЭКС (то есть создается ограничение проведения предсердных импульсов на желудочки). Наиболее перспективной является трансвенозная катетерная абляция re-entry предсердий и/или очагов эктопической активности (по типу операции "лабиринт"). Такая процедура высокоэффективна, но весьма сложна технически и трудоемка. В первую очередь это относится к лицам с синкопальными состояниями на фоне высокой ЧСС, а также имеющим короткий рефрактерный период ДПП (<250 мс). В ряде стран предлагаются более широкие показания к деструкции дополнительных путей предсердно-желудочкового проведения при ФП. Аблация ДПП, как правило, не предупреждает рецидив ФП, но облегчает ее течение и упрощает фармакотерапию аритмии.
Показания для катетерной аблации (HRS/EHRA/ECAS, 2007) [64]
Симптомная ФП c рефрактерностью или непереносимостью по меньшей мере 1 или 3 класса ААП.
В редких случаях возможно выполнить абляцию ФП в качестве первоначальной терапии.
Выбранные пациенты с симптомной ФП и сердечной недостаточностью или сниженной ФВ .
Внимание. Наличие тромбов в ЛП является противопоказанием к катетерной абляции ФП.
При ПФФП достаточно выполнить электрическую изоляцию легочных вен или антральную изоляцию. По данным ХМ ЭКГ положительный результат достигается в 60-85% случаев. Рецидивирующая ФП в 50-70% случаев протекает бессимптомно , что не отменяет приема варфарина. Рецидив ФП объясняется восстановлением проводящей способности легочных вен. Повторная абляция дает 80% успеха. При персистирующей и постоянной форме ФП требуются повторные пошаговые вмешательства. Сначала - изоляция легочных вен. Второй этап - направленная атриальная дефрагментирующая абляция. Третий этап – линейные повреждения на верхушке и устье ЛП. Синусовый ритм восстанавливается в 87-95% случаев. Этот метод лечения носит для больного эспериментальный характер. Осложнения: тампонада перикарда, инсульт, легочные стенозы, свищ между задней стенкой ЛП и передней стенкой пищевода как причина сепсиса [81].
ЧП ЭХОКГ.
Трансторакальная ЭХОКГ не является чувствительным методом изучения УЛП. Чреспищеводная эхокардиография- высокочувствительный метод выявления тромбов УЛП, специфичность которого составляет 98% [74]. Однако, есть сообщения о случаях эмболий при ФП при отсутствии выявляемых ЧП ЭХО тромбов УЛП. Тем не менее, предлагается следующая стратегия:
1.Если ФП существует более 48 часов, а при ЧП ЭХО (непосредственно перед исследованием обязательно вводится гепарин) тромбы УЛП не детектируются, то кардиоверсия фармакологическая или электрическая выполняется через 1-2 суток на фоне гепаринотерапии , то есть можно ускорить проведение кардиоверсии ( исследование ACUTE II)
2.Если при ЧП ЭХО выявляются тромбы ЛП, то назначают на 6 недель ОАК и повторяют ЧП ЭХО (можно неоднократно), а далее… Если тромбы не визиализируются (перестали выявляться при ЧП ЭХО), то выполняется электрическая кардиоверсия, а если сохраняются, то это - противопоказание для кардиоверсии. Компьютерная томография создает 3-D изображение УЛП высокого качества.
ЭФИ. Электрофизиологическое исследование у больных с ПФФП помогает определить механизм развития ФП, что важно при намерении применить катетерную абляцию. Причиной ФП может быть фокус с быстрой импульсацией часто находящийся в области легочных вен (ЛВ), наджелудочковая тахикардия (НЖТ) с правильным ритмом, АВ-узловое ре-энтри или трепетание предсердий (ТП), переходящее в ФП. ЭФИ используется при подозрении на дисфункцию синусового узла (СУ), а также для определения механизма образования широких комплексов QRS при ФП, особенно при быстром желудочковом ритме, для контроля ритма путем катетерной абляции или изменения АВ проведения, а также для отбора больных в плане профилактической имплантации ИВР [27]. Не у всех больных метод ЭФИ позволяет восстановить синусовый ритм.
11. Последствия ФП.
Сама по себе ФП не относится к фатальным нарушениям ритма сердца, связанных с высоким риском внезапной аритмической смерти, в отличие от желудочковых аритмий. Однако здесь имеется одно исключение: ФП у больных с манифестирующим синдромом WPW может привести к чрезвычайно выраженной тахисистолии желудочков и закончиться их фибрилляцией [26].
Дилемма. С одной стороны, формальная логика и прогностически неблагоприятные факторы, связанные с ФП позволяют думать, что сохранение синусового ритма с помощью постоянного приема ААП является предпочтительным. С другой стороны не вызывает сомнений, что удержание синусового ритма с помощью постоянного приема ААП класса I A, I C или III связано с реальной возможностью развития проаритмических эффектов, в том числе и фатальных желудочковых аритмий. В тоже время, отказ от восстановления и удержания синусового ритма, требует проведения постоянной антикоагулянтной терапии, связанной с повышенным риском кровотечений и необходимостью частого контроля уровня антикоагуляции [3]. ФП вызывает снижение качества жизни ( трудоспособность, ощущение сердцебиения, страх смерти, нехватка воздуха и т. д.), нарушение гемодинамики, повышает риск возникновения тромбоэмболий, прежде всего в сосуды мозга. Некоторые из этих осложнений могут представлять определенную опасность для жизни. ФП вызывает выраженные нарушения гемодинамики — уменьшение ударного объема и сердечного выброса примерно на 25 %. Неблагоприятно влиять на гемодинaмику могут 3 фактора: а\ отсутствие синхронной механической активности предсердий, б\ нерегулярность желудочковых сокращений и слишком высокая частота сердечных сокращений, в\ риск развития жизнеугрожающих аритмий . Постоянно высокая частота сокращений предсердий неблагоприятно влияет на их сократительную способность (кардиомиопатия предсердий, вызванная тахикардией ). Эти изменения могут объяснять медленное восстановление сократительности предсердий (оглушение ) после восстановления синусового ритма. Высокая частота сокращений желудочков способна вызвать дилятационную кардиомиопатию. Выраженное снижение сердечного выброса из-за исчезновения систолы предсердий часто возникает у больных с нарушенным диастолическим наполнением левого желудочка ( митральным стенозом, гипертрофией миокарда при АГ , гипертрофической или рестриктивной кардиомиопатией). Нарастание гемодинамических расстройств в таких случаях может сыграть фатальную роль.
Ряд исследований, проведенных у пациентов, страдающих ФП, показал, что нижняя часть межпредсердной перегородки характеризуется выраженным замедлением проведения электрического импульса, что может быть связано с наличием у них аритмии [88]. Установлено, что для больных с ФП характерна негомогенность проведения возбуждения и чрезмерная морфологическая неоднородность предсердий и предсердно-желудочкового соединения [89]. Есть предположения, что указанные характерные нарушения могут быть как следствием, так и причиной ФП [90]. Следует учитывать и угрозу тяжелых системных тромбоэмболий. В целом летальность при ФП возрастает в 2 раза. Причиной ее нередко становится церебральный инсульт, вероятность которого достигает 5% в год даже при неревматической этиологии ФП . По данным Фремингемского исследования ФП в 5 раз повышает вероятность ишемического инсульта , опасность которого нарастает с возрастом .
По данным института мозга во Франции, 50% инсультов мозга возникают вследствие кардиоэмболии, при этом в 40% случаев имеется постоянная или пароксизмальная ФП , 30% таких больных умерли в течение последующих 6 мес (G. Runcural, 1994).
Без постоянного приема ААП после кардиоверсии синусовый ритм сохраняется в течение 1 года у 15–50 % больных.
Заключение.
Нет сомнения в том, что интенсивные исследования в области создания новых ААП , прежде всего III класса, приведут к появлению высокоэффективных препаратов. Недавно опубликованы данные об испытаниях нового российско-германского ААП III класса AL-275 . В настоящее время предпринята попытка синтеза амиодарона, лишенного йода (дронедарон) , хотя следует напомнить: однажды такой препарат был создан под названием L-9394 (Woleffie и соавт., 1973), но оказался неэффективным, что наводит на мысль об интимных механизмах антиаритмического эффекта амиодарона, связанных с участием в аритмогенезе тиреоидных гормонов (?).
По мнению профессора H.Wellens (1997), и в новом тысячелетии аритмологам придется решать такие проблемы, как фибрилляция предсердий, растущее число нарушений насосной функции сердца у пациентов с аритмиями, внебольничная внезапная смерть. В то же время им на помощь придет молекулярная и генетическая аритмология. Высокая частота аритмогенного действия и побочных эффектов ААП позволяют в качестве одного из основных принципов лечения аритмий предложить следующее: «Избегать назначения ААП всегда, когда это возможно» (R. N. Fogoros, 1997).
По заключению экспертов ВОЗ , состояние здоровья населения зависит от следующих причин :
10%- медицинская наука и практическая медицина ( диагностика и лечение ),
20%- наследственность,
20%- состояние окружающей среды (экология, радиция, почва, воздух, вода),
50%- образ жизни (поведение, питание, вредные привычки, физкультура ).
12. Список использованной литературы.
1.Кушаковский М.С. Фибрилляция предсердий . Причины , механизмы, клинические формы / Лечение и профилактика. Ст.- Петербург. Фолиант. 1999. 176. 2. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients WitH Atrial Fibrillation). 3.Сулимов В.А. Методические рекомендации. Алгоритм диагностики и лечения аритмий на догоспитальном этапе. Неотложная терапия. 2004.3.18-28. 4. Relation of C-reactive protein and new-onset atrial fibrillation in patients with acute myocardial infarction. Am J Cardiol 2007 ; 100 (5): 753-7. 5. Эл. Ресурс: www.medafarm.ru . Шевченко Н.М. Мерцательная аритмия . 6. Богданова Е.Я., Шуаева Р., Рыжова Т.В., Шевченко Н.М. Мерцательная аритмия . 7. Мазур Н.А. Фибрилляция предсердий . 8. Levy S, Novella P, Ricard PL. J Cardiovasc Electrophysiol. 1995; 6: 69-74. 9. ACC/AHA/ESC Guidelines for the Management of Patients With Atrial Fibrillation: Executive Summary. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients With Atrial Fibrillation). Developed in Collaboration With the North American Society of Pacing and Electrophysiology. JACC 2001; 38: 1231-1265. 10. Мрочек А.Г. Применение этацизина в лечении сердечных аритмий. Бел МАПО. 11. Tsaknakis T.K. et al. Hellenic J of Cardiology 1999; 40/5: 408-412 . 12. Преображенский Д.В. Медикаментозное лечение мерцания предсердий - стр. 117 . 13. Многоцентровое исследование SATE, 1999 3.G Boraini et al., 1997. 4. A. Capucci et al., 1999. 14. Miller J., Zipes D. Management of the patient with cardiac arrhithmias. A textbook of cardiovascular medicine. Philadelphia: W.B.Saunders company. 2001. P. 731-736. 15. Botto G., Bonini W., Broffoni T. Et al. Conversion of recent onset atrial fibrillation with single loading oral dose of propafenone // Pacing Clin Electrophysiol 1996;19:1939-1943 . 16. Capucci A., Boriani G., Botto G. Et al. Conversion of recent-onset atrial fibrillation by a single oral loading dose of propafenone or flecainide // Am J Cardiol 1994; 74: 503-505. 17. Boriani G., Capucci A., Lenzi T. Et all. Propafenone for conversion of recent-onset atrial fibrillation: a controlled comparison between oral loading dose and intravenous administration // Chest 1995; 108: 355-358 . 18. Замотаев Ю.Н., Кремнев Н.А., Гриненко С.Е. Оценка антиаритмической эффективности препарата аллапинин у больных ИБС с нарушениями ритма сердца . 19. Toubout P., Brugada J. ,Capucci A. Dronedarone for prevention of atrial fibrillation : A dose-ranging study.- Europ Heart L, 2003: 24: 481-1487) . 20. Руда М.Ю., Меркулова И.Н., Тарарак А.Э. и др. Клиническое изучение нового антиаритмического препарата III класса нибентана. Сообщение 1. Исследование переносимости. Кардиология 1995;9:4-15. 21. Меркулова И.Н., Тарарак А.Э., Коткин К.Л. и др. Клиническое изучение нибентана - нового антиаритмического препарата III класса. Сообщение 3. Эффективность нибентана у больных с желудочковыми нарушениями ритма, аритмогенные эффекты. Кардиология 1997;4:14-19. 22. Руда М.Я., Меркулова И.Н., Тарарак А.Э. и др. Клиническое изучение нибентана - нового антиаритмического препарата III класса. Сообщение 2. Эффективность препарата у больных с суправентрикулярными нарушениями ритма. Кардиология 1996;6:28-35. 23. Сулимов В.А., Гиляров М.Ю. Применение нового отечественного антиаритмического препарата III класса нибентана для устранения пароксизмальной формы фибрилляции предсердий. Рос. Кард. Журн. 2002;6:49-55. 24. Попов С.В., Аубакирова Г.А., Антонченко И.В. и др. Эффективность антиаритмического препарата III класса нибентана у больных с фибрилляцией предсердий. Вестн аритмол 2003;31:10-14. 25. Шубик Ю.В., М. М. Медведев А. Е. Ривин. Нибентан: препарат для фармакологической кардиоверсии при персистирующей фибрилляции предсердий. Www.mediasphera.ru . 26. Миллер О.Н., Белялов Ф.И. Фибрилляция предсердий. Тaктика ведения пациентов на догоспитальном, стационарном и амбулаторном этапах // Рос. Кард. Журнал. 2009. 4. C. 94-111. 27. ДИАГНОСТИКА И ЛЕЧЕНИЕ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ. Рекомендации Рабочей группы по нарушениям сердечного ритма Украинского научного общества кардиологов. Киев, 2009 г. 28. Finkle JK, Plunkitt K, Kowey PR. Pharmacologic management of atrial fibrillation. In Ganz LI, Braunwald E. (eds). Management of cardiac arrhythmias . 2004; p. 97–162. 29. Mittal S., Ayati S., Stein K.S. et al. Transthoracic cardioversion of atrial fibrillation: comparison of rectilinear biphasic versus damped sine wave monophasic shicks. Circulation 2000;101: 1282-1287. 30. Olgin EJ, Zipes DP. Specific arrhythmias: diagnosis and treatment. In Braunwald E, Zipes D, Libby P, Bonow R (eds.). Heart disease. Saunders Company 2005; p. 803–63. 31. Бунин Ю.А. Неотложная терапия пароксизмальных тахиаритмий. М.: «Прогресс-Традиция», 2005; 67–74 . 32. Costantini O, Stambler B. Approach to the patient with atrial fibrillation. In Ganz LG, Braunwald E (eds.). Management of cardiac arrhythmias. Humana Press 2004; 75–96. 33. Mathew JP, Fontes ML, Tudor IC et al. A multicentr risk index for atriаl fibrillation after cardiac surgery. JAMA 2004; 291: 1720–9. 34. Daoud EG, Strickberger SA, Man KC et al. Preoperative amiodarone as prophylaxis against atrial fibrillation after heart surgery. N Engl J Med 1997; 337: 1785–91. 35. Khan IA, Mehta NJ, Gowda RM. Amiodarone for pharmacological cardioversion of recent-onset atrial fibrillation. Int J Cardiol 2003; 89: 239–48. 36. Khan IA. Single oral loading dose of propafenone for pharmacological cardioversion of recent-onset atrial fibrillation. JACC 2001; 37: 542–7. 37. Bunin Yu, Anfalova L. Efficacy of propafenone as single oral loading dose in pharmacology converting recent-onset atrial fibrillation and atrial flutter. Europace 2005; 7 (Supplement 1): 121–2. 38. Розенштраух Л.В., Руда М.Я., Голицын С.П., Майков Е.Б. Новый отечественный антиаритмический препарат III класса нибентан: от экспериментальных исследований к клинической практике. Кардиология. 2003; 43: 66–8. 39. Бунин Ю.А. Фармакологическая и электрическая кардиоверсия фибрилляции предсердий . 40. Корнелюк И. В., Никитин Я. Г. Методика подбора антиаритмических препаратов при мерцательной аритмии с учетом динамики ВРС.Мед.панорама.2003.8. 41 . Кушаковский М.С. Фибрилляция предсердий (причины, механизмы, клинические формы, лечение и профилактика). Спб. "Фолиант". 1999. 176 с. 42. Кушаковский М.С. Аритмии сердца: Руководство для врачей. – С-Пб.: Фолиант, 1998. – 640 с. 43. Лещинский Л.А., Тюлькина Е.Е. Фармакологическое лечение фибрилляции предсердий. В кн. Егоров Д.Ф., Лещинский Л.А., Недоступ А.В., Тюлькина Е.Е. "Мерцательная аритмия: стратегия и тактика лечения на пороге XXI века". Спб. Ижевск. М. 1998. С.15-82. 44. Avram R., Cristodorescu R., Darabantin D. Et al. The Medical Treatment of Reccurent Atrial Fibrillation // Eur. J.C.P.E. 1996. Vol.133. N6. Suppl.1. P.8. 45. Барт Б.Я., Смирнова О.Л., Ларин В.Г., Морозовская Л.А. // Кардиология. 1997. Т.37. N3. С. 33-36. 46. Антонченко И.В., Попов С.В., Савенкова Г.М. // Кардиостим-98. Тезисы докладов. Спб. Вестник аритмологии. 1998. N8. С.53. 47. Бокерия Л.А., Борисов К.В. // Кардиостим-98. Тезисы докладов. Спб. Вестник аритмологии. 1998. N8. С. 93. 48. Бокерия Л.А., Ревишвили А.Ш., Свешников А.В. // Кардиостим-1993. Тезисы докладов. Спб. С. 58. 49. Задионченко В.С ., Мартынова Л.Н., Тимофеева Н.Ю., Вариабельность СР в оценке прогрессирования СН и эффективности терапии ИАПФ. Серд. Недостаточность. 2000. 5. 215 - 217. 50. Maggioni et al. Am Heart J 2005 ,149.548-557. 51. Бойцов С.А., Колос И.П . К вопросу о месте блокаторов рецепторов ангиотензина 11 в лечении АГ .Рациональная фармакотерапия в кардиологии 2008.4 . Www.medi.ru. 52. Dahlof B., Devereux R.S. ,Kjeldsen S.E. Lancet 2002, 359. 995-1003 . 53. Den Ruijter HM et al. Circulation 2008, 117.536-544. 54. Marchioli R. Et al. Circulation 2002, 105. 1897-1903. 55. GISSI-Prevenzione Invectigitirs. Dietary supplementation with n-3 polyunsaturated fattyacids and vitamin E after myocardial infarction : results of the GISSI-Prevenzione trial. Lancet 1999;384: 447-455 ).
56. Mozaffarian D., Geelen A., Brouwer I.A. et al. Effect of Fish Oil on Heart Rate in Humans: A Meta-Analysis of Randomized Controlled Trials // Circulation, September 27, 2005; 112(13): 1945-1952. 57.Mclennan PL. Myocardial membrane fatty acids and antiarrhythmic actions of dietary fish oil in animal models // Lipids. 2001; 36: 111S-114S . 58. Townend JN, West JN, Davies MK, Littles WA .Effect of quinapril on blood pressure and heart rate in congestive heart failure.Am J Cardiol 1992; 69: 1587-90. 59. Binkley PF, Haas GJ, Starling RC et al.Sustained augmentation of parasympathetic tone with angiotensin converting enzyme inhibitor in patients with congestive heart failure.J Am Coil Cardiol 1993; 21: 655-61. 60. Татарский Б.А. Стратегия «таблетка в кармане» при купировании фибрилляции предсердий // Российский кардиологический журнал. – 2005. – № 5. – С. 72-75. 61. Antiarrhythmic Therapy: A Pathophysiologic Approach by Members of the Sicilian Gambit, Armonk NY: Fimira Publishing Company 1994; ISS-93. 62. Макаров И.М., Холтеровское мониторирование. М. 2008 ,стр. 315 . 63.Электронный ресурс: http://www.webmed.irkutsk.ru/doc/pdf/af1a.pdf. Диагностика и лечение фибрилляции предсердий, ВНОК . 64.Электронный ресурс : www. Therapy.irkutsk.ru/my/book/arrhyth8.pdf. Белялов Ф.И. Аритмии сердца. Ирк.2011. 65.Электронный ресурс: http:// www.practica.ru /SMM / 0205 / 0205part3. Pdf. 66.Электроный ресурс: Ройтберг Г. Е. Струтынский А. В. Внутренние болезни . Http://medbook. Medicina. Ru/chapter. Php? Id_ level= 82. 67. Kochiadakis G.E., Igoumenidis N.E., Hamilos M.I. et al. Long-term maintenance of
Normal sinus rhythm in patients with current symptomatic atrial fibrillation: amiodarone vs
Propafenone: both in low doses // Chest. – 2004. – Vol. 125. – P. 377–383. 68. Электронный ресурс: http://smed.ru/guides/43287/#1001 ). 69. Электронный ресурс: www.medi.ru. Бойцов С.А., Колос И.П. К вопросу о месте БРА II в лечении АГ. Рац. Фармакотерапия в кард.2008,4. 70.Pitt B. Regression of Left Ventricular Hypertrophy in Patients With Hypertension. Blockade of the Renin-Angiotensin-Aldosterone System. Circulation 1998;98:1987-1989.
71.Эл.ресурс. http://www.vestar.ru/article.jsp?id=2505. Шварц, Ю. Г., Салеева, Е. В., Кузнецова, Л. И. ЛОЗАРТАН В ЛЕЧЕНИИ БОЛЬНЫХ ПАРОКСИЗМАЛЬНОЙ МЕРЦАТЕЛЬНОЙ АРИТМИЕЙ, СОЧЕТАЮЩЕЙСЯ С АРТЕРИАЛЬНОЙ ГИПЕРТОНИЕЙ. 72.Электронный ресурс: http://www.escardio.org/communities/councils/ccp/e-journal/volume9/Pages/clinical-relevance-pharmacogenetics-warfarin-pavel-poredos-jezovnik.aspx Poredos, P., Jezovnik, M.K. Clinical relevance of the pharmacogenetics of warfarin . An article from the e-journal of the ESC Council for Cardiology Practice. 73. Е.С. Кропачёва, Е.П. Панченко, А.Б. Добровольский, М.А. Саидова. РЕЗИСТЕНТНОСТЬ К ВАРФАРИНУ У БОЛЬНОЙ С АБСОЛЮТНЫМИ ПОКАЗАНИЯМИ К ПРИЕМУ АНТАГОНИСТОВ ВИТАМИНА К. 74. Е.П.Панченко. Профилактика инсульта у больных мерцательной аритмией. Consilium medicum. Том 05/N 11/2003. 75. Lloyd-Jones D, Adams RJ, Brown TM, et al. Heart disease and stroke statistics —2010 update: a report from the American Heart Association. Circulation. 2010; 121: E46-E215. 76. Guidelines for the management of atrial Fibrillation. The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). European Heart Journal (2010) 31, 2369–2429 doi:10.1093/eurheartj/ehq278. 77.Электронный ресурс: http://www.accessdata.fda.gov/ drugsatfda_docs/ label/ 2010 / 009218s108lbl.pdf. 78.Электронный ресурс: pt.wkhealth.com/.../dyslipidaemia/fulltext. 00007536- 200935050-00007.htm; In the Warfarin and Antiplatelet Therapy in Chronic Heart Failure (WATCH).
79.
Электронный
ресурс:
http://www. thrombosisadviser.com/en/ current-treatments/
anticoagulants/index.php.
80.
Электронный
ресурс:
http://ardashev-arrhythmia.
ru/ files/ 189/ src. Pdf. .
АРДАШЕВ
А.В.,
Е.Г.
ЖЕЛЯКОВ,
А.А.
ШАВАРОВ,
А.В.
КОНЕВ,
С.В.
ВОЛОШКО,
О.Ю.
ВРУБЛЕВСКИЙ,
М.С.
РЫБАЧЕНКО.
Типичное
трепетание предсердий: классификация,
клинические проявления, диагностика
и лечение.
81.
Гоффманн
Б., Вильке И., Древитц И., Стевен Д., Росток
Т., Виллемс С.. Рациональная терапия
мерцания предсердий в интенсивной
медицине. Кардиология,
№8, 2010.
82.
Roberto
Fogari,
Annalisa
Zoppi,
Amedeo
Mugellini.
Comparative evaluation of effect of valsartan/amlodipine and
atenolol/amlodipine combinations on atrial fibrillation recurrence in
hypertensive patients with type 2 diabetes mellitus. J.
cardiovasc
pharm
51(3):217-22
(2008).
http://pubget.com/paper/18356684.
83. Nieuwlaat
R et al. European Heart Survey Investigators. Atrial fibrillation
management: a prospective survey in ESC member countries: the Euro
Heart Survey on Atrial Fibrillation. Eur
Heart
J.
2005; 26(22): 2422-34.
84. Макаров
Л.М., Комолятова В.Н.
![]() Появление
электрокардиографических признаков
синдрома Бругада на фоне терапии
антиаритмическим препаратом I С класса
этацизином
. Кардиология,
2011.-N 4.-С.93-95.
85. Мамедов
М.Н., Канорский С.Г., Концевая А.В. 17-й
Европейский конгресс кардиологов:
краткий отчет и обзор крупных клинических
исследований : Кардиология. - М., 2011. -
Т. 51, N 4. - С. 56-64 .
86. Бойцов
С.А. Актуальность проблемы. В кн.
Мерцательная аритмия /Под ред. Бойцова
С.А. - СПб.: ЭЛБИ-СПб., 2001. - С. 7-18.
87. Шейх-Заде
Ю.Р., Чередник И.Л., Галенко-Ярошевский
П.А. Значение нейротропного компонента
в терапевтическом действии антиаритмических
средств // Бюл. Экспер. Биол. и Мед. 1999.
-Т.127,№3.-С. 353-356.
88. Atrioventricular
plane displacement correlates closely to circulatory, dimensions but
not to ejection fraction in normal young subjects / C.J. Carlhall, L.
Lindstrom, B. Wranne, E. Nylander // Clin Physiol. 2006:
- Vol. 21.-№5.-P. 621-628.
89. Potential
pitfalls in strain rate imaging: angle dependency / P.L. Castro, N.L.
Greenberg, J. Drinko et al. // Biomed. Sci.
Instrum. 2000. -Vol. 36.-P. 197-202.
90. Лупанов,
В.П. Прогноз больных коронарной болезнью
сердца .
91. Braunwald
E. Heart disease: a textbook of cardiovascular medicine// -W.B.
Saunders Co. 1997. - P. 654-656.
92.
Глиган Л.И.
Опыт лечения кордароном и дигоксином
мерцательной аритмии / Л.И. Глиган, И.В.
Оль, Л.А. Шмелева // Клин. Мед. -1990.-№2. с.
46-48.
93.
Преображенский Д.В. Фибрилляция
предсердий: выбор способа фармакологической
кардиоверсии / Д.В. Преображенский и др.
// Кардиология.- 2005.- Т.45, № 2. С.72 - 80.
94. Ревишвили А.Ш. Особенности клинической
электрофизиологии легочных вен у
пациентов с пароксизмальной формой
фибрилляциипредсердий / А.Ш Ревишвили.,
Г.Г. Имнадзе, Е.В. Любкина // Вестн.
Аритмологии.- 2003.- № 34 С. 5-10.
95. Провоторов
В.М. Анализ клинической эффективности
антиаритмической и антитромботической
терапии персистирующей фибрилляции
предсердий / В.М. Провоторов, Е.Ю Блащенко.
/ Системный анализ и управление в
биомедицинских системах.-2007.-Т.6,№1-
С.71-74.
96. Wojakowsky
W.
Percutaneous
closure of left atrial appendage in patients with atrial fibrillation
: An overview . An
article from the e-journal of ESC Council for Cardiology Practice .
97.
Firouzi M, Ramanna H, Kok B, Jongsma HJ, Koeleman BP, Doevendans PA,
Groenewegen WA, Hauer RN. Association
of human connexin40 gene polymorphisms with atrial vulnerability as a
risk factor for idiopathic atrial fibrillation.
Circ Res. 2004
Aug 20;95(4): e29-33. Epub 2004 Aug 5.
98. Calo L, Bianconi
L, Colivicchi F, Lamberti F, Loricchio ML, de RE, Meo A, Pandozi C,
Staibano M, Santini M. 2005. N-3 Fatty acids for the prevention of
atrial fibrillation after coronary artery bypass surgery: a
randomized, controlled trial. Journal of the American College of
Cardiology. 2005. 45:1723-1728.
99. Bacova B, Radosinska J, Knezl V, Kolenova L, Weismann P, Navarova
J, Barancik M, Mitasikova M, Tribulova
N. Omega-3
fatty acids and atorvastatin suppress ventricular fibrillation
inducibility in hypertriglyceridemic rat hearts: implication of
intracellular coupling protein, connexin-43.
J
Physiol Pharmacol.
2010 Dec;61(6):717-23.
100.
Funck–Brentano C, Becquemont L, Leneveu A, et al. Inhibition by
omeprazole of proguanil metabolism: mechanism of the interaction in
vitro and prediction of in vivo results from the in vitro
experiments. J
Pharm Exp Ther 1997; 280: 730–8.
101. Mehra
R,
Stone
KL,
Varosy
PD,
Hoffman
AR,
Marcus
GM
et al. Nocturnal
Arrhythmias across a spectrum of obstructive and central
sleep-disordered breathing in older men: outcomes of sleep disorders
in older men (MrOS sleep) study.
. Arch
Intern Med.
2009 Jun 22;169(12):1147-55. 102. Christian
Torp-Pedersen; Harry J.G.M. Crijns; Christophe Gaudin; Richard L.
Page; Stuart J. Connolly; Stefan H. Hohnloser. . Impact of
Dronedarone on Hospitalization Burden in Patients With Atrial
Fibrillation. Results From the ATHENA Study.
102. . Ребеко
Е.С. Роль
ИПАФ рамиприла
в профилактике
рецидивов пароксизмов
мерцательной аритмии.
ARS MEDICA.8.2011.с.109-112.
103. Simopoulos
AP.
The
importance of the ratio of omega-6/omega-3 essential fatty acids.
Biomed
Pharmacother. 2002
Oct;56(8):365-79.
104.
Булгак А. Г. Влияние
степени митральной регургитации на
тромбообразование у больных ИБС с
мерцательной аритмией.
Новости
лучевой диагностики 2001 1-2: 68-69.
Появление
электрокардиографических признаков
синдрома Бругада на фоне терапии
антиаритмическим препаратом I С класса
этацизином
. Кардиология,
2011.-N 4.-С.93-95.
85. Мамедов
М.Н., Канорский С.Г., Концевая А.В. 17-й
Европейский конгресс кардиологов:
краткий отчет и обзор крупных клинических
исследований : Кардиология. - М., 2011. -
Т. 51, N 4. - С. 56-64 .
86. Бойцов
С.А. Актуальность проблемы. В кн.
Мерцательная аритмия /Под ред. Бойцова
С.А. - СПб.: ЭЛБИ-СПб., 2001. - С. 7-18.
87. Шейх-Заде
Ю.Р., Чередник И.Л., Галенко-Ярошевский
П.А. Значение нейротропного компонента
в терапевтическом действии антиаритмических
средств // Бюл. Экспер. Биол. и Мед. 1999.
-Т.127,№3.-С. 353-356.
88. Atrioventricular
plane displacement correlates closely to circulatory, dimensions but
not to ejection fraction in normal young subjects / C.J. Carlhall, L.
Lindstrom, B. Wranne, E. Nylander // Clin Physiol. 2006:
- Vol. 21.-№5.-P. 621-628.
89. Potential
pitfalls in strain rate imaging: angle dependency / P.L. Castro, N.L.
Greenberg, J. Drinko et al. // Biomed. Sci.
Instrum. 2000. -Vol. 36.-P. 197-202.
90. Лупанов,
В.П. Прогноз больных коронарной болезнью
сердца .
91. Braunwald
E. Heart disease: a textbook of cardiovascular medicine// -W.B.
Saunders Co. 1997. - P. 654-656.
92.
Глиган Л.И.
Опыт лечения кордароном и дигоксином
мерцательной аритмии / Л.И. Глиган, И.В.
Оль, Л.А. Шмелева // Клин. Мед. -1990.-№2. с.
46-48.
93.
Преображенский Д.В. Фибрилляция
предсердий: выбор способа фармакологической
кардиоверсии / Д.В. Преображенский и др.
// Кардиология.- 2005.- Т.45, № 2. С.72 - 80.
94. Ревишвили А.Ш. Особенности клинической
электрофизиологии легочных вен у
пациентов с пароксизмальной формой
фибрилляциипредсердий / А.Ш Ревишвили.,
Г.Г. Имнадзе, Е.В. Любкина // Вестн.
Аритмологии.- 2003.- № 34 С. 5-10.
95. Провоторов
В.М. Анализ клинической эффективности
антиаритмической и антитромботической
терапии персистирующей фибрилляции
предсердий / В.М. Провоторов, Е.Ю Блащенко.
/ Системный анализ и управление в
биомедицинских системах.-2007.-Т.6,№1-
С.71-74.
96. Wojakowsky
W.
Percutaneous
closure of left atrial appendage in patients with atrial fibrillation
: An overview . An
article from the e-journal of ESC Council for Cardiology Practice .
97.
Firouzi M, Ramanna H, Kok B, Jongsma HJ, Koeleman BP, Doevendans PA,
Groenewegen WA, Hauer RN. Association
of human connexin40 gene polymorphisms with atrial vulnerability as a
risk factor for idiopathic atrial fibrillation.
Circ Res. 2004
Aug 20;95(4): e29-33. Epub 2004 Aug 5.
98. Calo L, Bianconi
L, Colivicchi F, Lamberti F, Loricchio ML, de RE, Meo A, Pandozi C,
Staibano M, Santini M. 2005. N-3 Fatty acids for the prevention of
atrial fibrillation after coronary artery bypass surgery: a
randomized, controlled trial. Journal of the American College of
Cardiology. 2005. 45:1723-1728.
99. Bacova B, Radosinska J, Knezl V, Kolenova L, Weismann P, Navarova
J, Barancik M, Mitasikova M, Tribulova
N. Omega-3
fatty acids and atorvastatin suppress ventricular fibrillation
inducibility in hypertriglyceridemic rat hearts: implication of
intracellular coupling protein, connexin-43.
J
Physiol Pharmacol.
2010 Dec;61(6):717-23.
100.
Funck–Brentano C, Becquemont L, Leneveu A, et al. Inhibition by
omeprazole of proguanil metabolism: mechanism of the interaction in
vitro and prediction of in vivo results from the in vitro
experiments. J
Pharm Exp Ther 1997; 280: 730–8.
101. Mehra
R,
Stone
KL,
Varosy
PD,
Hoffman
AR,
Marcus
GM
et al. Nocturnal
Arrhythmias across a spectrum of obstructive and central
sleep-disordered breathing in older men: outcomes of sleep disorders
in older men (MrOS sleep) study.
. Arch
Intern Med.
2009 Jun 22;169(12):1147-55. 102. Christian
Torp-Pedersen; Harry J.G.M. Crijns; Christophe Gaudin; Richard L.
Page; Stuart J. Connolly; Stefan H. Hohnloser. . Impact of
Dronedarone on Hospitalization Burden in Patients With Atrial
Fibrillation. Results From the ATHENA Study.
102. . Ребеко
Е.С. Роль
ИПАФ рамиприла
в профилактике
рецидивов пароксизмов
мерцательной аритмии.
ARS MEDICA.8.2011.с.109-112.
103. Simopoulos
AP.
The
importance of the ratio of omega-6/omega-3 essential fatty acids.
Biomed
Pharmacother. 2002
Oct;56(8):365-79.
104.
Булгак А. Г. Влияние
степени митральной регургитации на
тромбообразование у больных ИБС с
мерцательной аритмией.
Новости
лучевой диагностики 2001 1-2: 68-69.
105. Rikitake Y, Kawashima S, Takeshita S, et al. Anli-oxidative properties of fluvastatin, an HMG-CoA reductase inhibitor, contribute to prevention of atherosclerosis in cholesterol-fed rabbits. Atherosclerosis 2001:154:87-96.
106. Shiroshita-Takeshita A, Brundel BJ, Burstein B. et al. Effects of simvastatin on the development of the atrial fibrillation substrate in dogs with congestive heart failure. Cardiovasc Res. 2007 Apr 1;74(1):75-84. Epub 2007 Jan 11.
Top of Form
Top of Form
Пособие для врачей
Раповец Валерий Александрович
Пароксизмальная форма фибрилляции предсердий
Перепечатка без разрешения автора запрещена.
( rapovets@tut.by )
