
6 курс / Кардиология / Джон_Кэмм_Болезни_сердца_и_сосудов_2011
.pdf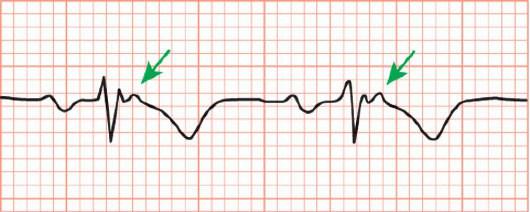
отведениях V1-V3, превышающую 25 мс от его продолжительности в отведении V6, следует расценивать как волну эпсилон [200].
Рис. 18.24. ЭКГ пациента с аритмогенной кардиомиопатией: инверсия зубца Т и эпсилонволна в отведении V1.
"Золотой стандарт" диагностики АКМП - рентгеноконтрастная вентрикулография ПЖ. Обнаруживают характерную дилатацию ПЖ в сочетании с региональными нарушениями сократительной способности или дискинезией по типу выпячиваний и аневризм в области выходного тракта ПЖ, верхушки или трикуспидального клапана. Эти же признаки, имеющие специфичность 90%, можно обнаружить и с помощью таких неинвазивных методов исследования, как МРТ сердца и ЭхоКГ. МРТ позволяет точно охарактеризовать функцию и анатомию ПЖ, но этот метод имеет ограниченные диагностические возможности. Например, невозможно оценить точный размер утолщения свободной стенки ПЖ и количество жировой ткани по сравнению с ее обычным содержанием в эпикарде и перикарде (рис. 18.25). В настоящее время ЭхоКГ - наиболее ценный метод, поскольку позволяет провести дифференциальную диагностику, исключить другие заболевания сердца, уточнить функциональную способность ПЖ и ЛЖ и обнаружить их структурные аномалии. ЭхоКГ широко применяют для ранней диагностики прогрессирования заболевания, а также для скринингового обследования членов семьи пациента. При малых формах АКМП локализацию структурных изменений ПЖ обнаружить достаточно сложно. К сожалению, незначительные отклонения от нормы можно не диагностировать даже при использовании всех методов исследования.
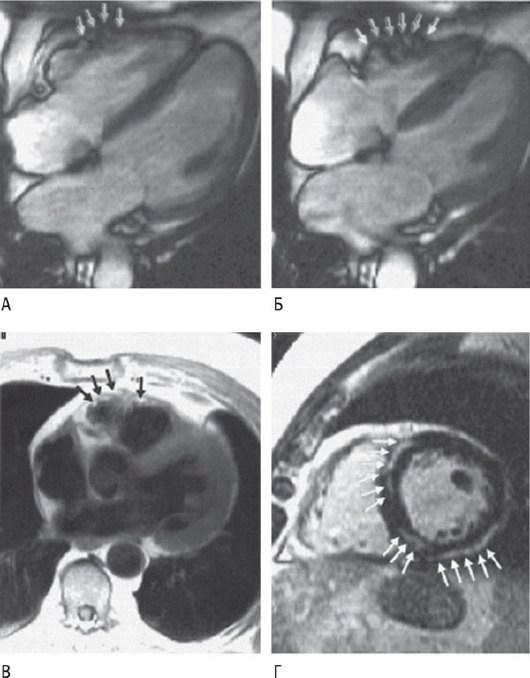
Рис. 18.25. Магнитно-резонансная томография сердца, выполненная больному в возрасте 72 лет с аритмогенной кардиомиопатией: четырехкамерная позиция в диастоле (А) и систоле (Б). Визуализируются диффузные региональные нарушения движения стенок на путях оттока с аневризматическими изменениями свободной стенки желудочка (стрелка). На короткой оси (В) видна жировая ткань миокарда (черные стрелки). На последнем изображении (Г) заметны фиброзные изменения (белые стрелки) в МЖП, в том числе в ее нижних отделах, а также в области нижнелатеральной стенки ПЖ. Источник (с разрешения):
Sen-Chowdhry S.K., Prasad S., Syrris P. et al. Cardiovascular magnetic resonance in arrhythmogenic right ventricular cardiomyopathy revisited // J. Am. Coll. Cardiol. - 2006. - Vol. 48. - P. 2132-2140.
Обнаружение типичных гистологических изменений in vivo при АКМП с помощью эндомиокардиальной биопсии имеет определенную диагностическую ценность, но ограничено низкой чувствительностью метода (особенно при невыраженных формах АКМП). Эндомиокардиальная биопсия не может подтвердить трансмуральное замещение миокарда жировой или фиброзно-жировой тканью. Более того, фокальные или сегментарные изменения, отсутствие вовлечения в патологический процесс МЖП и естественное присутствие жировой ткани у пожилых пациентов может привести к гипердиагностике заболевания на основании результатов

прогнозировать сложно, особенно у асимптомных молодых людей и атлетов. В настоящее время отсутствуют рекомендации о назначении профилактического лечения пациентам с установленным диагнозом АКМП, минимальными клиническими симптомами или морфологическими изменениями. Асимптомные пациенты с высоким риском возникновения ВСС имеют отягощенный семейный анамнез, желудочковые нарушения ритма в детском или подростковом возрасте или во время занятий спортом, обмороки или вовлечение в патологический процесс ЛЖ. Прогностическая ценность ЭКГ, ХМ, нагрузочных тестов и сигнал-усредненной ЭКГ в качестве предиктора ВСС невысока. Пациентов с клиническими симптомами необходимо обследовать более тщательно и при необходимости проводить ангиографию ЛЖ, программируемую желудочковую стимуляцию и эндомиокардиальную биопсию.
ЛЕЧЕНИЕ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Лечение тяжелой правожелудочковой или бивентри-кулярной систолической дисфункции включает постоянную терапию СН, в том числе применение иАПФ или антагонистов рецепторов ангиотензина I, β-адренобло-ка-торов, диуретиков, сердечных гликозидов, антагонистов альдостерона и прием внутрь антикоагулянтов. Пациентам с рефрактерной ХСН можно рекомендовать трансплантацию сердца.
ЛЕЧЕНИЕ НАРУШЕНИЙ РИТМА
В связи с тем что риск возникновения ВСС у пациентов с АКМП прогнозировать достаточно трудно, медикаментозное лечение и другие методы устранения нарушений ритма подбирают каждому пациенту индивидуально. У больных с сохраненной систолической функцией желудочка лечение гемодинамически незначимых и нежизнеугрожающих желудочковых нарушений ритма включает эмпирическое назначение амиодарона, β-адрено-блокаторов или пропафенона. У пациентов с дисфункцией ЛЖ медикаментозное лечение ограничено использованием амиодарона, возможно, в комбинации с антиаритмическими препаратами I класса или β-адрено-блокаторами.
Установка ИКД - метод выбора в случае, если в анамнезе у пациента есть обмороки, остановка сердца, ЖТ или указания в семейном анамнезе на ВСС.
В связи с тем что при прогрессировании заболевания новые проаритмогенные очаги возникают постоянно, частота рецидива ЖТ после катетерной абляции превышает 50%. Тем не менее в случае неэффективности медикаментозного лечения мономорфная ЖТ успешно поддается коррекции методом радиочастотной абляции.
ПРОГНОЗ И ИСХОД
Бивентрикулярное диспластическое поражение сердца, приводящее к значительному нарушению функции ЛЖ и имитирующее ДКМП, обнаруживают достаточно редко. У части больных прогрессирующая недостаточность ПЖ и желудочковые нарушения ритма могут быть серьезной проблемой. В отсутствие лечения у большинства пациентов устойчивые и неустойчивые ЖТ могут присутствовать в течение многих лет и перейти в ФЖ, приводя к ВСС (частота - 1-2% в год) [196,
204].
НЕКЛАССИФИЦИРУЕМАЯ КАРДИОМИОПАТИЯ: НЕКОМПАКТНЫЙ МИОКАРД ЛЕВОГО ЖЕЛУДОЧКА
Некомпактный миокард ЛЖ (НМЛЖ) - генетически обусловленное поражение миокарда, манифестирующее СН, нарушениями ритма, тромбоэмболиями и ВСС. В качестве отдельной нозологической формы НМЛЖ выделили относительно недавно. Для этого заболевания характерны следующие структурные изменения.
• Двухслойный миокард с тонким компактным слоем, соседствующим с эпикардом, и тонким некомпактным слоем, расположенным рядом с эндокардом (рис. 18.26). Стенка желудочка на всем протяжении выглядит значительно истонченной. Указанные диагностические критерии основаны на измерении максимальной конечно-систолической толщины некомпактного (N) и компактного (C) слоев миокарда. Диагноз подтверждают в том случае, если соотношение слоев N и C ≥2 у взрослых и ≥1,4 у детей [227]. Показатель X/Y, характеризующий соотношение между глубиной межтрабекулярных карманов (Х) и общей толщиной стенки (Y), у пациентов с НМЛЖ значительно повышен по сравнению с нормой. Попытка дифференцировать в миокарде два слоя в конце диастолы может вызвать некоторое затруднение [228].
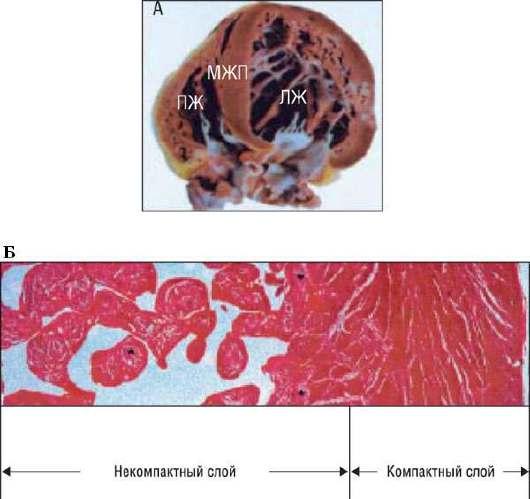
Рис. 18.26. Анатомические изменения (A) у пациента с некомпактным миокардом ЛЖ в области задненижней стенки: можно выделить два структурных слоя стенки - более плотный со стороны эпикарда и утолщенный некомпактный слой со стороны эндокарда. При гистологическом исследовании (Б) также обнаружены два слоя - компактный внешний и некомпактный внутренний. Изменено (с разрешения): Jenni R., Oechslin E., Schneider J. et al. Echocardiographic and pathoanatomical characteristics of isolated left ventricular noncompaction: a step towards classification as a distinct cardiomyo-pathy // Heart. - 2001. - Vol. 86. - P. 666-671.
•Рельефная и чрезмерная трабекулярность в некомпактном слое миокарда (три трабекулы и более).
•Глубокие межтрабекулярные карманы, которые заполняются кровью прямо из ЛЖ, что можно обнаружить при цветной допплерографии.
•Преимущественная локализация некомпактного слоя в боковой, верхушечной и (или) нижней стенке ЛЖ. Сегментарное поражение ЛЖ преобладает над диффузным. В отличие от этого, для здорового сердца характерна выраженная трабекулярность в зон, располагающейся между свободной стенкой ЛЖ и МЖП [229].
По этим признакам можно отличить НМЛЖ от повышенной трабекулярности, которая может быть вариантом нормы и существовать при таких заболеваниях, как артериальная гипертензия, клапанные аномалии или ДКМП. Дилатация желудочка и (или) систолическая дисфункция - достаточно частые находки, но их обнаружения недостаточно для установления диагноза.
ЭТИОЛОГИЯ И РАСПРОСТРАНЕННОСТЬ
Следует отметить, что по сравнению с другими КМП НМЛЖ гораздо чаще принимают за другие патологические изменения, такие как ГКМП, ДКМП или тромб в области верхушки ЛЖ [230]. Диагностика заболевания стала возможна только с внедрением в практику ЭхоКГ, позволившей различить два слоя миокарда. Порой бывает достаточно сложно отличить трабекулярность от гипертрофии миокарда, особенно при использовании аппаратов с низким ультразвуковым
разрешением. Наоборот, выраженную трабекулярность и ложные хорды ошибочно принимают за НМЛЖ, что приводит к гипердиагностике. Именно с этим связана необходимость стандартизации диагностических критериев НМЛЖ. В связи с отсутствием последних до настоящего времени достаточно трудно оценить истинную распространенность этого заболевания.
Считают, что причина возникновения НМЛЖ - несовершенный эмбриогенез, в результате которого нарушается нормальное развитие миокарда. Первичный миокард состоит из неплотно связанной сети переплетенных между собой волокон, разделенных глубокими карманами, сообщающимися с полостью ЛЖ. В период с 5-й по 8-ю нед эмбрионального развития эта рыхлая сеть волокон постепенно становится компактной. Процесс начинается с эпикарда и идет к эндокарду, от основания сердца к его верхушке. В то же время развивается коронарное крово-обращение и межтрабекулярные карманы превращаются в капилляры [231]. Несмотря на то что причиной развития заболевания с фенотипом НМЛЖ служит нарушение уплотнения миокарда, непосредственные механизмы его возникновения до сих пор остаются неизученными.
Как правило, НМЛЖ отличается от интрамиокардиальных синусоидов, которые обнаруживают при врожденных обструктивных поражениях выносящих трактов ПЖ и ЛЖ [232]. Перегрузка давлением препятствует регрессу эмбриональной синусоиды желудочков, в результате чего глубокие карманы сообщаются как с полостями обоих желудочков, так и с коронарным руслом. Считают, что заболевание носит изолированный характер, но НМЛЖ может сосуществовать с другими врожденными пороками сердца в качестве отдельного наследственного синдрома. Мутация α- дистробревина, обнаруженная в одной из японских семей с НМЛЖ, сочеталась с одним или несколькими ДМЖП и другими врожденными аномалиями [233]. α-Дистробревин - компонент дистрофинсвязаного гликопротеинового комплекса, который обеспечивает контакт цитоскелета кардиомиоцитов с экстрацеллюлярным матриксом.
Изолированный НМЛЖ (т.е. при отсутствии других патологических изменений сердца) связан с мутацией в гене G4.5 в Xq28 [233], которую также регистрируют при синдроме Барта [234] - рецессивном наследственном заболевании, сцепленном с хромосомой Х. Оно манифестирует в детском возрасте триадой симптомов: ДКМП, нейтропенией и скелетной миопатией. Ген G4.5 кодирует группу белков тафазинов, функция которых до сих пор остается малоизученной.
Мутации в Cypher/ZASP обнаруживают как при семейной форме ДКМП, так и при изолированной форме НМЛЖ [60]. Cypher/ZASP - недавно открытй белок Z-диска саркомера, присутствующий в скелетной мускулатуре и миокарде и выполняющий функцию мостика между саркомером и цитоскелетом.
ПАТОФИЗИОЛОГИЯ
Данные аутопсии и морфологических исследований эксплантированного сердца у больных с НМЛЖ подтверждают существование анатомических изменений, обнаруженных при жизни. При гистологическом исследовании в толще эндокардиального слоя и трабекул определяют фокальные участки ишемического некроза, которые отсутствуют в эпикардиальном слое. Характерны участки интерстициального фиброза различной степени выраженности. Нередко имеются морфологические признаки хронического миокардита [227].
Обнаруженные изменения позволяют предположить возможные механизмы возникновения нарушений ритма и прогрессирующей недостаточности ЛЖ, характерной для НМЛЖ. Межтрабекулярные карманы получают кровь прямо из полости ЛЖ, но эпикардиальный и эндокардиальные слои миокарда, включая трабекулы, зависят от коронарного кровоснабжения [235]. Постепенно развивающиеся микроциркуляторные нарушения в многочисленных трабекулах приводят к несоответствию массы миокарда количеству обеспечивающих ее капилляров. Кроме того, утолщенный миокард может создавать дополнительную компрессию интрамурального коронарного русла. В конечном итоге оба процесса приводят к уменьшению субэндокардиальной перфузии, несмотря на отсутствие обструкции в венечных артериях. Снижение коронарного резерва регистрируют у пациентов с НМЛЖ при ПЭТ сердца [236]. Прогрессирующая ишемия и фиброз могут привести к ухудшению систолической функции и создать субстрат для возникновения нарушений ритма.
Выраженная трабекулярность способствует возникновению диастолической дисфункции. Рестриктивные изменения регистрируют у 35% взрослых пациентов с НМЛЖ [235]. Частота возникновения тромбоэмболических осложнений достаточно высока и составляет 24%. Считают, что тромбоэмболии возникают вследствие застоя крови в межтрабекулярных карманах. Болезнь может манифестировать с цереброваскулярных осложнений, транзиторных ишемических атак, мезентериальных ИМ или ТЭЛА.
КЛИНИЧЕСКАЯ КАРТИНА
Заболевание может дебютировать как в неонатальном периоде, так и более позднем возрасте. У пациентов с НМЛЖ могут возникать нарушения ритма, симптомы недостаточности ЛЖ, реже - тромбоэмболии. В детском возрасте также описаны цианоз, плохая прибавка массы тела и дисморфические признаки [237]. Достаточно большое число случаев НМЛЖ диагностируют при обследовании семей больных НМЛЖ или как случайную находку при рутинном обследовании сердца.
До сих пор остается неясным, может ли НМЛЖ дебютировать с ВСС. Это заболевание достаточно редко обнаруживают при аутопсии пациентов, умерших внезапно, что может быть связано с низкой осведомленностью врачей о существовании такой болезни. Существует предположение, что на долю НМЛЖ приходится некоторая часть смертей, приписываемых миокардитам или ВСС у людей с морфологически неизмененным сердцем.
ДИАГНОСТИКА
План обследования пациентов с подозрением на НМЛЖ включает 12-канальную ЭКГ, трансторакальную ЭхоКГ и ХМ. Кардиопульмональный тест также может быть полезен для объективной оценки функционального резерва.
У большинства пациентов с НМЛЖ на ЭКГ регистрируют неспецифические изменения. Характерны отклонение и высокий вольтаж комплекса QRS, задержка внутрижелудочкового проведения, БНПГ и АВ-блокады различной степени. Также обнаруживают изменения реполяризации:
инвертированный зубец Т и изменение сегмента ST [231]. До 17% педиатрических пациентов имеют изменения на ЭКГ в виде WPW-синдрома [237], несмотря на то что, как правило, у взрослых их обнаруживают достаточно редко.
При диагностике НМЛЖ большое внимание уделяют такому методу исследования, как МРТ сердца. Это связано с тем, что в отличие от ЭхоКГ МРТ сердца не ограничена акустическим окном и имеет дополнительные преимущества для визуализации очерченных полей миокардиального фиброза в случае контрастирования парамагнетиком гадолинием. Несмотря на это, главным и наиболее доступным методом обследования остается 2D-ЭхоКГ. Использование в/в контрастных веществ для УЗИ позволяет улучшить визуализацию и облегчить определение границ эндокарда.
ЛЕЧЕНИЕ
Для лечения дисфункции ЛЖ используют стандартную терапию СН. Данные о частоте возникновения нарушений ритма при НМЛЖ чрезвычайно разнообразны. Показано, что примерно у 41% взрослых пациентов с НМЛЖ развивается ЖТ [235]. С другой стороны, по данным японских авторов, ЖТ у детей с НМЛЖ возникала достаточно редко [238]. Основываясь на данных, полученных в популяции больных ДКМП, лечение β-адреноблокаторами и (или) амиодароном не только позволяет сохранить функцию ЛЖ, но и предупредить развитие неустойчивой ЖТ. Пациентам с НМЛЖ и устойчивой ЖТ, повторными обмороками в анамнезе или ФВ ЛЖ менее 35% рекомендована установка ИКД в случае регистрации неустойчивой ЖТ при ХМ на фоне оптимального медикаментозного лечения.
Данные о частоте тромбоэмболических осложнений при НМЛЖ противоречивы. В настоящее время подход к приему внутрь антикоагулянтов прагматический, и подразумевает их назначение пациентам с НМЛЖ, дилатацией желудочка и (или) значимой систолической дисфункцией. Назначение постоянной антикоагулянтной терапии пациентам без клинических симптомов при сохраненной функции желудочков необоснованно.
НМЛЖ наследуется по аутосомно-доминантному типу [239] и может манифестировать с вероятностью до 50% у любого родственника первой степени родства, носителя генной мутации. Именно поэтому обследование членов семей больных НМЛЖ считают обязательным.
ПРОГНОЗ
При наблюдении в течение 44 мес смертность среди 34 взрослых пациентов с НМЛЖ составила более 35%. Около половины летальных исходов приходится на долю ВСС. Причиной смерти одного пациента послужила рефрактерная к лечению устойчивая ЖТ. Один больной скончался вследствие ТЭЛА. Примерно около трети всех смертей связаны с терминальной СН, и около 12% пациентов перенесли трансплантацию сердца. В большинстве описанных случаев клинический исход НМЛЖ был неблагоприятным [235].
Тем не менее это не означает, что НМЛЖ традиционно ассоциируется с неблагоприятным прогнозом. Данные предварительного обследования у пациентов с тяжелым течением недавно
диагностированных заболеваний всегда имеют тенденцию доминировать над реально существующей ситуацией. Например, нежелательные симптомы у больных с НМЛЖ в общей популяции обнаруживают гораздо реже, чем предполагали первоначально на основании данных исследовательских центров. У многих пациентов с НМЛЖ на момент установления диагноза клинические симптомы отсутствуют (часто - в течение продолжительного периода времени). Своевременная диагностика жизнеугрожающих нарушений ритма и установка ИКД во многом улучшает прогноз больных с НМЛЖ. В настоящее время предпринимаются попытки изучения клинического течения НМЛЖ в больших популяциях без системной ошибки выборки.
ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ МИОКАРДА
МИОКАРДИТ И ПОСТМИОКАРДИТИЧЕСКИЯ КАРДИОМИОПАТИЯ
ОПРЕДЕЛЕНИЕ
Термин "миокардит" был впервые введен Собер-нхеймом в 1937 г. С тех пор доказано, что ДКМП может развиться вследствие хронического воспаления миокарда, спровоцированного вирусной инфекцией. Именно поэтому понятие воспалительного заболевания миокарда в настоящее время не ограничивается только ранней фазой острого миокардита. На основании накопленных знаний о патогенетической связи между миокардитом и ДКМП рабочая группа Комитета экспертов ВОЗ и Международного общества и федерации кардиологов в 1995 г. пересмотрела классификацию КМП, выделив среди них группу воспалительных КМП (ВКМП), характеризующихся систолической дисфункцией ЛЖ на фоне текущего миокардита [38]. Воспаление миокарда подтверждают гистологическими, иммунологическими и иммуногистохимическими критериями. Выделяют идиопатический, аутоиммунный и инфекционный варианты ВКМП.
ЭТИОЛОГИЯ И РАСПРОСТРАНЕННОСТЬ
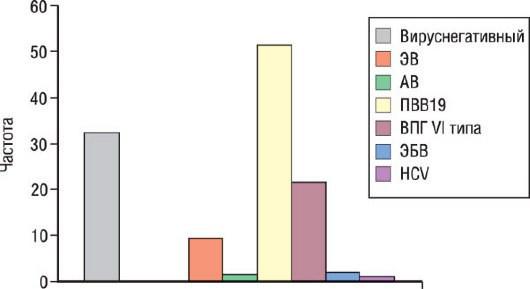
В процессе изучения миокардитов и ВКМП были выделены вирусы, обладающие кардиотропностью (табл. 18.11). У пациентов с ВКМП чаще обнаруживают инфицирование парвовирусом В19, вирусом герпеса человека VI типа, энтеровирусами (вирус Коксаки), аденовирусами и вирусом Эпштейна-Барр (рис. 18.27). В Западной Европе ВКМП невирусной этиологии (бореллиоз, болезнь Чага, дифтерия) регистрируют редко. У 21% больных миокардитом при наблюдении в течение 33 мес описано развитие ДКМП.
Рис. 18.27. Спектр кардиотропных вирусов при воспалительной кардиомиопатии: распространенность кардиотропных вирусов доказана с помощью ПЦР-исследования эндомиокардиальных биоптатов у больных с дилатационной кардиомиопатией. Результаты включают часть случаев с множественной вирусной инфекцией. AВ - аденовирус; ЭБВ - вирус Эпштейна-Барр; ЭВ - энтеровирус; HCV - вирус гепатита С; ВПГ-VI - вирус герпеса
VI типа; ПВВ19 - парвовирус B19. Источник (с разрешения): Kühl U., Pauschinger M., Noutsias M, et al. High prevalence of viral genomes and multiple viral infections in the myocardium of adults with ‘idiopathic’ left ventricular dysfunction // Circulation. - 2005. - Vol. 111. - P. 887-893.

Таблица 18.11. Вирусы, обладающие кардиотропностью и обнаруживаемые при миокардите и воспалительной кардиомиопатии
Вирус Коксаки
Аденовирусы
Парвовирусы В19
Вирус человеческого герпеса VI типа
Вирус Эпштейна-Барр
Цитомегаловирус
Вирусы ЕСНО
Вирус эпидемического паротита
Вирус гриппа типа А и В
Флавовирусы
Вирус иммунодефицита человека
Вирус кори
Вирус полиомиелита
Вирус гепатита С
Вирус бешенства
Вирус краснухи
Вирус натуральной оспы человека
Вирус ветряной оспы
Ежегодная заболеваемость ДКМП составляет 29 случаев на 1 млн человек, а вирусным миокардитом - 131 случай на 1 млн человек. Точные эпидемиологические данные о заболеваемости острым миокардитом, к сожалению, отсутствуют.
ГЕНЕТИКА
В настоящее время нет данных, подтверждающих моногенное наследование миокардита или ВКМП. Существует теория о существовании генетической предрасположенности, выражающейся в повышенной чувствительности к кардиотропным вирусам и (или) развитии хронической воспалительной реакции в ответ на вирусную инфекцию. Установлена связь HLA-гаплотипов с частотой развития миокардитов: при HLA-DR4 (51% при ДКМП против 27% в контрольной группе, р‹0,001) отмечено увеличение частоты, а при HLA-DRw6 - снижение (9% при ДКМП против 24% в контрольной группе) [240]. Тем не менее следует отметить, что генетическое наследование определенных мутаций и интерференция модифицированных генов при семейной форме КМП не исключает участие иммунных механизмов в патогенезе заболевания. Подтверждением этому факту служит одинаково высокая заболеваемость ВКМП среди пациентов с семейной формой
ДКМП и их асимптомных родственников, а также у больных со спорадическими формами ДКМП
[41].
ПАТОГЕНЕЗ И ПАТОФИЗИОЛОГИЯ
При исследовании материала, полученного при эндомиокардиальной биопсии от пациентов с подозрением на миокардит или ВКМП, были выделены следующие вирусы. Наиболее часто обнаруживали энтеровирусы (вирус Коксаки), аденовирус, парвовирус B19, вирус герпеса человека VI типа и вирус Эпштейна-Барр (см. рис. 18.27) [42, 241]. Именно благодаря вирусу Коксаки удалось детально изучить патофизиологические механизмы развития заболевания. Экспрессию Коксаки-аденовирусных рецепторов (CAR-рецепторов) в миокарде одновременно с корецепторами, облегчающими проникновение аденовирусов αvγ3 и αvγ5, обнаруживают у больных ДКМП в 60% случаев (рис. 18.28). Это служит важной молекулярной детерминантой кардиотропности вируса Коксаки и аденовируса [242]. Можно выделить два типа патологического воздействия вирусной инфекции:
•прямой цитопатический эффект;
•вторично индуцированный эффект.
