
6 курс / Кардиология / Джон_Кэмм_Болезни_сердца_и_сосудов_2011
.pdfиспользуются более чем в 80% всех процедур ЧТА. По результатам внутрисосудистого УЗИ было выяснено, что техника имплантации стентов зависит от правильно подобранного размера стента по отношению к ширине просвета сосуда [250]. Ангиопластика со стентированием превосходит по эффективности баллонную ангиопластику по следующим параметрам:
•процессы тромбообразования и диссекция при баллонном вмешательстве очень часто являются результатами псевдоуспешных процедур, при которых достигается временное расширение просвета сосуда;
•степень и длительность дилатации лучше при стентировании, в то время как при баллонной ангиопластике эффект длится менее 48 ч (не более 15% при наличии тяжелой резидуальной диссекции);
•достижение оптимального ангиографического результата при стентировании не зависит от степени сложности стеноза;
•проведенные исследования показали, что частота появления рестеноза меньше при имплантации стентов.
Несколько клинических исследований подтверждают вышеизложенную информацию, в частности BENESTENT (BElgian NEtherlands Stent studies), которое изучало эффективность процедуры ЧТА в Европе. Другие клинические исследования показали эффективность процедуры стентирования на протяжении 5 лет после имплантации стентов. При проведении метаанализа 29 исследований с участием 9918 пациентов не было доказано наличия различий между плановым коронарным стентированием и стандартной баллонной ангиопластикой по отношению к летальным исходам и развитию ИМ, или различия в необходимости последующего проведения АКШ. Однако, при проведении последних метаанализов был подтвержден тот факт, что стентирование венечных артерий снижает уровень рестенозов и необходимости проведения повторной ЧТА [251, 252]. Риск летального исхода при проведении ангиопластики составляет 0,3-1%.
Несмотря на огромные достижения в процедуре постановки стентов, до сих пор процесс раннего рестеноза остается "ахилловой пятой" для ЧТА, имея место в 20-25% случаев.
ДОСТИЖЕНИЯ В ЛЕЧЕНИИ, ПРЕДУПРЕЖДЕНИЕ РЕСТЕНОЗОВ
До эпохи стентов многочисленные попытки механического и лекарственного предупреждения рестенозов осуществлялись, но безрезультатно. Хотя и применялись различные способы по разрушению атеросклеротических бляшек, самым успешными считались процедуры, при которых рестеноз возникал в течение 6 мес в 50% случаев. Процесс рестенозирования после баллонной ангиопластики и любого механического вмешательства, кроме стентирования, представляет собой комплекс восстановительных процессов после повреждения, в результате которого происходит пролиферация интимы и ремоделирование сосуда. Имплантация металлического стента минимизирует повреждение стенки сосуда, тем самым уменьшая вероятность развития клинического рестеноза и снижая необходимость в проведении повторной операции по поводу рецидива симптомов. В то же время, имплантация металлического стента вызывает пролиферацию неоинтимы. Таким образом, при имплантации стентов в мелкие сосуды, с протяженным повреждением, происходит рестеноз, достигающий уровня 30% [253]. Кроме того, рестеноз в зоне имплантации стента трудно поддается лечению, и с каждой новой процедурой частота рестеноза увеличивается на 19-83% [254]. Это возникает в случае происхождения диффузного или пролиферативного рестеноза. Вследствие того что в основе рестеноза в зоне имплантации стентов лежит пролиферации неоинтимы, нашло успешное применение внутрисердечное облучение как γ-, так и β-лучами. Тем не менее долгосрочные результаты такой терапии (брахитерапия) были ассоциированы с чрезвычайно высокими темпами тромбоза стента и поздней окклюзией сосуда, предположительно, из-за замедления процессов восстановления эндотелия [255]. Использование сосудистого облучения, применяемого во время имплантации стента с целью предупреждения поздней пролиферации неоинтимы внутри стента, было прекращено в результате развития осложнений: острого и позднего тромбоза стентов.
В настоящее время стенты (DES) с лекарственным покрытием вытесняют простые металлические стенты (BMS). Их металлические основы покрыты полимерными соединениями, содержащими менее 0,1 мг цитотоксических и противовоспалительных компонентов (например, паклитаксел, сиролимус, эверолимус), исчезающими постепенно в течение первых недель после имплантации стентов. Три препарата показали одинаковые положительные эффекты в исследованиях с DES (паклитаксел, сиролимус и его производное эверолимус).
Применение в последнее время специальных приспособлений позволило сократить как уровень ангиографических рестенозов, так и необходимость прибегать к повторным вмешательствам вследствие рецидива симптомов более чем на 60% [256]. Частота зафиксированных случаев
возникновения тяжелых побочных эффектов, включающих необходимость повторного вмешательства, за последние 9 мес колеблется в пределах 7,1-0,3% со стентами с лекарственным покрытием (DES) по сравнению с уровнем 13,3-18,9% с простыми стентами (BMS). Современные рекомендации по использованию DES представлены в европейских рекомендациях по ЧТА [257]. Другое направление заключается в увеличении частоты использования прямого стентирования, т.е. осуществлении имплантации стентов без предварительной баллонной дилатации. Эксперименты на животных подтвердили тот факт, что при прямом стентировании не происходит повреждение сосудистой стенки и меньше повреждается эндотелий [258]. Если прямое стентирование осуществляется с DES, то частота рестенозов уменьшается до 2% [259].
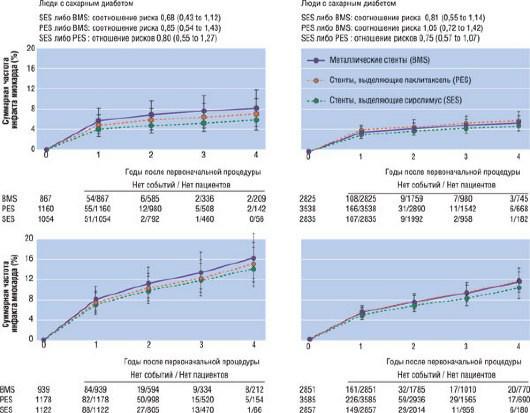
Недостаток имплантации стентов заключается в наличии риска тромбоза стента, который приводит к высокой смертности на госпитальном этапе. Частота возникновения тромбоза стентов в течение первого года 2%, и прибавляется на 0,5% с каждым прожитым годом. Риск тромбоза стентов DES больше, чем BMS. Высокий риск тромбоза, ассоциированный с имплантацией DES, однако, не приводит к увеличению уровня смертности и развития ИМ (рис. 17.27). Таким образом, значительно уменьшая риск рестеноза по сравнению с обычными стентами, стенты с лекарственным покрытием напрямую уменьшают риск летального исхода и нефатального ИМ, тем самым компенсируя риск тромбоза стента [261]. В совокупности метаанализы и клинические исследования указывают на тот факт, что имплантация DES незначительно уменьшает уровень серьезных кардиальных осложнений, таких как летальный исход и ИМ, при сравнении с имплантацией BMS [262].
Рис. 17.27. Метаанализ со сравнением способов лечения. Прямое сравнение результатов клинических исследований, полученных при условии сохранения случайного распределения пациентов по группам (рандомизации). Риск ИМ и смерти или ИМ был одинаков для стентов, выделяющих сиролимус (SES), паклитаксель (PES) и обычных металлических стентов (BMS), как у пациентов с диабетом, так и без диабета. Изменено: Stettler C., Alleman S., Wandel S. et al. Drug eluting and bare metal stents in people with and without diabetes: collaborative network meta-analysis // BMJ. - 2008. - Vol. 337. - P. 1331.
Таким образом, при наличии высокого риска рестеноза следует использовать стенты с лекарственным покрытием. При имплантации стентов с лекарственным покрытием необходима пролонгированная двойная антикоагулянтная терапия.
ДОПОЛНИТЕЛЬНАЯ МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
Механическая травма при проведении ЧТА, нанесенная эндотелиальному слою и глубоким слоям сосудистой стенки, наличие самого стента являются мощнейшими стимуляторами для активации тромбоцитов и процесса свертывания. Таким образом, становится очевидным факт необходимости назначения антиагрегантной терапии.
Всем пациентам необходимо назначать терапию аспирином♠ и тиенопиридином [260]. Для полного достижения уровня антитромботической активности необходимо назначать клопидогрел за 6 ч до операции в дозе 300 мг, в идеальных условиях его следует назначать за сутки до запланированной операции [261]. До сих пор до конца не определена оптимальная продолжительность двойной антиагрегантной терапии после имплантации стентов с лекарственным покрытием, но многие доктора рекомендуют продолжительность терапии до года, особенно после комбинированного стентирования нескольких артерий и после сложной процедуры. Влияние возможной резистентности к антиагрегантной терапии требует дальнейшего тщательного исследования.
Ингибиторы гликопротеинов IIb/IIIa, наиболее мощные представители антиагрегантных препаратов, действуя на блокирование рецепторов фибриногена, доказали свою эффективность при ЧТА с высоким риском, в частности во время ОКС. Учитывая низкий риск при проведении ЧТА у больных со стабильным течением ИБС, мощность эффектов ингибиторов гликопротеинов IIb/IIIa в увеличении риска осложненного кровотечения и их значительную себестоимость при системном использовании, эти препараты не входят в состав стандартной антиагрегантной терапии, но необходимо их использовать при сложных ЧТА или связанных с высоким уровнем риска [264].
Низкомолекулярный гепарин обычно применяется болюсно, определяется время активации свертываемости и рассчитывается на массу (обычно 100 ЕД на кг или 50 ЕД на кг при одновременном применении ингибиторов гликопротеинов IIb/IIIa). В недавно проведенных исследованиях у пациентов, идущих на ЧТА, было установлено, что при однократном болюсном в/в введении эноксапарина 0,5 мг на кг массы наблюдалось снижение уровня кровоточивости по сравнению с применением низкомолекулярного гепарина и сопровождалось более предсказуемым эффектом антикоагулянтной терапии [265]. Бивалирудин является ингибитором прямого тромбина с кратковременным эффектом и может использоваться у больных с гепарин-индуцированной тромбоцитопенией [266]. Продолжение гепаринизации после завершения процедуры не рекомендуется.
ПОКАЗАНИЯ К ЧРЕСКОЖНОЙ АНГИОПЛАСТИКЕ
По имеющимся данным, считается, что ЧТА в отличие от медикаментозной терапии существенно не улучшает выживаемость при стабильной стенокардии. По данным клинических исследований ЧТА более эффективно по сравнению с медикаментозным лечением в снижении частоты событий, которые ухудшают качество жизни (стенокардия, одышка, необходимость в повторной госпитализации или ограничение физической активности). В исследовании ACME (Acute Mountain Sickness and Endothelin) показано, что у пациентов с выполненным ЧТА, по сравнению с медикаментозной терапией, наблюдались лучший результат в отношении симптомов заболевания и большая переносимость физических нагрузок [267] при одинаковом уровне летальности и развития ИМ. Необходимо отметить, что у пациентов с двухсосудистым поражением коронарного русла отмечалось схожее улучшение в переносимости физической активности, устранение стенокардии и улучшение качества жизни в течение последующих 6 мес наблюдения. В
исследовании RITA-2 (Randomized Intervention Treatment of Angina) было рандомизировано 1018
пациентов со стабильной стенокардией (62% с многососудистым поражением коронарного русла и 34% со значимым поражением проксимальных отделов передней межжелудочковой ветви), которым выполняли либо ЧТА, либо назначали медикаментозную терапию и наблюдали в течение 2,7 года [268]. Пациентам с рецидивом клинических симптомов на фоне оптимальной медикаментозной терапии было разрешено перейти в группу реваскуляризации миокарда. Данное исследование продемонстрировало, что ЧТА более эффективно в отношении симптомов ишемии миокарда и улучшения переносимости физических нагрузок по сравнению с медикаментозной терапией, но, однако, ассоциировано с более высоким уровнем развития комбинированных конечных точек в виде смерти и интраоперационного ИМ. В исследовании AVERT (A Very Early Rehabilitation Trial) наблюдался 341 пациент со стабильным течением ИБС, нормальной сократительной способностью ЛЖ и стенокардией напряжения на уровне I или II функционального класса. Они были рандомизированы в группы лечения ЧТА или медикаментозной терапии в сочетании с ежедневным приемом аторвастатина в дозе 80 мг [269]. Через 18 мес у 13% больных из группы медикаментозной терапии отмечался рецидив ишемии по сравнению с 21% у пациентов с перенесенной ЧТА. Однако частота уменьшения симптомов стенокардии у пациентов с ЧТА была выше. Сравнительный метаанализ консервативной терапии и ЧТА при хроническом поражении
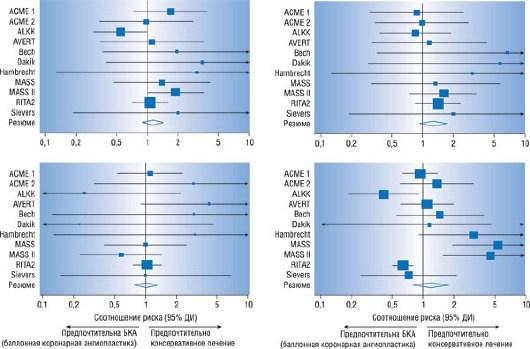
венечных артерий, включивший 2950 пациентов, не обнаружил существенных различий между двумя стратегиями лечения в отношении общей смертности, сердечной летальности или развития ИМ, нефатального ИМ, необходимости выполнения АКШ или ЧТА в течение периода наблюдения
[270] (рис. 17.28). Исследование COURAGE (Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation) подтвердило ранее полученные результаты. В этом исследовании принимали участие 2287 больных со значимым поражением коронарного русла и объективизированными данными об ишемии миокарда, которые были рандомизированы в группу ЧТА в сочетании с оптимальной медикаментозной терапией и группу, получающую только ЛС [271]. Первичной конечной точкой была комбинация смерти от любой причины и развития нефатального ИМ в ходе наблюдения в среднем около 4,6 года. Уровень общих первичных событий в группе ЧТА составил 19,0% и 18,5% в группе медикаментозной терапии. Самый последний метаанализ, включивший исследование COURAGE, показал, что в группе с ЧТА уровень летальности ниже по сравнению с медикаментозной терапией [272]. Однако, некоторые ограничения, например, включение в группу лиц с наличием в анамнезе недавно перенесенного ИМ, затрудняет интерпретацию результатов. Кроме того, никаких различий в уровне сердечной летальности обнаружено не было.
Рис. 17.28. Метаанализ рандомизированных исследований, сравнивающих ЧТА и медикаментозную терапию. Риск развития кардиальной смерти или любого ИМ (верхний рисунок слева), нефатального ИМ (верхний рисунок справа), АКШ (нижний рисунок слева) и повторной ЧТА за время наблюдения (нижний рисунок справа) был схож в двух группах лечения. Каждое исследование отмечено названием вместе с точечной оценкой степени риска и соответственных 95% ДИ. На каждом рисунке размер квадратика, обозначающего точечную оценку в каждом исследовании, пропорционален объему исследования. Также показаны суммарная степень риска и 95% ДИ в соответствии с моделью случайного эффекта Der Simonian и Laird. Изменено (с разрешения): Katritsis D.G., Ioannidis J.P. Percutaneous coronary intervention versus conservative therapy in nonacute coronary artery disease: a meta-analysis // Circulation. - 2005. - Vol. 111. - P. 2906-2912.
Хотя по правилам до проведения коронарографии следует выполнять неинвазивные нагрузочные пробы [193], большинству пациентов проводят ангиографию без предварительной оценки функционального состояния. При условии незадокументированной стресс-индуцированной ишемии миокарда измерение резерва кровотока могут выполнить во время инвазивного исследования. Данный тест прост в применении, высокоспецифичен, а его значение ниже 0,75 является достаточно надежным показателем преходящей ишемии. В исследовании DEFER (Deferral of percutaneous coronary intervention) ЧТА выполнялась или откладывалась на основании значений резерва кровотока. Выживаемость при выполненной ЧТА и без ЧТА была практически одинаковой (92 против 89% к 12 мес и 89 против 83% к 24 мес). Данное обстоятельство указывает на тот факт, что ЧТА не улучшает прогнозы при наличии гемодинамически незначимых стенозов
[273] (глава 8).
Суммируя все вышеизложенное, существующие в настоящее время данные предполагают, что у пациентов низкого и среднего риска со стабильным течением ИБС медикаментозное лечение, включающее агрессивную липидснижающую терапию, так же эффективно, как и ЧТА в отношении снижения риска развития основных сердечно-сосудистых осложнений, в то время как ЧТА связана с лучшим прогнозом относительно ангинозного синдрома и поэтому является жизнеопределяющей процедурой у пациентов с сохраняющейся стенокардией на фоне антиангинальной терапии.
АОРТОКОРОНАРНОЕ ШУНТИРОВАНИЕ
ВВЕДЕНИЕ
АКШ считают наиболее разработанной, проверенной, документированной, развитой операцией в истории медицины. Впервые данная хирургическая манипуляция была предложена Фавалоро (Favaloro) совместно с коллегами в 1969 г., использовавшими участок бедренной вены, соединивший аорту и ветви венечной артерии дистальнее критического стеноза [274]. АКШ быстро стало краеугольным камнем в лечении больных ИБС, приводя к замечательным результатам улучшения клинических проявлений заболевания у отдельной группы больных.
ПОДБОР ШУНТА
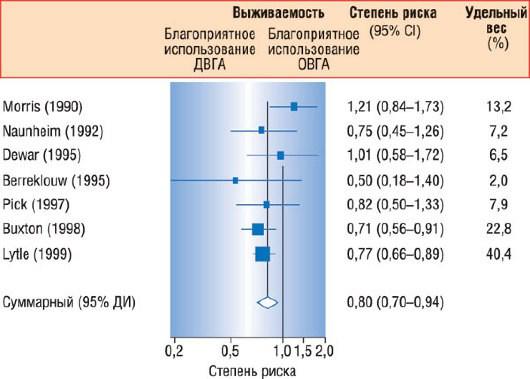
Через 10 лет после АКШ в 60% случаев происходит стенозирование или окклюзия венозных шунтов. Рецидив клинических симптомов вследствие поражения венозных шунтов остается актуальной проблемой, так как, по крайней мере, у 70% пациентов после хирургического вмешательства продолжительность жизни составляет 10 лет. Большие обзорные исследования показали, что использование левой внутренней грудной артерии по сравнению с венозными шунтами улучшает выживаемость и снижает количество ИМ в отдаленном периоде, рецидивов стенокардии и повторных вмешательств. [275, 276]. Таким образом, независимыми предикторами развития рецидива стенокардии после АКШ являются женский пол, ожирение, артериальная гипертензия и неиспользование левой внутренней грудной артерии к передней межжелудочковой ветви [277]. За последние 20 лет стало стандартом использовать левую внутреннюю грудную артерию в качестве анастомоза к передней межжелудочковой ветви и венозные шунты при шунтировании других венечных артерий. Оказывается, что происходит значительное улучшение уровня выживаемости при использовании двух билатеральных внутренних грудных артерий в виде шунтов независимо от возраста, функции ЛЖ и наличия диабета [278, 279] (рис. 17.29). Кроме того, эффективность использования двух внутренних грудных артерий повышалась по мере увеличения периода наблюдения, особенно, что касалось необходимости повторных операций. С использованием скелетированных отрезков внутренней грудной артерии риск деваскуляризации грудины и последующего нарушения кровообращения значительно снизился, даже у диабетиков.
Рис. 17.29. Системный обзор исследований, сравнивающих использование одной внутренней грудной артерии (ОВГА) и двух внутренних грудных артерий (ДВГА) в качестве анастомозов. Среди больных, у которых использовались обе внутренние грудные артерии, выживаемость была выше. Изменено (с разрешения): Taggart D.P., D’Amico R., Altman D.G. Effect of arterial revascularisation on survival: a systematic review of studies comparing bilateral and single internal mammary arteries // Lancet. - 2003. - Vol. 361. - P. 615-616.
В качестве других артериальных анастомозов могут быть использованы лучевая артерия и правая желудочносальниковая артерия. Наибольший опыт наблюдался при использовании лучевой артерии, проходимость которой составляет более чем 90% в течение 3 лет. Существует кривая обучения (характеризующая процесс постепенного приобретения опыта или эффект обучения) относительно использования лучевых артерий в качестве шунтов, однако в настоящее время очевидно, что их следует применять только при серьезных стенозах или окклюзии венечных сосудов. В проспективном рандомизированном одноцентровом исследовании, в котором сравнивалась ангиографическая проходимость лучевой артерии и правой внутренней грудной артерии или вены, не выявлено доказательств в пользу меньшей частоты развития неблагоприятных событий при использовании лучевой артерии [280]. Кроме того, недавние данные показали неутешительные результаты по проходимости лучевой артерии в средние сроки после операции [281]. В течение 5 лет проходимость шунтов составила 92% при использовании левой внутренней грудной артерии, 85% - правой внутренней грудной артерии, 64% - бедренной вены и 53% - лучевой артерии. Проходимость лучевой артерии зависела от пола, наиболее плохой она была у пожилых женщин.
ОПЕРАЦИИ НА РАБОТАЮЩЕМ СЕРДЦЕ
Использование экстракорпорального кровообращения (сердечно-легочный шунт) при выполнении оперативного вмешательства остается наиболее широко используемым методом. Однако существует риск образования микроэмболов и развития воспалительной реакции во всем организме. Необходимость катетеризации аорты и манипуляции на восходящем отделе аорты могут привести к отрыву эмболов, особенно у лиц пожилого возраста с атероматозным поражением аорты, которые составляют основную часть пациентов с показаниями к хирургическому вмешательству. Так называемая операция на работающем сердце ("off-pump") может вести к снижению периоперационной смертности и заболеваемости. В последнее время использование cтабилизирующих устройств дало возможность оперировать пациентов с трехсосудистым поражением. В настоящее время доступны рандомизированные исследования по сравнению эффективности операции на работающем сердце и стандартной методики. Хотя в группе операций на работающем сердце уменьшилась частота использования компонентов крови (3 против 13%), а нарастание изофермента КФК-МВ было меньше на 41%, уровень развития интраоперационных осложнений оказался одинаковым. Также не наблюдалось различий в исходах операций на работающем сердце и стандартной методики в течение 3 лет [282, 283]. Метаанализ 6 исследований, включавший 558 пациентов, рандомизированных на операцию в условиях искусственного кровообращения, и 532 пациента, рандомизированных на операцию на работающем сердце, не выявил значимых различий по развитию таких конечных точек, как инсульт, смерть или ИМ [284]. Дальнейшее рандомизированное исследование, проводящее ангиографию через 3-6 мес наблюдения, показало значительное снижение проходимости шунтов (90 против 98%) в группе пациентов с операцией на работающем сердце [285]. Таким образом, по данным последних обзорных исследований с участием 49 830 пациентов операция на работающем сердце ассоциирована с более низкой внутригоспитальной смертностью и частотой развития осложнений, чем операция с использованием искусственного кровообращения. Однако отдаленные результаты этих операций сравнимы, за исключением случаев реваскуляризации, требующих условий экстракорпорального кровообращения [286]. Данные исследования предполагают, что к выбору метода АКШ на работающем сердце у пациентов с хорошими сосудами и наличием значимой сопутствующей патологии следует подходить избирательно и с осторожностью.
В спорах об операциях на работающем сердце и операциях с искусственным кровообращением последнее обычно имеет мало преимуществ. Однако искусственное кровообращение может быть осуществлено различными способами. Кардиоплегия может быть выполнена с использованием множества растворов разных температур и разными способами, антеградно или ретроградно, или комбинируя оба способа. Некардиоплегические методы имеют длинную историю и могут быть очень эффективными. Искусственное кровообращение с использованием стабилизаторов может не вызывать развития повреждающей глобальной ишемии в результате пережатия аорты и использоваться при выделении необходимого сосуда. Когда сосуд вскрыт, шунт можно присоединять, минимизируя региональную ишемию. Этот метод доказал свою эффективность у

больных с наличием зон гибернирующего миокарда и дилатированными камерами сердца, а также при повторном хирургическом вмешательстве.
ПОВТОРНЫЕ ОПЕРАЦИИ НА ВЕНЕЧНЫХ СОСУДАХ
Частота повторных операций на венечных артериях по отношению ко всем операциям АКШ в Европе (5-10%) меньше, чем в Северной Америке (10-15%). При этом по сравнению с первичной операцией уровень смертности от 2 до 3 раз выше [287]. Хотя устранение стенокардии менее прогнозируемое и менее полное как после первичной операции, но отдаленные результаты обнадеживают - 73% больных не имеют признаков стенокардии в течение 5 лет. Показания к повторному АКШ не были определены при рандомизированных исследованиях, однако используются те же принципы отбора, что и для первичной операции. Например, стеноз в венозном шунте к передней межжелудочковой ветви связан со снижением выживаемости. Главное достижение в улучшении выживаемости после повторных операций стало особенно очевидно у данной категории больных. Среди этих пациентов уровни выживаемости после повторной операции составили 84 и 74% в течение 2 и 4 лет по сравнению с 76 и 53% пациентов, пролеченных медикаментозно [288].
ПОКАЗАНИЯ К АКШ
Существуют два основных показания к выполнению АКШ: прогностическое и симптоматическое. Прогностическая эффективность АКШ в основном связана со снижением уровня сердечной летальности, доказательств о снижении частоты развития ИМ меньше [289, 290].
Метаанализ хирургических исследований, сравнивающих АКШ и медикаментозную терапию, не выявил преимуществ выполнения АКШ у пациентов группы низкого риска (ежегодная смертность менее 1%), тогда как было установлено, что АКШ улучшает прогноз у пациентов со средним и высоким риском [290]. Данные регистра Дьюка подтвердили тот факт, что низкая смерность в отдаленный период после операции обусловлена группой больных высокого риска [291]. Анализ обзорных и рандомизированных исследований выявил, что наличие определенной анатомии коронарного русла ассоциировано с лучшим прогнозом хирургического лечения по сравнению с медикаментозной терапией. К таким состояним относятся следующие [292-294] (табл. 17.17).
•Значимый стеноз ствола левой венечной артерии.
•Значимый проксимальный стеноз трех основных венечных артерий.
•Значимый стеноз двух основных венечных артерий, включая значимый стеноз проксимального отдела передней межжелудочковой ветви.
Таблица 17.17. Уровень смертности в подгруппах пациентов с хронической ИБС, пролеченных медикаментозно, и статистическое сравнение с уровнем смертности, полученным в тех же подгруппах, среди больных, которым выполнено АКШ
Подгруппа |
Медикаментозное |
Значение p для АКШ против |
|
лечение |
медикаментозной терапии |
|
|
|
Поражение сосудов |
|
|
|
|
|
Однососудистое |
9,9 |
0,18 |
|
|
|
Двухсосудистое |
11,7 |
0,45 |
|
|
|
Трехсосудистое |
17,6 |
‹0,001 |
|
|
|
Ствол левой артерии |
36,5 |
0,004 |
|
|
|
Без поражения передней |
|
|
межжелудочковой ветви левой |
|
|
венечной артерии |
|
|
|
|
|
Одноили двухсосудистое |
8,3 |
0,88 |
|
|
|

Трехсосудистое |
14,5 |
0,02 |
|
|
|
Ствол левой артерии |
45,8 |
0,03 |
|
|
|
Общее |
12,3 |
0,05 |
|
|
|
Передняя межжелудочковая ветвь |
|
|
левой венечной артерии поражена |
|
|
|
|
|
Одноили двухсосудистое |
14,6 |
0,05 |
|
|
|
Трехсосудистое |
19,1 |
0,009 |
|
|
|
Основной ствол левой артерии |
32,7 |
0,02 |
|
|
|
Общее |
18,3 |
0,001 |
|
|
|
Функция ЛЖ |
|
|
|
|
|
Нормальная |
13,3 |
‹0,001 |
|
|
|
Нарушенная |
25,2 |
0,02 |
|
|
|
Результат нагрузочной пробы |
|
|
|
|
|
Отсутствует |
17,4 |
0,10 |
|
|
|
Нормальный |
11,6 |
0,38 |
|
|
|
Положительный |
16,8 |
‹0,001 |
|
|
|
Тяжесть стенокардии |
|
|
|
|
|
Функциональный класс 0, I, II |
12,5 |
0,005 |
|
|
|
Функциональный класс |
22,4 |
0,001 |
III, IV |
|
|
|
|
|
* Систематизированный обзор исходов АКШ по сравнению с результатами медикаментозной терапии по выживаемости, основанный на данных семи рандомизированных иследований, сравнивающих стратегию первичного АКШ и первичной медикаментозной терапии. Показаны 5- летние результаты по подгруппам.
Изменено (с разрешения): Yusuf S., Zucker D., Peduzzi P. et al. Effect of coronary artery bypass graft surgery on survival: overview of 10-year results from randomised trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration // Lancet. - 1994. - Vol. 344. - P. 563-570.
В таких исследованиях значимым стенозом считали сужение просвета более 70% основных венечных артерий или сужение более 50% ствола левой венечной артерии поражена. Наличие сниженной сократительной функции ЛЖ улучшает прогноз хирургического лечения по сравнению с медикаментозным у всех категорий больных. Эти данные получены на основе 3 основных исследований: European Coronary Artery study [295], Coronary Artery Surgery study [296], Veterans Administration study [289].
Помимо исследований, посвященных исключительно сравнению ЧТА и медикаментозной терапии, АКШ и медикаментозной терапии, проводилось несколько исследований по сравнению эффективности реваскуляризации (ЧТА или АКШ) и медикаментозной терапии. Исследование ACIP (Asymptomatic Cardiac Ischemia Pilot) прибавило дополнительную информацию на основании сравнения эффективности медикаментозной терапии и реваскуляризации миокарда (ЧТА или АКШ) у пациентов с доказанной ИБС и ишемией миокарда, наблюдаемой при выполнении стресстеста и амбулаторного мониторирования ЭКГ [297]. Это небольшое исследование с участием 558 пациентов с проявлениями стенокардии или без нее, рандомизированных на три тактики ведения: антиангинальная терапия, направленная на устранение симптомов; терапия, направленная на устранение симптомов и ишемии; реваскуляризация миокарда (ЧТА или АКШ). В течение 2 лет наблюдения уровень смертности и ИМ у пациентов после реваскуляризации составил 4,7% по сравнению с 8,8% среди пациентов с противоишемической терапий и 12,1% в группе антиангинального лечения. Таким образом, результаты исследования ACIP предполагают тот факт, что у пациентов высокого риска с подтвержденной ишемией при повседневной жизни и со значимым поражением коронарного русла исход после реваскуляризации миокарда (либо АКШ, либо ЧТА) лучше, чем у пролеченных медикаментозно; правда, для получения уверенных заключений исследование было недостаточно мощным; действительно, не могло быть получено статистически значимых различий в клинических исходах реваскуляризации и медикаментозной терапии ишемии миокарда. Необходимо отметить, что другие исследования (TIME и Medicine, Angioplasty or Surgery Study, MASS) не показали снижения уровня основных сердечно-сосудистых осложнений среди пациентов, радомизированных в группу реваскуляризации миокарда по сравнению с медикаментозной терапией [298, 299].
Показано, что хирургическое лечение убедительно уменьшает проявления ишемии, улучшает качество жизни у пациентов с хронической стенокардией. Данные эффекты проявляются в гораздо более обширных подгруппах по сравнению с группами больных, показавших улучшение выживаемости. У пациентов с многососудистым поражением коронарного русла полная реваскуляризация является основополагающим фактором устранения симптомов стенокардии на протяжении 5 лет. Примерно 80% пациентов не имеют стенокардии в течение 5 лет после операции и 63% - на протяжении 10 лет, но через 15 лет только у 15% нет рецидива стенокардии
[300].
Общая внутриоперационная летальность при выполнении первичного АКШ составляет 2-4% [301]. Существуют хорошо разработанные модели стратификации риска для оценки индивидуального риска у каждого пациента в отдельности. Обычно чем выше риск операции, тем эффективнее хирургическое лечение по сравнению с медикаментозным. Таким образом, у пациентов с низким уровнем риска, которым планируется выполнение хирургического вмешательства только на основании клинической картины, следует рассматривать индивидуально риск операции и ожидаемую эффективность, так же как у пациентов с высоким риском.
Таким образом, АКШ является "золотым стандартом" в облегчении симптомов у пациентов с ИБС. Кроме того, существуют подгруппы пациентов, которым выполнение хирургического лечения улучшит прогноз, особенно при стенозе ствола левой венечной артерии или проксимальных отделов передней межжелудочковой ветви, так же как и при сниженной сократительной способности ЛЖ и многососудистом поражении коронарного русла. Кроме того, реваскуляризация миокарда является важной формой лечения пациентов с кардиомиопатией ишемического генеза и большими зонами жизнеспособного миокарда, у которых единственное проявление заболевания - приступы стенокардии.
СРАВНЕНИЕ ЧРЕСКОЖНОЙ АНГИОПЛАСТИКИ И АОРТОКОРОНАРНОГО ШУНТИРОВАНИЯ
Проводились многочисленные исследования по сравнению ЧТА и АКШ с целью определения предпочтительной тактики ведения, как до, так и после появления стентов. Метаанализ выполненных исследований до 1995 г., когда стентирование было редким, не выявило каких-либо значимых различий в стратегии лечения по критерию развития смерти или по комбинированной конечной точке - смерти и ИМ [302]. Уровень внутригоспитальной смертности в связи с выполненнием АКШ составил 1,3% по сравнению с 1% при ЧТА. Необходимость в повторной реваскуляризации была значительно выше в группе ЧТА, и хотя у пациентов значительно реже возникал рецидив стенокардии в течение года после АКШ, чем после ЧТА, через 3 года различие переставало быть статистически значимым. Результаты исследования BARI (Bypass Angioplasty Revascularization Investigation), крупнейшего исследования по сравнению ЧТА и хирургического вмешательства, не вошедшего в этот метаанализ, тем не менее подтверждали данное наблюдение, хотя уровень выживаемости в группе АКШ был выше у больных с диабетом [303]. По сравнению с эрой баллонной ангиопластики, ангиопластика с использованием стентов без
лекарственного покрытия сократила в 2 раза необходимость в повторной реваскуляризации миокарда в течение 1 года, которая, тем не менее остается около 18% после ЧТА по сравнению
4,4% после АКШ [304, 305].
Метаанализ исследований, изучавших использование стентов, подтверждает факт уменьшения уровня смертности у пациентов с многососудистым поражением коронарного русла после АКШ по сравнению с ЧТА на протяжении от 5 до 8 лет. Более того, было показано уменьшение частоты рецидивов стенокардии и необходимости в повторной реваскуляризации миокарда [306]. При анализе исследованных групп пациентов с имплантированными стентами и без них была определена неоднородность внутри групп. С учетом данных исследований в эру, предшествующую стентированию, было отмечено снижение уровня смертности после АКШ, который не был очевиден для стентирования. В недавнем метаанализе четырех рандомизированных контролируемых исследований с ЧТА со стентированием, сравниваемых с АКШ, было установлено, что между этими процедурами нет каких-либо существенных отличий в отношении развития первичных конечных точек - летальный исход, ИМ или инсульт в течение года [307]. Однако данные Нью-Йорского регистра (New York Cardiac Registry) по более чем 60 000 пациентов показали, что при двухили более сосудистых поражениях венечных артерий выполнение АКШ приводит к значимому увеличению продолжительности жизни по сравнению с ЧТА [308]. Похожие данные были получены и в ходе более поздних исследований по сравнению АКШ и ангиопластики с использованием стентов с лекарственным покрытием [309].
Вышеуказанные исследования по сравнению ЧТА и АКШ были ограничены по одному или нескольким критериям:
•они были ограничены строго отобранной субпопуляцией пациентов (обычно отражающей не более чем 5% всех осмотренных пациентов);
•у них не было активного контроля за пациентами скринированными, но не рандомизированными;
•в них не использовались современные, стандартные техники выполнения АКШ и ЧТА.
В исследовании SYNTAX (SYNergy between PCI with TAXus and cardiac surgery) были учтены все вышеуказанные факторы. Было набрано 3075 пациентов с многососудистым поражением и/или стенозом ствола левой венечной артерии; 1800 пациентов, у которых было возможно выполнение хирургической реваскуляризации миокарда, были рандомизированы; 1077 пациентов, которым было выполнено АКШ из-за наличия противопоказаний к ЧТА, и 198 пациентов, которым выполнена ЧТА при наличии противопоказаний к АКШ, были включены в регистры. Первичной конечной точкой было сочетание всех случаев - летальность, цереброваскулярные события, подтвержденный ИМ или повторная реваскуляризации в течение 12 мес наблюдения. Исследование не подтвердило преимуществ ЧТА по отношению к АКШ по первичной конечной точке, которая соответственно составила 13,7% в группе ЧТА и 5,9% в группе АКШ. Это различие было в основном обусловлено высокой частотой выполнения повторной реваскуляризации миокарда (14,7 против 5,4%), хотя уровень смертности, развития инсультов и ИМ был одинаков (7,7 против 7,6% соответственно). Был установлен интересный факт, что частота развития инсультов в группе после АКШ была больше, чем после ЧТА (2,2 против 0,6%), в то же время частота развития ИМ в группе ЧТА была выше по сравнению с АКШ (4,8 против 3,2%) (рис. 17.30). Среди пациентов после АКШ первичная конечная точка составила 8,8%. Таким образом, с учетом того, что около трети больных были с многососудистым поражением или стенозом ствола левой венечной артерии, у данной категории больных, благодаря АКШ, были достигнуты превосходные результаты. Среди пациентов после ЧТА (из регистра ЧТА) первичная конечная точка составила 20,5%. У этих пациентов, однако, предоперационный риск был выше. Таким образом, выполнение ЧТА показано пациентам с противопоказаниями к АКШ, где ожидается развитие тяжелых сердечно-сосудистых осложнений. Интересно, что авторам удалось разработать новую шкалу оценки описания сложности поражений венечных сосудов, на основе которых можно было предопределить первичный результат. Среди пациентов с низким уровнем риска (что составляло 1/3 всех исследуемых больных) частота достижения первичной конечной точки была одинакова как в группе АКШ, так и ЧТА [316].
