
2 курс / Гистология / КОЛИЧЕСТВЕННАЯ_ОЦЕНКА_ИЗМЕНЕНИЙ_В_МИКРОСТРУКТУРЕ_ПЕРИНЕЙРОНАЛЬНЫХ
.pdfТакже PNN защищают нейроны [3], в том числе от оксидативного стресса [4, 17].
В работе [61] была исследована функция ХСПГ в поддержании правильной структуры аксонов Пуркинье в мозжечке взрослых здоровых крыс. Для этого исследовалась морфология и распределение интракортикальных нейритов Пуркинье после введения хондроитиназы ABC.
Окрашивание лектином WFA и антителами 2B6 показали, что хондроитиназа
ABC эффективно удаляла ХСПГ из обширных областей коры мозжечка. В
этих же участках имелось обильное разрастание концевых ветвей инфраганглионарного сплетения Пуркинье, прорастающих в более глубокие отделы зернистого слоя. Миелинизированные сегменты аксонов не были затронуты и сохранили свои нормальные взаимодействия с олигодендроглиальными оболочками. Прорастание аксонов Пуркинье было впервые заметно через 4 дня и еще больше увеличилось через 7 дней после применения фермента. В течение 42 дней характер экспрессии хондроитинсульфат протеогликанов постепенно восстанавливался, тогда как прорастание аксонов постепенно замедлялось. Эти результаты показывают,
что в отсутствие повреждений или новых внешних раздражителей деградации хондроитинсульфат протеогликанов достаточно, чтобы вызвать прорастание аксонов Пуркинье, но не образование длительных синаптических контактов. Вместе с другими ингибирующими рост молекулами, такими как миелин-ассоциированные белки,
хондроитинсульфат протеогликаны ограничивают структурную пластичность интактных аксонов Пуркинье, чтобы поддерживать нормальные паттерны синаптических сетей в коре мозжечка взрослого человека.
21
https://t.me/medicina_free
1.4. Механизмы влияния PNN на регенерацию и пластичность
ЦНС
Регуляцию пластичности ЦНС перинейрональными сетями при изменениях сенсорного входа, приобретении нового поведенческого опыта, а
также при посттравматической регенерации следует рассматривать как составную часть многокомпонентных изменений, связанных с перестройками синаптических сетей в мозге.
Формирующийся после травмы головного или спинного мозга глиальный рубец представляет собой результат комплексной трансформации ткани и ее архитектуры под действием миграции и пролиферации нескольких типов клеток [8, 83, 84]. В глиальном рубце наблюдается общее повышение количества протеогликанов, особенно ХСПГ, которое держится в течение длительного периода после травмы [61, 85, 86]. В частности, ряд исследований показал повышение уровня нейрокана, версикана и бревикана после повреждения ЦНС как у человека, так и у других млекопитающих [87, 57]. При этом некоторые исследования показали снижение уровня аггрекана после гемисекции спинного мозга [88, 89]. Также было обнаружено снижение уровня аггрекана, нейрокана и фосфакана в развивающемся глиальном рубце после черепно-мозговой травмы, наряду со значительным увеличением уровня мРНК версикана вокруг места поражения [90]. Возможно, что природа и место травмы определяют, как и какие именно протеогликаны будут менять свой уровень. В патологоанатомическом исследовании травмы спинного мозга человека (SCI) было обнаружено, что фосфакан и NG2
связаны с глиальным рубцом, в то время как нейрокан и версикан были обнаружены в эпицентре поражения, связанном с вторжением шванновских клеток [57]. Изменения во внеклеточном матриксе наблюдались и вдали от места поражения. После травмы дорсального корешка в зоне его входа наблюдается резкое увеличение уровня бревикана, нейрокана и версикана
(V1 и V2), но в дорсальном столбе увеличение уровня нейрокана и бревикана меньше, медленнее и менее заметно [91].
22
https://t.me/medicina_free
Помимо общемго повышению уровня различных ХСПГ после травмы также происходят претерпиватю изменения и сульфатирования остатков хондроитин сульфатов. На рис. 3 показаны наиболее распространенные сульфатированные изоформы ХС.
Основная дисахаридная субъединица хондроитин сульфата состоит из
GlcA и N-ацетилгалактозамина. Сульфатирование ХС происходит по углероду (C-) 2 или 3 остатка GlcA и C-4 или C-6 остатка GalNAc.
Комбинация одного или нескольких сульфатирований в разных местах двух субъединиц сахара приводит к появлению различных изоформ ХС. Наиболее известным ХС-ГАГ является хондроитин-4-сульфат. В некоторых статьях также указывалось на активацию в поврежденном мозге 4,6-сульфата, 6-
сульфата и 2-сульфата [92, 93, 94].
Считается, что ХС-ГАГ препятствуют регенерации нейронов после повреждения. Это было продемонстрировано многочисленными исследованиями, в которых происходило расщепление хондроитиназой ABC.
Однако определенные изоформы ХС на самом деле могут способствовать регенерации нейронов: Роллс и др. показали, что дисахариды ХС,
образующиеся в результате расщепления хондроититназой ABC,
индуцируют рост нейритов и защищают нейроны от нейрональной токсичности и коллапса аксонов in vitro [95].
Эксперименты по культивированию гранулярных нейронов мозжечка мыши на различных ХС-ГАГ показали, что хондроитин-6-сульфат (CS-C) не оказывал такого сильного отрицательного воздействия на нейроны, как хондроитин-4-сульфат (CS-A) [94].
23
https://t.me/medicina_free
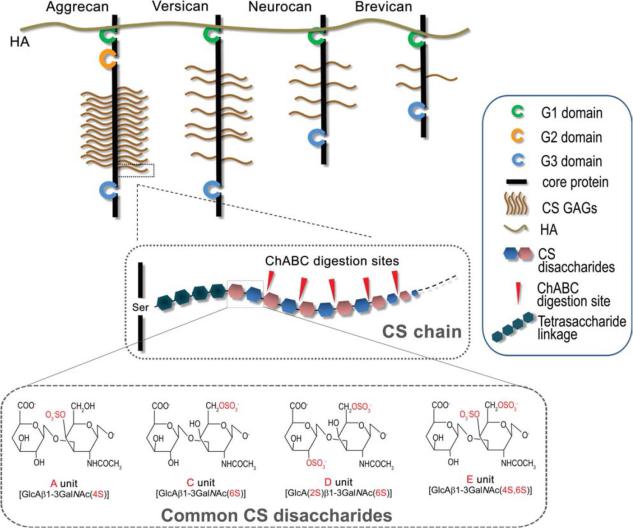
Рисунок 3. Структура некоторых хондроитин сульфатов. Заимствовано из Kwok J. C. F.,
«Extracellular matrix and perineuronal nets in CNS repair» (2011) [8]
Влияние биохимического состава глиального рубца на посттравматическую регенерацию.
В целом, активация ХСПГ после повреждения ЦНС создает барьер для регенерации, а также ограничивает пластичность. Реактивные астроциты и клетки-предшественники олигодендроцитов активируют ХСПГ и оказывают зависимое от ХС-ГАГ ингибирующее действие на рост аксонов нейронов ганглия задних корешков (DRG) [8, 54, 96]. Распространённым способом воздействия на ХСПГ в различных частях ЦНС, включая, глиальные рубцы,
является применение хондроитиназы ABC, которая представляет собой бактериальный фермент, выделенный из Proteus vulgaris [97]. Он расщепляет
24
https://t.me/medicina_free
CS A, B и C путем реакции исключения с образованием D4,5-ненасыщенных дисахаридов. Исследования показали, что удаление цепей ХС из ХСПГ делает их менее ингибирующими [98, 99, 100]. После введения хондроитиназы ABC криосрезы из поврежденного спинного мозга взрослых крыс поддерживают лучшую регенерацию аксонов DRG [101]. Результаты исследований действия хондроитиназы ABC in vitro создали предпосылки для изучения эффектов этого фермента в нервной ткани и в поведенческих моделях. В различных моделях широко наблюдались стимуляция посттравматической регенерации в головном и спинном мозге после введения хондроитиназы ABC [58, 59, 102,103, 104].
Помимо стимулирования регенерации поврежденных аксонов после инъекции хондроитиназы ABC in vivo, обширные данные также показывают,
что она способствует анатомической пластичности поврежденной ЦНС,
главным образом, вызывая прорастание поврежденных аксонов и дендритов.
В сочетании с инъекцией мозгового нейротрофического фактора (BDNF)
хондроитиназа ABC способствует прорастанию неповрежденных аксонов сетчатки в денервированные верхние холмики после частичного повреждения сетчатки [62]. Инъекция хондроитиназы ABC в модели шейного дорсолатерального рваного повреждения индуцировала функциональное коллатеральное прорастание сенсорных волокон в частично денервированные клиновидные ядра, а электрофизиологические исследования рецептивных полей в клиновидном ядре затем выявили значительное увеличение областей, реагирующих на стимуляцию передних конечностей при введении хондроитиназы ABC, что указывает на что эти прорастающие сенсорные афференты образуют функциональные связи [64].
Дополнительные доказательства повышенной пластичности спинномозговых синаптических сетей при применении хондроитиназы ABC были продемонстрированы в исследовании повреждения периферических нервов
[105]. У взрослой крысы перерезали локтевой и срединный нервы передней конечности, а культи разорванных нервов хирургическим путем сшивали
25
https://t.me/medicina_free
либо правильно, либо перекрестно (т. е. культю локтевого нерва сшивали с культей срединного нерва). Животным давали возможность восстановиться в течение 4 недель, после чего им делали однократную инъекцию хондроитиназы ABC в передний рог спинного мозга. Последующие поведенческие тесты показали, что функциональные нарушения,
возникающие в результате неточной реиннервации в пораженных передних конечностях, могут быть преодолены однократной инъекцией хондроитиназы ABC в спинной мозг. Инъекция хондроитиназы ABC привела к уменьшению ХСПГ, удалению PNN вокруг пула спинальных двигательных нейронов, усилению прорастания и восстановлению функции передних конечностей. Этот эксперимент предполагает, что изменения в ВКМ и PNN в
спинном мозге позволяют адаптировать спинальные синаптические сети к периферической стимуляции и способствуют функциональному восстановлению [105]. Эти исследования показывают, что ХСПГ ингибируют потенциальные пластические изменения в спинном мозге и что воздействие хондроитиназы ABC делает спинной мозг более пластичным,
позволяя формировать новые синаптические сети.
Хондроитиназа ABC также применялась к моделям ТСМ у других млекопитающих, в том числе у кошек. После гемисекции грудного отдела спинного мозга повторные интраспинальные инъекции хондроитиназы ABC
у кошек индуцировали расщепление ХСПГ in vivo, ускоряли восстановление поведения (ходьба по лестнице и шагание по доске), улучшали кинематические движения задних конечностей и повышали серотонинергическую иммунореактивность на ростральных границах травмы
[106, 107].
Взаимосвязь между PNN, пластичностью и критическим периодом наблюдалась не только в спинном мозге, но и в других частях ЦНС. Плотные внеклеточные PNN окружают субпопуляции нейронов в то время, когда стабилизируются синаптические связи и заканчивается критический период,
например, из зрительной коры и бочонковой коры [1, 2, 108].
26
https://t.me/medicina_free
Критический период в зрительной коре.
После окончания критического периода нейрональная пластичность значительно ослабевает в целом ряде отделов ЦНС. Эти изменения хорошо согласуются с повышение экспрессии ХСПГ и изменением паттернов сульфатирования ГАГ, в том числе в зрительной коре [2, 66]. В зрительной системе если в течение критического периода один глаз по каким-то причинам не получает информации (например, он был зашит) происходит сдвиг глазного доминирования, при котором кора обоих полушарий становится более чувствительна к оставшемуся открытому глазу [8]. Этот сдвиг не произойдет, если монокулярная депривация начнется после окончания критического периода. Удаление ХС-ГАГ с помощью хондроитиназы ABC у взрослых животных повторно открывает критический период, реактивируя пластичность глазного доминирования после монокулярной депривации [2], подразумевая, что Chase ABC может реактивировать состояние высокой пластичности в ЦНС. У крыс,
перенесших монокулярную депривацию в критический период, во взрослом возрасте ожидается минимальное восстановление реакции коры на депривацию глаза. Однако, если хондроитиназа ABC вводилась в
комбинации с монокулярной зрительной депривацией, когда ранее не депривированный глаз был зашит, чтобы принудительно использовать ранее лишенный депривации глаз во время инъекции Chase ABC, наблюдалось полное восстановление остроты зрения и плотности дендритных шипиков
[109]. Эти результаты позволяют сделать вывод, что Chase ABC создает тканевой биохимический контекст, благоприятный для нейрональной пластичности, стимулированной обучением. Существование критического периода зрительной системы было продемонстрировано у многих млекопитающих, включая мышей, кошек и людей, у которых воздействие зрительных стимулов в раннем возрасте считается критическим для правильного развития зрительной системы. Исследование зрительной системы кошек продемонстрировало уменьшение количества аггрекан-
27
https://t.me/medicina_free
положительных PNN у взрослых кошек, у которых постнатально экспериментально выработали косоглазие и амблиопию (рассечение сухожилия латеральной прямой мышцы к одному глазу и блокада зрительных нервов) [110]. Это исследование продемонстрировало изменения в зрительной системе кошек, связанные с активностью, как до, так и после окончания критического периода, предполагая, что зависящие от активности изменения PNN и пластичности возможны даже у взрослых животных. Этот результат был подтвержден на крысах; у взрослых крыс с амблиопией и длительной монокулярной депривацией в критический период восстановились острота зрения и кортикальные реакции на депривированный глаз после обратного сшивания и обогащения среды. Это сопровождалось уменьшением количества PNN в зрительной коре [111].
В целом исследования зрительной системы согласуются с гипотезой о том, что PNN ограничивают пластичность во время постнатального развития.
Они также демонстрируют взаимодействие между сенсорным опытом и формированием и поддержанием PNN. Соответствующие сенсорные стимулы важны для запуска формирования PNN, которые, в свою очередь,
действуют как тормоз в ЦНС, чтобы остановить дальнейшие изменения в ответ на изменение сенсорного входа.
Роль PNN в выработке условных рефлексов.
Современное состояние исследований физиологической роли PNN
позволяет говорить о разностороннем влиянии этого типа внеклеточного матрикса на пластичность ЦНС. У взрослых животных выработка страха путем сочетания нейтрального сигнала с болевым сигналом создает постоянную память, которая может быть временно подавлена при тренировке, но в конечном итоге устойчива к стиранию. Напротив, во время раннего постнатального развития семь дней тренировки угасания после выработки условного рефлекса страха вызывают стирание условной памяти.
Сила памяти также снижена у этих животных без тренировки угасания, что подразумевает активную защиту воспоминаний о страхе у взрослых [112].
28
https://t.me/medicina_free
Расщепление PNN с помощью хондроитиназы ABC в базально-латеральной миндалине взрослых мышей позволяет впоследствии стирать память о страхе с помощью тренировки угасания, что позволяет предположить, что PNN
важны для формирования долговременной стабильной памяти страха у взрослых.
Молекулярные механизмы физиологических функций PNN.
Главный эффект PNN, вероятно, заключается в ограничении образования новых нейронных контактов [8]. Прорастание и реиннервация после деградации PNN были продемонстрированы в нескольких моделях повреждений [64, 113]. Хондроитиназа ABC разрушает ХС-ГАГ в PNN, что способствуетет формированию новых синапсов и повышению пластичности
[60, 64, 114]. Молекулярные механизмы, лежащие в основе ингибирующих эффектов ХС-ГАГ, могут быть (1) прямым взаимодействием через рецептор ХС-ГАГ, (2) механизмом, при котором ХС-ГАГ превращают PNN в
непермиссивный/непропускающий субстрат для интегринов или других белков в адгезии и механизм роста или (3) непрямое взаимодействие, при котором ХС-ГАГ взаимодействует с белками, ингибирующими рост, и
обеспечивает их контакт с аксонами. Некоторое время назад было обнаружено, что контактин-1 [115] и RPTPδ [116] являются рефепторами,
взимодействующими с ХС. Трансмембранный рецептор RPTPδ с высокой аффинностью связывается с нейронными ХСПГ, такими как нейрокан и аггрекан. Роль RPTPδ в ингибировании роста нейронов убедительно демонстрируется надежной регенерацией при нокауте RPTPδ (-/-) после ТСМ
[116, 117]. Поскольку RPTPδ способен по-разному взаимодействовать с ХС, а
также с ХС-ГАГ, возможно, что взаимодействующие ГАГ определяют биологический эффект RPTPδ на рост [118]. При этом есть также предположения, что степень и характер сульфатации важны для регенерации после травмы [92, 94].
Второй потенциальный механизм угнетения регенерации аксонов и синапсов может заключаться в контроле активации интегрина. Интегрины
29
https://t.me/medicina_free
опосредуют адгезию и рост нейронов, но их стимулирующая рост активность сильно зависит от субстрата, к которому прикреплены нейроны.
Нейрональные клетки, растущие на субстрате, покрытом ХСПГ, таким как аггрекан, демонстрируют ингибирование роста, сопровождающееся снижением активации интегрина [119]. Ингибирование преодолевалось за счет активации экспрессии интегрина или повышенной активации интегрина с использованием активирующих антител [120, 121]. В некоторых системах негативные эффекты ХСПГ на активацию интегрина и взаимодействие с субстратом были уменьшены с помощью Chase ABC [119], что подразумевает, что ХС ГАГ модулируют активацию интегрина. Однако о прямом взаимодействии между интегринами и ХС-ГАГ не сообщалось.
Примером аккумуляции внеклеточных ингибиторных лигандов в PNN
является связывание молекулы семафорина 3A с PNN [122, 69]. Sema3A
локализуется в структурах PNN, и локализация зависит от фрагмента ХС-
ГАГ. Связывание отталкивающей направляющей молекулы Sema3A с PNN
может объяснить их эффекты на ингибирование роста и динамику синапсов.
Это свидетельствует о том, что биологический эффект взаимодействия лиганд-ГАГ может меняться в зависимости от типа и структуры ГАГ [123].
30
https://t.me/medicina_free
