
2 курс / Гистология / ВОЗМОЖНОСТИ_ЖИДКОЙ_БИОПСИИ_В_СОВЕРШЕНСТВОВАНИИ_ПРОГНОЗА_ТЕЧЕНИЯ
.pdf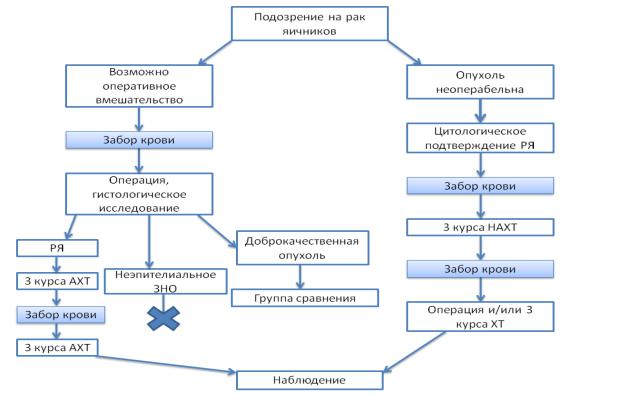
41
-острые и хронические сопутствующие заболевания любой этиологии в стадии обострения;
-неэпителиальная злокачественная опухоль яичников.
2.1. Дизайн исследования
В экспериментальную группу включались пациентки, соответствовавшие
нижеперечисленным критериям (рис. 3):
-возраст старше 18 лет;
-впервые выявленная злокачественная эпителиальная опухоль яичников;
-гистологическая либо цитологическая верификация диагноза;
-отсутствие в анамнезе других злокачественных опухолей, за исключением тех, у которых срок ремиссии составлял >5 лет после радикального лечения;
-отсутствие острых и хронических в стадии обострения сопутствующих заболеваний любой этиологии.
Рисунок 3. - Дизайн исследования. Образцы периферической крови получали стандартной пункцией локтевой вены (РЯ - рак яичников, НАХТ - неоадъювантная химиотерапия, АХТ - адъювантная химиотерапия)
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
42
На основании этих критериев в работу была включено 114 пациенток с диагнозом рака яичников (РЯ).
Группу сравнения составила 31 пациентка с доброкачественными опухолями яичников, получавшие хирургическое лечение в гинекологическом отделении ГУЗ ОКОД г. Ульяновска, не имевшие острых и хронических в стадии обострения сопутствующих заболеваний любой этиологии и любой злокачественной патологии в анамнезе. При исследовании уровней цитокинов также учитывались показатели контрольной группы (n=14), которую составили здоровые добровольцы женского пола в возрасте 56 (53-70) лет.
Медиана возраста пациенток с РЯ составила 61 (IQRQ1-Q3 53-69) лет.
Медиана возраста пациенток с доброкачественными опухолями яичников составила 57 (IQRQ1-Q3 50.5-67.25) лет.
Первый образец крови у всех пациенток получали до начала какого-либо противоопухолевого лечения. Затем, в зависимости от возможности выполнения оперативного вмешательства в объеме оптимальной либо полной циторедукциисогласно критериям Российского Общества Клинической Онкологии (RUSSCO) на первом этапе пациентки распределялись на две группы:
1. В первой группе согласно действующим клиническим рекомендациям проводилось хирургическое лечение - лапаротомия, экстирпация матки с придатками, оментэктомия. На данном этапе 3 пациентки были исключены из исследования: у 1 по результатам гистологического исследования операционного материала опухоль яичников была злокачественной неэпителиальной и у 2
присутствовала синхронно развивавшаяся опухоль тела матки.
Если по результатам исследования операционного материала гистологически опухоль оказывалась доброкачественной, анализ крови пациентки учитывался в группе сравнения. Если подтверждался диагноз рака яичников, анализ учитывался в экспериментальной группе, а пациентке проводили 6 курсов адъювантной химиотерапии (АХТ) с оценкой эффекта. После 3-го курса АХТ осуществлялся повторный забор крови для оценки параметров в динамике. Химиотерапию в режиме АХТ получала 41 пациентка.
43
2. Во второй группе (неоперабельные на первом этапе пациентки по оценке мультидисциплинарного консилиума) проводилось полное клиническое обследование пациентки и цитологическое исследование материала, полученного при пункции заднего свода влагалища и/или лапароцентезе, а также забор крови.
На данном этапе из исследования были исключены 2 пациентки: у 1
обнаружилась злокачественная опухоль желудка при ФГДС с биопсией, у 1 - рак толстой кишки при ФКС с биопсией.
В случае наличия клеток аденокарциномы в брюшной полости и при отсутствии иных возможных источников данных клеток, кроме опухоли яичника,
проводилась неоадъювантная химиотерапия (НАХТ) с оценкой эффекта. Если была достигнута операбельность опухоли, пациентке проводилось хирургическое лечение, а затем завершение первой линии химиотерапии (ХТ) до 6 курсов в общей сложности. Если операбельность не была достигнута, лечение ограничивалось 6 курсами лечебной ХТ. Повторный забор крови проводился после 2-4 курса ХТ (во всех случаях - до хирургического вмешательства).
Химиотерапию в режиме НАХТ получала 81 пациентка.
В обеих группах в первой линии использовалась схема ХТ ТР: паклитаксел
175 мг/м2внутривеннов течение 3 часов в1-й день, карбоплатин AUC 6
внутривеннов течение 1 часа в 1-й день каждые 3 недели. Каждые 2 курса проводилась оценка эффекта при помощи УЗИ органов брюшной полости и малого таза, рентгенографии органов грудной клетки в двух проекциях, анализе уровня СА-125 в сыворотке крови, по показаниям - МРТ органов малого таза.
Эффективность ХТ при наличии измеримых опухолевых масс оценивали по шкале RECIST 1.1 [128], согласно которой:
полный ответ - это исчезновение всех целевых очагов, наименьший диаметр лимфатических узлов не более 10 мм;
частичный ответ - уменьшение суммы диаметров целевых очагов на 30% и
более;
прогрессирование заболевания - увеличение суммы диаметров очагов на 20% (5 мм) и более, либо появление новых очагов;
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
44
стабилизация - уменьшение суммы очагов менее, чем на 30% либо увеличение менее, чем на 20,0%.
При принятии клинических решений также учитывали динамику изменения объема опухолевого асцита.
Циторедуктивное хирургическое вмешательство удалось произвести 73
пациенткам в общей когорте, в том числе 33 пациенткам из группы НАХТ; в 6
случаях циторедукция была расценена как неоптимальная, в остальных случаях -
оптимальная. Шести пациенткам хирургически удалось произвести только биопсию очагов. У 41 пациентки, получавшей НАХТ, не было попыток хирургического лечения, так как наступило прогрессирование на фоне ХТ (25
случаев) либо произошла стабилизация болезни в неоперабельном по данным обследований состоянии (16 случаев). Одна пациентка, получавшая НАХТ,
выбыла из наблюдения после начала ХТ.
В процессе проведения статистического анализа учитывались следующие клинические данные:
-возраст на момент первичной диагностики;
-стадия опухолевого процесса согласно классификациям AJCCTNM 8
издания (2016) и FIGO (2015) [134];
-наличие асцита на момент первичной диагностики;
-уровень СА-125 в сыворотке крови до лечения;
-количество лейкоцитов, тромбоцитов в крови до начала лечения;
-гистологический подтип и дифференцировка опухоли (при наличии гистологического анализа) согласно классификации эпителиальных опухолей яичника ВОЗ (2014) [171];
-степень лечебного патоморфоза (в группе НАХТ) по шкале S. Bohm [95],
где:
а) CRS1 - отсутствие ответа либо минимальный ответ. В основном
жизнеспособная опухоль с минимально выраженными очаговыми фиброзно-
воспалительными изменениями;
45
б) CRS2 - заметный ответ на фоне жизнеспособной опухоли. Фиброзно-
воспалительные изменения от мультифокальных до диффузных сочетаются с легко идентифицируемой жизнеспособной опухолью;
в) CRS3 - полный или почти полный ответ. Остаточная опухоль не наблюдается либо присутствует очагово в виде клеток, групп клеток или узлов до
2мм;
-клиническая платиночувствительность согласно критериям GCIG 4-th Ovarian Cancer Consensus Meeting [164], учитывая длительность интервала от последнего введения препарата платины в первой линии до прогрессирования/рецидива болезни: бесплатиновый интервал >6 месяцев считали признаком платиночувствительной опухоли; интервал <6 месяцев -
платинорезистентной опухоли; прогрессирование во время платиносодержащей химиотерапии первой линии либо интервал менее 4 недель -
платинорефрактерной опухоли (платинорезистентные и платинорефрактерныеопухоли для статистических подсчетов объединялись в группу „платинонечувствительные‟).
После окончания первичного лечения пациентки оставались под динамическим наблюдением (осмотр гинеколога, контроль СА-125, УЗИ органов малого таза 1 раз в 3 месяца, МРТ органов малого таза по показаниям). При наличии показаний к применению и доступа к препарату часть пациенток (n=14)
также получала поддерживающую терапию бевацизумабом, что учитывалось при статистическом анализе.
2.2 Определение количества циркулирующих опухолевых клеток различного фенотипа
2.2.1 Подсчет ЦОК эпителиального и мезенхимального фенотипов в крови
В ходе исследования был произведен подсчет количества ЦОК методом проточной цитометрии с использованием тройной флуоресцентной метки на приборе Cytoflex S (BeckmanCoulter, США).
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
46
Выделение мононуклеарной фракции клеток производили методом центрифугирования на градиенте фиколла (плотность 1,077см3). Окрашивание проводили моноклональными антителами (МКА) к лейкоцитарному антигену
CD45, мечеными FITC (BioLegend, США), МКА к эпителиальному мембранному антигену EpCAM (CD326), мечеными Pe-Cy7 (BioLegend, США), первичными МКА к цитокератинам 8,18 (Abcamplc., Великобритания), с использованием вторичных антител меченыхBV421 (BioLegend, США); МКА к маркеру мезенхимальных клеток (Vimentin), мечеными AlexaFluor647 (BioLegend, США);
также использовали изотипический контроль (таблица 1).
1.Цельную кровь (9мл), стабилизированную цитратом натрия,
разбавлялифосфатно-солевым раствором Дульбекко (DPBS) в соотношении 1:1.
2. Разбавленную кровь наслаивали в пробирках на слой фиколла
(соотношение 2мл крови на 1 мл фиколла).
3.Пробирки центрифугировали при 500 х g 40 минут.
4.Слой мононуклеарной фракции клеток над фиколлом переносили в чистую пробирку и промывали дважды DPBS 500 х g при 40С.
5.Окрашиваниефлюоресцентномечеными антителами отмытых клеток проводили в рабочем растворе DPBS c 1,0% фетальной бычьей сыворотки (FBS)в
концентрации 0,25мг/1млн.кл.
6.500тыс. клеток перерастворяли в рабочем растворе (плотность клеток 5-
10х106 клеток на мл раствора). Добавляли по 2,5 мкл антител при совместном
окрашивании.
7.Для контроля одиночного окрашивания готовили по 250 тыс. клеток того же образца для каждого антитела. Добавляли по 1,25 мкл антител.
8.Инкубировали на льду при 40С 40минут под фольгой.
9.После инкубации образцы промывали DPBS c 1,0% FBS путем центрифугирования.
10.Анализ на проточном цитометре.
47
Обработка результатов проводились с помощью программы CytExpert Software. Анализировали не менее 100000 событий в секторе живых клеток мононуклеарной фракции.
В качестве контроля фоновой флуоресценции клетокиспользовали суспензию неокрашенных антителами клеток. На графике по уровню прямого и бокового светорассеивания (FSC-A и SSC-A) устанавливали целевую популяцию P1. Затем на графике по FCS-W и FSC-H определяли популяцию одиночных клеток,
исключаяя дуплеты и слипшиеся клетки, обозначив как P2. По контрольным пробиркам с одиночным окрашиванием выставляли границы флуоресценции на каналах, соответствующих флуоресцентной метке моноклонального антитела.
Для разделения лейкоцитарных фракций крови и атипичных клеток нелейкоцитарной природы использовали дискриминацию по уровню связывания с
CD45. Отрицательную по данному признаку популяцию использовали для дальнейшего анализа. Для идентификации циркулирующих клеток с эпителиальным фенотипом использовали двойную дискриминацию клеток с высоким уровнем CK и EpCAM. Для идентификации циркулирующих клеток с мезенхимальнымфенотипомиспользовали дискриминацию клеток с высоким уровнем экспрессии Vimentin и без сигнала флуоресценции по эпителиальным маркерам (EpCam и CK).
Подсчитано количество клеток с фенотипом CD45-/EpCAM+/CK+, CD45- /EpCAM+/Vimentin-, CD45-/EpCAM-/Vimentin+, CD45-/CK-/Vimentin+, CD45- /Vimentin+.
2.2.2. Подсчет ЦОК стволового фенотипа в крови
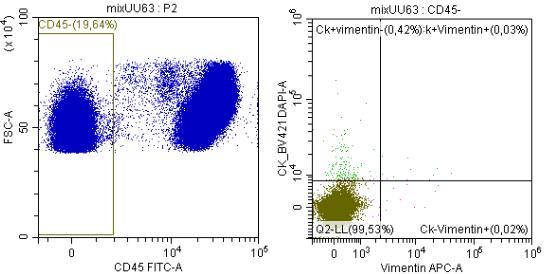
Окрашивание проводили моноклональными антителами (МКА) к
лейкоцитарному антигену CD45, мечеными FITC (BioLegend, США) (рис.4), МКА к CD44, мечеными APC (BioLegend, США), МКА к CD133, мечеными VioBright 667 (Miltenyibiotec, Германия), и МКА к ALDH, мечеными FITC (Stemcell, Корея);
также использовали изотипический контроль для всех антител, кроме ALDH,
имевшего внутренний контроль в составе набора (таблица 2).
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
48
Рисунок 4. - Негативная селекция клеток по экспрессии CD45
Подготовка образцов для анализаALDH1 включала окраску образцов моноклональными антителами в соотношении 5 мкл на 1*10^6клеток (2,5 мкл на
0,5*10^6кл), разведенных в DPBS с содержанием 1,0% FBS. Инкубировали в течение 40 минут, проводили отмывку антител (центрифугирование при 400-500g
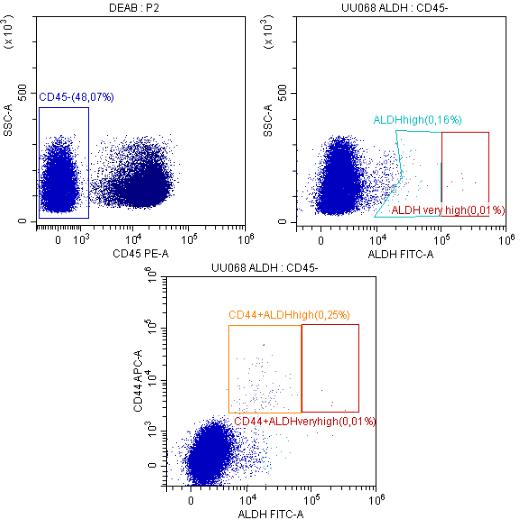
5 минут). Для идентификации клеток с высоким уровнем активностиальдегиддегидрогеназы1 (ALDH1) в крови пациентов использовали коммерческий набор ALDEFLUORТМKit (STEMCELLTechnologies, Канада),
предназначенный для идентификации клеток с высоким уровнем экспрессии фермента. Готовили пары контрольных и тестовых пробирок, с подготовленными для анализа клетками в концентрации 1*10^6кл./мл, перерастворенные в коммерческом буфере, добавляли 5мкл ALDEFLUORDEAB– ингибиторALDH1 -
в пробирки, маркированные как контрольные, и 5мклактивированного реагента
ALDEFLUOUR в тестовые пробирки (2,5 мкл на 0,5*10^6кл). Перемешивали и немедленно переносили 500 мклсмеси (250 мкл на 0,5*10^6кл) в контрольную пробиркуDEAB. Образцы инкубировали в течение 40 минут при 370С.Отмывали и переразводили образцы в коммерческом буфере для дальнейшего анализа. По интенсивности флюоресценции на канале ALDH клетки внутри популяции CD45-
были поделены на ALDH intermediate и ALDH high, где ALDH intermediate -
клетки расположены посередине, ALDH high – клетки расположены правее на
49
канале интенсивности флюоресценции Fitc в пределах гейта, выставленного по пробирке с DEAB. Данные гейты применяли для анализа (рис.5).
Подсчитывали количество клеток популяций CD45-/CD44+, CD45-/CD133+, CD45-/CD44-/CD133+, CD45-/CD44+/CD133-, CD45-/CD44+/CD133+, CD45- /ALDHhigh, CD45-/ALDHveryhigh, CD45-/CD44+/ALDHhigh, CD45- /CD44+/ALDHveryhigh, а также CD45+/ALDHhigh и CD45+/ALDHveryhigh.
Рисунок 5. - Оценка экспрессии стволовых маркеров в ЦОК
2.2.3. Подсчет ЦОК стволового фенотипа в асцитической жидкости
1.Асцитическую жидкость, полученную при лапароцентезе,
центрифугировали в течение 10 минут при 1500 об/мин.
2.Обогащенный клетками асцит фиксировали в 40% забуференном растворе формалина.
3.Выделение ЦОК было проведено согласно протоколу, описанному выше,
начиная с пункта 5. Использовались те же антитела к CD45, CD44 и CD133
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
50
(таблица 2). CD45 использовали для негативной селекции. Подсчитывали количество клеток популяций CD45-/CD44+, CD45-/CD133+, CD45-/CD44- /CD133+, CD45-/CD44+/CD133-, CD45-/CD44+/CD133+.
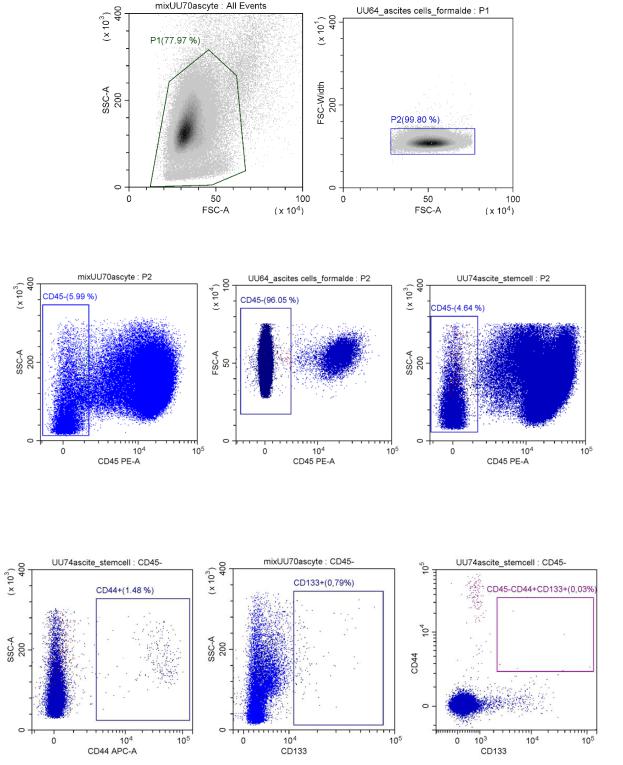
По уровню прямого и бокового светорассеивания устанавливалицелевуюпопуляцию (рис.6, 7, 8).
Рисунок 6. - Примеры дискриминации дуплетов и конгломератов клеток. Далее анализировали P2
Рисунок 7. - Дискриминация клеток асцита РЯ в ходе проточной цитометрии по уровню связывания с CD45. Отрицательную по данному признаку популяцию использовали для дальнейшего анализа
Рисунок 8. - Идентификация клеток CD44+, CD133+, CD44+CD133+ среди CD45- в асците РЯ в ходе проточной цитометрии
