
- •введение
- •санационная бронхоскопия
- •регионарная лимфатическая терапия
- •терапия лазерным облучением
- •лазерная фотокоагуляция
- •озонотерапия
- •NO-терапия
- •аргоноплазменная коагуляция
- •радиоволновая хирургия
- •Глава III. Патология органов дыхания
- •Хроническая обструктивная болезнь легких
- •Абсцедирующая пневмония
- •Легочное кровотечение
- •патогенез и патологическая анатомия
- •клинические варианты легочного кровотечения
- •диагностика
- •лечение
- •Доброкачественные опухоли легких
- •Бронхоплевральные свищи
- •эндоскопическая ваготомия
- •озонотерапия
- •Остановка желудочно-кишечного кровотечения
- •инъекционный метод
- •электрокоагуляция
- •лазерная фотокоагуляция
- •аргоноплазменная коагуляция
- •комплексный эндоскопический гемостаз и NO-терапия
- •Удаление инородных тел
- •Заключение
- •Список литературы
На основании нашего первого опыта применения оксида азота во время ЭГДС для лечения больных язвенной болезнью желудка и двенадцатиперстной кишки, можно сделать предвари тельные выводы о том, что включение оксида азота в комплекс ную противоязвенную терапию способствует сокращению сро ков лечения больных язвенной болезнью желудка и двенадцати перстной кишки в среднем на 11 ±0,4 дн. Данное лечение можно проводить в амбулаторных условиях.
Остановка желудочно-кишечного кровотечения
Обоснование применения NO-терапии при желудочнокишечном кровотечении
Наиболее актуальной проблемой хирургии является крово течение из острых и хронических язв желудка и двенадцатипер стной кишки в связи с тяжелыми послеоперационными осложне ниями! и высокой летальностью, достигающей 8 - 25% (Григорьев С.Г. и соавт., 1999).
Исследования патоморфологии язвенной болезни, ослож ненной кровотечением, достаточно полно представлено в лите ратуре (Логинов А.С. и соавт., 1993; Аруин Л.И. и соавт., 1998). Большинство авторов, давая описание морфологии слизистой оболочки желудка, уделяют внимание изучению различных на рушений, возникающих в результате язвенной болезни, в попу ляции клеток слизистой оболочки, межуточной ткани, лимфо идной инфильтрации, сдвигам в системе окислительновосстановительных ферментов. Известно, что желудочные кро вотечения сопровождаются циркуляторной гипоксией и вызы
вают |
морфологические |
изменения структуры |
органа, кото |
рые |
могут привести к |
нарушениям I процессов |
регенерации |
(Меерсон Ф.З., 1993). |
;: |
|
|
Процессы репаративной регенерации тканей при гастродуоденальных кровотечениях играют важную роль, поскольку у этих больных нередко возникает необходимость в операции. Развивающаяся в результате кровопотери очаговая ишемия влияет не только на нарушения процессов клеточного метабо лизма, но и ведет к поражению структурных компонентов в со ответствующих участках органа. В первую очередь нарушения связаны с изменениями ангиоархитектоники, следствием чего является резкое снижение трофики тканей. Если патологические процессы в кровеносных микрососудах описаны в единичных
114
монографиях, посвященных этому вопросу (Сацукевич В.Н. и соавт., 1999 ), то описание процессов восстановления системы микроциркуляции стенки желудка, т.е. неоваскулогенез, практи чески полностью отсутствует.
Гемомикроциркуляторное русло желудка и двенадцатипер стной кишки имеет сложную систему пространственной органи зации. С помощью методов СЭМ, геометрия кровеносных мик рососудов подробно изучена (Волкова О.В. и соавт., 1987; Ефименко Н.А. и соавт., 2003).
Одной из важных проблем восстановления трофики органа в результате кровотечения является процесс ангиогенеза, т.е. фор мирование новых сосудистых образований взамен утраченных в результате ишемии участка стенки желудка или двенадцатипер стной кишки. Репаративная регенерация эндотелия кровеносных микрососудов имеет важное клиническое значение. Конечной целью фундаментальных исследований ; регенерации должна стать разработка подходов к управлению этим процессом с це лью профилактики таких грозных осложнений, как кровотече ние. Однако очевидно, что достижение поставленной цели не возможно без решения ключевого вопроса о механизмах регуля ции восстановления эпителиальной выстилки. Первичным фак тором регуляции является контактное взаимодействие эндотелиальных клеток в пласте. Изучение регенерации эндотелия in vitro (т.е. в условиях, исключающих большинство внешних влияний) продемонстрировало поразительное сходство с процессами, происходящими в целостном организме, что, очевидно, позволя ет выдвинуть предположение о базисной роли именно внутриэндотелиальных межклеточных взаимодействий в динамике репа рации.
В качестве основных информационных параметров при ана лизе репаративных процессов логично, очевидно, использовать показатели топографии пролиферирующих эндотелиальных клеток, а также их контактные взаимодействия.
Фрагментарность и разноречивость сведений о пространст венном распределении делящихся эндотелиальных клеток не по зволяет составить определенного мнения на этот счет. Макси мальное включение тимидина обнаружено после криоповреждения на краю эндотелиального пласта. При механическом повре ждении зона пролиферации простиралась далеко за пределы первоначального дефекта, и наибольший индекс меченых ядер наблюдался на расстоянии 2,9 мм от границы дефекта (Schwartz S.M. и соавт., 1977). Через 2 сут после повреждения эндотелия с помощью высушивания эндотелиальные клетки на краю пласта
115
не метились тимидином, зато обнаруживалось много меченых эндотелиальных клеток в отдалении от края раны: через 7 сут картина менялась на противоположную. После повреждения эн дотелия атравматической иглой максимальная пролиферация наблюдалась у края раны, но в реакцию вовлекались и значи тельно удаленные от него участки ткани. In vitro максимальный индекс меченых ядер определялся у края дефекта монослоя. Скорее всего, отсутствие единства результатов разных авторов обусловлено применением различных моделей деэндотелизации (Рехтер М.Д., Миронов А.А., 1990). §
Какие же факторы выступают в качестве инициаторов неоваскулогенеза? В качестве инициаторов роста сосудов выступает огромное число самых разнообразных факторов, которые обо значены термином «индукторы ангиогенеза» (Куприянов В.В. и соавт., 1993). Можно выделить три группы факторов, прини мающих участие в ангиогенезе: 1) физические - связанные боль шей частью с воздействием потока крови, кровяного давления или натяжения тканей; сюда же должны быть отнесены электро магнитные - показано, что пульсирующее электромагнитное по ле вызывает формирование почек роста и образование просвета в культивируемых эндотелиальных клетках, температурные, ра диационные и другие; 2) химические - обусловленные воздейст вием различных веществ или изменением химического состава тканей; 3) биологические - наследственные, иммуногенные и
другие.
С другой стороны, среди индукторов ангиогенеза выделяют стимуляторы ангиогенеза — прямого действия, которые инду цируют рост сосудов вне зависимости от взаимодействия их с клетками других типов, и ангиогенные факторы — непрямого действия, влияние которых опосредуется через взаимодействие с другими клеточными формами, например, макрофагами. По следние при таком взаимодействии секретируют стимуляторы ангиогенеза. В зависимости от механизма действия стимуляторы ангиогенеза делят на митогены, инициирующие пролиферацию эндотелиальных клеток, и хемотаксические стимуляторы, кото рые вызывают направленную миграцию эндотелиоцитов.
Индукторы ангиогенеза имеют значение не только в инициа ции процесса образования новых сосудов, но и в поддержании структуры вновь образованной сосудистой сети.
В качестве стимуляторов ангиогенеза могут выступать самые разнообразные воздействия: гипоксия, накопление метаболитов, отек тканей, некоторые неорганические вещества (муравьиная кислота, кремний и др.), вазоактивные вещества, кинины, акти-
116
ватор плазминогена, гепарин,фибрин и некоторые продукты его расщепления, субстанции, продуцируемые нейтрофильными гранулоцитами, макрофагами, лимфоцитами и другими клетками, некротизирующие воздействия, факторы роста, продуцируемые опухолевыми клетками, воспалительные изменения тканей и т.д. Митогенной активностью по отношению к клеткам сосудистой стенки обладают лектины с бета-галактозидной специфичностью. Митогенный эффект на сосудистый эндотелий может оказывать вазодилятация в условиях функциональной нагрузки.
Особенно мощными низкомолекулярными стимуляторами ангиогенеза являются молочная кислота, аденозин, инозин, никотинамид, комплексы с ионами меди, гистамин и его дериваты, фрагменты гиалуроновой кислоты, простагландины, лейкотриен С4 . К этой группе стимуляторов ангиогенеза относится ряд ве ществ с неустановленной химической природой: низкомолеку лярный фактор опухолевого ангиогенеза M l , ангиогенный фак тор плаценты, плацентарный фактор и т.д. Большинство низко молекулярных стимуляторов ангиогенеза ведет свое происхож дение из тканей, подвергнутых гипоксии. Поэтому многие из этих факторов являются продуктами анаэробного метаболизма или кофакторами его.
Открыто большое число стимуляторов ангиогенеза пептидной природы. К числу стимуляторов ангиогенеза относятся фактор рос та фибробластов, ростовой фактор сосудистого эндотелия; проис ходящий из тромбоцитов фактор роста эндотелиальных клеток; эпидермальный фактор роста; ангиогенин; ангиотропин; опухоле вый некротизирующий фактор-альфа; фактор, стимулирующий об разование колоний (Куприянов В.В. и соавт., 1993).
В упрощенном виде можно выделить три основных стимула, вызывающих «гормональную» реакцию эндотелиальной клетки:
1) изменение скорости кровотока (увеличение напряжения сдвига);
2)тромбоцитарные медиаторы (серотонин, АДФ, тромбин);
3)циркулирующие и/или «внутристеночные» нейрогормоны
(катехоламины, вазопрессин, ацетилхолин, эндотелии, брадикинин, гистамин и др.). ,,
Действие медиаторов и нейрогормонов осуществляется через специфические рецепторы, расположенные на поверхности кле ток эндотелия. Ряд веществ (арахидоновая кислота, А-23187) воздействуют на эндотелиальную клетку, минуя рецепторы, не посредственно через клеточную мембрану.
В норме в ответ на эти стимулы клетки эндотелия реагируют усилением синтеза веществ, вызывающих расслабление гладко-
117
мышечных клеток сосудистой стенки, в первую очередь оксида азота (N0) и его дериватов (эндотелиальные факторы релакса ции - ЭФР), а также простациклина и эндотелийзависимого фактора гиперполяризации. Важно отметить, что влияние ЭФР - NO не ограничивается дилатацией локального участка, он ока зывает также антипролиферативное влияние на гладкомышечные клетки сосудистой стенки. Кроме того, в просвете сосуда этот комплекс дает ряд важных системных эффектов, направ ленных на защиту сосудистой стенки и предупреждение тромбообразования: блокирование агрегации тромбоцитов, окисления липопротеидов низкой плотности, экспрессии молекул адгезии, «прилипания» моноцитов и тромбоцитов к стенке сосуда, про дукции эндотелина и т.д.
В определенных ситуациях (например, при острой гипоксии) клетки эндотелия, напротив, становятся «причиной» вазоконстрикции как за счет снижения продукции ЭФР - N 0 , так и вслед ствие усиленного синтеза веществ с вазоконстрикторным эффек том - эндотелиальных факторов констрикции: сверхокисленных анионов, вазоконстрикторных простаноидов типа тромбоксана Аг, а также эндотелина -1 и др.
Одним из известных механизмов проявления эндотелиальной дисфункции при хронической сердечной недостаточности, явля ется подавление экспрессии/инактивации эндотелиальной NO-синтазы и снижение синтеза NO, обусловленные хрониче ским снижением кровотока и извращением реакции сосудов на «напряжение сдвига», повышением уровня противовоспали тельных цитокинов и фактора некроза опухоли (ФНО-альфа), подавляющих синтез NO, увеличением концентрации свободных R, инактивирующих ЭФР-NO (Беленков Ю.Н., 2001).
Экспериментальные исследования на мышиной модели ХСН показали, что применение квинаприла ассоциируется с улучше нием функционирования Вг-брадикининовых рецепторов эндо телиальных клеток. Этот вывод был сделан на основании того факта, что в эндотелии сосудов при использовании этого препа рата обнаруживали повышение активности тканевого фермента NO-синтазы и увеличение продукции самого N 0 .
J В настоящее время установлен факт благоприятного воздей ствия на процессы ангиогенеза оксида азота (Шехтер А.Б. и со авт., 2001; Ефименко Н.А., Чернеховская Н.Е., 2003).
Биологическое действие оксида азота на факторы ангиогене за было изучено в эксперименте. Результаты показали высокую степень митотической активности эндотелиоцитов на фоне NO-
118
терапии (Москаленко В.И., Марахонич Л.А., Шишло В.К., 2002).
- На биопсийном материале, взятом во время гастроскопии у больных язвенной болезнью желудка, осложненной кровотече нием, мы исследовали с помощью методов иммуногистохимии, криофрактографии и световой электронной микроскопии спо собность эндотелия к пролиферации и восстановлению функций массапереноса. Биоптаты брали до и после терапии оксидом азота.
Анализ полученных результатов показал, что в момент оста новки кровотечения, в зоне края язвы пролиферативная актив ность эндотелия кровеносных микрососудов низкая, и составля ет не более одной маркированной клетки в поле зрения эндотелиального пласта. Этот факт соответствует проведенным ранее исследованиям (В.В.Куприянов, В.А.Миронов, 1993), показав шим практически полное отсутствие клеток, готовых к делению, что объясняется контактным торможением эндотелиальных кле ток, плотно связанных в монослое.
После нескольких сеансов NO-терапии мы наблюдали уве личение количества маркированных клеток МКА PCNA более чем в 3 раза (с 1,07±0,003 абс.ед. до 3,51 ±0,17 абс.ед.). Таким об разом, можно предположить побуждение эндотелия к митотической активности. Это означает, что в потенцированных к деле нию клетках появился белок циклин - двигатель процессов про лиферации.
Влияние NO-терапии на эндотелий осуществляется через специфические рецепторы, расположенные апикально на по верхности клетки. В результате гипоксии происходит резкое снижение эндогенного N 0 , что приводит к истощению и извра щению компенсаторной способности эндотелия (Беленков Ю.Н. и соавт., 2001). Подача экзогенного NO восстанавливает функ циональную активность эндотелиального пласта, способствует неоваскулогенезу.
В ходе анализа препаратов с помощью СЭМ, в зоне дефекта слизистой оболочки желудка (в зоне язвы) наблюдали повышенную активность тромбоцитов, в отдельных участках плотно закрываю щих язвенную поверхность. Тромбоцитарная активность сопряже на с воздействием оксида азота, и если в сосудах NO блокирует аг регацию тромбоцитов, то на поверхности язвы он создает условия для формирования пласта клеток (Ferrari R. и соавт., 2000).
Описывая этапы заживления язвенного дефекта слизистой оболочки желудка, обычно опираются на патоморфологические
119
аспекты процессов регенерации. Как правило - это эффект экс судации, появления грануляций и пролиферации элементов рых лой волокнистой неоформленной соединительной ткани (Аруин Л. И. и соавт., 1998).
Однако, одним из факторов наползания эпителиального пла ста с краев дефекта является создание матрицы из тромбоцитов, которые мигрируют из сосудистого русла и составляют вместе с моноцитами (макрофагами) популяцию пришлых клеток. Ак тивность этих клеток значительно возрастает при действии экзо генного оксида азота.
Одной из важных характеристик эндотелия является его спо собность образовывать трансэндотелиальные каналы, через ко торые осуществляется питание тканей, окружающих микрососу ды. Трофика тканей напрямую зависит от этой способности эндотелиоцитов, что, в свою очередь, находится в связи с процес сами регенерации.
В научных исследованиях широко используется метод криофрактографии в связи с его высокой информативностью и на глядностью. Этот метод был разработан в конце 50-х - начале 60-х годов (Steer R.L., 1957; Moor Н. и соавт., 1961). Криофрактографические исследования наиболее подходят для изучения трансэндотелиального переноса эндотелия кровеносных микро сосудов. Оценивается криофрактография в отношении про странственного распределения плазмалеммальных пузырьков, которые представляют собой одну из важнейших структур эндотелиоцитов. Функция плазмалеммальных пузырьков заключает ся в транспорте белковых молекул. Разработка критериев иден тификации плазмалеммальных пузырьков дает возможность пе рейти к количественной оценке их частоты и распределения в клетках эндотелия.
Подготовка образца для криоскалывания состоит из трех эта пов: химической криофиксации образца, его пропитывания криопротектантом и быстрого замораживания в охлажденном фреоне. Затем производят непосредственное скалывание образца, находя щегося в стеклообразном состоянии, методом срезывания.
В отличие от других пограничных тканей, эндотелий микро сосудов характеризуется проницаемостью для воды и водорас творимых веществ, включая макромолекулы типа плазменных протеинов. Поскольку объем жидкости, проникающей через клеточную мембрану эндотелиоцитов, невелик, уникальные транспортные свойства эндотелия микрососудов объясняются наличием системы гидрофильных коммуникаций, обладающих высокой гидравлической проводимостью. Благодаря электрон-
120
но-микроскопическим исследованиям было выявлено, что эти коммуникации представлены плазмалеммальными пузырьками, их дериватами - трансэндотелиальными каналами и фенестрами, а также межклеточными контактами (Шахламов В.А., 1971; Ка раганов Я.Л. и соавт., 1978, 1981, 1982; Банин В.В., 2001). |
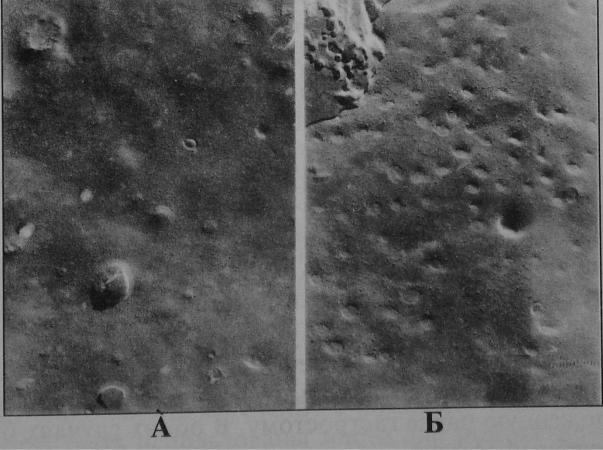
В нашем исследовании при определении плотности кавеол эндотелия кровеносных микрососудов в биоптатах слизистой оболочки желудка, полученных из зоны язвенного дефекта в пилорическом отеделе, отмечено равномерное распределение плазмалеммальных пузырьков (рис. 42), кластерные образования не определялись, что в основном соответствует данным литера туры (Караганов Я.Л. и соавт., 1983). До сеансов NO-терапии плотность кавеол эндотелия составляла 10,47±2,11 абс.ед, а по сле сеансов NO-терапии количество кавеол увеличилось до 27,18±3,68 абс.ед., в отдельных эндотелиальных клетках фикси ровали кластерные образования плазмалеммальных пузырьков, что свидетельствовало о конвекционном трансцитозе, который считается более эффективным в системе массапереноса. Таким образом, функциональная активность эндотелиальных клеток под воздействием оксида азота заметно возрастает, что благо приятно сказывается на трофике окружающих тканей и способ ствует процессам репаративной регенерации.
Рис.42. Криофрактограмма эндотелия кровеносных микрососудов слизистой оболочки пилорического отдела желудка до (А) и после
(Б) сеансов МО-терапии, х 34000.
121
Первое упоминание об эндоскопическом исследовании при кровотечении из пищеварительного тракта принадлежит Killian (1900). Уже в середине 20-х годов XX века некоторые авторы (Jackson, Korbsch и др.) применяли эзофагогастроскопию у больных с желудочно-кишечными кровотечениями. Однако эти наблюдения были немногочисленны из-за несовершенства аппа ратуры и отсутствия гибких эндоскопов.
Потребовались годы, чтобы метод эндоскопии получил ши рокое распространение для диагностики причин желудочнокишечных кровотечений. Наибольшая заслуга в этом принадле жит Palmer, который занимался вопросами эндоскопической диагностики причин желудочно-кишечных кровотечений с 1945 г. Palmer пропагандировал раннее эндоскопическое исследова ние, которое он называл «энергичным диагностическим мето дом». Применение экстренной эзофагогастроскопии позволило автору поставить правильный диагноз в 87,1% случаев против 34,9%, когда больные обследовались «классическим» методом.
Широкое внедрение в клиническую практику эндоскопиче ских методов исследования позволило решить вопросы экстрен ной диагностики локальной причины кровотечений из верхних отделов пищеварительного тракта. Диагностическая ценность ЭГДС при остром кровотечении составляет 75 - 98% (Кузин М.И., 2001; Курыгин А.А. и соавт., 2001). Однако применение разнообразных способов остановки кровотечения, в том числе и эндоскопических, существенно не повлияло на общую леталь ность при этом осложнении (Чернов В.Н. и соавт., 1999; Pollard T.R. и соавт., 1996). Основной проблемой, по-прежнему, остают ся профузные кровотечения. Именно в этих случаях применяе мые в настоящее время эндоскопические методы гемостаза ма лоэффективны. Решение этой задачи наиболее актуально для эн доскопии. Другой проблемой является профилактика рецидива кровотечения, так как при повторных кровотечениях леталь ность возрастает в 6 - 8 раз (Луцевич Э.В. и соавт., 1991).
Первые попытки остановки желудочного кровотечения через эндоскоп путем термического воздействия были предприняты C.R.Youmans и соавт. в 1970 г. у 2 больных. Они осуществили прижигание источников кровотечения электрокаутером, прове денным через цистоскоп, который вводили в полость желудка через наложенную ранее гастростому. В обоих случаях был дос тигнут лечебный эффект.
Начиная с 1971 г. в литературе стали появляться отдельные сообщения о проведении диатермокоагуляции через фиброэндо-
122
