
- •Введение
- •Катаболизм (распад) основных пищевых веществ - углеводов, жиров, белков (аминокислот).
- •Связь окислительного декарбоксилирования пирувата с процессом окислительного фосфорилирования
- •Регуляция пируватдегидрогеназного комплекса
- •Цикл лимонной кислоты
- •Реакции цикла трикарбоновых кислот
- •Зависимость цикла трикарбоновых кислот от недостатка кислорода
- •Регуляция общего пути катаболизма
- •Механизмы регуляции цитратного цикла
- •Анаболические функции цикла лимонной кислоты
- •Связь между общим путем катаболизма и цепью переноса электронов и протонов.
- •Макроэргические соединения
- •Дегидрирование субстратов и окисление водорода (образование воды) как источник энергии для синтеза атф
- •Митохондриальная цепь переноса электронов
- •Компоненты дыхательной цепи
- •Переносчики электронов
- •Система цитохромов дыхательной цепи, убихинол-дегидрогеназа (цитохром с редуктаза). Цитохром с оксидаза.
- •Структурная организация дыхательной цепи
- •Трансмембранный электрохимический потенциал как промежуточная форма энергии при окислительном фосфорилировании
- •Структурная организация цепи переноса электронов
- •Регуляция цепи переноса электронов (дыхательный контроль).
Митохондриальная цепь переноса электронов
Цепь переноса электронов (дыхательная цепь) представляет собой организованную совокупность белковых и небелковых переносчиков электронов локализо-
ванную во внутренней митохондриальной мембране. Электроны перемещаются по цепи ступенчато, в одном направлении, от переносчика с низким электрохимическим потенциалом к переносчику с более высоким потенциалом. Многоступенчатый транспорт электронов от НАДН и ФАДН2 к О2 по цепи этих переносчиков приводит к выбросу протонов из митохондриального матрикса в межмембранное пространство и генерированию протонного градиента. Протоны перекачиваются тремя видами электронпереносящих комплексов. АТФ синтезируется при обратном токе протонов через АТФ-синтетазный комплекс. Сопряжение окисления и фосфорилирования обеспечивается протонным градиентом через внутреннюю мембрану.
Компоненты дыхательной цепи
Дыхательная цепь включает в себя три основных белковых ферментативных комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану и две подвижные молекулы-переносчика (кофермент Q и цитохром С).
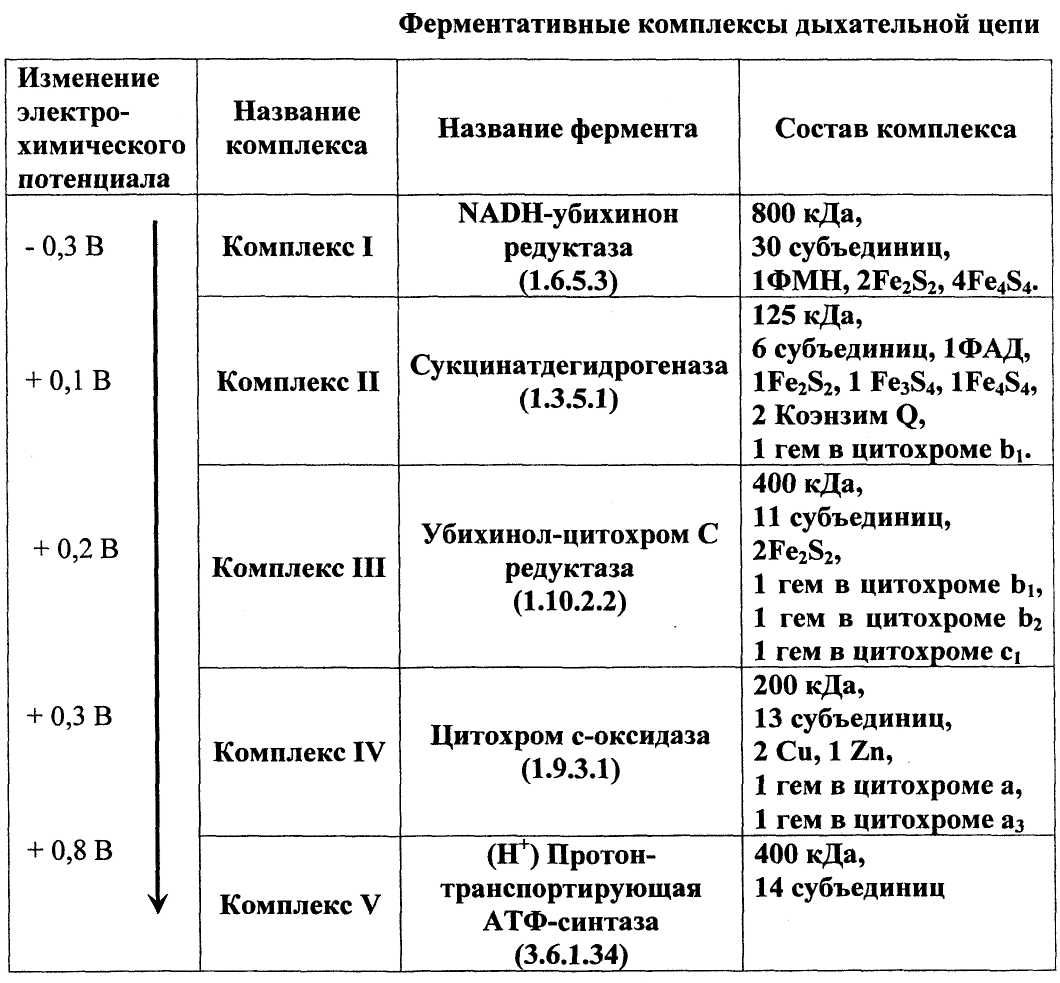
С укцинатдегирогеназа,
относящаяся к циклу трикарбоновых
кислот, в цепи переноса
электронов рассматривается как комплекс
П. Комплексом V
иногда называют
АТФ-синтетазу, хотя этот фермент не
принимает участия в транспорте
электронов.
Комплексы (I-IV)
дыхательной цепи состоят из большого
числа полипептидных
цепей и содержат ряд различных
окислительно-восстановительных
ко-ферментов,
связанных с белками. К ним относятся
ФМН (флавинмононуклеотид), ФАД
(флавинадениндинуклеотид) в комплексах
I
и II;
железо-серные (FeS)
центры в комплексах I,
II
и III
и
группы гема в комплексах II,
III
и IV.
Электроны транспортируются от комлексов
I
и II
к комплексу III
и, затем к комплексу IV
в сторону увеличения электрохимического
потенциала.
укцинатдегирогеназа,
относящаяся к циклу трикарбоновых
кислот, в цепи переноса
электронов рассматривается как комплекс
П. Комплексом V
иногда называют
АТФ-синтетазу, хотя этот фермент не
принимает участия в транспорте
электронов.
Комплексы (I-IV)
дыхательной цепи состоят из большого
числа полипептидных
цепей и содержат ряд различных
окислительно-восстановительных
ко-ферментов,
связанных с белками. К ним относятся
ФМН (флавинмононуклеотид), ФАД
(флавинадениндинуклеотид) в комплексах
I
и II;
железо-серные (FeS)
центры в комплексах I,
II
и III
и
группы гема в комплексах II,
III
и IV.
Электроны транспортируются от комлексов
I
и II
к комплексу III
и, затем к комплексу IV
в сторону увеличения электрохимического
потенциала.
Переносчики электронов
Многие переносчики электронов представлены белками цитохромами, содержащие в качестве простетической группы гем, который придает им красное окрашивание. Цитохромы (сь с, а и а3) расположены в различных участках дыхательной цепи и различаются структурой полипептидных цепей, строением боковых групп и способом прикрепления к апобелку. Присоединение электрона к гему влечет за собой изменение степени окисления железа в активном центре.
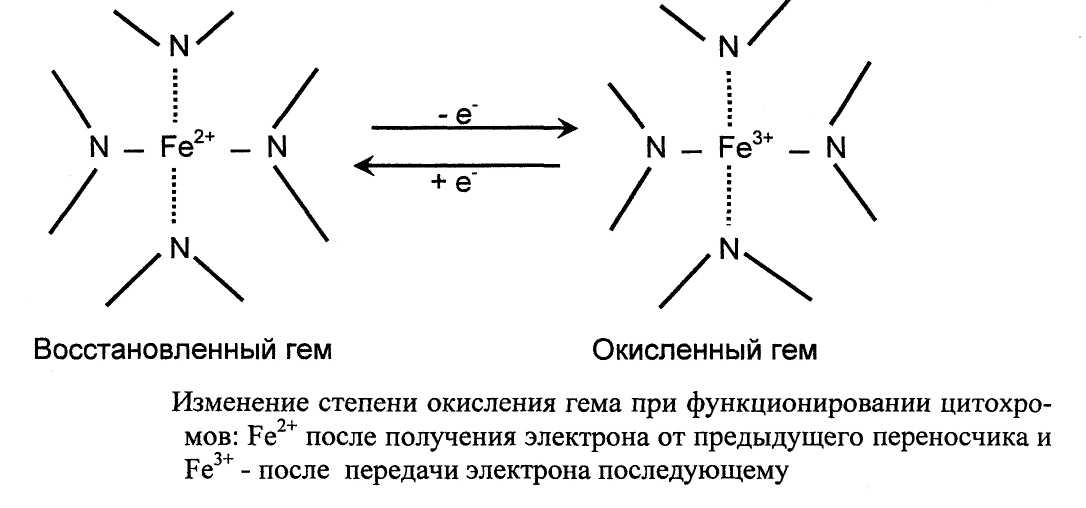
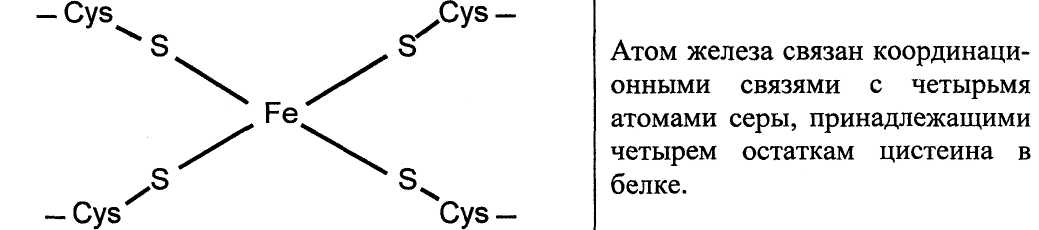
К другому типу негемовых белков - переносчиков электронов относят железо-серные белки (FeS). В них атомы железа связаны с сульфгидрильными группами остатков цистеина белка, а также сульфгидрильными анионами, образуя железо-серные комплексы или центры.
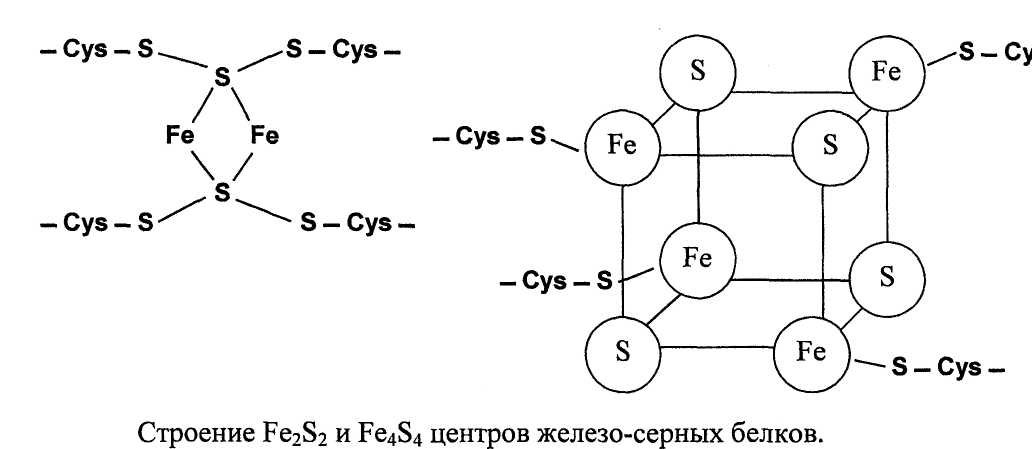
В Fe2S2 центре каждый из двух атомов железа связан координационными связями с двумя атомами неорганической серы и двумя остатками цистеи-на в белке.
В Fe4S4 четыре атома железа связаны с четырьмя атомами серы и четырьмя остатками цистеина в белке.
Атомы железа в FexSx-4eHTpax могут находиться в окисленном (Fe3+) или восстановленном (Fe2+) состоянии.
Атомы железа в FexSx-4eHTpax могут принимать или отдавать электроны переходя в 4>eppo(Fe2+)- или ферри(Ре3+)- состояния. Железо-серные центры функционируют совместно с флавиновыми ферментами, принимая электроны от сукцинатде-гидрогеназы (комплекс II) и дегидрогеназ, участвующих в окислении липидов.
Еще одним типом переносчиков электронов является ФМН-содержащий белок. ФМН (флавин-мононуклеотид) переносит электроны от НАДН на железо-серные центры (включен в состав комплекса I).
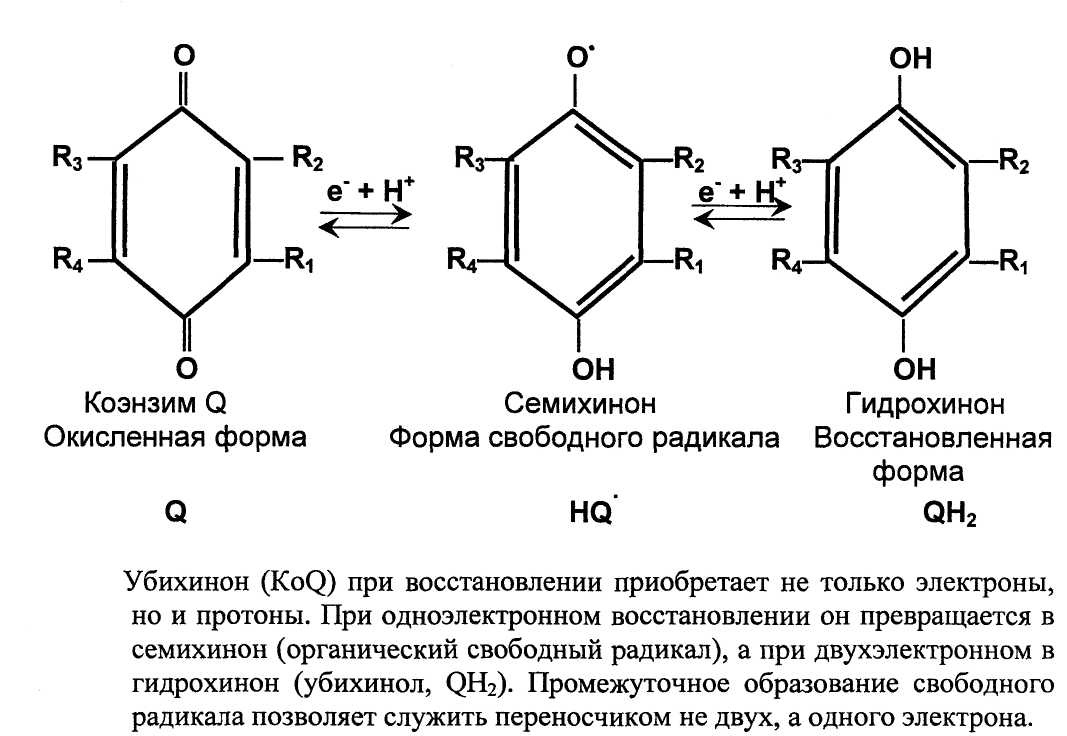
Единственный небелковый переносчик электронов - убихинон (коэнзим Q), названный так, потому, что с одной стороны он хинон, а с другой встречается повсюду (ubiquitous - вездесущий). Железо-серные центры отдают электроны уби-хинону, который включен в состав комплекса III.
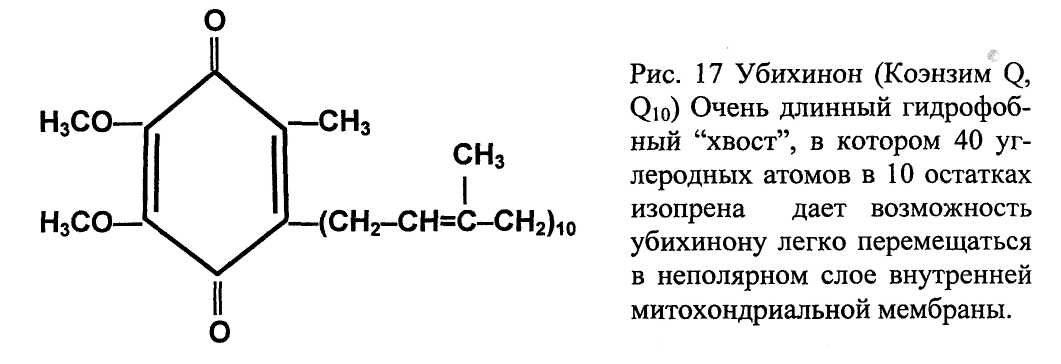
Один из цитохромов - цитохром С не закреплен жестко в митохондриальной мембране, а свободно перемещается между III и IV комплексами по внешней стороне мембраны и переносит электрон. Цитохром С гемсодержащий водорастворимый белок, массой 12,5 кДа, содержит 104 аминокислотных остатка.
Коэнзим Q и цитохром С - мобильные переносчики электронов дыхательной цепи. Все другие белковые переносчики - интегральные белки, занимают в мембране строго фиксированное положение и ориентированы определенным образом.
НАД-зависимые и Флавиновые дегидрогеназы, НАДН-дегидрогеназа. Коэнзим Q-редуктаза митохондриальной цепи
НАД-зависимые и Флавиновые дегидрогеназы - ферменты, катализирующие реакции дегидрирования субстратов (I класс, оксидоредуктазы), катализируют реакции переноса электронов и протонов с субстрата на кофермент.
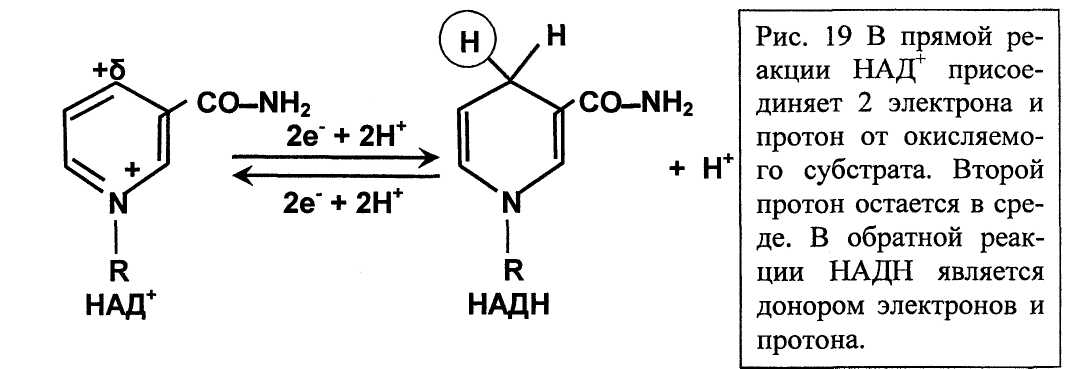
НАД-зависимые дегидрогеназы содержат НАД+ в активном центре и при взаимодействии с субстратом отбирают от него два электрона и протон, которые присоединяются к молекуле НАД+ образуя НАДН (Рис. 18). Поскольку НАД+ или НАДН находятся в активном центре дегидрогеназ не постоянно - их рассматривают в качестве вторых субстратов реакции и переносчиков электронов.
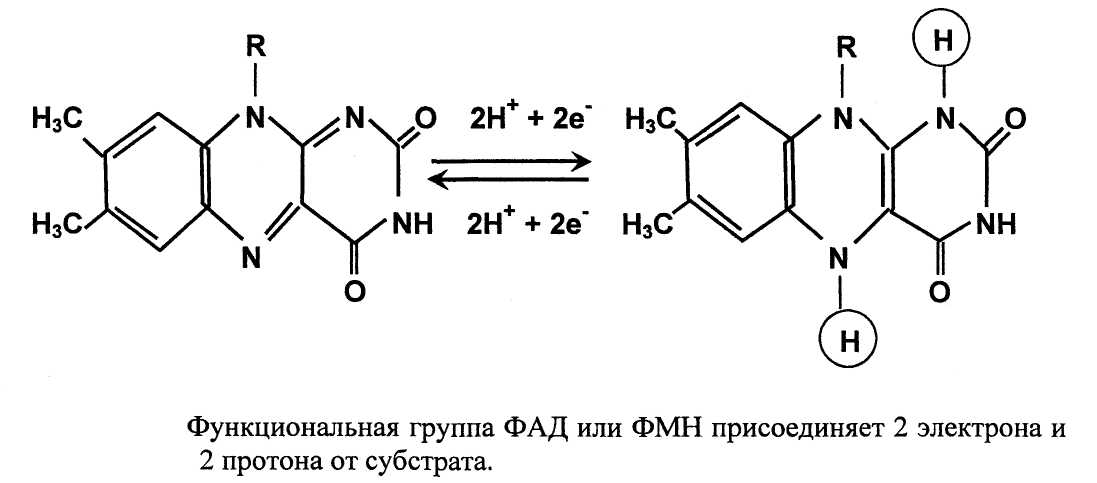
Флавиновые дегидрогеназы содержат ФАД или ФМН (флавин адениндинук-леотид или флавин мононуклеотид) в активном центре. Флавиновые дегидрогеназы катализируют реакции переноса электронов в составе атомов водорода от субстрата на ФАД или ФМН (Рис. 20).
НАДН-дегидрогеназа (НАДН-С^-редуктаза, комплекс I) состоит из нескольких полипептидных цепей. Роль небелковой (простетической) группы выполняет ФМН. Субстратом фермента является НАДН, с которого 2 электрона переносятся на ФМН с образованием ФМН-Нг. При этом второй протон поглощается из матрик-са. С ФМН-Нг электроны переносятся на ряд FeS-белков, играющих роль второй простетической группы этого фермента. От FexSx-n,eHTpoB (FeS, Fe2S2, Fe4S4) электроны переносятся на коэнзим Q. В процесс переноса электронов с НАДН-дегидрогеназы через FeS-белки на коэнзим Q (убихинон) он обратимо превращается в гидрохинон (QH2). Возможно также превращение коэнзима Q в форму се-михинона при присоединении одного протона и одного электрона. Убихинон выполняет коллекторную функцию, присоединяя электроны от НАДН-дегидрогеназы и других флавиновых дегидрогеназ, таких как сукцинат-дегидрогеназа (комплекс II).
