
- •Автор не сдержался и стал готкой делает перерыв на мемы.
- •ИЗОФЕРМЕНТЫ
- •Субстратная:
- •Каталитическая:
- •1. Гипотеза Фишера ака модель «жёсткой матрицы» ака «ключ-замок».
- •Всё логично, правда?
- •КОМПАРТМЕНТАЛИЗАЦИЯ
- •ЭНЗИМОДИАГНОСТИКА
- •ЭНЗИМОТЕРАПИЯ
- •ЭНЗИМОПАТИИ
- •Витамины витамины витаминчики мои
- •Курина Таня, 2.2.15
- •Каждый витамин имеет 3 названия:
- •ЕЩЁ РАЗ ВСЕМ СПАСИБО ЗА ВНИМАНИЕ У ВАС ВСЁ ПОЛУЧИТСЯ!!!!
- •Курина Таня, группа 2.2.15
- •Надеюсь, все сдали коллок на ура, в отличии от меня (прямо перед колком посадили на карантин, здоровья погибшим…) и готовы с новыми силами копаться в биохимии вместе со мной!
- •I этап
- •II этап
- •III этап
- •Всем спасибо за внимание!
- •1) Переваривание углеводов. Полостное и пристеночное пищеварение
- •3) Причины непереваривания целлюлозы в жкт. Роль целлюлозы в пищеварении
- •5) Пути превращения глюкозы в клетке. Источники глюкозы в клетке
- •9) Особенности обмена гликогена в печени и мышцах при некоторых физиологических состояниях (потребление пищи, голодание, мышечная активность). Участие гормонов в этих процессах
- •11) Генетические нарушения синтеза (агликогеноз) и распада гликогена (печеночные, мышечные и смешанные гликогенозы)
- •Дорогие друзья, всё…
- •ГЛИКОЛИЗ. ГЛЮОНЕОГЕНЕЗ.
- •Оглавление
- •Оглавление
- •Пусть он будет намного лучше, чем уходящий<3
ИЗОФЕРМЕНТЫ
Ферменты, катализирующие одну и ту же химическую реакцию, но с разной первичной структурой белка, называют изоферментами. Они отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента. Возникают изоформы в основном в результате небольших генетических различий в первичной структуре фермента.
Что нам важно запомнить. Они часто являются органоспецифичными. То есть опреденная изоформа фермента встречается в одном органе, другая – во втором органе.
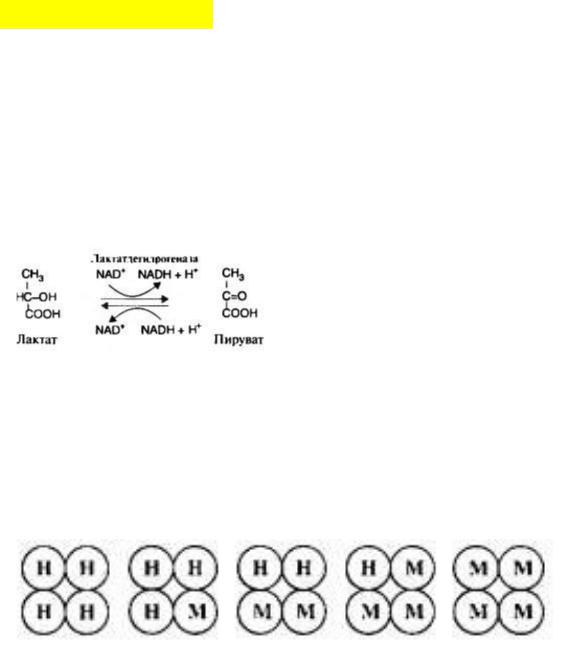
Например – ЛДГ - лактактдегидрогеназа (ну ка вспомни к какому классу она относится), катализиующая обратимую реакцию окисления (мега спойлер, да) лактата до пирувата (ПВК).
ЛДГ состоит из 4х субъединиц двух типов – М(muscule – мышца) и H(heart – сердце). Определённая
комбинация этих субъединиц как раз и приводит к появлению изоформ.
ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках. Значит, они состоят преимущественно из субъединиц H(сердце)
ЛДГ4 и ЛДГ5 – в скелетных мышцах и печени. Значит, больше субъединиц М.
Изоформы лактактдегидрогеназы

ВАЖНО: Выявление в плазме крови тканеспецифичных форм ЛДГ широко используется в качестве диагностического теста. Изоформы ЛДГ различаются друг от друга электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ. Для диагностики заболеваний сердца печени и мышц необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. Например, изоформы ЛДГ1 и 2 будут встречаться в плазме крови больного инфарктом миокарда и больного гепатитом.
Такая же ситуация и с креатинкиназой (КК), катализирующей реакцию образования креатинфосфата.
Она уже состоит из 2х субъединиц – М (muscle - мышцы) и В(brain - мозг). Итого мы получаем три возможные изоформы: ВВ, ВМ, ММ. Нетрудно догадаться, что изофермент ВВ находится преимущественно в головном мозге, ММ – в скелетных мышцах, а ВМ – в сердечной мышце.
Они, как и изоформы ЛДГ, имеют разную электрофоретическую подвижность.
ВАЖНО: Определение активности КК в плазме крови имеет значение при диагностике инфаркта миокарда (повышение уровня МВ изоформы). При травмах мышц – ММ формы, а вот уже ВВ не может проникнуть через гематоэнцефалический
На печеньки моим общажным тараканам: 5469
барьер (мы, конечно, все знаем, что это), поэтому даже при инсультах в крови не определяется.
На печеньки моим общажным тараканам: 5469

СПЕЦИФИЧНОСТЬ, ВИДЫ
ВИДЫ СПЕЦИФИЧНОСТИ
СПЕЦИФИЧНОСТИ
Специфичность – наиболее важное свойство ферментов, определяющее их биологическую значимость. Различают субстратную и каталитическую специфичность.
Субстратная:
- абсолютная - фермент производит катализ только одного вещества. Только уреаза может быть ферментом в реакции расщепления мочевины.
- групповая - катализ субстратов с общими особенностями. Наблюдаем градацию: субтилизин может разрушить связь между любым аминокислотами, пепсин же катализирует разрыв пептидной связи между аминогруппами только ароматических кислот, то есть он может помочь разорвать связь между фениаланином, тирозином, триптофаном, а вот тромбин – лишь между аргинином и глицином. Так же алкогольдегидрогеназа может окислить любые OH-группы.
-относительная групповая специфичность - превращение субстратов с некоторыми общими признаками. Например, цитохром Р450 окисляет только гидрофобные вещества, которых насчитывается около 7000
Каталитическая:
Один и тот же субстрат под действием разных ферментов может преобразоваться в разные продукты.
Видишь, субстрат один – глюкозо-6- фосфат, но при действии разных
ферментов она может стать аж 4мя разными продуктами.
На печеньки моим общажным тараканам: 5469
