
6 курс / Анестезиология и реаниматология / Obschaya_anesteziologia_Schegolev
.pdf
Глава 3. Регионарная анестезия |
121 |
дить из позвоночного канала через межпозвонковые отверстия (преимущественно у молодых пациентов). Сужение этих отверстий у пожилых людей приводит к более интенсивному распространению введенного объема в каудальном и краниальном направлениях — необходима меньшая дозировка.
Проведение ЭА по сравнению со СА имеет свои преимущества и недостатки (приложение 8).
Доза МА необходимая для обезболивания или анестезии зависит от концентрации раствора и объема инъекции. Концентрация препарата влияет на выраженность блоков. Чем выше концентрация, тем сильнее моторный и сенсорный блок. Более низкие концентрации приводят к селективному сенсорному или вегетативному блоку. Рекомендованные дозировки для ЭА приведены в приложении 9.
Не рекомендуют использовать непрерывное введение лидокаина с помощью катетера из-за нейротоксического действия!
Наиболее безопасным (с учетом нейротоксического и системного токсического действия) препаратом для ЭА, особенно для длительного введения, являются ропивакаин и левобупивакаин. Для анестезии возможно использование ропивакаина в концентрации 0,5–1% с максимальной разовой дозой 250 мг, а для послеоперационного обезболивания применяют ропивакаин 0,2% инфузией в эпидуральный катетер со скоростью 6–14 мл/ч — при умеренном и 12–28 мг/ч — при выраженном болевом синдроме. Разрешается комбинация ропивакаина и фентанила (1–4 мкг/мл) с добавлением адреналина, что приводит к усилению обезболивания.
Смесь Ниеми–Брейвика (ропивакин 2 мг/мл, фентанил 2 мкг/мл, адреналин 2 мкг/мл), вводимая с скоростью 3–15 м/ч, обеспечивает развитие только сенсорного блока без возникновения моторного. Для того чтобы составить такую смесь, в 50-мл шприц набирают: ропивакаин 0,2% — 47,0 мл; фентанил 0,005% — 2,0 мл; адреналин — 1 мл 0,01%, раствора, полученного добавлением к 1 мл (1 ампуле) 0,1% раствора 9 мл 0,9% раствора натрия хлорида.
Для ЭА разрешено использовать и другие наркотические анальгетики (тримеперидин — 0,1–0,15 мг/кг, предварительно разводят в 2–4 мл 0,9% раствора натрия хлорида). Морфин эпидурально рекомендован при наличии у больных острых и хронических болей (2–5 мг в 10 мл 0,9% раствора натрия хлорида).
Начало действия ЭА растянуто во времени. После введения аналгезия кожи наступает примерно через 2–6 мин, операционная аналгезия и двигательная блокада — только через 20–30 мин. Двигательная блокада при ЭА часто неполная (частично сохраняется тонус мышц).
При абсорбции МА, введенного эпидурально, некоторая часть препарата попадает в кровь. Наивысшая концентрация в плазме достигается через

122 Общая анестезиология
10–30 мин после инъекции (возможно общетоксическое действие!). Токсические реакции проявляются в течение 30–60 мин после введения МА.
На распространение МА в эпидуральном пространстве влияют следующие факторы:
–объем введенного раствора — чем больше объем, тем обширнее его распространение (для взрослых в среднем по 1–2 мл на сегмент);
–количество МА (концентрация × объем) — обеспечивает качество анестезии (начало действия, глубина блокады, длительность сенсорной и моторной блокады);
–место пункции — располагается в центре подлежащего отключению чувствительности участка;
–скорость введения — быстрое введение с усилием не приводит к лучшему распространению препарата (рекомендуемая скорость 0,3– 0,74 мл/с);
–укладка — влияет на эффект меньше, чем при СА;
–масса тела пациента — не влияет на требуемую дозировку и распространение МА;
–рост пациента (по Бромейджу) — при росте < 152 см — 1 мл на сегмент, при росте >152 см дополнительно по 0,1 мл на каждые 5 см сверх 152 см;
–возраст пациента — у пациентов старше 70 лет доза МА должна снижаться на 30–40%.
Введение МА в эпидуральное проводят однократно или дробными дозами. При однократном введении вводится сразу вся расчетная дозировка. Введение МА методом дробных доз является важной мерой безопасности при ЭА. После тест-дозы следует вводить не более 5 мл МА одномоментно. Каждую последующую инъекцию выполняют после предварительной аспирационной пробы (не пропустить случайного повреждения ТМО или сосуда). Уменьшение разовой дозы до 5 мл и соблюдение интервала между инъекциями не менее 3–5 мин, но не более 10 мин значительно уменьшает выраженность осложнений при непреднамеренном введении МА в субарахноидальное пространство (опасность высокой СА!) или кровеносный сосуд.
Повторная доза МА зависит от продолжительности действия. Как только происходит снижение чувствительного блока на два дерматома (двухсегментарная регрессия), вводят повторную дозировку, которая составляет одну треть или половину начальной нагрузочной дозы.
В практической деятельности применяются эпидуральные наборы, в которые входят 8–18-см иглы диаметром 14–20 G, имеющие интервальную маркировку по 1 см и скошенный под углом 15–30° срез. Наиболее часто используется игла Туохи со срезом Хубера (рис. 3.13).
Доступные сейчас иглы Туохи/Хубера оснащены специальными крылышками (крылышки Вейсса), прикрепленными в месте соединения иглы с павильоном и позволяющими лучше контролировать продвижение иглы.

Глава 3. Регионарная анестезия |
123 |
|
|
|
|
|
|
|
Рис. 3.13. Иглы для пункции эпидурального пространства
Эпидуральные катетеры имеют на своем окончании одно или несколько боковых отверстий, а также диаметр, соответствующий просвету иглы (рис. 3.14).
Эпидуральную пункцию выполняют на грудном, |
|
|
поясничном и крестцовом уровнях, с использовани- |
|
|
ем срединного или парамедиального доступа. |
|
|
Расстояние от кожи до эпидурального простран- |
|
|
ства варьирует в зависимости от строения тела. |
|
|
У 80% пациентов в поясничной области оно состав- |
|
|
ляет 4–6 см, однако при ожирении это расстояние |
|
|
может увеличиться до 8 см и более. Срединный и па- |
|
|
рамедиальный доступы выполняют так же, как и при |
|
|
проведении СА. |
|
|
Точная идентификация момента попадания иглы в |
Рис. 3.14. Концевые |
|
эпидуральное пространство снижает риск поврежде- |
||
отверстия эпидуральных |
||
ния ТМО. Игла попадает в эпидуральное простран- |
||
катетеров |
||
ство, как только ее конец проходит через желтую |
|
связку. Методы идентификации эпидурального пространства делят на три основные категории: «утрата сопротивления», «подвешенная капля», а также аппаратный метод (например, с помощью устройства Epidrum).
«Утрата сопротивления» — наиболее распространенный способ идентификации эпидурального пространства. После прокола кожи эпидуральную

124 Общая анестезиология
иглу с мандреном продвигают вплоть до межостистой связки. Удаляют мандрен и присоединяют к канюле шприц с низким сопротивлением. Шприц заполняют 0,9% раствором натрия хлорида 5–10 мл, может быть оставлен пузырек воздуха 1–1,5 мл.
Шприц держат в правой руке, установив большой палец на поршень. Большим и указательным пальцами левой руки удерживают иглу за крылышки, упираясь тылом ладони в спину пациента. Левой рукой поддерживают иглу в стабильно срединном положении и одновременно препятствуют ее случайному глубокому введению. Существуют несколько вариантов техники выполнения пункции (рис. 3.15, а–г).
Осуществляя постоянное давление большим пальцем на поршень шприца, продвигают иглу сквозь межостистую связку. В тот момент как срез иглы пройдет ее, появится некоторое чувство потери сопротивления, поскольку подлежащая ткань имеет меньшую по сравнению со связкой плотность. Иногда эта ложная потеря сопротивления может вызвать ощущение попадания в эпидуральное пространство. При дальнейшем продвижении игла входит в желтую связку, и появляется значительное сопротивление давлению на поршень, поскольку желтая связка по плотности близка к коже. При давлении на поршень пузырек воздуха остается сжатым.
а |
б |
в |
г |
Рис. 3.15. Варианты техники выполнения пункции: а, б — положение рук при проведении иглы; в, г — положение рук при тестировании эпидурального пространства

Глава 3. Регионарная анестезия |
125 |
Оказывая постоянное давление на поршень, медленно продвигают иглу, пока ее срез не пройдет сквозь желтую связку. После прохождения желтой связки сопротивление тканей резко снижается, раствор из шприца легко поступает в эпидуральное пространство, пузырек воздуха расправляется. Как только это произошло, немедленно прекращают продвижение иглы, отсоединяют шприц и фиксируют иглу (между острием иглы и ТМО всего несколько миллиметров!).
«Подвешенная капля» — методика основана на эффекте отрицательного давления в эпидуральном пространстве.
Иглу вводят глубоко в межостистую связку, после чего удаляют мандрен. К павильону иглы подвешивают каплю 0,9% раствора натрия хлорида. Пока игла продвигается через плотные связки, капля не смещается. После пункции желтой связки и попадания конца иглы в эпидуральное пространство «висячая капля» исчезает в просвете иглы под воздействием отрицательного давления. Однако, если игла окажется обтурированной, то капля не будет втягиваться из павильона в просвет иглы, и ее будут продвигать вперед вплоть до того момента, когда истечение СМЖ засвидетельствует перфорацию ТМО. Следует отметить, что методику «подвешенной капли» применяют только опытные анестезиологи.
Работа устройства Epidrum (рис. 3.16) также основана на эффекте отрицательного давления в эпидуральном пространстве.
Тестируют устройство Epidrum. Иглу вводят в межостистую связку, удаляют мандрен. Закрепляют Epidrum между иглой и шприцом вращательными движениями. Медленно заполняется полость диафрагмы до шарообразной формы. Медленно продвигают иглу, непрерывно наблюдая за диафрагмой Epidrum. При попадании в эпидуральное пространство отрицательное давление втягивает воздух из полости диафрагмы, и она опадает. Величина спадания зависит от градиента давления между Epidrum и эпидуральным пространством.
Введение катетера при правильной технике его выполнения не должно вызывать затруднений. На уровне выхода катетера из просвета иглы в эпидуральное пространство возникает некоторое сопротивление, которое следует преодолевать осторожными поступательными движениями.
а |
б |
Рис. 3.16. Устройство для определения эпидурального пространства Epidrum: а — устройство с надутой мембраной; б — устройство со спущенной мембраной

126 Общая анестезиология
Выведение катетера обратно после безуспешной попытки продвинуть его дальше связано с опасностью отсечения краем острия иглы той его части, которая находится за пределами просвета иглы. Если после введения 5 мл катетер ввести не удается, то катетер удаляют вместе с иглой. После этого эпидуральное пространство пунктируют повторно.
Достигнув намеченного уровня продвижения катетера в эпидуральное пространство, иглу постепенно извлекают и по мере выведения в просвет ее продвигают катетер. Как только дистальный конец иглы выходит из кожи, катетер фиксируют, а иглу удаляют.
Катетер закрепляют к коже, место его выхода закрывают стерильной наклейкой. Затем катетер выводят на переднюю поверхность тела и на всем протяжении фиксируют к коже липким пластырем. Убедившись еще раз, что из катетера не поступает СМЖ или кровь и он проходим, вводят пробную дозу (3–5 мл) раствора МА.
Введение МА в эпидуральное пространство неизменно начинается с инъекции тест-дозы. С этой целью обычно применяют 2–5 мл МА (лучше лидокаина, даже если для развития основного блока используется бупивакаин или ропивакаин) в сочетании с адреналином в пропорции 1 : 200 000. Тест-дозу вводят как через пункционную иглу, так и через катетер. Если тест-доза попала в кровеносный сосуд, то спустя 30–60 с ЧСС увеличится на 20%. При инъекции в субарахноидальное пространство в течение 3 мин разовьются симптомы СА.
Комбинированная спинально-эпидуральная анестезия (КСЭА) — метод, сочетающий СА с катетеризацией эпидурального пространства с целью углубления последней или же с целью послеоперационного обезболивания. КСЭА позволяет сочетать преимущества обеих методов и в некоторой степени нивелировать их недостатки, в первую очередь за счет снижения дозы интратекально вводимого МА.
Различают одно- и двухуровневую КСЭА. Для проведения первой используют и обычную эпидуральную иглу, но предпочтительнее — специальные иглы для КСЭА, имеющие дополнительное отверстие для проведения спинальной пункции. Если таких игл нет в наличии, используют стандартную эпидуральную иглу. Для проведения КСЭА двухуровневым способом необходимо иметь наборы и для ЭА, и СА.
При КСЭА одноуровневым способом пациента готовят так же, как и для стандартной НАА.
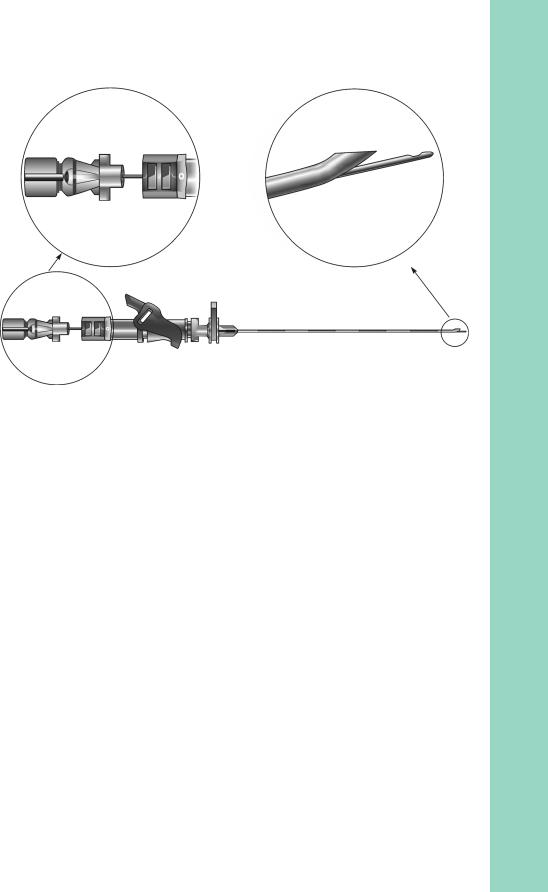
Выполняют пункцию эпидурального пространства по общепринятой методике. При использовании обычной эпидуральной иглы спинальную проводят через нее до перфорации ТМО. Аналогично проводят спинальную иглу через специальную (эпидуральную), имеющую дополнительное отверстие для КСЭА (рис. 3.17). После появления в спинальной игле ликвора вводят необходимую дозу МА. Уделяют самое пристальное внимание неподвижной фиксации иглы, так как ее очень легко сместить. Лучше ис-
|
Глава 3. Регионарная анестезия |
127 |
|
|
|
|
|
а |
б |
|
|
|
|||
в
Рис. 3.17. Игла для КСЭА: а — место введения спинальной иглы через эпидуральную; б — специальное отверстие в эпидуральной игле для выхода спинальной; в — общий вид спинально-эпидуральной иглы
пользовать фиксаторы спинальной иглы в просвете эпидуральной. После введения МА, просвет спинальной иглы закрывают мандреном и ее извлекают из субарахноидального пространства. Катетеризацию эпидурального пространства проводят по общепринятой методике с соблюдением всех мер предосторожности.
Принцип КСЭА двухуровневым способом состоит в том, что СА производится в соседнем промежутке после катетеризации эпидурального пространства.
Каудальная (сакральная) анестезия является разновидностью ЭА и заключается во введении раствора МА в крестцовый канал через крест- цово-копчиковую связку. Введенный МА попадает в крестцовое эпидуральное пространство, распространяясь далее, причем число захваченных сегментов прямо пропорционально количеству введенного препарата.
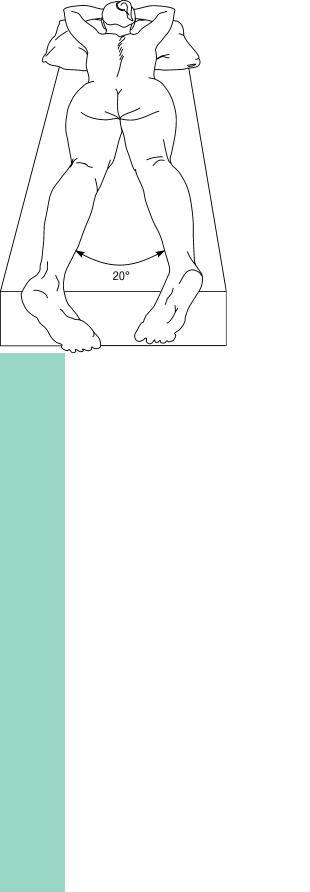
Анестезию выполняют в классическом положении пациента на животе, а также в коленно-локтевом положении, положении на боку или коленногрудном положении. Наиболее часто применяют классическое положение пациента на животе с несколько разведенными и ротированными внутрь коленями (рис. 3.18). Указанным положением достигают наибольшего расслабления ягодичных мышц (облегчает определение анатомических ориентиров).
128 |
Общая анестезиология |
|
|
|
|
|
|
|
|
|
|
|
|
|
При |
использовании |
коленно- |
|
|
|
|||
|
|
|
локтевого положения под бедра па- |
||
|
|
|
циента помещают подушку с целью |
||
|
|
|
зафиксировать сгибание в бедрен- |
||
|
|
|
ном суставе и разведение мышц, |
||
|
|
|
кроме того, пациента также просят |
||
|
|
|
развести ноги и повернуть стопы |
||
|
|
|
внутрь. После придания |
пациенту |
|
|
|
|
необходимого положения идентифи- |
||
|
|
|
цируют анатомические ориентиры. |
||
|
|
|
С этой целью представляют равно- |
||
|
|
|
бедренный треугольник, вершинами |
||
|
|
|
которого |
служат обе верхнезадние |
|
|
|
|
ости подвздошных костей и крест- |
||
|
|
|
цовая щель (рис. 3.19). Сакральный |
||
|
|
|
канал определяют, пальпируя сна- |
||
|
|
|
чала копчик, а затем смещая палец |
||
|
|
|
краниально до чувства прогибания |
||
|
|
|
кожи. У взрослых расстояние от кон- |
||
|
|
|
чика копчика до сакрального канала |
||
|
|
|
примерно такое же, что и от кончи- |
||
|
|
|
ка указательного пальца до прокси- |
||
|
Рис. 3.18. Положение для сакральной |
мального |
межфалангового сустава. |
||
|
анестезии |
Очень важно установить |
среднюю |
||
|
|
|
линию крестца (рис. 3.20). |
|
|
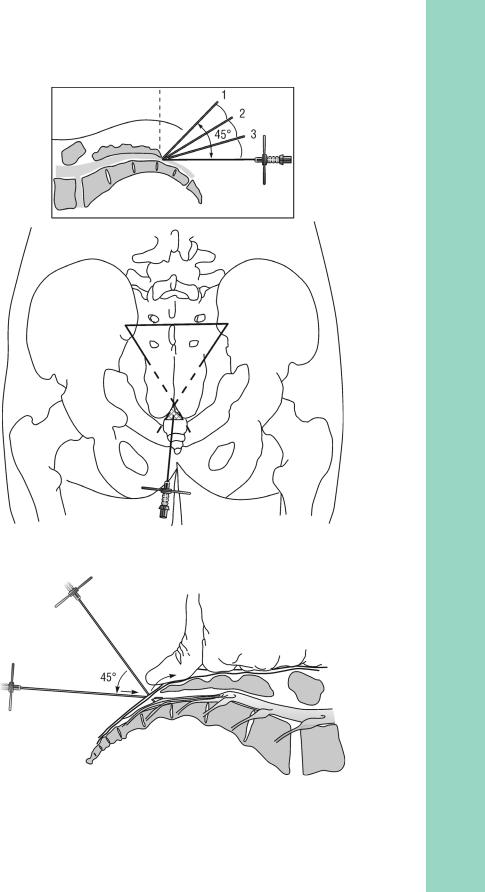
После обработки кожи производят местную инфильтрационную анестезию, для чего над связкой внутрикожно, а затем и подкожно вводят небольшое количество МА. Следует избегать распространенной инфильтрации, так как это будет затруднять идентификацию анатомических ориентиров.
Если не планируется продленная анестезия с установкой эпидурального катетера, то для пункции используют иглу калибра 22 G. Ее проводят через анестезированные ткани по направлению к крестцово-копчиковой мембране, под углом 45° к поверхности крестца. После проникновения через крестцово-копчиковую мембрану (ощущается как потеря сопротивления) направление иглы меняют на более плоское по отношению к коже (канюлю иглы опускают вниз к межъягодичной складке) и продвигают в сакральный канал на глубину не более 4 см. Иглу направляют практически параллельно продольной оси спины. Следует обратить внимание, что срез иглы должен быть повернут лицевой частью вниз для снижения возможности весьма болезненного повреждения надкостницы крестца. Недопустимо боковое отклонение иглы.
После попадания иглы в сакральный канал к ней подсоединяют шприц с изотоническим раствором натрия хлорида (5 мл) и быстро вводят его,
Глава 3. Регионарная анестезия |
129 |
|
|
|
|
|
|
|
Рис. 3.19. Ориентиры для сакральной анестезии
Рис. 3.20. Техника сакральной анестезии

130 Общая анестезиология
пальпируя при этом кожу над крестцовым каналом. Если нет выбухания, то игла установлена верно. Производят катетеризацию каудального канала (если она предполагалась). После аспирационной пробы вводят тест-дозу, содержащую 3 мл 2% раствора лидокаина с адреналином (1 : 200 000), после чего наблюдают за признаками субарахноидального блока и ЧСС.
Если признаков внутрисосудистого или субарахноидального введения тест-дозы не обнаружено, производят введение основной дозы МА (дробно, при постоянном наблюдении за пациентом и со скоростью не более 10 мл за 30 секунд). После введения МА иглу осторожно извлекают, место пункции заклеивают асептической наклейкой и пациента перемещают на спину.
Анестезия достаточного уровня обычно развивается через 20 мин после инъекции. Признаком наступающей анестезии часто служит ощущение пациентом тепла, распространяющегося от поясницы до ступней. Обязательно проведение гемодинамического мониторинга, включающего в себя пульсоксиметрию и контроль АД. Венозный доступ устанавливается еще до начала проведения анестезии.
Нейроаксиальная анестезия, как и любой другой метод анестезии, не является строго локальной, а затрагивает в той или иной степени все органы и системы организма, расстройства которых могут привести к различным осложнениям со стороны органов и систем (приложение 11).
Одним из осложнений со стороны ЦНС при спинальной и ошибочном проколе ТМО при эпидуральной анестезиях считают ППГБ. Частота ее развития колеблется от 1 до 10% и зависит от:
–индивидуальных особенностей больного: возраста (значительно реже у детей моложе 10 и взрослых старше 50 лет, наиболее часто в возрастной группе 31–50 лет); массы тела (значительно чаще у пациентов с низким индексом массы тела (ИМТ)); пола (в два раза чаще у женщин, чем у мужчин); наличие в анамнезе постпункционных головных болей;
–технических особенностей манипуляции: повторные пункции, конфигурация среза иглы, направление среза иглы, диаметр иглы, положение
пациента, состав раствора. При непреднамеренном проколе ТМО иглой Туохи калибром 16 G , частота возникновения ППГБ составляет 60–80%.
Согласно классификации Международного общества головной боли ППГБ определяют как любую головную боль после пункции субарахноидального пространства которая появляется в течение первых 5 дней, сопровождающуюся не менее чем одной из характеристик: напряжение мышц шеи, шум в ушах, гипоакузия, фотофобия, тошнота и головная боль, которая не может быть объяснена другими причинами.
ППГБ обычно возникает через 24–48 ч после пункции, но известны случаи, когда она возникала и через 12 суток после процедуры. Симптоматика обычно регрессирует спонтанно. Консервативное лечение приводит к исчезновению боли у 50% больных через 4 дня, у 75% через 7 дней и у 95% через 6 недель. Более раннее начало ППГБ коррелирует с плохим прогнозом.
