

2. константой диссоциации - Кдис.
I. Степень диссоциации ( ) – это отношение числа молекул, распавшихся
на ионы к общему числу молекул электролита.
Факторы, влияющие на степень диссоциации:
1.Природа растворенного вещества, тип связи (чем полярнее связь, тем легче идет диссоциация).
2.Природа растворителя (чем больше величина диэлектрической проницаемо-
сти ε, тем легче идет диссоциация).
3. Концентрация (при разбавлении увеличивается; |
= |
К |
|
|
дис |
). |
|||
с |
||||
|
|
|
4. Температура (с увеличением температуры растет до определенной вели-
чины, затем уменьшается).
5. Влияние одноименного иона (вводимый в систему одноименный ион подав-
ляет диссоциацию слабого электролита).
По величине степени диссоциации электролиты делятся на:
1. Сильные, у которых α > 30% : соли, некоторые кислоты - HClO4, H2SO4, HNO3, HI, HBr, HCl, гидроксиды щелочных металлов, гидроксиды щелочно-
зельных металлов: кальция, стронция и бария.
2.Средние, у которых 30% < <5% : H3PO4.
3.Слабые, у которых <5% : H2O, HCN, NH4OH.
II. Константа диссоциации (Кдис) – это константа равновесия процесса диссо-
циации.
Рассмотрим равновесие в растворе слабого электролита.
KA K+ + A-
41

Пусть концентрация слабого электролита в растворе С моль/л, - степень дис-
социации. Тогда концентрация недиссоциированных молекул [KA]= с(1- ), а
концентрация каждого из ионов [K+]=[ A-]= с . Выражение для константы дис-
социации имеет вид:
Это уравнение представляет собой закон разбавления Оствальда. Оно позволяет определять степень диссоциации при разных концентрациях элек-
тролита, если известна его константа диссоциации; а также константу диссоци-
ации электролита, если известна его степень диссоциации при какой-либо кон-
центрации.
Для растворов, в которых диссоциация электролита очень мала, <<1,
уравнение примет следующий вид:
Кдис 2·с или
= 

К дис с
.
Таким образом, степень диссоциации возрастает при разбавлении раствора.
Факторы, влияющие на константу диссоциации
1.Константа диссоциации зависит от природы растворенного вещества;
2.Константа диссоциации зависит от природы растворителя;
3. Константа диссоциации зависит от температуры;
4.Константа диссоциации не зависит от концентрации;
5.Константа диссоциации не зависит от наличия одноименного иона.
Ионные реакции в растворах электролитов
Обменные реакции в растворах электролитов идут до конца в трёх случаях:
1)когда образуется осадок;
2)когда образуется газообразное вещество;
3)когда образуется слабый электролит.
42
Ионные уравнения реакции показывают, между какими ионами про-
изошла реакция.
а) ВаСl2 + К2СО3 = ВаСО3↓ + 2КСl Ва2+ + СО32- = ВаСО3↓
б) BaCO3 + 2НСl = CO2 + H2O + BaCl2
BaCO3 + 2H+ = CO2 + H2O + Ba2+ в) NaOH + НСl = NaCl + Н2О
OH- + Н+ = H2O
Алгоритм составления ионных уравнений:
1. Записывается молекулярное уравнение реакции:
FeCl3 + 3NaOH→ Fe(OH)3↓+ 3NaCl
2. Записывается полное ионное уравнение: сильные электролиты представля-
ются в виде ионов, а труднорастворимые, газообразные вещества, слабые элек-
тролиты в виде молекул:
Fe3++3Cl- +3Na++3OH- → Fe(OН)3↓ + 3Na+ + 3C1-
3. Из полного ионного уравнения исключаются те ионы, которые повторяются в обеих частях, при этом получается сокращенное ионное уравнение:
Fe3+ + ЗОН- → Fe(OH)3
1.4.6. Электролитическая диссоциация воды
Водородный показатель
Вода – слабый электролит, из 226 молекул диссоциирует одна. Диссо-
циацию молекулы воды можно выразить уравнением:
2H2O <=> H3O+ + OH¯,
где H3O+ - ион гидроксония.
Упрощенно диссоциацию воды можно представить Н2О<=> Н+ + ОН-
Таким образом, молекула Н2О источник двух ионов Н+ и ОН¯, несущих проти-
воположные свойства (кислотные и основные), т.е. Н2О - амфолит.
43
Количественно процесс диссоциации воды характеризуется константой равновесия (диссоциации):
Кдис= [H+] [OH-] / [H2О] = 1,8 ∙ 10-16 (при 22◦С)
Так как вода диссоциированна слабо, концентрацию воды [H2О] можно счи-
тать постоянной: С = m / M ∙ V
[H2O] = 1000г / 18г/моль ∙ 1л = 55.56 моль/л
[H+] [OH-] = Кдис∙[H2О] = Kw ; Kw – ионное произведение воды
[H+] [OH-] = 1.8 ∙ 10-16 ∙ 55.56 = 10-14 (при 22◦С) ; Kw =10-14
Ионное произведение воды зависит от температуры. При увеличении температуры значение ионного произведения воды возрастает (например, при
100 С оно достигает величины 5.5·10-13). [H+] = [OH-] = √10-14 = 10-7 моль/л
Понятие среды: в химическом аспекте понятие среды означает концентрацию
вней ионов водорода. Среда бывает кислой, нейтральной или щелочной.
1)[H+] = [OH-] = 10-7 – нейтральная среда
2)[H+] > [OH-] > 10-7 – кислая среда
3)[H+] < [OH-] < 10-7 – щелочная среда
Для удобства расчетов было введено понятие водородного показателя (рН).
Водородный показатель рН – это отрицательный десятичный логарифм кон-
центрации ионов водорода:
pH = – ℓg[H+] , отсюда [H+] = 10-pH pOH = - ℓg[OH-], отсюда [OH-] = 10-pOH
pOH – гидроксильный показатель.
pH + pOH = 14
Исходя из вышесказанного, для количественной характеристики среды можно использовать следующие величины:
а) концентрацию ионов водорода СН+ или [Н+]; б) водородный показатель, рН.
44
концентрация ионов |
|
|
Водородный |
|
|
[Н+], моль/л |
|
|
среда |
показатель |
|
|
|
|
|
|
|
|
|
|
|
|
|
10-7 |
|
|
нейтральная |
7 |
|
|
|
|
|
|
|
> 10-7 (10-6, 10-5) |
|
|
кислая |
< 7 |
|
|
|
|
|
|
|
< 10-7 (10-8, 10-9) |
|
|
щелочная |
> 7 |
|
|
|
|
|
||
Расчеты рН сильных и слабых кислот и оснований |
|||||
Рассмотрим 4 возможных случая: |
|
|
|||
1. Сильная кислота – НCl, HNO3, H2SO4, HClO4 |
и др. |
||||
HАn <=> H+ + An- |
диссоциация идет практически нацело. |
||||
[H+] = C кислоты |
|
|
|
|
|
рН = - ℓg[H+] = - ℓg C кислоты |
|
|
|||
Пример 1: Рассчитать рН раствора HNO3, молярная концентрация которой |
|||||
С(HNO3) = 0.02 моль/л. |
|
|
|
|
|
Решение: рН = -lg 0,02 |
= - lg 2 ∙ 10-2= - (lg 2+lg 10-2) = -[0,3+(-2)]=1.7 |
||||
2. Слабая кислота – H2S, HCN, H2CO3, HNO2, H2SO3 и др. |
|||||
HАn <=> H+ + An- |
диссоциация идет слабо, меньше 5%. |
||||
[H+] ≠ С кислоты
[H+] = √Kдис ∙ C; это уравнение логарифмируют, меняют знаки и получают: pH = 1/2 pKа – 1/2 ℓg C кислоты
pKа - силовой показатель кислоты; pKа = - ℓg Kдис к-ты
Пример 2: Рассчитайте рН раствора цианистоводородной кислоты, молярная концентрация которой 0,1 моль/л, Ка HCN = 4.9∙10-10
Решение: рН = 1/2 рКа - 1/2 lg СHCN = 1/2 ∙ 9.31 - 1/2 1g l ∙ 10-1 =5.16; pKа (HCN) = - lg (4.9∙10-10) = 9.31
3. Сильное основание (щелочи) LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2
MeOH <=> Me+ + OH- диссоциация идет полностью.
45
[ОН-] = C основания
pOH- = - ℓg[OH-] = -ℓg C основания
рН = 14 – pOH- = 14 + ℓg C основания
Пример 3: Рассчитайте рН раствора КОН, молярная концентрация которого 3 ∙10-3 моль/л.
Решение: pOH = -lg (3 ∙10-3) = 2.56; рН = 14 – 2,56 = 11. 44
4. Слабое основание: |
NH4OH |
MeOH <=> Me+ + OH- |
диссоциация идет не полностью, меньше 5% |
[OH-] ≠ С основания |
|
[OH-] = √ Kдис ∙ C |
|
pH = 14 – 1/2 рКв + 1/2 ℓg Cоснования
pKв – силовой показатель основания; pKв= -ℓg Kдис осн
Пример 4: Рассчитать рН раствора гидроксида аммония, молярная концентрация раствора 0.002 моль/л, Кв NH4OH = 1.79 10-5
Решение: рН = 14 - 1/2 lg (l.79 ∙10-5) + 1/2 lg 0.002 = 10.27
Качественно кислотность среды определяется с помощью индикаторов – веществ, которые меняют свою окраску в зависимости от характера среды. Бо-
лее точно измерение pH среды проводят с помощью приборов pH –метров.
1.4.7. Кислотно-основное равновесие в биосистемах
Буферные растворы
Минеральный состав почв, органические вещества почвы создают раз-
личную реакцию почвенного раствора. В природных условиях реакции почвен-
ного раствора колеблется от рН 3-3.5 (в сфагновых торфах) до рН 9-10 (в со-
лонцовых почвах), но чаще всего она не выходит за пределы рН 4-8.
Реакции почвенного раствора оказывают большое влияние на развитие растений и микроорганизмов, на скорость, направленность происходящих в почве химических и биохимических процессов. Кислые почвы занимают в
46
нашей стране значительные площади. Многие сельскохозяйственные культуры отрицательно относятся к повышенной кислотности. Древесные растения мо-
гут активно изменять в нужном для себя направлении реакцию почвенного рас-
твора. Такие, как береза, ольха, уменьшают кислотность почвы на 0.5 - 1 еди-
ниц рН. Дуб, ель обыкновенная и сибирская увеличивают кислотность почвы на 0.4 - 1.98 единиц рН. Реакцию почвенного раствора могут изменять и вно-
симые удобрения.
Способность некоторых растворов сохранять постоянное значение рН при добавлении небольших количеств кислот и щелочей называют буферным действием.
Буферные растворы – это растворы, рН которых практически не изме-
няются при разбавлении, концентрировании, а так же при добавлении неболь-
ших количеств сильных кислот и щелочей.
Примеры буферных растворов:
1.Растворы, содержащие слабую кислоту и её соль, образованную сильным основанием.
СН3СООН + СН3СООNa – ацетатный буфер
2.Растворы, содержащие слабое основание и его соль образованную силь-
ной кислотой.
NH4OH + NH4Cl – аммиачный буфер
3.Растворы, содержащие смесь кислых солей
NaH2PO4 + Na2HPO4 – фосфатный буфер.
NaHCO3 + Na2CO3 – карбонатный буфер.
Врасчетах рН менее замещенная соль играет роль кислоты.
рН буферных растворов
I. Рассчитаем рН буферного раствора на примере ацетатного буфера:
СН3СООН + СН3СООNa
СН3СООН <=> CH3COO- + H+
47
Kдис = [CH3COO-] ∙ [H+] / [CH3COOH] [H+] = Kдис ∙ [CH3COOH] / [CH3COO-] [CH3COOH] = C кислоты
[CH3COO-] = C соли
-lg[H+] = - lg Kдис – lg C кислоты/С соли
рН = рКа – lg C кислоты/С соли
Если соль и кислота взяты в разных объемах, то формула имеет следую-
щий вид:
рН = рКа – lg (C кислоты ∙ V кислоты) / (Cсоли ∙ V соли)
С - молярная концентрация, моль/л.
рКа – силовой показатель кислоты
II. Для аммиачного буфера:
рН = 14 – рКв + lg (C основания ∙ V основания) / (C соли ∙ V соли)
рКв – силовой показатель основания.
Наиболее часто применяют буферные растворы с концентрацией компонентов
0.1 моль/л.
Механизм буферного действия
Буферное действие этих растворов объясняется их способностью связывать как ионы Н+, так и ОН-.
Рассмотрим механизм буферного действия на примере ацетатного буфера:
a)Добавляем кислоту:
СН3COONa + HCl → CH3COOH + NaCl CH3COO- + Na+ + H+ + Cl- → CH3COOH + Na+ + Cl-
CH3COO- + H+ → CH3COOH
Добавили сильную кислоту, получилась слабая кислота, рН практически не изменится.
в) Добавляем щелочь:
СH3COOH + NaOH → CH3COONa + H2O
CH3COOH + Na+ + OH- → CH3COO- + Na+ + H2O
48
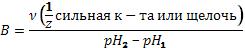
CH3COOH + OH-→ CH3COO- + H2O
Добавили сильную щелочь, получился слабый электролит – вода, рН не изме-
нится. Таким образом, способность буферного раствора поддерживать практи-
чески постоянной величину рН основана на том, что один компонент раствора связывает ионы [Н+], а другой [OH-]
Разбавление буферного раствора или его концентрирование путём вы-
паривания не влияет на pH, т.к. при этом меняется концентрация компонентов буфера, но их отношение остается неизменным.
Буферная ёмкость
Способность буферных растворов сохранять постоянство pH небезгра-
нична. Предел, в котором проявляется буферное действие называется буферной ёмкостью (B). Она определяется количеством эквивалентов сильной кислоты или щелочи, которое надо добавить к 1 литру буферного раствора, чтобы его pH изменился на 1.
;
где pH1 исходное значение pH буферного раствора, pH2 значение после добавления щелочи или кислоты.
Буферная ёмкость тем выше, чем больше концентрация компонентов бу-
ферного раствора. Наибольшей буферной емкостью обладают растворы с оди-
наковой концентрацией компонентов. В таких растворах всегда  или
или
 . Разбавление буферного раствора не влияет на его pH, но сильно ска-
. Разбавление буферного раствора не влияет на его pH, но сильно ска-
зывается на его буферной ёмкости, она уменьшается.
1.4.8. Контрольные задания 61-70
Заполните графы таблицы
49
|
|
|
|
Молярная |
|
|
|
|
|
|
Молярная кон- |
Степень дис- |
концентрация |
|
|
|
|
Вариант |
Вещество |
центрация С(Х), |
социации α % |
эквивалента |
рН |
СОН |
- |
рОН |
|
||||||||
|
|
моль/л |
|
С(1/ZХ), |
|
|
|
|
|
|
|
|
моль/л |
|
|
|
|
61 |
НСlO |
0.01 |
* |
|
|
* |
|
|
62 |
HCN |
0.005 |
|
|
|
|
|
|
63 |
NaOH |
|
|
|
12 |
|
|
|
64 |
Mg(OH)2 |
* |
|
|
11 |
|
|
|
65 |
HCN |
2. 5 10-1 |
|
|
* |
* |
|
* |
66 |
НВг |
0.05 |
* |
|
* |
|
|
* |
67 |
HCN |
0.03 |
0.02 |
|
|
|
|
|
68 |
HNO3 |
|
* |
* |
2 |
|
|
|
69 |
CH3COOH |
10-3 |
|
* |
|
* |
|
|
70 |
H2SO3 |
0.06 |
* |
|
|
|
|
* |
Примечание: задания, помеченные "*", не выполняются
Контрольные задания 71-80
71. Рассчитайте рН буферного раствора, состоящего из 10 мл раствора уксус-
ной кислоты C(CH3COOH) = 2 моль/л и 15 мл раствора ацетата натрия
C(CH3COONa) = 0.1 моль/л
72. Необходимо приготовить аммонийный буфер с рН=9.8. Имеется 10 мл рас-
твора аммиака C(NH4OH) = 0.2 моль/л. Рассчитайте объём нитрата аммония
C(NH4NO3)= 0.5 моль/л, который необходим.
73. Определите рН буферной аммонийной смеси, состоящей из 2.70 мл раствора хлорида аммония C(NH4Cl) = 0.5 моль/л и 10 мл раствора аммиака C(NH4OH) = 0.10 моль/л.
74. Рассчитайте рН фосфатного буфера, составленного из 15.0 мл С(Na2HPO4)= 0.2 моль/л и 25.0 мл C(NaH2PO4) = 0.2 моль/л. Рассмотрите механизм действия такой буферной смеси.
75. Для определения содержания магния в почве комплексонометрическим ме-
тодом используют буферную смесь, приготовленную так: 20 г NH4C1 раство-
ряют в 500 мл воды, добавляют 100 мл раствора NH4OH с массовой долей 20%, ρ = 0.91 г/мл. Рассчитайте рН такой смеси. Объясните механизм действия тако-
го буфера.
50
