
46 |
7,15,25,34,43,58,61,73,81,93,110,114,130,133,149,160,169,178,183,193 |
|
|
47 |
6,16,26,33,42,59,68,74,90,94,106,115,121,134,150,151,170,179,184,192 |
|
|
48 |
5,17,27,32,41,51,67,75,88,95,107,116,122,135,141,152,161,180,185,193 |
|
|
49 |
4,18,28,33,42,52,68,76,89,96,108,117,123,136,142,153,162,180,196 |
|
|
50 |
3,19,29,34,49,53,65,77,86,97,109,118,124,137,143,151,161,171,181,191 |
|
|
51 |
1,11,21,31,41,51,61,71,81,91,101,111,121,131,141,151,161,171,181,191 |
|
|
52 |
2,12,22,32,42,52,62,72,82,92,102,112,122,132,142,152,162,172,182,192 |
|
|
53 |
3,13,23,33,43,53,63,73,83,93,103,113,123,133,143,153,163,173,183,193 |
|
|
54 |
4,14,24,34,44,54,64,74,84,94,104,114,124,134,144,154,164,174,184,194 |
|
|
55 |
5,15,25,35,45,55,65,75,85,95,105,115,125,135,145,155,165,175,185,195 |
|
|
56 |
6,16,26,36,46,56,66,76,86,96,106,116,126,136,146,156,166,176,186,196 |
|
|
57 |
7,17,27,37,47,57,67,77,87,97,107,117,127,137,147,157,167,177,187,197 |
|
|
58 |
8,18,28,38,48,58,68,78,88,98,108,118,128,138,148,158,168,178,188,198 |
|
|
59 |
9,19,29,39,49,59,69,79,89,99,109,119,129,139,149,159,169,179,189,199 |
|
|
60 |
10,20,30,40,50,60,70,80,90,100,110,120,130,140,150,160,170,180,190, |
|
200 |
|
|
61 |
1,11,22,32,43,53,64,74,85,95,106,116,127,137,148,158,169,179,190,199 |
|
|
62 |
2,12,23,33,44,54,65,75,86,96,107,117,128,138,149,159,170,180,181,198 |
|
|
63 |
3,13,24,34,45,55,66,76,87,97,108,118,129,139,150,160,171,181,162,197 |
|
|
64 |
4,14,25,35,46,56,67,77,88,98,109,119,121,132,141,151,161,172,183,196 |
|
|
65 |
5,15,26,36,47,57,68,78,89,99,110,120,122,132,142,152,162,173,184,197 |
|
|
66 |
6,16,27,37,48,58,69,79,90,100,101,111,123,133,143,153,163,174,185,191 |
|
|
67 |
7,17,28,38,49,59,70,80,91,101,112,122,81,134,144,154,164,175,186,192 |
|
|
68 |
8,18,29,39,41,51,62,72,81,92,103,113,123,135,144,155,165,176,187,193 |
|
|
69 |
9,19,30,40,42,53,63,73,82,93,103,114,124,136,145,156,166,177,188,194 |
|
|
70 |
10,20,21,31,43,54,64,74,83,94,104,115,125,137,146,157,167,178,189,195 |
|
|
71 |
1,12,23,34,45,56,67,78,89,100,106,117,129,131,142,153,164,175,186,196 |
|
|
72 |
2,13,24,35,46,57,68,79,90,95,107,118,121,132,143,154,165,176,187,197 |
|
|
73 |
3,14,25,36,47,58,69,80,85,96,108,119,122,133,144,155,166,177,188,198 |
|
|
74 |
4,15,26,37,48,59,70,74,86,97,109,120,123,134,145,156,167,172,189,199 |
|
|
75 |
5,16,27,38,49,60,66,75,87,98,110,119,124,135,146,157,168,173,190,200 |
|
|
76 |
6,17,28,39,50,51,61,76,88,99,101,111,125,136,147,58,169,174,181,191 |
|
|
77 |
7,18,29,40,41,52,62,77,89,100,91,101,111,125,136,147,158,169,175,182, |
|
192 |
|
|
11
78 |
8,19,30,31,42,53,63,78,90,92,102,112,126,137,148,159,161,176,183,193 |
|
|
79 |
9,20,21,32,43,54,64,79,81,93,103,113,127,138,149,160,162,177,184,194 |
|
|
80 |
10,11,22,33,44,55,65,80,82,94,104,114,128,139,150,151,163,178,184,195 |
|
|
81 |
9,12,21,39,49,51,69,71,85,99,101,119,121,139,141,60,161,179,181,196 |
|
|
82 |
8,13,22,38,48,52,68,72,84,98,102,118,122,138,142,158,162,178,182,197 |
|
|
83 |
7,14,23,37,47,53,67,73,83,97,103,117,123,137,143,57,163,177,183,198 |
|
|
84 |
6,15,24,36,46,54,66,74,82,96,104,116,124,136,144,156,164,176,184,199 |
|
|
85 |
5,16,25,35,45,55,65,75,81,91,105,115,125,135,145,155,165,175,185,200 |
|
|
86 |
4,17,26,34,50,56,64,76,89,92,106,114,126,134,146,154,166,174,190,199 |
|
|
87 |
3,18,27,33,43,57,63,77,88,107,113,127,133,147,153,167,173,186,198 |
|
|
88 |
2,19,28,32,42,58,62,78,87,94,108,112,130,132,148,152,168,172,187,197 |
|
|
89 |
1,20,29,31,41,59,61,79,86,95,110,111,128,131,149,151,169,171,188,196 |
|
|
90 |
6,18,30,32,44,51,68,73,82,91,106,113,130,131,142,153,164,175,186,195 |
|
|
91 |
7,19,21,33,49,52,67,74,81,92,107,112,128,131,143,154,165,176,187,194 |
|
|
92 |
8,20,22,39,48,53,66,75,89,93,108,111,130,131,144,155,166,177,188,193 |
|
|
93 |
9,11,21,38,47,54,65,76,88,94,110,113,128,139,145,156,167,178,189,192 |
|
|
94 |
10,12,22,37,46,55,64,77,87,95,106,112,129,140,146,157,168,179,190,191 |
|
|
95 |
9,13,23,36,45,56,63,78,86,91,107,111,127,131,147,158,169,180,181,192 |
|
|
96 |
8,14,24,35,50,67,62,79,82,92,108,113,129,132,148,159,170,179,182,193 |
|
|
97 |
7,15,25,34,43,58,61,73,81,93,110,114,130,133,149,160,169,178,183,194 |
|
|
98 |
6,16,26,33,42,59,68,74,90,94,106,115,121,134,150,151,170,179,184,195 |
|
|
99 |
5,17,27,32,41,51,67,75,88,95,107,116,122,135,141,152,161,180,185,196 |
|
|
12
1.Теоретические основы неорганической химии
1.1.Периодический закон и периодическая система химических элемен-
тов Д.И. Менделеева. Строение вещества
Периодический закон – это основной закон современной химии. В исто-
рии открытия и развития периодического закона можно выделить три основных этапа:
1) Первый этап: XIX век. Растет количество открытых химических эле-
ментов, определяются их атомные массы. К этому времени были известны 63
элемента, введено понятие валентность, изучены формы и свойства соединений элементов. Систематизация растущего фактического материала становилась акту-
альной задачей. В 1869 г. русский химик Д.И. Менделеев сформулировал от-
крытый им закон следующим образом: «Свойства элементов, а так же форма и
свойства соединений элементов находятся в периодической зависимости от
величины атомной массы элементов».
2)Второй этап: Начало XX века – революция в области физики.
В1896 г. А. Беккерель обнаруживает явление радиоактивности у соединений урана. Мария и Пьер Склодовские-Кюри обнаружили радиоактивность и у соеди-
нений тория, а в 1898 г. они открыли в составе урановых руд присутствие двух но-
вых радиоактивных элементов – полония и радия. 1897 г. Томпсон открывает элек-
трон и в 1903 г. создает первую модель атома «сливовый пудинг». Развивая эти представления, Э. Резерфорд в 1911г. предложил ядерную модель строения атома.
В 1913 г. Мозли, изучая спектры атомов, установил, что положительный заряд ядра равен порядковому номеру элемента. В 1923 г. Д. Иваненко и В. Гейзенберг предложили протонно-нейтронную теорию строение ядер атома. Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом же атом – система электронейтральная. Атомное ядро состоит из нуклонов: протонов (заряд +1, массовое число 1) и нейтронов (заряд 0, массовое число 1). Заряд ядра, равный порядковому номеру элемента в таблице Д.И. Менделеева, совпадает с числом протонов; массовое число ядра равно сум-
13
марному количеству протонов и нейтронов. У одного элемента возможно суще-
ствование атомов с различным массовым числом ядер – изотопов, т.е. атомов с различным числом нейтронов и одинаковым числом протонов. Наличие изотопов позволило объяснить порядок расположения в таблице некоторых элементов:
Ar – K; Te – I; Ca-Ni.
Современная формулировка периодического закона – свойства элементов и их соединений находятся в периодической зависимости от заряда ядра ато-
ма или порядкового номера элемента.
3) 3 этап: 20-е годы XX века – Развитие квантовой механики и квантовой физи-
ки. Основоположники: Макс Планк, В. Гейзенберг, Нильс Бор, Де Броль. Еще в
1900 г. М. Планк предположил, что лучистая энергия испускается и поглощается телами не непрерывно, а дискретно. При этом, он определил энергию каждой та-
кой порции как Е=h∙ (уравнение Планка), где – частота излучения; h = 6,626∙10-34 Дж∙с – постоянная Планка.
Де Броль показал, что электрон обладает корпускулярно-волновой двой-
ственностью. В одних опытах он ведет себя как частица (корпускула) – имеет массу и заряд. В других – движущийся электрон проявляет волновые свойства, он способен к дифракции и интерференции. Был сформулирован принцип неопреде-
ленности Гейзенберга – невозможно одновременно точно указать местоположе-
ние и скорость движения электрона, если мы знаем, где он находится, то не знаем,
с какой скоростью он движется, и наоборот. Электрон не имеет определенной траектории движения. Можно говорить только о вероятности нахождения элек-
трона в разных точках пространства. Было введено понятие атомной орбитали.
Атомная орбиталь – это часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (≈ 90%).
Квантовые числа
Для характеристики орбиталей используют квантовые числа: n, ℓ, m, s.
1) n – главное квантовое число, характеризующее энергию и размер орбиталей.
Оно определяет число электронов на уровне N = 2n2. Принимает значения n=1,2,3,4……. ∞ – все целые числа от 1 до бесконечности. Совокупность орбита-
14
лей с одинаковым значением n – энергетический уровень, n равно номеру перио-
да.
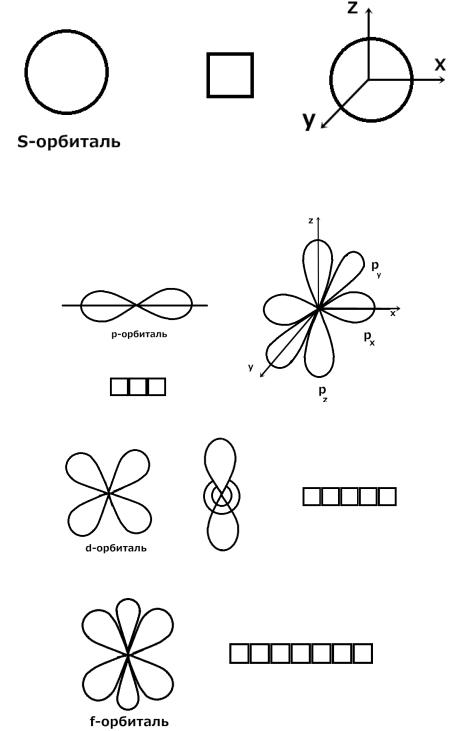
2) ℓ – побочное (орбитальное) квантовое число. Характеризует форму облаков и
орбиталей. Принимает значения от 0 до n-1.
1) ℓ = 0. Орбиталь имеет имеет форму шара. Это s-орбиталь. Имеется на всех энергетических уровнях.
2) ℓ = 1. Орбиталь имеет имеет форму гантели.. Это p-орбиталь. Имеется на всех энергетических уровнях, кроме первого.
3)ℓ = 2. Это d - орбиталь. Появляется на третьем энергетическом уровне.
4)ℓ = 3. Это f-орбиталь. Появляется на четвертом энергетическом уровне.
15
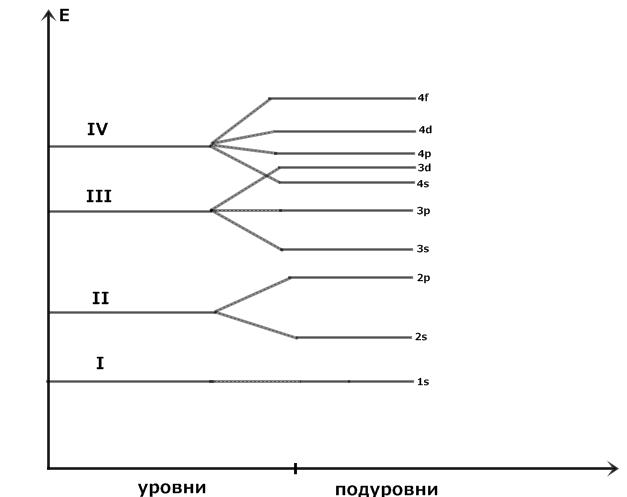
Энергетические уровни состоят из подуровней, число подуровней равно главному квантовому числу.
Рис. 1. Энергетическая диаграмма распределение электронов по уровням и под-
уровням.
По величине энергии электронные уровни и подуровни располагаются в следую-
щий ряд: 1s<2s<2p<3s<3p<4s≈3d<4p<5s<4d<5p<6s≈5d≈4f<6p<7s≈6d≈4f.
3) m – магнитное квантовое число. Характеризует направление орбиталей в про-
странстве и число орбиталей на подуровнях. Принимает значения от – ℓ до + ℓ (одно значение – одна квантовая ячейка.)
s: |
ℓ =0, m=0 [_] |
p: |
ℓ =1, m= -1, 0, +1 [_|_|_] |
d: |
ℓ =2, m= -2, -1, 0, +1, +2 [_|_|_|_|_] |
f: |
ℓ =3 , m= -3, -2, -1, 0, +1, +2, +3 [_|_|_|_|_|_|_] |
16
4) S – спиновое квантовое число. Характеризует вращение электрона вокруг сво-
ей оси. Принимает 2 значения +1/2 (электрон вращается влево) и -1/2 (электрон вращается вправо). Обозначается: S=+1/2(↑), S=-1/2(↓).
Правила заполнения орбиталей:
1)Принцип запрета Паули – в атоме не может быть двух электронов, у кото-
рых все 4 квантовых числа одинаковы. Поэтому на каждой орбитали может быть не более 2-х электронов с антипараллельными спинами.
2)Правило Хунда – в основном состоянии атом должен иметь максимально воз-
можное число неспаренных электронов в пределах одного подуровня.
3)Принцип наименьшей энергии - в основном состоянии атома каждый элек-
трон располагается так, чтобы его энергия была минимальной, поэтому элек-
троны заполняют уровни в порядке возрастания их энергии
4)Правило Клечковского – прежде всего заполняются орбитали с меньшим значением суммы n + ℓ .
Объяснение, почему 4s заполняется раньше, чем 3d:
4s: n=4; ℓ =0 |
n + ℓ = 4 |
3d: n =3; ℓ =2 |
n + ℓ = 5 |
Поэтому первым заполняется 4s уровень.
Примеры заполнения уровней:
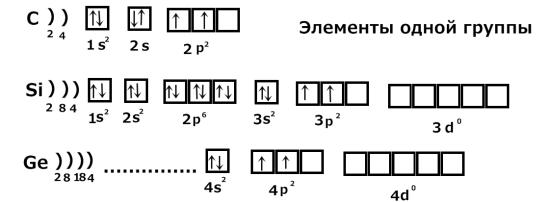
1) Рассмотрим заполнение уровней у элементов одной группы:
Элементы одной группы имеют одинаковое строение внешнего элек-
тронного слоя. Число электронов на внешнем уровне равно номеру группы.
17
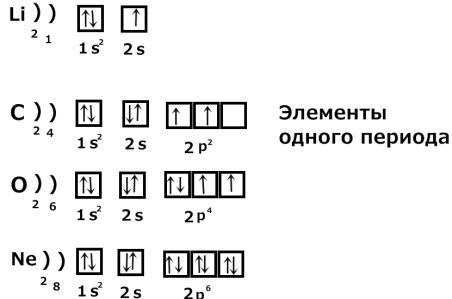
2) Рассмотрим заполнение уровней у элементов одного периода:
Элементы одного периода имеют одинаковое число энергетических уровней. Это число равно номеру периода.
Физический смысл периодического закона: периодическое изменение
свойств химических элементов и их соединений с увеличением порядкового номера объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов.
Периодическая система Д.И. Менделеева – это наглядное графическое изображение периодического закона. Наиболее распространена её так называемая короткопериодная форма.
В структуре таблицы выделяют периоды, группы и подгруппы.
Периодом называют горизонтальную совокупность элементов, располо-
женных в порядке возрастания заряда ядра. Каждый период начинается s - эле-
ментом с конфигурацией внешнего энергетического уровня ns1 и завершающийся p - элементом с конфигурацией внешнего энергетического уровня ns2np6 (кроме первого периода, который заканчивается гелием – 1s2). Номер периода определя-
ется значением главного квантового числа внешнего энергетического уровня.
Первые три периода называют малыми и состоят они только из s- и и - элементов.
Четыре остальных периода называют большими. В составе четвёртого и пятого
18
периодов появляются d- элементы, а в шестой и седьмой периоды входят f- эле-
менты. В связи с закономерным изменением электронного строения атомов в пре-
делах малых периодов свойства элементов изменяются резко, в больших перио-
дах – медленно.
Группой называют совокупность элементов, расположенных в таблице вертикально в порядке возрастания заряда ядра. В периодической системе нахо-
дится 8 групп, так как на внешнем энергетическом уровне не может быть больше восьми валентных электронов. Каждая группа состоит из главной и побочной подгрупп. В состав главных подгрупп входят только s- или p- элементы, а побоч-
ных – d- и f- элементы.
Просматривается четкая связь между электронной структурой атомов и его поло-
жением в таблице:
1)номер элемента совпадает с величиной положительного заряда ядра, числом протонов и электронов;
2)номер периода показывает число электронных оболочек или энергетических уровней и значение главного квантового числа;
3)номер группы показывает число валентных электронов. Для s- и p- элементов валентные электроны находятся на внешнем энергетическом уровне, для d-
элементов на s- и p-подуровнях внешнего и d- подуровне предпоследнего уровня;
4)элементы главных и побочных подгрупп отличаются по заполнению электрон-
ных оболочек (у главных подгрупп заполняются s- и p- уровни, у побочных d-
и f- уровни);
5)высшая валентность по кислороду равна номеру группы.
Спиновая теория валентности
Понятие валентности было введено в 1853г английским ученым Франклан-
дом. Валентность элемента – это число химических связей, которые атом дан-
ного элемента образует с другими атомами в данной молекуле.
Согласно современным представлениям валентность элемента определяется тремя факторами:
19
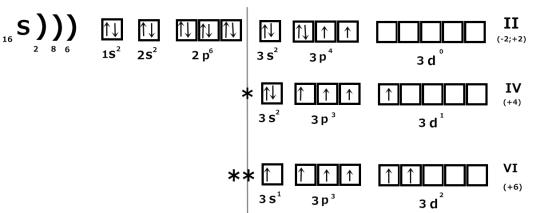
1)числом неспаренных электронов;
2)наличием свободных орбиталей и возможностью распаривания электро-
нов;
3)наличием неподеленных электронных пар на внешнем уровне и возможно-
стью донорно-акцепторного взаимодействия.
Рассмотрим на примере серы:
Сера в основном состоянии имеет валентность II, в возбужденном - IV и VI.
1.1.1. Контрольные задания 1-10
Для атомов и ионов указанных элементов:
а) представьте электронную структуру;
б) изобразите графически нормальное и возбужденное состояние;
в) укажите валентные электроны.
1 |
6С, 14 Si, 11Na+ |
6 |
8O, 33As, Cu2+ |
|
|
|
|
2 |
13Al, 15P, 17Cl- |
7 |
19K, 25Mn, Ca2+ |
|
|
|
|
3 |
12Mg, 17Cl, 4Be2+ |
8 |
16S, 23V, O2- |
|
|
|
|
4 |
20Ca, 24Cr, 9F- |
9 |
32Ge, 38Sr, S4+ |
|
|
|
|
5 |
12Mg, 30 Zn, 22Ti4+ |
10 |
7N, 29Cu, P3- |
|
|
|
|
1.1.2. Контрольные задания 11-20
Для указанных молекул изобразите геометрическую форму, характер перекрыва-
ния валентных орбиталей, укажите вид химической связи, возможный тип гибри-
дизации атомных орбиталей.
20
