
РУКОВОДСТВО ДЛЯ ВРАЧЕЙ
.docxНорма и патология |
Исследуемый образец |
Концентрация, пкг/мл |
|
ИЛ- Ip |
ФНОа |
||
Взрослый здоровый человек |
Сыворотка крови |
62±8 |
64±38 |
Новорожденный |
» » |
<50 |
<50 |
Менингит: бактериальный асептический норма |
Цереброспинальная жидкость » » » » |
944±128 48±11 37,5±19 |
7291227 |
Септический шок норма |
Плазма крови » » |
120±17 62±8 |
1119±30 25±8 |
Болезни легких: бактериальные небактериальные норма |
Бронхоальвеолярная жидкость » » » » |
354±75,3 136±76,6 56±25,1 |
— |
Тяжелая форма гепатита В |
Сыворотка крови |
221,5±84,5 |
6800-118 000 |
Увеличение уровня цитокинов ИЛ-1, ИЛ-6, ИЛ-8 возникает одновременно с активацией систем комплемента и каскада коагуляции. В результате метаболизма арахидо-новой кислоты образуются лейко-триены, ПГ, тромбоксан A2 и ТАФ. Это вызывает вазодилатацию, активацию системы свертывания крови и повышение прокоагулянтной активности. На базальной мембране появляются адгезивные наложения из тромбоцитов и фибрина. По мере прогрессирования процесса медиаторы могут взаимодействовать между собой, активируя друг друга. Если повреждение достаточно сильное, происходит выброс громадного количества цитокинов (каскад воспалительных цитокинов: ФНО« -> ИЛ-1 -> ИЛ-6, ИЛ-8). С током крови цитокины попадают в гипоталамус, действуя на клетки гипоталамуса, последние активируют деятельность передней доли гипофиза к выработке АКТГ и синтезу кортикостероидов надпочечниками. Повышение концентрации провоспалительных цитокинов в крови приводит к активации различных систем организма, и начинается острофазовый ответ, который характеризуется лихорадкой, лейкоцитозом, гиперметаболизмом, наличием острофазовых белков в сыворотке крови, активацией системы свертывания крови, усилением болевого синдрома, полиорганной дисфункцией. Концентрация провоспалительных цитокинов в сыворотке крови и других биологических жидкостях резко возрастает. Интересно отметить, что несте-роидные противовоспалительные средства, в частности ингибиторы циклооксигеназы, снижая индуцированный ИЛ-1, синтез ПГ и тром-боксана, подавляют воспалительный процесс, опосредованный этими метаболитами арахидоновой кислоты. Низкие дозы кортикостероидов стимулируют иммунные процессы, тогда как высокие дозы кортикостероидов подавляют как иммунные реакции, так и воспалительный процесс [Марино П., 1998]. Медиаторы синдрома системной воспалительной реакции (CCBP): • ФИО, TNF; • интерлейкины (ИЛ-1, ИЛ-4, ИЛ-6, ИЛ-8 и др.); • ТАФ; • дейкотриены; • тромбоксан A^; • ПГ (E2, I2) • гистамин, клеточные адгезивные молекулы; • оксид азота; • γ-интерферон; • токсические метаболиты кислорода и другие свободные радикалы; • катехоламины; • стрессовые гормоны. Другие медиаторы CCBP. Известно много медиаторов, участвующих в формировании ПОН. Среди них, кроме цитокинов, наибольшее функциональное значение имеют лейкотриены, ПГ, пептиды, гормональные амины, опиоиды, а также лизосомальные ферменты, кислородсодержащие радикалы и др. Следует подчеркнуть, что в отношении критических состояний и ПОН указанные субстанции рассматриваются как дезорганизующие и патогенные, хотя истинная их роль укладывается также в рамки физиологических регуляторных функций [Go-ris R., 1990; Marini J.J., Wheeler A.P., 1997]. ^ Продукты распада арахидоновой кислоты (лейкотриены, ПГ EI и £2, тромбоксан, эпоксиды). Их совокупные факторы характеризуются брон-хоконстрикцией, повышенной проницаемостью мембран, микротромбозами, адгезией, агрегацией, дегра-нуляцией лейкоцитов [Goris R., 1990]. Оксид азота (NO) — самая маленькая по размерам молекула, синтезируемая в клетке и проявляющая свою биологическую активность. Оксиду азота приписывают роль фактора, вызывающего релаксацию сосудов. Повреждающее действие NO выражается в ингибировании ряда ферментов, индукции процессов ПОЛ, снижении антиоксидант-ного потенциала клеток [Жданов ГГ., Модель М.Л., 1996; Рябов Г.А., Азизов Ю.М., 2000]. Интерфероны являются цитоки-нами. Известно три вида интерфе-ронов: И Фа (лейкоцитарный), ИФР (фибробластный) и ИФУ (иммунный). ИФ« и ИФРобладают сильной противовирусной активностью. ИФУ обладает иммунорегуляторным противовирусным и антипролифератив-ным свойствами. ИФ« и ИФР усиливают действие N К-клеток (основная функция NK-клеток — разрушение клеток, инфицированных вирусом, и опухолевых клеток — естественных киллеров). ТАФ усиливает агрегацию тромбоцитов и нейтрофилов, способствует освобождению оксидантов, образованию продуктов цикло- и липоок-сигеназы в метаболизме арахидоновой кислоты. Непосредственное действие приводит к вазоконстрикции и вазодилатации, повышению проницаемости легочных и системных сосудов [Ковальчук Л.В. и др., 1999]. Фибронектин — белок, существующий в двух основных формах: тканевая — обеспечивает непроницаемость волокон и соединений клеток; циркулирующая — вызывает адгезию частиц, подлежащих уничтожению, к макрофагам и эндотелию. ^ Кислородные радикалы повреждают эндотелиальную мембрану, клетки легочного интерстиция, участвуют в образовании хемотаксического ли-пида, притягивающего лейкоциты. Основными факторами, усугубляющими «медиаторно-цитокиновую бурю», являются гипоксия и дизок-сия [Боун Р., 1995; Жданов Г.Г., Ho-дель M.Л., 1996], глубокие нарушения микроциркуляции, аномально высокие концентрации промежуточных и конечных продуктов обмена веществ, циркулирующих иммунных комплексов, биогенных аминов, продуктов ПОЛ [Ковальчук Л.В., 1999;CerraF., 1987]. Основными морфологическими признаками системной воспалительной реакции и ПОН у пациентов с клинической картиной дыхательной, сердечно-сосудистой, почечной, печеночной недостаточности были деструкция, отек, геморрагии и микротромбы в тканях основных органов [Боун Р., 1995]. Суммарные эффекты, оказываемые медиаторами повреждения, формируют генерализованную системную реакцию, или CCBO — SIRS (табл. 27.3). ^ Таблица 27.3. Медиаторы сепсиса и их действие [по Marini J. и Wheeler Α., 1997]
Агент |
Действие |
Клеточные элементы: |
|
моноциты и макрофаги нейтрофилы |
Продукция TNF и IL-I Разрушение ткани путем |
|
оксидантного и протеаз-ного механизмов |
Эйкозаноиды: |
|
ПГ, проста-циклин |
Вазодилатация, ингиби-рование агрегации тромбоцитов |
Тромбоксан |
Вазоконстрикция, образование агрегатов тромбоцитов |
Серия E ПГ: лейкотриены |
Вазодилатация почечных сосудов, ингибиро-вание образования ци-токинов |
Цитокины: ФНО (TNF) |
Активизирует нейтрофилы, вызывая образование ИЛ-1, ИЛ-6 и ИЛ- 8, способствует лейкоцитарной адгезии стенок сосудов |
ИЛ-1, ИЛ-6, ИЛ-8 |
Нейтрофильный аттрак-тант |
Оксиданты H2O2, НОСГ2, O2 |
Прямое повреждение липидов, нуклеотидов и протеинов |
Протеазы |
Разрушение жизненных клеточных белков, в том числе оксидантов |
Упрощенное
представление развития синдрома сепсиса
(рис. 27.2): в большинстве случаев
воспалительный стимул (триггер) и
ИЛ-1 активируют базальную ткань и
циркулирующие мононуклеарные клетки,
в результате происходит образование
ФНО и FiJI-I, которые активизируют
ядросодержащие клетки; другие клетки,
особенно нейтрофилы, в ответ на ФНО
вырабатывают дополнительно ИЛ, большее
количество ФНО, кислородные радикалы,
ПГ, лейкотриены, протеазы. ФНО и ИЛ-1
также активируют молекулы адгезии на
нейтрофилах и сосудистом эндотелии,
что заканчивается закреплением клетки
и повреждением сосуда.
Диагностика.
Клинический диагноз сепсиса основывается
на ряде ключевых витальных симптомов,
включающем наличие инфекции и системного
воспалительного ответа. Это положение
находится в противоречии с прежней
концепцией заболевания, в которой
основополагающим признаком считалось
присутствие бактерий в крови. В настоящее
время можно утверждать, что сама инфекция
не является причиной многочисленных
патологических сдвигов, характерных
для сепсиса. Они возникают как результат
ответной реакции организма на инфекцию
и некоторые другие факторы. Сепсис есть
клинический синдром, он не может быть
основан на одном лабораторном признаке
инфекции.
Лихорадка является
ключевым признаком сепсиса. Она возникает
как результат присутствия в крови
определенных медиаторов, наблюдается
более чем в 90 % случаев диагностированного
сепсиса. Лихорадка может быть минимальной
или вообще отсутствовать у пожилых
больных, больных с почечной недостаточностью
или получающих стероиды и другие
противовоспалительные препараты.
Гипотермия встречается примерно в 10 %
случаев сепсиса и
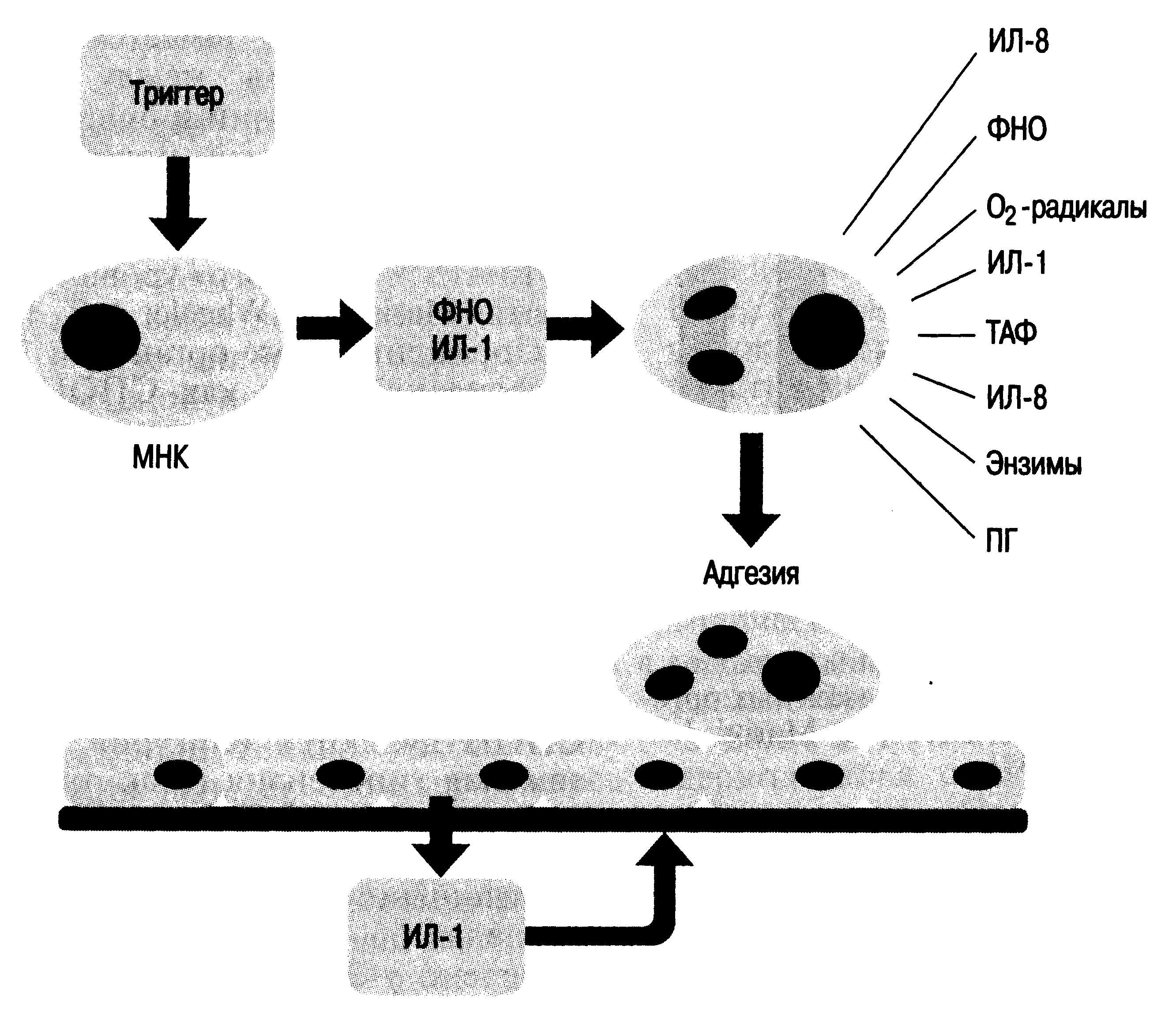 Рис.
27.2. Системная воспалительная реакция
[по Marini J.J., Wheeler A.Р., 1997]. Объяснение в
тексте.
является
плохим прогностическим признаком:
смертность при этом более 80 %. Полагают,
что высокая смертность при гипотермической
реакции обусловлена грамотрицатель-ной
бактериемией, шоком и/или сопутствующими
заболеваниями [Marini JJ., Wheeler A.Р.,
1997].
Тахипноэ —
второй витальный симптом, обычно ранний
признак сепсиса. В ранней стадии сепсиса
нарушения дыхания выражены по типу
гипервентиляции и дыхательного алкалоза.
Учащение дыхания вызвано прогрессирующей
гипоксе-мией и повышенными метаболическими
потребностями, развивающимися при
метаболическом ацидозе. У 90 % больных с
гипоксемией необходимо проведение
оксигенотера-пии, особенно если
соотношение PaO2/FiO2<300.
B то же время диагноз сепсиса не исключается
у па-
циентов
без тахипноэ и изменений газового
состава крови.
Тахикардия — важный
(кардинальный) симптом сепсиса. Считается
универсальным признаком во всех случаях,
за исключением заболеваний, связанных
с нарушением проводящей системы сердца,
или приема β-блокаторов.
Изменение
уровня циркулирующих лейкоцитов —
важный критерий сепсиса. Типично для
сепсиса либо повышение числа лейкоцитов,
либо падение их и часто появление
незрелых форм нейтрофилов.
Сердечно-сосудистые
расстройства могут
иметь различный характер. В ранней фазе
сепсиса обычно отмечается снижение
ОПСС на фоне увеличенного CB, результатом
чего является гипотензия. Позднее CB
может уменьшаться, ОПСС оставаться
сниженным или как аль-
Рис.
27.2. Системная воспалительная реакция
[по Marini J.J., Wheeler A.Р., 1997]. Объяснение в
тексте.
является
плохим прогностическим признаком:
смертность при этом более 80 %. Полагают,
что высокая смертность при гипотермической
реакции обусловлена грамотрицатель-ной
бактериемией, шоком и/или сопутствующими
заболеваниями [Marini JJ., Wheeler A.Р.,
1997].
Тахипноэ —
второй витальный симптом, обычно ранний
признак сепсиса. В ранней стадии сепсиса
нарушения дыхания выражены по типу
гипервентиляции и дыхательного алкалоза.
Учащение дыхания вызвано прогрессирующей
гипоксе-мией и повышенными метаболическими
потребностями, развивающимися при
метаболическом ацидозе. У 90 % больных с
гипоксемией необходимо проведение
оксигенотера-пии, особенно если
соотношение PaO2/FiO2<300.
B то же время диагноз сепсиса не исключается
у па-
циентов
без тахипноэ и изменений газового
состава крови.
Тахикардия — важный
(кардинальный) симптом сепсиса. Считается
универсальным признаком во всех случаях,
за исключением заболеваний, связанных
с нарушением проводящей системы сердца,
или приема β-блокаторов.
Изменение
уровня циркулирующих лейкоцитов —
важный критерий сепсиса. Типично для
сепсиса либо повышение числа лейкоцитов,
либо падение их и часто появление
незрелых форм нейтрофилов.
Сердечно-сосудистые
расстройства могут
иметь различный характер. В ранней фазе
сепсиса обычно отмечается снижение
ОПСС на фоне увеличенного CB, результатом
чего является гипотензия. Позднее CB
может уменьшаться, ОПСС оставаться
сниженным или как аль-
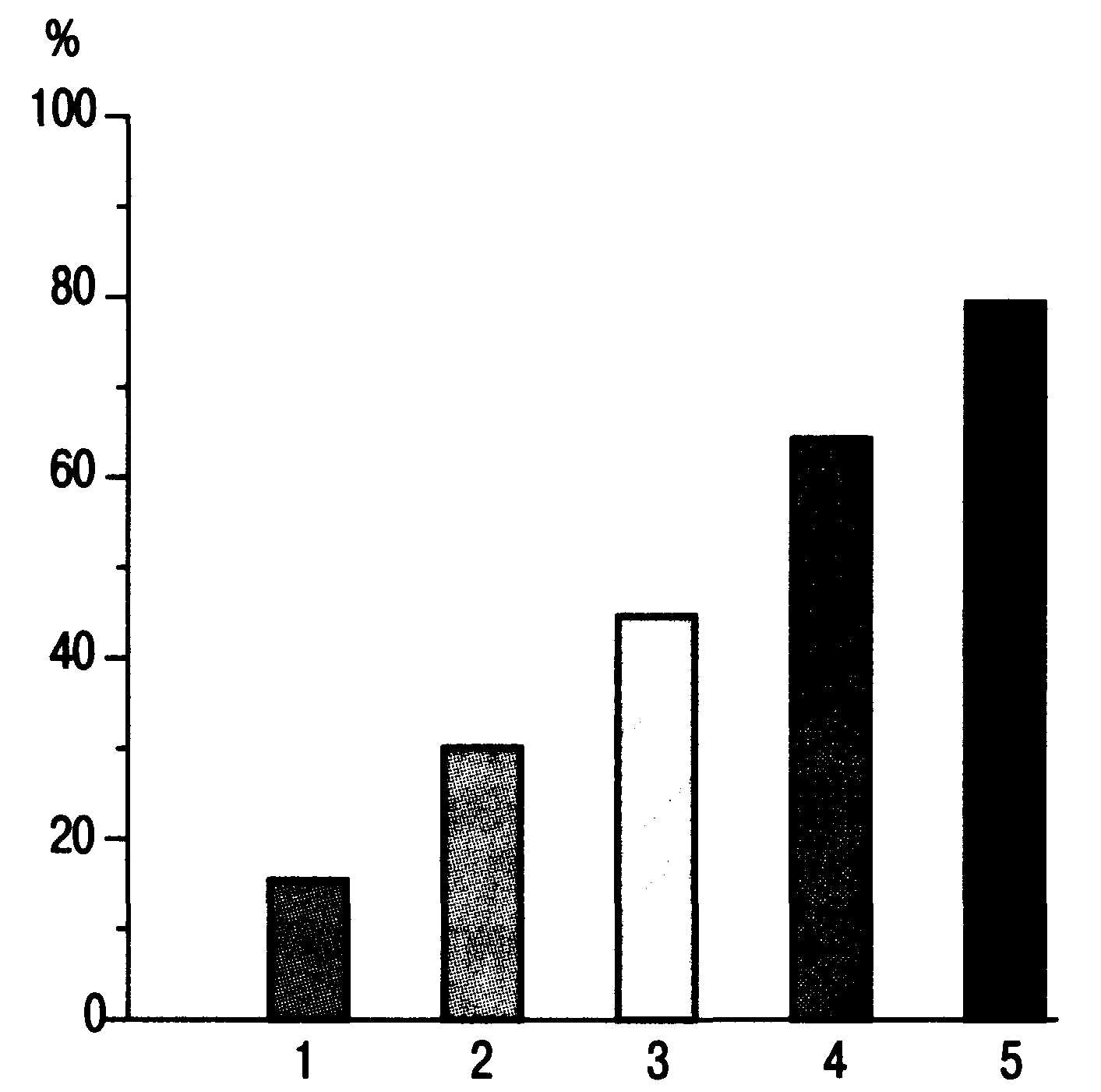 Рис. 27.3.
Процент летальных исходов в зависимости
от числа пораженных органов (1—5) при
сепсисе [по Marini JJ., Wheeler A. Р., 1997].
тернатива
развивается вазокон-стрикция; при этом
гипотензия сохраняется. В поздней фазе
сепсиса развивается почечная
недостаточность с такими тяжелыми
признаками, как азотемия и олигурия.
При поражении печени возрастает уровень
билирубина. Вследствие активации системы
гемостаза развивается ДВС-синдром. При
сепсисе возможно поражение ЦНС,
сопровождающееся дезориентацией,
летаргией, возбуждением или психозом.
По
мере прогрессирования сепсиса появляются
признаки недостаточности органов, в
том числе увеличение в плазме крови
лактата, ги-поксемия, олигурия и нарушение
сознания.
Полиорганная
недостаточность (поражение органных
систем). Не
поддающийся лечению сепсис неизбежно
ведет к прогрессирующей дисфункции
многих органов, включая легкие, почки,
печень и мозг. Кумулятивные эффекты
поражения органных систем обычно
являются причиной летального исхода.
Поэтому выявление начала, течения и
исхода органных нарушений имеет важное
значение для определения
тактики
лечения. Имеется прямая взаимозависимость
между числом органных нарушений и
смертностью от сепсис^. Каждый новый
орган, вовлеченнЬш в процесс ПОН,
увеличивает эту возможность на 15—20 %
от 10—15 % «базового» уровня смертности
[Marini J.J., Wheeler A.P., 1997].
Поражение
двух органов и более классифицируется
как СПОН (рис. 27.3). Данный синдром
характерен для терминальной стадии
сепсиса. Больные сепсисом в среднем
имеют более чем две пораженные органные
системы [Горобец B.C. и др., 1997; Сизов Д.H.
и др., 1998; Чаленко В.В., 1998; Лейдерман И.Н.,
2000].
Наиболее
частыми признаками СПОН являются
олигурия (65 %), тяжелая гипотензия (шок
отмечается в среднем у 62 % больных с
тяжелым течением сепсиса). Снижение
соотношения PaO2/FiO2<300
— в пределах 56—60 %, развитие РДСВ отмечено
у 24—28 % больных. Различные степени
дисфункции ЦНС, как правило, развиваются
несколько позже и наблюдаются примерно
в 3—8 % случаев.
Большинство
полиорганных нарушений возникает
быстро, обычно в пределах 72 ч после
начала сепсиса. Шок имеет менее короткий
период продолжительности (1—2 дня), а
легочная дисфункция более продолжительна.
Наиболее быстрое начало СПОН отмечается
со стороны легочной функции, нередко
формируется РДСВ со значительным
снижением PaO2/FiO2.
Средняя продолжительность легочной
дисфункции составляет 8 дней, изменений
ЦНС — 6—7 дней, олигурия и шок купируются
в течение 1—2 дней [Marini J.J., Wheeler A. Р.,
1997].
Не
только число органных нарушений
коррелирует с исходом заболевания, но
и степень поражения каждой системы.
Смертность от сепсиса достоверно выше
среднего статистического уровня у
больных с PaO2/FiO2>150,
длительной гипо-тензией, нарушением
сознания и
высоким
уровнем креатинина (более 3,5
мг/дл). Дисфункция
системы дыхания.
Легкие
— один из первых органов, вовлекающихся
в системный воспалительный ответ.
Легочные нарушения при сепсисе редко
отсутствуют, и обычно сразу возникает
дисфункция в виде снижения оксигенации
артериальной крови. Полагают, что
поражение легких при сепсисе возникает
в результате того, что медиаторы,
содержащиеся в крови, проходят через
легочный фильтр. Следует также полагать,
что большая поверхность альвеол при
сепсисе в результате воздействия
медиаторов существенно уменьшается,
при этом повреждается тонкая
эндотелиаль-но-эпителиальная структура,
через которую осуществляется диффузия
газов.
При
сепсисе значительно возрастает
потребность тканей в кислороде,
развивается метаболический ацидоз. Это
требует компенсации со стороны
респираторной системы, т.е. увеличения
объема минутной вентиляции для поддержания
оксигенации и компенсации метаболического
ацидоза. У септических больных возрастает
резистентность к воздушному потоку в
легких, снижается легочная податливость,
что приводит к усилению работы дыхания.
Резервы вентиляции при тяжелом сепсисе
значительно снижены также вследствие
уменьшения пер-фузии и оксигенации
дыхательной мускулатуры (усталость
дыхательной мускулатуры). Эти
патогенетические механизмы ведут к
дыхательной (гипоксической и
гиперкапни-ческой) недостаточности.
Большинству
больных с тяжелым сепсисом требуются
интубация и ИВЛ. Средняя продолжительность
механической вентиляции в этих случаях
составляет 7—10 дней. У больных с наиболее
выраженной дыхательной дисфункцией
ИВЛ может продолжаться дольше. У 35— 45
% больных развивается РДСВ,
снижается
PaO2/FiO2 до
200 и ниже, на рентгенограмме грудной
клетки появляются диффузные двусторонние
инфильтраты. Манифестация этих признаков
происходит уже через 48 ч после начала
сепсиса. Отмечено, что падение соотношения
PaCb/FiCb ниже 150 коррелирует с высокой
летальностью (плохой прогностический
признак). Если процесс компенсируется,
то легочная дисфункция проходит через
30 дней [Marini J.J., Wheeler A.P., 1997].
Циркуляторные
нарушения. Критерием
шока является снижение систолического
АД, несмотря на энергично проводимую
инфузионную терапию. Обычно шок не
продолжается более 24 ч, поскольку
длительный период шока сопряжен с
высокой летальностью. Примерно у 50 %
больных сепсисом развивается
шок.
Сердечно-сосудистые
расстройства могут иметь различный
характер. В раннем периоде сепсиса
обычно отмечается снижение ОПСС, чем и
объясняется артериальная гипотен-зия.
Инвазивный мониторинг при этом показывает
снижение ДЗЛА и нормальный или умеренно
повышенный CB с низким системным
периферическим сопротивлением (обычно
ниже 1000 дин/с-см~5-м2).
При сопутствующих жидкостных потерях
(рвота, диарея, потливость, перспирация,
повышение сосудистой проницаемости)
отмечаются уменьшение плазматического
объема и снижение давления наполнения
сердечных камер. Общие жидкостные потери
достигают 4—6 л, что требует соответствующего
возмещения. После возмещения жидкостных
потерь следует ожидать повышения ДЗЛА.
Оптимальный уровень его в данной ситуации
составляет 14—18 мм рт.ст. Однако, если
имеется нарушение миокардиаль-ной
сократимости (например, вследствие
сопутствующего заболевания или
присутствия TNF), давление заклинивания
может повышаться, но СИ оставаться
низким —
«кардиогенный
механизм шока». Нарушение механизма
Франка— Старлинга при этом является
плохим прогностическим признаком.
В
поздней стадии шока CB может уменьшаться,
а ОПСС, наоборот, повышаться. Развивается
вазокон-стрикция, при этом гипотензия
сохраняется, нарастают симптомы почечной
недостаточности.
Реналъные
нарушения. В
раннем периоде сепсиса олигурия —
довольно постоянный синдром. Диурез
обычно меньше 0,5 мл/(кг-ч). Олигурия чаще
всего связана с артериальной гипотензией
и шоком. При устранении гипотензии, как
правило, восстанавливается достаточный
диурез. Продолжающийся шок и олигурия
сопровождаются более высокой летальностью.
У 80 % больных продолжительность олигурии
не превышает 5 дней. Уровень креатинина
умеренно возрастает (до 2—3 мг/дл). При
высоком уровне креатинина в крови (более
3,5 мг/дл) наблюдается высокая смертность
(80 %), при уровне креатинина 2—3,5 мг/дл
смертность составляет 50 %, а при его
снижении до 2 мг/дл и ниже смертность
составляет 30 %. У 10— 15 % больных олигурия
имеет большую продолжительность. Менее
чем у 5 % больных сепсисом требуется
проведение гемодиализа [Marini J.J., Wheeler
A.P., 1997].
Метаболический
ацидоз. Обычно
метаболический ацидоз развивается по
типу лактат-ацидоза несколько позже,
чем возникают гипотензия и олигурия.
Причиной лактат-ацидоза служит анаэробный
метаболизм, обусловленный низким CB,
гипок-семией и сниженной доставкой
кислорода. Однако далеко не у всех
больных с сепсисом можно констатировать
повышение уровня лактата в крови.
По-видимому, это связано с тем, что не
только доставка кислорода, но и, главным
образом, потребление его играют при
этом решающую роль. Нельзя исключить
поражение митохондрий и органелл
клеток
при сепсисе, подобно поражениям других
органов и систем. При исследовании КОС
необходимо иметь в виду, что данные
могут быть противоречивы. Они могут
зависеть как от ишемии отдельных органов
и регионов, так и от восстанавливаемого
кровотока в этих областях. Нельзя не
учитывать, что повышенный уровень
лактата в крови может быть обусловлен
печеночной и кишечной недостаточностью
(см.. главу 32). Во всех случаях DO2 и
VO2 —
основные факторы, определяющие
направленность метаболических
нарушений.
Нарушения
коагуляции. При
сепсисе, в том числе тяжелом, ДВС-синдром
возникает нередко. Наличие этого синдрома
является чрезвычайно плохим прогностическим
признаком. В большинстве случаев
развивается умеренная тромбоцитопе-ния
(число тромбоцитов 75,0— 100,0-109/л).
Небольшое снижение уровня фибриногена
и удлинение протромбинового и частичного
тромбопластинового времени являются
общими признаками. Следует полагать,
что основными механизмами коагуляции
могут быть эндоте-лиальные повреждения
и образование в местах этих повреждений
клеточных тромбоцитарных
наложений.
Дисфункция
ЦНС. Незначительные
изменения функции ЦНС при сепсисе обычно
документируются при использовании
шкалы Глазго. Отмечается снижение
балльной оценки на 2 и более пунктов.
Длительные изменения функции ЦНС
предвещают плохой прогноз.
Синдром
кишечной недостаточности. Выдвинутая
Дж. Меакинсом и Дж. Маршаллом в 1986 г.
гипотеза о развитии ПОН в результате
изменений проницаемости слизистой
кишечника нашла дальнейшее свое развитие
и подтверждение [Гутие-рез Г., Малик С.,
1996]. Действительно, транслокация бактерий
и токсинов через поврежденную стенку
кишечной трубки в системный
кровоток
сопровождается выраженной токсемией
и сепсисом. При первичном или вторичном
воздействии страдают не только органы,
называемые ранее шоковыми (легкие,
почки), но и чревная область. Гипоксия
кишечника — двигатель СПОН. Высокое
содержание бактерий в просвете кишечника
и предрасположенность кишечной стенки
к атрофии, морфологическим изменениям,
включая образование стрессовых язв, —
все это подтверждает возможность
бактериальной транслокации при
критических состояниях. Терминальный
отдел подвздошной кишки и слепая кишка
являются естественным резервуаром
грамотрицательных бактерий и других
продуктов, содержащих эндотоксин.
Целость слизистой оболочки кишки может
быть нарушена при различных ситуациях:
шоке, крово-потере, септических состояниях.
Повреждение целости кишечника приводит
к патологической проницаемости внутренней
оболочки ЖКТ и сопровождается транслокацией
бактерий и/или токсинов в ме-зентериальные
лимфатические сосуды и портальную
систему. В печени бактерии и токсины
могут запускать системную воспалительную
реакцию посредством активации
купфе-ровских клеток (звездчатые
ретику-
лоциты)
или гепатоцитов и в дальнейшем приводят
к СПОН. Транслокация кишечной флоры
может быть первичным или вторичным
механизмом инициации и распространения
системного воспалительного
ответа.
Трудности
диагностики ишемии кишечника у
реанимационных больных осложняют
проведение убедительных исследований,
подтверждающих эту гипотезу. Само
повреждение кишечника может привести
к активации нейтрофилов и выбросу мощных
цитокинов. Эти вещества могут расстроить
механизмы печеночного клиренса, особенно
у больных с предшествующей патологией
печени, и достичь эндотелия легких в
количествах, достаточных чтобы вызвать
острое поражение легких по типу
дистресс-син-дрома. Поражение легких и
кишечника могут взаимно усиливать
дисфункцию этих органов. Слизистая
оболочка кишечника имеет высокую степень
метаболической активности и при ишемии
становится наиболее уязвимой для
возникновения в ней острых стрессовых
язв. Если эпителиоциты лишены постоянного
притока питательных веществ, снижается
репродукция клеток кишечника и нарушается
барьерная функция последнего.
Рис. 27.3.
Процент летальных исходов в зависимости
от числа пораженных органов (1—5) при
сепсисе [по Marini JJ., Wheeler A. Р., 1997].
тернатива
развивается вазокон-стрикция; при этом
гипотензия сохраняется. В поздней фазе
сепсиса развивается почечная
недостаточность с такими тяжелыми
признаками, как азотемия и олигурия.
При поражении печени возрастает уровень
билирубина. Вследствие активации системы
гемостаза развивается ДВС-синдром. При
сепсисе возможно поражение ЦНС,
сопровождающееся дезориентацией,
летаргией, возбуждением или психозом.
По
мере прогрессирования сепсиса появляются
признаки недостаточности органов, в
том числе увеличение в плазме крови
лактата, ги-поксемия, олигурия и нарушение
сознания.
Полиорганная
недостаточность (поражение органных
систем). Не
поддающийся лечению сепсис неизбежно
ведет к прогрессирующей дисфункции
многих органов, включая легкие, почки,
печень и мозг. Кумулятивные эффекты
поражения органных систем обычно
являются причиной летального исхода.
Поэтому выявление начала, течения и
исхода органных нарушений имеет важное
значение для определения
тактики
лечения. Имеется прямая взаимозависимость
между числом органных нарушений и
смертностью от сепсис^. Каждый новый
орган, вовлеченнЬш в процесс ПОН,
увеличивает эту возможность на 15—20 %
от 10—15 % «базового» уровня смертности
[Marini J.J., Wheeler A.P., 1997].
Поражение
двух органов и более классифицируется
как СПОН (рис. 27.3). Данный синдром
характерен для терминальной стадии
сепсиса. Больные сепсисом в среднем
имеют более чем две пораженные органные
системы [Горобец B.C. и др., 1997; Сизов Д.H.
и др., 1998; Чаленко В.В., 1998; Лейдерман И.Н.,
2000].
Наиболее
частыми признаками СПОН являются
олигурия (65 %), тяжелая гипотензия (шок
отмечается в среднем у 62 % больных с
тяжелым течением сепсиса). Снижение
соотношения PaO2/FiO2<300
— в пределах 56—60 %, развитие РДСВ отмечено
у 24—28 % больных. Различные степени
дисфункции ЦНС, как правило, развиваются
несколько позже и наблюдаются примерно
в 3—8 % случаев.
Большинство
полиорганных нарушений возникает
быстро, обычно в пределах 72 ч после
начала сепсиса. Шок имеет менее короткий
период продолжительности (1—2 дня), а
легочная дисфункция более продолжительна.
Наиболее быстрое начало СПОН отмечается
со стороны легочной функции, нередко
формируется РДСВ со значительным
снижением PaO2/FiO2.
Средняя продолжительность легочной
дисфункции составляет 8 дней, изменений
ЦНС — 6—7 дней, олигурия и шок купируются
в течение 1—2 дней [Marini J.J., Wheeler A. Р.,
1997].
Не
только число органных нарушений
коррелирует с исходом заболевания, но
и степень поражения каждой системы.
Смертность от сепсиса достоверно выше
среднего статистического уровня у
больных с PaO2/FiO2>150,
длительной гипо-тензией, нарушением
сознания и
высоким
уровнем креатинина (более 3,5
мг/дл). Дисфункция
системы дыхания.
Легкие
— один из первых органов, вовлекающихся
в системный воспалительный ответ.
Легочные нарушения при сепсисе редко
отсутствуют, и обычно сразу возникает
дисфункция в виде снижения оксигенации
артериальной крови. Полагают, что
поражение легких при сепсисе возникает
в результате того, что медиаторы,
содержащиеся в крови, проходят через
легочный фильтр. Следует также полагать,
что большая поверхность альвеол при
сепсисе в результате воздействия
медиаторов существенно уменьшается,
при этом повреждается тонкая
эндотелиаль-но-эпителиальная структура,
через которую осуществляется диффузия
газов.
При
сепсисе значительно возрастает
потребность тканей в кислороде,
развивается метаболический ацидоз. Это
требует компенсации со стороны
респираторной системы, т.е. увеличения
объема минутной вентиляции для поддержания
оксигенации и компенсации метаболического
ацидоза. У септических больных возрастает
резистентность к воздушному потоку в
легких, снижается легочная податливость,
что приводит к усилению работы дыхания.
Резервы вентиляции при тяжелом сепсисе
значительно снижены также вследствие
уменьшения пер-фузии и оксигенации
дыхательной мускулатуры (усталость
дыхательной мускулатуры). Эти
патогенетические механизмы ведут к
дыхательной (гипоксической и
гиперкапни-ческой) недостаточности.
Большинству
больных с тяжелым сепсисом требуются
интубация и ИВЛ. Средняя продолжительность
механической вентиляции в этих случаях
составляет 7—10 дней. У больных с наиболее
выраженной дыхательной дисфункцией
ИВЛ может продолжаться дольше. У 35— 45
% больных развивается РДСВ,
снижается
PaO2/FiO2 до
200 и ниже, на рентгенограмме грудной
клетки появляются диффузные двусторонние
инфильтраты. Манифестация этих признаков
происходит уже через 48 ч после начала
сепсиса. Отмечено, что падение соотношения
PaCb/FiCb ниже 150 коррелирует с высокой
летальностью (плохой прогностический
признак). Если процесс компенсируется,
то легочная дисфункция проходит через
30 дней [Marini J.J., Wheeler A.P., 1997].
Циркуляторные
нарушения. Критерием
шока является снижение систолического
АД, несмотря на энергично проводимую
инфузионную терапию. Обычно шок не
продолжается более 24 ч, поскольку
длительный период шока сопряжен с
высокой летальностью. Примерно у 50 %
больных сепсисом развивается
шок.
Сердечно-сосудистые
расстройства могут иметь различный
характер. В раннем периоде сепсиса
обычно отмечается снижение ОПСС, чем и
объясняется артериальная гипотен-зия.
Инвазивный мониторинг при этом показывает
снижение ДЗЛА и нормальный или умеренно
повышенный CB с низким системным
периферическим сопротивлением (обычно
ниже 1000 дин/с-см~5-м2).
При сопутствующих жидкостных потерях
(рвота, диарея, потливость, перспирация,
повышение сосудистой проницаемости)
отмечаются уменьшение плазматического
объема и снижение давления наполнения
сердечных камер. Общие жидкостные потери
достигают 4—6 л, что требует соответствующего
возмещения. После возмещения жидкостных
потерь следует ожидать повышения ДЗЛА.
Оптимальный уровень его в данной ситуации
составляет 14—18 мм рт.ст. Однако, если
имеется нарушение миокардиаль-ной
сократимости (например, вследствие
сопутствующего заболевания или
присутствия TNF), давление заклинивания
может повышаться, но СИ оставаться
низким —
«кардиогенный
механизм шока». Нарушение механизма
Франка— Старлинга при этом является
плохим прогностическим признаком.
В
поздней стадии шока CB может уменьшаться,
а ОПСС, наоборот, повышаться. Развивается
вазокон-стрикция, при этом гипотензия
сохраняется, нарастают симптомы почечной
недостаточности.
Реналъные
нарушения. В
раннем периоде сепсиса олигурия —
довольно постоянный синдром. Диурез
обычно меньше 0,5 мл/(кг-ч). Олигурия чаще
всего связана с артериальной гипотензией
и шоком. При устранении гипотензии, как
правило, восстанавливается достаточный
диурез. Продолжающийся шок и олигурия
сопровождаются более высокой летальностью.
У 80 % больных продолжительность олигурии
не превышает 5 дней. Уровень креатинина
умеренно возрастает (до 2—3 мг/дл). При
высоком уровне креатинина в крови (более
3,5 мг/дл) наблюдается высокая смертность
(80 %), при уровне креатинина 2—3,5 мг/дл
смертность составляет 50 %, а при его
снижении до 2 мг/дл и ниже смертность
составляет 30 %. У 10— 15 % больных олигурия
имеет большую продолжительность. Менее
чем у 5 % больных сепсисом требуется
проведение гемодиализа [Marini J.J., Wheeler
A.P., 1997].
Метаболический
ацидоз. Обычно
метаболический ацидоз развивается по
типу лактат-ацидоза несколько позже,
чем возникают гипотензия и олигурия.
Причиной лактат-ацидоза служит анаэробный
метаболизм, обусловленный низким CB,
гипок-семией и сниженной доставкой
кислорода. Однако далеко не у всех
больных с сепсисом можно констатировать
повышение уровня лактата в крови.
По-видимому, это связано с тем, что не
только доставка кислорода, но и, главным
образом, потребление его играют при
этом решающую роль. Нельзя исключить
поражение митохондрий и органелл
клеток
при сепсисе, подобно поражениям других
органов и систем. При исследовании КОС
необходимо иметь в виду, что данные
могут быть противоречивы. Они могут
зависеть как от ишемии отдельных органов
и регионов, так и от восстанавливаемого
кровотока в этих областях. Нельзя не
учитывать, что повышенный уровень
лактата в крови может быть обусловлен
печеночной и кишечной недостаточностью
(см.. главу 32). Во всех случаях DO2 и
VO2 —
основные факторы, определяющие
направленность метаболических
нарушений.
Нарушения
коагуляции. При
сепсисе, в том числе тяжелом, ДВС-синдром
возникает нередко. Наличие этого синдрома
является чрезвычайно плохим прогностическим
признаком. В большинстве случаев
развивается умеренная тромбоцитопе-ния
(число тромбоцитов 75,0— 100,0-109/л).
Небольшое снижение уровня фибриногена
и удлинение протромбинового и частичного
тромбопластинового времени являются
общими признаками. Следует полагать,
что основными механизмами коагуляции
могут быть эндоте-лиальные повреждения
и образование в местах этих повреждений
клеточных тромбоцитарных
наложений.
Дисфункция
ЦНС. Незначительные
изменения функции ЦНС при сепсисе обычно
документируются при использовании
шкалы Глазго. Отмечается снижение
балльной оценки на 2 и более пунктов.
Длительные изменения функции ЦНС
предвещают плохой прогноз.
Синдром
кишечной недостаточности. Выдвинутая
Дж. Меакинсом и Дж. Маршаллом в 1986 г.
гипотеза о развитии ПОН в результате
изменений проницаемости слизистой
кишечника нашла дальнейшее свое развитие
и подтверждение [Гутие-рез Г., Малик С.,
1996]. Действительно, транслокация бактерий
и токсинов через поврежденную стенку
кишечной трубки в системный
кровоток
сопровождается выраженной токсемией
и сепсисом. При первичном или вторичном
воздействии страдают не только органы,
называемые ранее шоковыми (легкие,
почки), но и чревная область. Гипоксия
кишечника — двигатель СПОН. Высокое
содержание бактерий в просвете кишечника
и предрасположенность кишечной стенки
к атрофии, морфологическим изменениям,
включая образование стрессовых язв, —
все это подтверждает возможность
бактериальной транслокации при
критических состояниях. Терминальный
отдел подвздошной кишки и слепая кишка
являются естественным резервуаром
грамотрицательных бактерий и других
продуктов, содержащих эндотоксин.
Целость слизистой оболочки кишки может
быть нарушена при различных ситуациях:
шоке, крово-потере, септических состояниях.
Повреждение целости кишечника приводит
к патологической проницаемости внутренней
оболочки ЖКТ и сопровождается транслокацией
бактерий и/или токсинов в ме-зентериальные
лимфатические сосуды и портальную
систему. В печени бактерии и токсины
могут запускать системную воспалительную
реакцию посредством активации
купфе-ровских клеток (звездчатые
ретику-
лоциты)
или гепатоцитов и в дальнейшем приводят
к СПОН. Транслокация кишечной флоры
может быть первичным или вторичным
механизмом инициации и распространения
системного воспалительного
ответа.
Трудности
диагностики ишемии кишечника у
реанимационных больных осложняют
проведение убедительных исследований,
подтверждающих эту гипотезу. Само
повреждение кишечника может привести
к активации нейтрофилов и выбросу мощных
цитокинов. Эти вещества могут расстроить
механизмы печеночного клиренса, особенно
у больных с предшествующей патологией
печени, и достичь эндотелия легких в
количествах, достаточных чтобы вызвать
острое поражение легких по типу
дистресс-син-дрома. Поражение легких и
кишечника могут взаимно усиливать
дисфункцию этих органов. Слизистая
оболочка кишечника имеет высокую степень
метаболической активности и при ишемии
становится наиболее уязвимой для
возникновения в ней острых стрессовых
язв. Если эпителиоциты лишены постоянного
притока питательных веществ, снижается
репродукция клеток кишечника и нарушается
барьерная функция последнего.
Глава 28 Интенсивная терапия септического синдрома Декомпенсированная недостаточность и несостоятельность, затрагивающая три и более органов, а также системы, сопровождаются очень высокой летальностью (96— 98 %) при использовании только традиционного лечения, включающего лекарственную и инфузионно-трансфузионную терапию. Применение комплекса мероприятий и ИТ, в том числе высокотехнологичных методов (современной респира- торной, инотропной и нутритивной поддержки, иммунокоррекции, флу-орокоррекции, специальные приемы хирургической трансфузиоло-гии, детоксикации, санационной бронхоскопии, эпидуральной анестезии и др.), позволяет значительно снизить летальность при синдроме полиорганной недостаточности. Основные направления лечения. Специфической терапии сепсиса не существует. Основ- ные методы, которые проверены клиническими испытаниями и показали эффективность, следующие: • ранняя диагностика; • заместительная терапия — при прогрессирующей недостаточности органных систем; • устранение очага инфекции или дренирование инфицированной полости; • адекватная антимикробная терапия. Ряд методов продолжает разрабатываться в клиниках: проведение экстракорпоральной мембранной оксигенации, применение иммуно-глобулинов, рекомбинантного γ-ин-терферона человека, моноклональ-ных антител к TNF, антагонистов к рецепторам ИЛ-1 и др. ^ Антибактериальное лечение. При сепсисе, развившемся вследствие катетеризации вен и артерий, в 80 % случаев выделенные Staphylococcus epidermidis нечувствительны к мети-циллину и цефалоспоринам. Почти столько же из них резистентны к аминогликозидам. Антибиотиком выбора, активно влияющим на устойчивые к метициллину штаммы, является ванкомицин. Тщательная очистка кожи щеткой с антисептиком — наилучший метод удаления микроорганизмов с ее поверхности. Вокруг места введения катетера можно наносить мазь, содержащую полимиксина M сульфат, неомицина сульфат и бацитрацин. Катетер следует удалять, как только в нем отпала необходимость. Каждый день нахождения катетера увеличивает риск заражения. Каждая манипуляция, связанная с разъединением катетера, должна проводиться в строго асептических условиях. Замена катетера через каждые 3— 4 сут увеличивает частоту инфекции. Замена катетера в связи с подозрением на сепсис должна производиться с использованием проводника, не способствующего загрязнению вновь устанавливаемых катетеров. Для промывания катетера применяют ге-парин. Однако при угрозе тромбоци-топении этот метод противопоказан. Сепсис — смертельно опасное заболевание, способное возникать внезапно. При использовании антибактериальных средств предполагается, что патогенные бактерии являются причиной заболевания, но и возможность другого инфекционного начала, связанного с грибами и вирусами, не должна быть пропущена. В большинстве ОИТ регистрируются случаи сепсиса, вызванного грамотрицательными и грамположительными бактериями, представляющими часть нормальной микрофлоры организма. Раннее лечение антибиотиками начинается до выделения и идентификации культуры, что чрезвычайно важно для его эффективности. Это особенно необходимо у пациентов с нарушенным иммунитетом, где задержка лечения свыше 24 ч может закончиться летальным исходом. Немедленное эмпирическое применение антибиотиков широкого спектра действия парентерально рекомендуется всякий раз, когда подозреваются инфекция и сепсис. В ранней стадии лечения выбор антибиотика основан на известных вариантах антибактериальной чувствительности и ситуационном предположении инфекции. Часто штаммы микроорганизмов при сепсисе связаны с госпитальной инфекцией [Марино П., 1998]. До начала антимикробной терапии производят забор крови, мочи и мокроты для культурального анализа. Для бактериального анализа производят забор соответствующих материалов: из раны, асцитической, плевральной или цереброспинальной жидкости, что должно быть основано на клиническом исследовании и возможной локализации инфекции . Вероятность получения роста культуры увеличивается, если эти полученные без затрат времени пробы взяты до начала антибиотико-терапии. В конечном счете соответ- ствующая флоре антибиотикотера-пия очень важна: летальность среди больных с неустановленной флорой (инфекцией) на 10—20 % выше, чем среди больных, получавших адекватную антибиотикотерапию [Mari-ni JJ., Wheeler A.P., 1997]. В большинстве случаев применяются комбинации антибиотиков, что обеспечивает их высокую активность против широкого спектра микроорганизмов до того, как станут известны результаты микробиологического исследования. Одновременное использование нескольких антибиотиков у больных с угрозой сепсиса в большинстве случаев оправдано. Когда не обнаруживается очаг инфекции, терапия цефалоспоринами 3-го поколения (цефтриаксон) с аминогликозидами, вероятно, правильна. Широко используются и другие цефалоспорины, такие как цефотаксим и цефтазидим. Они эффективно воздействуют на различные микроорганизмы при сепсисе в отсутствие нейтропении. Антибиотики с коротким периодом полураспада должны использоваться в режиме больших суточных доз. Напротив, антибиотики с большим периодом полураспада (например, цефтриаксон) могут применяться 1 раз в сутки. У пациентов с нейтропенией целесообразно использовать пеницил-лины (мезлоциллин) с повышенной активностью против Pseudomonas aeruginosa в комбинации с аминогликозидами; при введении несколько раз в сутки они являются действенным средством в лечении госпитальных инфекций. При лечении сепсиса, вызванного резистентными к пенициллину пневмококками или стафилококками, должен быть добавлен ванкомицин. При большом подозрении анаэробной инфекции требуется дополнительное назначение метронида-зола или клиндамицина. С целью уменьшения токсичности амино-гликозидов, особенно у пожилых больных, рекомендуется их одно- кратное применение в сутки. Так, однократное применение цефтриак-сона в комбинации с нетилмицином дает достаточный эффект и безопасно в лечении тяжелой бактериальной инфекции, но это положение не подтверждено другими исследованиями. У больных в критическом состоянии лучше начинать терапию, рассчитанную на широкий антибактериальный эффект, а затем сужать ее, когда будут получены клинические данные. Ежедневно требуется дополнительная оценка эффективности выбранного антибиотика. Все ненужные средства должны быть исключены. Использование чрезмерной терапии антибиотиками — дорогостоящее лечение и предрасполагает пациента к аллергическим реакциям; оно связано с токсичностью лекарственного средства и, возможно, способствует появлению высокорезистентных бактерий. В случаях, когда удалось идентифицировать микрофлору, выбор антибактериального препарата становится ясным. При этом возможно использование монотерапии, например, цефалоспоринами третьего поколения (цефтриаксон, карбапе-нем, имипенем, циластатин) и другими антибиотиками, имеющими узкий спектр действия. Неэффективность антибиотико-терапии может быть связана с недренируемыми гнойными полостями (эмпиема плевры, абсцессы брюшной полости и др.), резистент-ностью флоры, недостаточной дозой препарата или недостатком времени после стартовой терапии. Респираторная поддержка. Дыхательная недостаточность развивается примерно у 80 % больных сепсисом и требует применения ВИВЛ или ИВЛ. Почти у всех больных сепсисом наблюдается гипоксемия, поэтому им требуется проведение оксигенотерапии. Если у больного тахипноэ приближается к 30 в минуту и SaO2 снижается до 90 %, необходимо планировать интубацию. Не следует думать, что быстро нарастающее тахипноэ и снижение сатурации исчезнут спонтанно. Поддержка дыхания облегчает нагрузку на систему дыхания и снижает кислородную цену дыхания. Газообмен улучшается за счет более хорошей оксигенации крови. Не имеется никаких определенных установок в выборе метода ИВЛ. Применяют вспомогательную контролируемую вентиляцию или вентиляцию в режиме IMV. Полная респираторная поддержка обеспечивает лучшее распределение кровото-ка к дыхательным мышцам, страдающим от гипоксии и усиленной работы [Marini J.J., Wheeler A.P., 1997]. Необходимость в полном выключении дыхания встречается редко (если есть возможность тщательной регулировки дыхательного объема, частоты, объемной скорости потока). Следует стремиться к оптимизации газообмена и созданию дыхательного комфорта, при котором не требуется применение мышечных релаксантов. Если попытки к дыханию высоки, могут быть назначены седативные средства. Хотя и нет точного показателя ба-ротравмы, все же существует определенная зависимость баротравмы от величины внутриальвеолярного давления, превышающей 30—35 см вод.ст. Рекомендуемые режимы механической вентиляции легких: • внутриальвеолярное давление во время плато вдоха не более 35 см вод.ст.; • ДО 5—6 мл/кг; • FiO2 до 0,6 или менее — до приемлемого SaO2 (выше 88 %); • режим ИВЛ — нормокапния или умеренная (контролируемая) ги-перкапния; • если SaO2 остается низким, показан режим ПДКВ. Принцип: самый «низкий» режим ПДКВ, который «держит» легкое в рас- правленном состоянии и обеспечивает приемлемое SaO2 при FiO2 ниже 0,6. В большинстве случаев ПДКВ, равный 10 см вод.ст., достаточен для достижения этой цели. Однако оптимальный ПДКВ, необходимый для предотвращения ауто-ПДКВ, неизвестен. Недавние данные//псйсазыва-ют, что уровни выше о см вод.ст. обеспечивают лучшую защиту для пациентов с РДСВ (см. главу 13). Несмотря на все эти положения, у большинства пациентов с сепсисом и РДСВ требуется поддержание FiO2 от 0,4 до 0,6 и ПДКВ в диапазоне от 7 до 15 см вод.ст. Сердечно-сосудистая поддержка. Проведение терапии, поддерживающей кровообращение, имеет важное значение при септическом синдроме. Нарушение кровообращения — один из ведущих симптомов шока, поэтому как можно раньше необходимо предпринимать попытки его коррекции. В начале синдрома, особенно у больных с септическим шоком, наблюдается существенное снижение общего жидкостного объема, в том числе сосудистого сектора с измененным уровнем сосудистого сопротивления (вазопле-гия) и миокардиальной дисфункцией. Давление наполнения левого желудочка обычно снижено, что также объясняется дефицитом жидкостного объема. Потери жидкости при сепсисе объясняются алимен-тарными факторами, большими внешними потерями (потливость, одышка, рвота или диарея), внутренними потерями (увеличенная эндотелиальная проницаемость) и жидкостным перераспределением (вазоплегия) — относительная и абсолютная гиповолемия. В среднем больному сепсисом требуется от 4 до 6 л кристаллоидных или сопоставимого объема коллоидных растворов, чтобы оптимизировать давление наполнения левого желудочка. Лучший режим инфузионной тера- ^ Таблица 28.1. Оптимальные значения некоторых показателей при лечении септического шока [Shoemaker W.C., 1987]
