
- •Патофизиология боли Боль как ощущение
- •Пути восприятия и проведения болевых ощущений
- •Реакция организма на боль
- •Патофизиологические механизмы соматогенных болевых синдромов
- •Механизмы возникновения первичной гипералгезии
- •Механизмы развития вторичной гипералгезии
- •Патофизиологические механизмы нейрогенных болевых синдромов
- •Острая боль
- •Интраоперационое обезболивание Немного история наркоза
- •Наркоз закисью азота
- •Эфирный и хлороформный наркозы
- •Физиологические основы влияния общей анестезии на цнс
- •Влияние общей анестезии на цнс
- •Антиоксиданты-антигипоксанты – перспективы их применения при хирургической агрессии и острой боли Патофизиология окислительного стресса
- •Основные патологические процессы, инициируемые чрезмерной активацией пол
- •I. Клеточно-тканевой уровень:
- •II. Органы и системы:
- •Антиоксидантная система
- •Антиоксиданты
- •1. Антиоксиданты ферментативной природы:
- •2. 2. Мембранные антиоксиданты
- •3. Внеклеточные атиоксиданты;
- •III. По растворимости
- •Принципы антиоксидантной терапи
- •1. Острая патология
- •Нарушения энергетических и метаболических процессов в клетках и тканях
- •Реамберин:
- •Особенности реакции цикла Кребса, связанной с сукцинатом:
- •Коррекция окислительного стресса в периоперационном периоде
- •Распределение больных по группам и методика интраоперационной коррекции окислительного и хирургического стресса
- •Результаты и их обсуждение
- •Выводы:
- •Резюме: продолжить !!!!!!!!!!!!!!!!!!!!!!!!!!!!
- •Многоуровневая ноцицептивная защита от хирургического стресса
- •Стресспротекторы как компанент анестезиологического пособия
- •Резюме:
- •Применение стресс протекторных и адаптогенных препаратов в периоперационном периоде у пациентов, оперируемых по поводу диффузного токсического зоба
- •Научная новизна
- •Материалы и методы исследования
- •Методика стресс протекторной и адаптогенной терапии клофелином и даларгином в периоперационном периоде у больных, оперируемых по поводу диффузного токсического зоба
- •Результаты собственных исследований
- •Практические рекомендации
- •Анестезия в акушерстве стреспротекторная анестезия при кесаревом сечении
- •Механизм действия пролонгированной стресспротекции ганглиолитиками и фармакологические эффекты
- •Метод пролонгированной ганглиоплегии:
- •Анестезия и интенсивная терапия в нейрохирургии
- •1. Ингаляционная анестезия ( j. Е. Cotterel, 1999);
- •2. Тотальная внутривенная анестезия (а. Н. Кондратьев с соавт, 1991; и. Смит, п. Уайт, 2002).
- •Общая характеристика методов общей анестезии, применявшихся в исследуемых группах больных, оперированных на мозге
- •Результаты и их обсуждение
- •Обезболивание у детей Стресспротекция при оперативной коррекции сколиоза у детей
- •Стресспротекция клофелином и адреноганглиолитиками при операциях у детей по поводу сколиоза Общая характеристика больных
- •Распределение больных, оперированных по поводу сколиоза, по возрастным группам
- •Распределение больных по характеру оперативных вмешательств
- •Сопутствующие заболевания у оперированных больных
- •Методика антистрессорной защиты клофелином и пентамином (азКиП)
- •19.2.3. Методы исследования
- •Центральная гемодинамика и микроциркуляция у детей на фоне стресспротекции
- •Функциональное состояние эндокринной системы больных при хирургической коррекции сколиоза на фоне стресспротекции
- •Изменение волемии и показателей красной крови при хирургической коррекции сколиоза на фоне стресспротекции
- •Коррекции сколиоза
- •Осложнения у детей при хирургической коррекции сколиоза
- •Резюме:
- •Практические рекомендации:
- •Регионарная анестезия
- •Эпидуральная анестезия
- •Комбинированная спинально-эпидуральная анестезия
- •Региональные нейроблокады в различных разделах хирургии
- •Результаты использования са в нашей клинике
- •Общая характеристика пациентов, методики анестезии и методы исследования
- •Общая характеристика пациентов старше 60 лет, в контрольной и исследуемой группах (м±m)
- •Результаты исследования
- •Показатели уос (мл) и мос (мл/мин) в контрольной и исследуемой группах на основных этапах периоперационного периода (м±m, р)
- •Показатели SpO2 и EtCo2 в контрольной и исследуемой группах на основных этапах операции (м±m, р)
- •Показатели чдд и до в контрольной и исследуемой группах на основных этапах операции (м±m, р)
- •Показатели кщр в контрольной группе (м ± m, р)
- •Практические рекомендации:
- •Резюме:
- •Проблемы послеоперационной боли
- •Современные тенденции послеоперационного обезболивания:
- •Преимущества эпидуральной инфузии
- •Наропин (ропивакаин)
- •Концепция и преимущества мультимодальной анальгезии
- •Метамизол и послеоперационное обезболивание
- •Послеоперационное обезболивание
- •Наркотические анальгетики
- •Ненаркотические анальгетики
- •Предупреждающая анальгезия
- •Предлагаемая методика нашей клиники
- •Результаты исследования
- •Премедикация:
- •Послеоперационная терапия:
- •Резюме:
- •Хронический болевой синдром
- •Вспомогательные средства для лечения хронической боли
- •Антагонисты nmda-рецепторов
- •Рекомендации по лечению болевых синдромов:
- •Основная литература:
Результаты использования са в нашей клинике
Больным 1-й группы на операционном столе: проводилась венепункция, премедикация и осуществлялась инфузия физиологического раствора в объеме 8 – 11 мл/кг. После введения местного анестетика в субарахноидальное пространство продолжалась инфузия физиологического раствора в объеме 6,7-9,3 мл/кг/час.
При развитии у пациентов гипотонии, снижения АД более чем на 40 мм.рт.ст. инфузия кристаллоидов увеличивалась до 10-20 мл/кг.
В случае отсутствия эффекта от проводимой инфузионной терапии использовали адреномиметик.
Пациентам 3-й группы за 15 минут до пункции субарахноидального пространства внутримышечно вводили 5% эфедрин в дозе 0,27-0,49 мг/кг. После интратекального введения местного анестетика, проводилась инфузионная терапия в объеме 7,3-8,5 мл/кг/час. В случае развития артериальной гипотонии объем инфузии увеличивался до 13-16мл/кг, при отсутствии эффекта вводился адреномиметик.
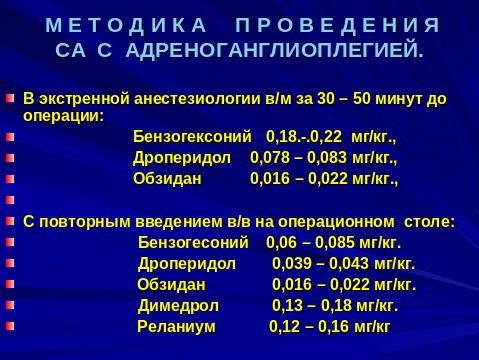
При проведении спинальной анестезии с адреноганглиоплегией (2-я группа), больным в течение суток перед операцией, в 17.00, 23.00, 6.00 в/м вводится: бензогексоний (0,18 - 0,25 мг/кг) или пентамин (0,32 – 0,47 мг/кг), дроперидол (0,063 – 0,098 мг/кг), обзидан (0,016 – 0,022 мг/кг), димедрол (0,15 – 0,21 мг/кг).
На операционном столе, как и больным 1-й группы, проводилась венепункция, премедикация и осуществлялась инфузия физ. раствора в объеме 7 – 10 мл/кг.
После введения местного анестетика в субарахноидальное пространство, продолжалась инфузионная терапия в объеме 4,8-5,6 мл/кг/час.


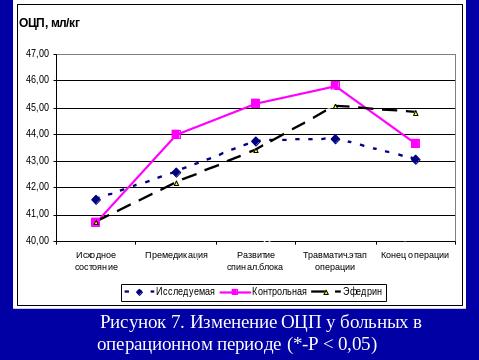
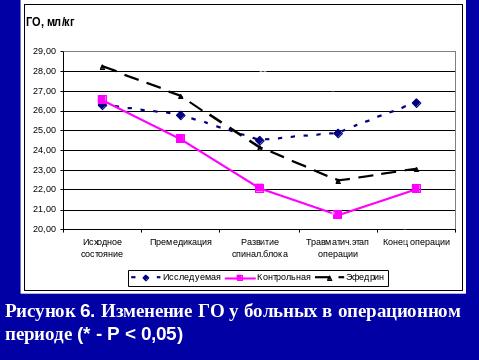

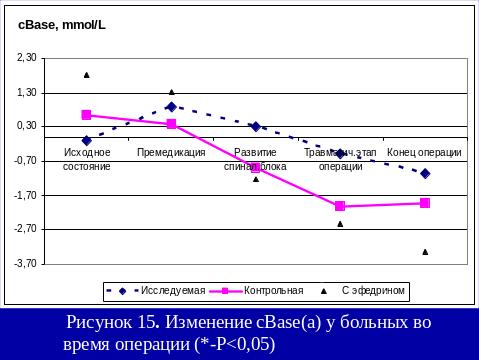
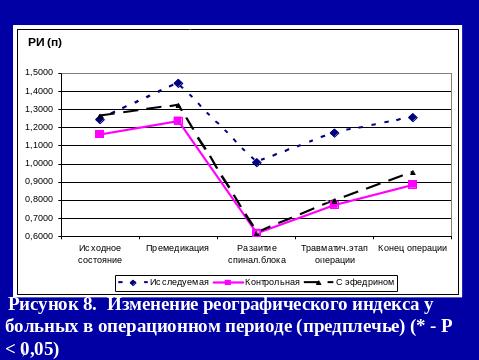
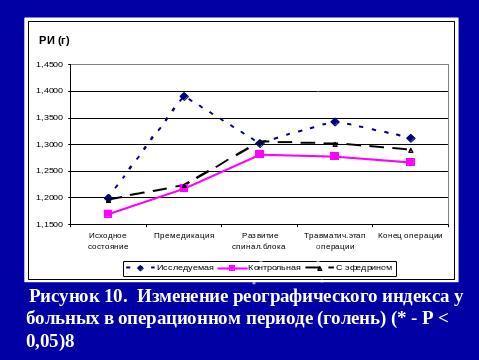
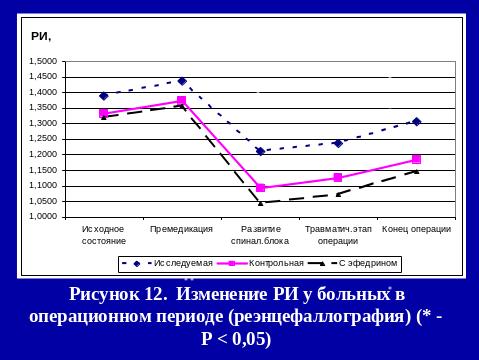
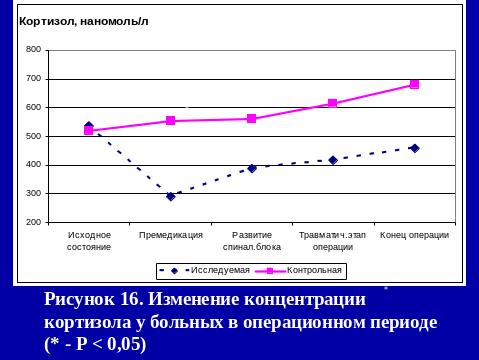
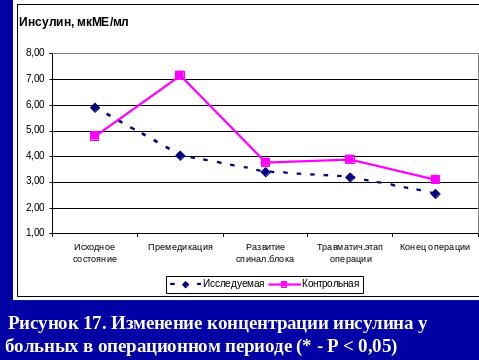
РЕЗЮМЕ
Частота развития артериальной гипотонии при СА практически не зависит от сред, используемых для проведения инфузионной преднагрузки – кристаллоидные растворы или сочетание кристаллоидных и коллоидных растворов.
Применение коллоидных растворов как компонента инфузионной преднагрузки, особенно в соотношении 1:1 с кристаллоидными растворами, у больных с сопутствующей патологией сердечно-сосудистой системы в 15% провоцируют развитие сердечной недостаточности.
При операциях на промежности и на органах забрюшинного пространства гемодинамические показатели при использовании маркаина, по сравнению с лидокаином, достоверно более стабильные, что позволяет проводить более качественную и безопасную СА.
Изобарические растворы маркаина и лидокаина при проведении СА для обеспечения операций на органах брюшной полости равнозначны по влиянию на интраоперационные гемодинамические изменения. Маркаин имеет преимущество только при операциях, превышающих по 2 часа
Для СА при экстренных гинекологических операциях, продолжительностью до 1,5 часов и связанных с ревизией и санацией брюшной полости, предпочтительней применение лидокаина.
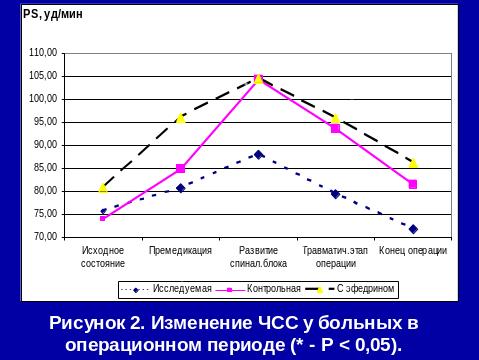
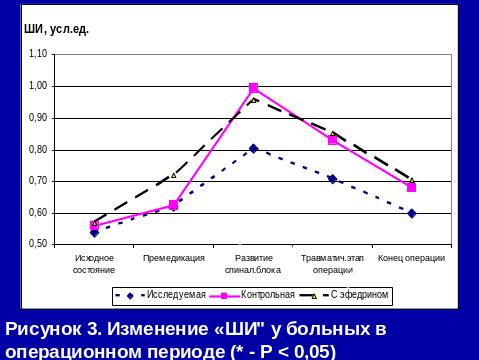
Метод СА с адреноганглиоплегией не только предотвращает выраженные сдвиги центральной и периферической гемодинамики, но и улучшает в периоперационном периоде показатели сердечного выброса (УИ к концу операции увеличивается на 13,9%), уменьшает тахикардию и ПМО2.
Традиционные методы профилактики гемодинамических нарушений (проведение инфузионной преднагрузки или включение адреномиметиков в премедикацию) не только не всегда эффективны, но могут и усугублять возникшие гемодинамические расстройства.
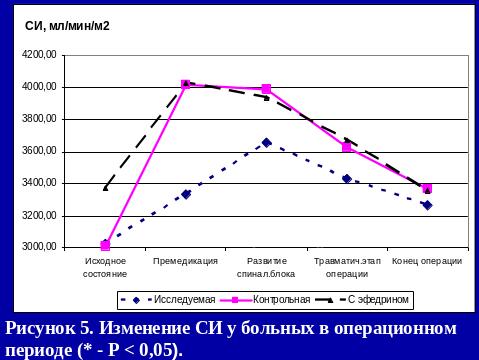
Применение СА с адреноганглиоплегией является надежным методом профилактики интраоперационного развития артериальной гипотензии. При этом, несмотря на хирургическую агрессию, проведение инфузионной терапии и СА, показатели ГО к концу операции не уменьшаются за счет выхода в русло активной циркуляции аутокрови из депо.
СА с адреноганглиоплегией обеспечивает более высокое качество анестезиологической защиты от операционного стресса и создает оптимальные условия для проведения урологических и гинекологических операций.
Выполнение оперативных вмешательств под СА с адреноганглиоплегией не вызывает нарушений кислотно-щелочного равновесия и эндокринного гомеостаза (снижение к концу операции уровеня кортизола на 14,4%, инсулина на 57%, глюкозы на 9,1%), метаболических расстройств (снижение cLactate(aP) на 53,7% относительно исходных показателей).
Применение СА с адреноганглиоплегией создает оптимальные условия для адаптации организма больных к резко развивающейся тотальной медикаментозной симпатэктомии.
При проведении СА с адреноганглиоплегией не отмечено кардиоваскулярных расстройств. Это делает саму спинальную анестезию более безопасной и расширяет показания к ее использованию при плановых гинекологических и урологических операциях.
Стоимость различных видов анестезии:
Комбинированный эндотрахеальный наркоз – 636 рублей
Эпидуральной анестезии – 348 рублей
Спинальной анестезии – 135 рублей
ГРУДНАЯ ЭПИДУРАЛЬНАЯ АНЕСТЕЗИЯ СО СПОНТАННЫМ ДЫХАНИЕМ БЕЗ ПРИМЕНЕНИЯ НАРКОТИЧЕСКИХ АНАЛЬГЕТИКОВ ПРИ ЛАПАРОСКОПИЧЕСКИХ ХОЛЕЦИСТЭКТОМИЯХ (совместно с Караваевым Д.А.)
Актуальность проблемы. После широкого внедрения в практику лапароскопической малоинвазивной техники наблюдается увеличение числа холецистэктомий (национальные регистры, пациенты программы Medicare). Возрастание эндохирургических вмешательств отмечается во многих странах (Ljungqvist O., Thorell A., Gutniak M., Haggmark T., Efendic S. 1996; Turkistani A.A. 2005.). Лапароскопическая холецистэктомия (ЛХЭ) является наиболее распространенным методом хирургического вмешательства при калькулезном холецистите при не осложненных заболеваниях внепеченочных желчевыводящих путей (Kobayashi N., Ishii S. 1996).
Несмотря на наличие обширного списка препаратов для наркоза (в том числе современное мультимодальное обезболивание), не один вид анестезии при ЛХЭ нельзя считать идеальным. Данный вопрос волнует специалистов (Sato K. Et al., 2000; Joshi GP. 2001; Dilek O.N. 2006).
Лапароскопические холецистэктомии являются серьезным вмешательством и требуют соответствующего анестезиологического обеспечения, опыта и внимания, соблюдения всех требований и правил хирургии (Naude G.P., Bongard F.S. 1996; Wallace D.H., O'Dwyer P.J. 1996; Leonard I.E., Cunningham A.J. 2002; Guller U, Pietrobon R. 2003). Увеличение числа ЛХЭ, соответствующее накопление опыта и улучшение технического обеспечения несколько снизило количество осложнений, но дальнейшей тенденции к регрессии не наблюдается (Sha M., Ohmura A. 2000).
Несмотря на относительно небольшую инвазивность, ЛХЭ сопровождаются существенными стрессорными реакциями со стороны организма (Firilas A., Duke B.E., Max M.H. 1996; Rishimani A.S., Gautam S.C. 1996; Sato K., Kawamura T., Wakusawa R. 2000.). Высокий уровень вегетативной и нейроэндокринной напряженности, значимые сдвиги в работе сердечно-сосудистой системы, комплексные нарушения в работе различных органов и систем – это основа реакции организма на операционную агрессию, к которой относится и лапароскопическое оперативное вмешательство (Kawasaki T. et al. 2001; O’Malley, 2001; Joshi GP. 2002.).
На данный момент общеизвестно преимущество регионарных методов анестезии, в том числе и эпидуральной анестезии (ЭА). Этот метод обезболивания при лапароскопических операциях зарекомендовал себя как наиболее безопасный в операционном и послеоперационном периодах (Fujii Y, Toyooka H, Tanaka H. 1998.). Большинство исследователей применяют ЭА совместно с автоматической искусственной вентиляцией легких (АИВЛ) и используют в схеме наркотические анальгетики (van Zundert J., Stultiens G., Jakimowicz J., van den Borne B., van der Ham W., Wildsmith J. 2006). А так же используют ЭА в составе мультимодального послеоперационного обезболивания (Thompson JS. 2002; Nishikawa K., 2007.).
Имеются сообщения об использовании ЭА со спонтанным дыханием при ЛХЭ (Русанов В.П. с соавт. 2000; Sulemanji D., 2007; A.A.J van Zundern, and all. 2007.). Однако во все схемы входят наркотические анальгетики и, соответственно, наблюдаются депрессия дыхания и другие побочные эффекты этих препаратов (Naguib M., 1998; Liao Q., 2003).
Многие исследователи делают вывод, что на данный момент сложно найти метод анестезиологического пособия полностью купирующего все нежелательные стрессорные воздействия на организм пациента при ЛХЭ (Zuckerman R.S., 2002; Qureshi F.A. 2003; Meierhenrich R., 2005.).
В нашей клинике мы предприняли попытку теоретически обосновать, разработать методику и определить эффективность применения эпидуральной анестезии с сохранением спонтанного дыхания в сочетании с клофелином без применения наркотических анальгетиков, как метода выбора анестезиологического обеспечения при ЛХЭ.
