- •Патофизиология боли Боль как ощущение
- •Пути восприятия и проведения болевых ощущений
- •Реакция организма на боль
- •Патофизиологические механизмы соматогенных болевых синдромов
- •Механизмы возникновения первичной гипералгезии
- •Механизмы развития вторичной гипералгезии
- •Патофизиологические механизмы нейрогенных болевых синдромов
- •Острая боль
- •Интраоперационое обезболивание Немного история наркоза
- •Наркоз закисью азота
- •Эфирный и хлороформный наркозы
- •Физиологические основы влияния общей анестезии на цнс
- •Влияние общей анестезии на цнс
- •Антиоксиданты-антигипоксанты – перспективы их применения при хирургической агрессии и острой боли Патофизиология окислительного стресса
- •Основные патологические процессы, инициируемые чрезмерной активацией пол
- •I. Клеточно-тканевой уровень:
- •II. Органы и системы:
- •Антиоксидантная система
- •Антиоксиданты
- •1. Антиоксиданты ферментативной природы:
- •2. 2. Мембранные антиоксиданты
- •3. Внеклеточные атиоксиданты;
- •III. По растворимости
- •Принципы антиоксидантной терапи
- •1. Острая патология
- •Нарушения энергетических и метаболических процессов в клетках и тканях
- •Реамберин:
- •Особенности реакции цикла Кребса, связанной с сукцинатом:
- •Коррекция окислительного стресса в периоперационном периоде
- •Распределение больных по группам и методика интраоперационной коррекции окислительного и хирургического стресса
- •Результаты и их обсуждение
- •Выводы:
- •Резюме: продолжить !!!!!!!!!!!!!!!!!!!!!!!!!!!!
- •Многоуровневая ноцицептивная защита от хирургического стресса
- •Стресспротекторы как компанент анестезиологического пособия
- •Резюме:
- •Применение стресс протекторных и адаптогенных препаратов в периоперационном периоде у пациентов, оперируемых по поводу диффузного токсического зоба
- •Научная новизна
- •Материалы и методы исследования
- •Методика стресс протекторной и адаптогенной терапии клофелином и даларгином в периоперационном периоде у больных, оперируемых по поводу диффузного токсического зоба
- •Результаты собственных исследований
- •Практические рекомендации
- •Анестезия в акушерстве стреспротекторная анестезия при кесаревом сечении
- •Механизм действия пролонгированной стресспротекции ганглиолитиками и фармакологические эффекты
- •Метод пролонгированной ганглиоплегии:
- •Анестезия и интенсивная терапия в нейрохирургии
- •1. Ингаляционная анестезия ( j. Е. Cotterel, 1999);
- •2. Тотальная внутривенная анестезия (а. Н. Кондратьев с соавт, 1991; и. Смит, п. Уайт, 2002).
- •Общая характеристика методов общей анестезии, применявшихся в исследуемых группах больных, оперированных на мозге
- •Результаты и их обсуждение
- •Обезболивание у детей Стресспротекция при оперативной коррекции сколиоза у детей
- •Стресспротекция клофелином и адреноганглиолитиками при операциях у детей по поводу сколиоза Общая характеристика больных
- •Распределение больных, оперированных по поводу сколиоза, по возрастным группам
- •Распределение больных по характеру оперативных вмешательств
- •Сопутствующие заболевания у оперированных больных
- •Методика антистрессорной защиты клофелином и пентамином (азКиП)
- •19.2.3. Методы исследования
- •Центральная гемодинамика и микроциркуляция у детей на фоне стресспротекции
- •Функциональное состояние эндокринной системы больных при хирургической коррекции сколиоза на фоне стресспротекции
- •Изменение волемии и показателей красной крови при хирургической коррекции сколиоза на фоне стресспротекции
- •Коррекции сколиоза
- •Осложнения у детей при хирургической коррекции сколиоза
- •Резюме:
- •Практические рекомендации:
- •Регионарная анестезия
- •Эпидуральная анестезия
- •Комбинированная спинально-эпидуральная анестезия
- •Региональные нейроблокады в различных разделах хирургии
- •Результаты использования са в нашей клинике
- •Общая характеристика пациентов, методики анестезии и методы исследования
- •Общая характеристика пациентов старше 60 лет, в контрольной и исследуемой группах (м±m)
- •Результаты исследования
- •Показатели уос (мл) и мос (мл/мин) в контрольной и исследуемой группах на основных этапах периоперационного периода (м±m, р)
- •Показатели SpO2 и EtCo2 в контрольной и исследуемой группах на основных этапах операции (м±m, р)
- •Показатели чдд и до в контрольной и исследуемой группах на основных этапах операции (м±m, р)
- •Показатели кщр в контрольной группе (м ± m, р)
- •Практические рекомендации:
- •Резюме:
- •Проблемы послеоперационной боли
- •Современные тенденции послеоперационного обезболивания:
- •Преимущества эпидуральной инфузии
- •Наропин (ропивакаин)
- •Концепция и преимущества мультимодальной анальгезии
- •Метамизол и послеоперационное обезболивание
- •Послеоперационное обезболивание
- •Наркотические анальгетики
- •Ненаркотические анальгетики
- •Предупреждающая анальгезия
- •Предлагаемая методика нашей клиники
- •Результаты исследования
- •Премедикация:
- •Послеоперационная терапия:
- •Резюме:
- •Хронический болевой синдром
- •Вспомогательные средства для лечения хронической боли
- •Антагонисты nmda-рецепторов
- •Рекомендации по лечению болевых синдромов:
- •Основная литература:
Особенности реакции цикла Кребса, связанной с сукцинатом:
1. Окисление сукцината – обязательное условие каталитического действия интермедиата на усвоение клеткой кислорода
2. Для пополнения пула органических кислот достаточно введения одного сукцината
3. Активность сукцинатдегидрогеназы не зависит от концентрации НАД и НАДхН
4. Мощность системы энергопродукции, использующей ЯК, в сотни раз превосходит все другие системы
5. Феномен быстрого окисления сукцината в цитоплазме клеток с восстановлением динуклеотида


















|
|
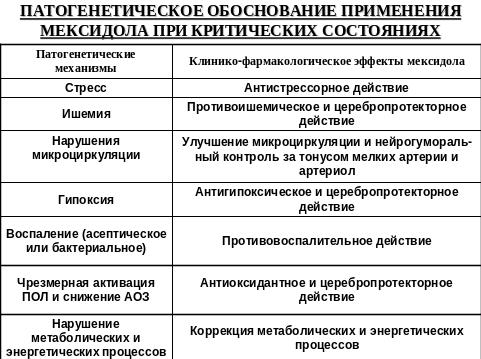
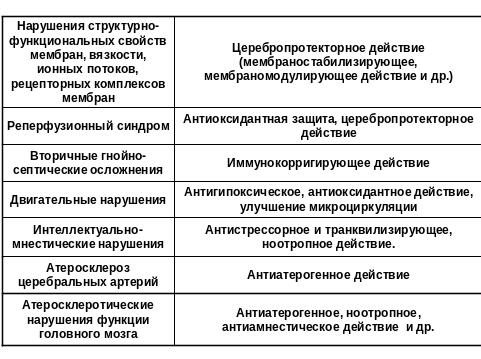
Активация окислительного стресса в ходе проведения операции и анестезии является ключевым звеном в развитии патофизиологических процессов критических состояний. А уровень окислительного стресса – это современный критерий адекватности анестезиологического пособия. Не вызывает сомнения необходимость включение антиоксидантов-антигипоксантов в анестезиологическое пособие с целью улучшения защиты оперированного больного от хирургической агрессии. В тоже время этот вопрос практически не изучен.
В нашей клинике, совместно с кафедрой общей хирургии (зав. проф. Ю.С.Винник), в течение ряда лет изчается окислительный стресс у хирургических больных и возможность его коррекции антиоксидантами и нейропептидами. В частности был изучен окислительный стресс при операциях на желчных путях.
Коррекция окислительного стресса в периоперационном периоде
Симпатоадреналовая реакция, активация гипоталамо-гипофизарно-надпочечниковой системы с увеличением секреции стрессорных гормонов на хирургическую стимуляцию, действие анестетиков, интубация трахеи, ИВЛ, кровопотеря, изменения водно-электролитного равновесия, кислотно-щелочного баланса и температуры тела – все эти факторы вызывают в организме каскад системных отрицательных патологических реакций в ответ на хирургический стресс.

Нельзя не учитывать, что подавляющее большинство анестетиков (ингаляционных и неингаляционных) оказывает определенное негативное влияние на сердечно-сосудистую, дыхательную деятельность, систему кроветворения, обладают нефротоксичностью, гепатотоксичностью, церебротоксичностью, а основной мишенью для них служит ЦНС, как наиболее чувствительная к дефициту кислорода, лишенная собственных систем антиоксидантной защиты. Во время наркоза мозговая ткань страдает вследствие прямого воздействия препаратов и опосредованно, за счет влияния на основные системы жизнеобеспечения (дыхание, кровообращение, метаболические процессы). Изменение показателей внешнего дыхания, гемодинамики, неадекватная перфузия в условиях общей анестезии - основные факторы риска развития гипоксии, ишемии.
Срыв регуляторных систем приводит к избыточной генерации активных форм кислорода, угнетению системы антирадикальной защиты с развитием окислительного стресса. Окислительный стресс является патогенетической основой изменения проницаемости клеточных мембран, функционирования мембрансвязанных ферментов и, в конечном итоге, приводит к тяжелым нарушениям клеточного метаболизма.
По среднестатистическим данным примерно у 9% оперируемых пациентов отмечается хотя бы одно интраоперационное осложнение: аритмия, гипотензия, неадекватная вентиляция легких, которые усугубляют гипоксию, а в совокупности с операционной травмой - окислительный стресс.
В организме существует физиологически нормальный уровень свободнорадикальных процессов и перекисного окисления липидов (ПОЛ), необходимый для регулирования липидного состава, проницаемости мембран, течение ряда биосинтетических процессов. Контроль над синтезом активных форм кислорода (АФК) осуществляет сложная, многоуровневая система антиоксидантной защиты (АОЗ), поэтому в нормальных условиях существует некое равновесное состояние между АОЗ и интенсивностью свободнорадикальных реакций. Срыв регуляторных систем приводит к избыточной генерации АФК, угнетению системы АОЗ, увеличению свободнорадикального окисления (СРО).
Свободнорадикальные процессы приводят к существенному изменению белковых и липидных компонентов плазматической мембраны, что не может не сказаться на ее функционировании.

Активные фракции кислорода являются сильными окислителями и могут вызывать необратимые изменения в структуре нуклеиновых кислот, белков липидов, инициировать цепную реакцию ПОЛ, с образованием свободных радикалов (СР). Лабораторные данные о состоянии АОЗ и уровне свободнорадикальных процессах в биологических объектах могут нести важную информацию о глубине и степени выраженности патологического процесса.
Одним из перспективных методов, позволяющих оценить состояние АОЗ и интенсивность перекисных процессов, является хемилюминесцентный (ХЛ) анализ. Хемилюминесцентный метод является объективным при определении качественного и количественного спектра и интенсивности процессов свободнорадикального окисления и параметров антиоксидантной системы.
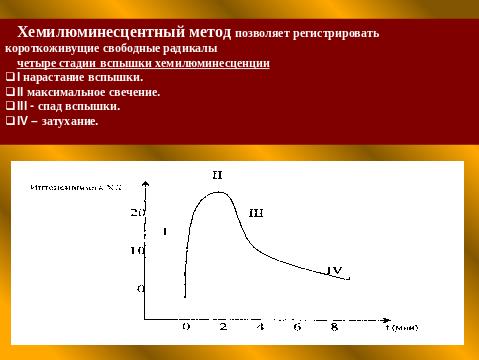
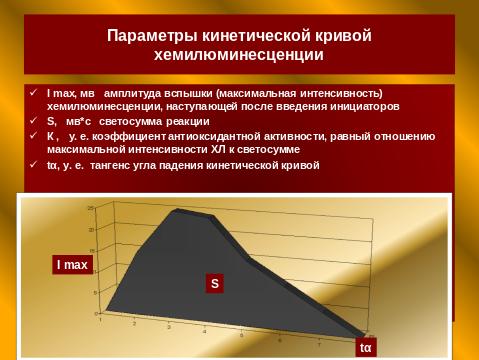
В режиме реального времени он позволяет интраоперационно «видеть» степень уровня нарушений в системе потребления кислорода, чтобы в последующем эффективно бороться с патологическими реакцими и постгипоксическими нарушениями, контролировать адекватность анестезиологического пособия.
В итоге, одной из актуальных проблем клинической анестезиологии является усовершенствование методов анестезиологического пособия, основой которого является не только защита пациента от болевой импульсации, но и применение дополнительных фармакологических препаратов, способных эффективно предупреждать негативные вегетативные и нейроэндокринные реакции организма на операционную травму, а также обладать антигипоксическими и антиоксидантными свойствами.
В ряде работ показана необходимость применения в качестве комонентов анестезиологической защиты даларгина - синтетического аналога нейропептида лейэнкефалина, содержащего ключевую последовательность аминокислот всех опиоидов (тирозин-глицин-глицин-фенилаланин), который является неселективным агонистом мю- и сигма-рецепторов. Этот препарат обладает выраженным стресс-протективным действием, стабилизирует гемодинамику, улучшает реологические свойства крови, игибирует чрезмерные гормональные реакции, повышает устойчивость организма к гипоксии, предупреждает нарушения в системе микроциркуляции.
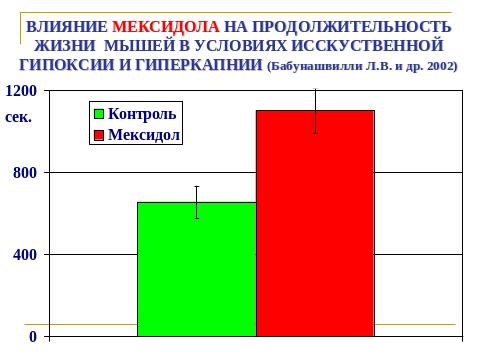
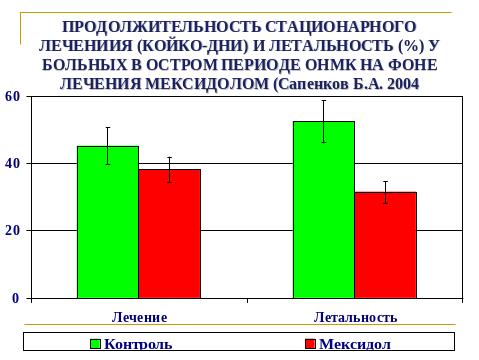
В общедоступной литературе нет сведений об использовании в анестезиологической практике в периоперационном периоде мексидола (2-этил-6-метил-3-оксипиримидина сукцината), который является ингибитором свободных радикалов и мембранопротектором, атигипоксантом и седатиком. Не изучено также совместное применение даларгина и мексидола у больных с патологией билиарной системы при проведении плановых и экстренных холецистэктомий.
Цель исследования. Повысить эффективность периоперационной защиты больных с высоким анестезиологическим риском при операциях на желчновыводящих путях, путем методики анестезии, обеспечивающей высокий уровень нейровегетативной, стресс-протективной, антиоксидантной и антигипоксической защиты, за счет дополнительного использования мексидола и даларгина.
Материалы и методы исследования. Данная работа основана на результатах исследования у 30 пациентов с желчнокаменной болезнью, которым была выполнена холецистэктомия из «мини-доступа».
Среди обследованных было 8 мужчин (26,6%) и 22 женщины (73,4%) в возрасте от 40 до 78 лет. Средний возраст больных в контрольной группе (КГ) составил 58±1,3 лет, а в исследуемых ИГ (с мекидолом и мексидолом + даларгином) – 62,6±1,2 и 57±1,3 соответственно. Достоверного различия по возрасту между группами не было. Масса тела больных КГ – 88±0,41 кг, а в ИГ-х – 90±0,44 кг и 91±0,43 кг соответственно, без достоверного различия между группами. Объективным статусом тяжести анестезиологического риска по классификации американского общества анестезиологов по (ASA) II -25 человек (83,3%), III- 5 человек (16,7%).
Всем пациентам была выполнена операция холецистэктомия из «мини-доступа» в условиях многокомпонентной внутривенной анестезии с тотальной миоплегией и искусственной вентиляцией легких (ИВЛ).
Премедикация включала в себя в/м введение за 30 минут до операции следующих препаратов: промедол в дозе 0,3±0,001 мг/кг, атропин – 0,07±0,0001 мг/кг, димедрол – 0,14±0,002 мг/кг.
Больным всех групп индукцию в анестезию проводили в/в введением реланиума в дозе 0,14±0,001 мг/кг, тиопентала натрия – 6,5±0,09 мг/кг, фентанила – 2,64±0,05 мкг/кг. Интубация трахеи проводилась после создания полной миоплегии дитилином 2,02±0,03 мг/кг, ИВЛ в условиях миорелаксации ардуаном в дозе 0,04±0,005 мг/кг/час.
Поддержание анестезии больным всех групп: реланиум – 0,12±0,002 мг/кг, фентанил – 2,44±0,05 мкг/кг, дроперидол – 0,04±0,002 мг/кг, тиопентал натрия – 2,86±0,07 мг/кг, кетамин - 1-1,3±0,05 мг/кг/.
Методика использования мексидола и даларгина (табл.1) применялась с учетом общепринятых показаний и противопоказаний к перечисленным препаратам. Больным всех групп проводилась инфузия кристаллоидов, коллоидов. Из коллоидных растворов предпочтение отдавалось гидроксиэтиленкрахмалам.
Всем больным в раннем послеоперационном периоде проводилась инфузионная терапия кристаллоидами 28,5±1,4 мл/кг, антибиотикопрофилактика цефтриаксоном 1 г/сутки, обезболивание наркотическими (промедол) и ненаркотическими (кетонал 2 мл 3 раза в сутки) анальгетиками.
Таблица 1