
- •5. Интраоперационные вопросы в кардиохирургии
- •I. Анестезия в кардиохирургии
- •Интраоперационный мониторинг.
- •Индукция анестезии
- •Предбайпассные вопросы
- •Период искусственного кровообращения
- •Прекращение ик
- •II. Искусственное кровообращение
- •Контур искусственного кровообращения
- •Начало искусственного кровообращения
- •Прекращение искусственного кровообращения
- •Неблагоприятные эффекты ик
- •III. Миокардиальная защита
Прекращение искусственного кровообращения
Пациент должен быть согрет до нормотермии. Легкие вентилируются, электрокардиостимуляция инициируется, в случае необходимости, а сердце наполняют, ограничивая венозный возврат, по мере того как байпассный поток уменьшают и останавливают. Низкое системное сопротивление является обычным явлением, поэтому α-агонисты и хлорид кальция полезны для улучшения системного кровяного давления. При плохой сердечной производительности следует рассмотреть вопрос об инотропной поддержке (смотрите 10 главу).
Если пациент стабилен, то для реверсии эффекта гепарина назначают протамин (смотрите страницу 162, где обсуждается реакция на протамин) и деканулируют сердце. Осуществляют гемостаз и закрывают грудную клетку.
Неблагоприятные эффекты ик
ИК активирует многочисленные каскады, включая: калликреиновый, коагуляционный и систему комплемента. Одной из первичных забот является то, что системная воспалительная реакция служит причиной проинфламматорного цитокинеза. Это способствует нейтрофил-эндотелиальной адгезии, которая влечет за собой миокардиальное реперфузионное повреждение, легочное повреждение и генерализованную капиллярную протечку.32-35 Другим проблемами, возникающими вследствие ИК являются коагулопатия (разведение факторов свертывания и тромбоцитов, дисфункция тромбоцитов) и почечная и спланхическая гипоперфузия (вызывающая почечную дисфункцию и гастроинтестинальные (GI) осложнения).
Использование мембранных оксигенаторов, гепаринизированных контуров, центрифужных насосов, интраоперационное применение стероидов, лейкоцитарных фильтров, или маннитола может уменьшать степень этих расстройств.36 Апротинин - ингибитор плазменной протеазы, который при введении в высоких дозах, кроме снижения кровопотери может уменьшать последствия воспалительного каскада.36-38
Гипотермический циркуляторный аррест используется в ситуациях, когда аорта не может быть пережата вследствие необходимости выполнения анастомоза с аортой. Пациента охлаждают до 18-20ºC, при котором ЭЭГ становится ровной. Для профилактики церебрального повреждения голову обкладывают льдом и вводят лекарства (стероиды, барбитураты). Артериальную линию пережимают и дренируют кровь из системы кровообращения, не позволяя воздуху попасть в линии. «Безопасная» верхняя граница для циркуляторного арреста при такой температуре составляет 45-60 минут. Введение крови из насоса ретроградно в головной мозг через канюлю в верхней полой вене может расширить этот верхний безопасный предел посредством некоторого обеспечения мозга кислородом и питанием. Однако главной выгодой ретроградной перфузии является поддержание церебральной гипотермии и вымывание воздуха и материальных эмболов из церебральных сосудов.39
III. Миокардиальная защита
Оптимальный хирургический результат зависит от защиты сердца от повреждения, которое может возникать во время корригирующей операции. Некоторые операции могут быть выполнены на бьющемся сердце, без использования искусственного кровообращения, к ним относятся «минимально инвазивная байпассная хирургия» через стернотомный или торакотомный доступы. Другие операции могут быть выполнены с использованием искусственного кровообращения на пустом бьющемся сердце (резекция левожелудочковой аневризмы, закрытие предсердного септального дефекта). Однако почти все интракардиальные процедуры и большинство коронарно-байпассных шунтирующих операций требуют неподвижного и бескровного операционного поля, предоставляющего возможность для осуществления точной хирургической техники и предотвращения воздушной эмболии. Это неизбежно влечет за собой использование некоторых форм «миокардиальной защиты».
Кардиоплегия применяется большинством хирургов для остановки сердца. Пережатие аорты без использования кардиоплегии приводит к анаэробному метаболизму и истощению миокардиальных энергетических запасов. Таким образом, без уменьшения миокардиального метаболизма, гипотермией или химическим кардиальным аррестом, пережатие аорты более, чем на 15-20 минут будет приводить к тяжелой миокардиальной дисфункции.
Существует две альтернативных технологии, применяющиеся в специальных ситуациях и еще рутинно использующиеся некоторыми хирургами с удовлетворительными результатами. Перемежающийся ишемический аррест предполагает периодическое кратковременное пережатие аорты с целью выполнения дистальных анастомозов. При технике гипотермического фибрилляторного арреста аорта не пережимается, и дистальные анастомозы выполняются на холодном и фибриллирующем сердце при высоком перфузионном давлении. Эта техника полезна, когда безопасное пережатие аорты не осуществимо, вследствие обширной кальцификации или атеросклероза.
Принципы кардиоплегии40-43
Быстрая диастолическая остановка сердца достигается с помощью хлорида калия (альтернативными агентами являются блокаторы калиевых каналов). Средство может быть кристаллоидом, но чаще всего является кровью из насоса, способной обеспечить кислородом и содержащей естественные буферные агенты. К дополнительным добавкам относятся другие буферы, агенты для поддержания легкой гиперосмолярности и низкого уровня кальция. Кислородная потребность сердца уменьшается почти на 90% просто в результате остановки сердца.
Первоначально гипотермия использовалась самостоятельно, а затем в сочетании с кардиоплегией для еще большего уменьшения миокардиального метаболизма. Однако сокращение миокардиального метаболизма относимое к гипотермии незначительно по сравнению с тем, что достигается диастолическим аррестом (рисунок 5.2). Поскольку функция ферментов и репаративные клеточные процессы лучше происходят при нормотермии, многие хирургии для миокардиальной защиты используют «тепловую кардиоплегию». Однако из-за тенденции сердца к возобновлению электрической активности при нормотермии, для его защиты, «тепловая кардиоплегия» должна осуществляться непрерывно или периодически через короткие промежутки времени. Непрерывное введение может затруднять обзор операционного поля. Терминальная тепловая кровяная кардиоплегия (так называемый «hot shot») обычно выполняется непосредственно перед снятием зажима с аорты, поскольку, было показано, что она улучшает миокардиальный метаболизм.
Кардиоплегия может быть введена антеградно в корень аорты или ретроградно в коронарный синус. Эффективность первой до некоторой степени сомнительная при тяжелых коронарный артериальных стенозах, она не может быть назначена пациентам с аортальной недостаточностью (за исключением непосредственного введения коронарные устья) и может быть обременительна для повторного введения при аортальных и митральных клапанных операциях. В тоже время ретроградная кардиоплегия легка для выполнения в прерывистом или непрерывном режимах и не останавливает ход операции. Оная обеспечивает отличную миокардиальную защиту, несмотря на тревогу, качающуюся защиты правого желудочка, при таком подходе.
Различные лекарства с различными достоинствами добавляются к кардиоплегическим растворам для улучшения миокардиальной защиты. К ним относятся глютамат, аспартат, свободно-радикальные скавенжеры, аденозин и другие субстраты. Также используются различные смеси крови с кардиоплегией (в приделах от 2:1 до 8:1). Огромное многообразие кардиоплегических растворов связано с тем, что их также много как и хирургических групп, выполняющих операции на открытом сердце.
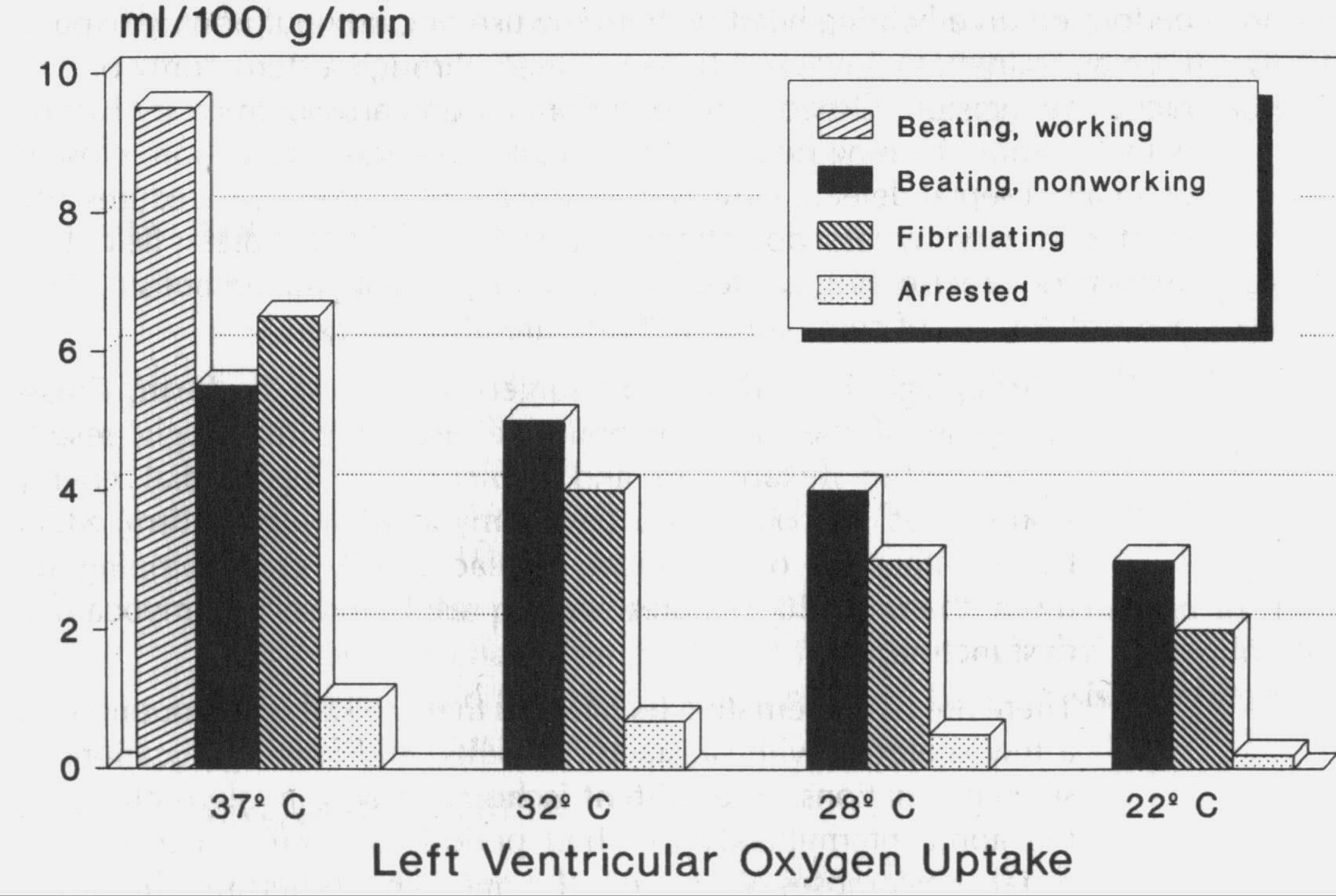
Рисунок 5.2 Миокардиальная кислородная потребность (mvO2). Заметьте, что наиболее значимое снижение mvO2 наблюдается при индукции состояния арреста и вследствие продукции гипотермии.
Ссылки
Loeb HS, Saudye A, Croke RP, et al. Effects of pharmaco|ogjca|ly-jnduced hypertension on myocardial ischemia and coronary hemodynamic in patents with fixed coronary obstruction. Circulation 1978; 57:41-6.
Sanchez R, Wee M. Perioperative myocardial ischemia: early diagnosis using the pulmonary artery catheter. J Cardiothorac Vasc Anesthesia 1991; 5:604-7.
Koide Y, Keehn L, Nomura T, Long T, Oka Y. Relationship of regional of regional wall motion abnormalities detected by biplane transesophageal echocardiography and electrocardiographic changes in patients undergoing coronary artery bypass graft surgery. J Cardiothorac Vasc Anesthesia 1996; 10:719-27.
Daniel WG, Mugge A. Transesophageal echocardiography. N Engl J Med 1995; 332:1268-79.
Lazar Hl, Plehn J. Intraoperative echocardiography. Ann -Thorac Surg 1990; 50:1010-8.
Murphy PM. Pro: intraoperative transesophageal echocardiography is a cost-effective strategy for cardiac surgical procedures. J Cardiothorac Vasc Anesthesia 1997; 11:246-9.
Kato M, Nakashima Y, Levine J, Goldinger PL, Oka Y. Does transesophageal echocardiography improve postoperative outcome in patients undergoing coronary artery bypass surgery? J Cardiothorac Vasc Anesthesia 1993; 7:285-9.
Engelman RM, Rousou JA, Flack JE III, et al. Fast-track recovery of the coronary bypass patient. Ann Thorac Surg 1994; 58:1 742-6.
Collard E, Delire V, Mayne A, et al. Propofol-alfentanil versus fentanyl-midazolam in coronary artery surgery. J Cardiothorac Vasc Anesthesia 1995-1Q-869-76.
Engoren MC, Kraras C, Garcia G. Propofol-based versus fentanyl-isoflurane based anesthesia for cardiac surgery. J Cardiothorac Vasc Anesthesia 1993-12:177-81.
Maitre PO, Funk B, Crevoisier C, Ha HR. Pharmacokinetics of midazolam in patients recovering from cardiac surgery. Eur J Clin Pharmacol 1989; 37:161-6.
Searle NR, Sahab P, Blain R, et al. Hemodynamic and pharmacodynamic comparison of doxacurium and high-dose vecuronium during coronary artery bypass surgery a cost-benefit study. J Cardiothorac Vasc Anesthesia 1994; 8:490-4.
Fremes SE, Wong BI, Lee E, et al. Metaanalysis of prophylactic drug treatment in the prevention of postoperative bleeding. Ann Thorac Surg 1994; 58:1580-8.
Chen RH, Frazier OH, Cooley DA. Antifibrinolytic therapy in cardiac surgery Texas Heart Inst J 1995; 22:211-5.
von Segesser LK, Weiss BM, Garcia E, von Felten A, Turina ML Reduction and elimination of systemic heparinization during cardiopulmonary bypass. J Thorac Cardiovasc Surg 1992; 103:790-9.
Aldea GS, Doursounian M, O'Gara P, et al. Heparin-bonded circuits with a reduced anticoagulation protocol in primary CABG: a prospective randomized study Ann Thorac Surg 1996; 62:410-8.
Kuitunen AH, Heikkila LJ, Selmenpera MT. Cardiopulmonary bypass with heparin-coated circuits and reduced systemic anticoagulation. Ann Thorac Surg 1997; 53:438-44.
Dietrich W, Jochum M. Effect of celite and kaolin on activated clotting time in the presence of aprotinin: activated clotting time is reduced by binding of aprotinin to kaolin (letter). J Thorac Cardiovasc Surg 1995; 1090:177-8.
Dietrich W, Spannagl M, Schramm W, Vogt W, Barankay A, Rjchter JA The influence of preoperative anticoagulation on heparin response during cardiopulmonary bypass. J Thorac Cardiovasc Surg 1991; 102:505-14.
Schwartz AE. Regulation of cerebral blood flow during hypothermic cardiopulmonary bypass. Review of experimental results and recommendations for clinical practice CVE 1997; 2:133-7.
Mines R. Pro: dopamine and renal preservation. J Cardiothorac Vase Anesthesia 1995; 9:333-4.
Zanardo G, Michielon P, Rosi P, et al. Effects of a continuous diltiazem infusion on renal function during cardiac surgery. J Cardiothorac Vase Anesthesia 1993; 7:711-6.
DiSesa VJ. Pharmacologic support for postoperative low cardiac output. Semin Thorac Cardiovasc Surg 1991; 3:13-23.
Royster RL. Intraoperative administration of inotropes in cardiac surgery patients. J Cardiothorac Anesthesia 1990; 4(suppl 5):17-28.
Butterworth J. Selecting an inotrope for the cardiac surgery patient. J Cardiothorac Vasc Anesthesia 1993; 7(suppl 2):26-32.
Cicek S, Demirkilic U, Kuralay E, Ozal E, Tatar H. Postoperative aprotinin: effect on blood loss and transfusion requirements in cardiac operations. Ann Thorac Surg 1996; 61:1372-6.
Deiss JM, Bojar RM. Cardiopulmonary bypass. In: Bojar RM. Adult cardiac surgery. Boston: Blackwell Scientific, 1992:1-36.
Utley JR. Cardiopulmonary bypass. CVE 1996; 1:7-26.
Hall TS. The pathophysiology of Cardiopulmonary bypass. The risks and benefits of hemodilution. Chest 1995; 107:1125-33.
Rosengart TK, DeBois W, O'Hara M, et al. Retrograde autologous priming for cardiopulmonary bypass: a safe and effective means of decreasing hemodilution and transfusion requirements. J Thorac Cardiovasc Surg 1998; 115:426-39.
Bert AA, Stearns GT, Feng W, Singh AK. Normothermic Cardiopulmonary bypass. J Cardiothorac Vase Anesthesia 1997; 11:91-9.
Miller BE, Levy JH. The inflammatory response to Cardiopulmonary bypass. J Cardiothorac Vase Anesthesia 1997; 11:355-66.
Downing SW, Edmunds LH Jr. Release of vasoactive substances during Cardiopulmonary bypass. Ann Thorac Surg 1992; 54:1236-43.
Boyle EM Jr, Pohlman TH, Johnson MC, Verrier ED. Endothelial cell injury in cardiovascular surgery: the systemic inflammatory response. Ann Thorac Surg 1997; 63:277-84.
Hill GE. Cardiopulmonary bypass-induced inflammation: is it important? J Cardiothorac Vase Anesthesia 1998; 12 (suppl 1):21-5.
Wan S, LeClerc JL, Vincent JL. Inflammatory response to Cardiopulmonary bypass. Mechanisms involved and possible therapeutic strategies. Chest 1997; !2:676-92.
Murkin JM. Cardiopulmonary bypass and the inflammatory response: a role for serine protease inhibitors? J Cardiothorac Vase Anesthesia 1997; 11:19-23.
Hill GE, Alonso AM, Spurzem JR, Stammers AH, Robbins RA. Aprotinin and methylprednisolone equally blunt Cardiopulmonary bypass-induced inflammation in humans. J Thorac Cardiovasc Surg 1995; 110:1 658-62.
Coselli JF. Retrograde cerebral perfusion is an effective means of neural support during deep hypothermic circulatory arrest. Ann Thorac Surg 1997; 64:908-12.
Buckberg CD, Beyersdorf F, Allen BS, Robertson JM. Integrated myocardial management: background and initial application. J Cardiac Surg 1995; 10:68-89.
Hoffenberg EF, Ghomeshi HR, Deslauriers R, Salerno TA. Perspectives on myocardial protection. CVE 1997; 2:3-10.
Buckberg CD. Update on current techniques of myocardial protection. Ann Thorac Surg 1995; 60:805-14.
Beyersdorf F, Buckberg CD. Myocardial protection with blood cardioplegia during valve operations. J Heart Valve Dis 1994; 3:388-403.
