
Билет № 5
1.Желчные кислоты: химическое строение, физико-химические свойства. Опишите образование желчных кислот: место синтеза, предшественники. Укажите роль желчных кислот в переваривании и всасывании липидов. Судьба желчных кислот, попавших в ЖКТ: энтерогепатическая циркуляция.
Ответ- Из холестерина в печени образуются желчные кислоты. По химическому строению эти соединения близки к холестерину. Для них характерно наличие укороченной разветвленной боковой цепи с карбоксильной группой на конце. Двойная связь в кольце В отсутствует, а кольца А и В сочленены в цис-положении. Стероидный кор в положениях 3, 7 и 12 содержит от одной до трех β-гидроксильных групп. Желчные кислоты обеспечивают растворимость холестерина в желчи и способствуют перевариванию липидов. В печени вначале образуются первичные желчные кислоты − холевая и хенодезоксихолевая (антроподезоксихолевая).
Дегидроксилирование этих соединений по С-7 микрофлорой кишечника приводит к образованию вторичных желчных кислот − литохолевой и дезоксихолевой.
2. Распад фосфолипидов в тканях организма: описать реакции, указать ферменты. Укажите причины и последствия накопления лизофосфолипидов в клетках?
Ответ-Известно, что молекулы белков расщепляются в тканях полностью. Поэтому для молекулы белков можно определить время обновления. Фосфоли-пиды также активно распадаются в тканях, но для каждой части молекулы время обновления различно. Например, время обновления фосфатной группы отличается от времени обновления 1-ацильной группы, и обусловлено это наличием ферментов, вызывающих частичный гидролиз фосфоли-пидов, вслед за которым снова может происходить их синтез. К сожалению, в настоящее время нет достаточно полных данных о фосфолипазном спектре той или иной ткани. Хорошо известно, что фосфолипаза A1атакует эфирную связь фосфолипидов в положении 1. Фосфолипаза А2 катализирует гидролиз эфирной связи в положении 2 гли-церофосфолипидов, в результате чего образуются свободная жирная кислота и лизофосфолипид (в случае фосфатидилхолина – лизолецитин), который реацилируется ацил-КоА при участии ацилтрансферазы. Фосфолипаза С атакует эфирную связь в положении 3, что заканчивается образованием 1,2-диглицерида и фосфорильного основания.
Фосфолипаза D катализирует отщепление от фосфолипида азотистого основания. Долгое время считалось, что фосфолипаза D содержится только в растительных тканях. В последнее время ее удалось обнаружить в растворимой фракции мозга крысы, а затем в микросомах мозга и других органов, а в самое последнее время-в митохондриях печени крысы.
Гидролитическое расщепление фосфолипазами строго определенных связей фосфолипидов.
Нет ясности в отношении фосфолипазы В. Возможно, что это-смесь ферментов, обладающих свойствами фосфолипаз А1и А2. Не исключено, что фосфолипаза В-фермент, действующий только на лизофосфолипид (например, лизолецитин), т.е. это лизофосфолипаза.
При ряде патологических состояний наблюдается активация тканевой фосфолипазы А2. Это сопровождается образованием продуктов неполного распада фосфолипидов - лизофосфолипидов. Накопление лизофосфолипидов в составе клеточной мембраны повышает её проницаемость для Na+, К+, Н2О, благодаря чему возможен лизис клеток (в частности, гемолиз эритроцитов).
3.Биосинтез кетоновых тел: опишите реакции, биологическое значение процесса. Укажите причины усиления биосинтеза кетоновых тел, последствия кетонемии и кетонурии.
Ответ- В некоторых случаях, например, при диабете, голодании, при диете, богатой липидами, в результате β-окисления происходит избыточное образование ацетил-СоА. Часть ацетил-СоА вступает в цикл лимонной кислоты и в дальнейшем используется в катаболизме и при производстве энергии. Избыток ацетил-СоА превращается в печени в соединение β-гидрокси-β-метилглутарил-СоА, являющийся предшественником в биосинтезе холестерина (рис. 7.).
Р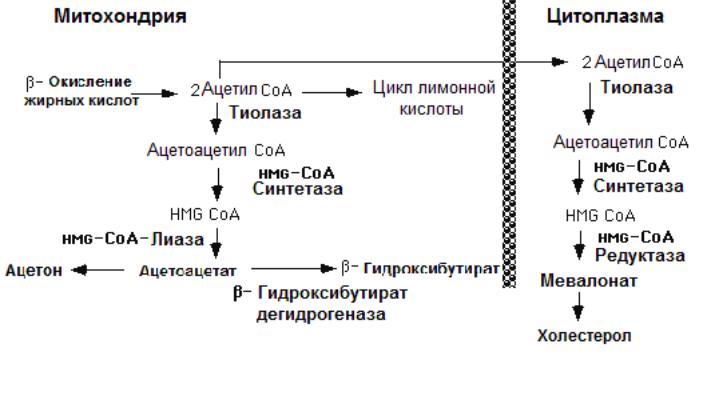 ис.7.
Образование
кетоновых тел в митохондриях печени
ис.7.
Образование
кетоновых тел в митохондриях печени
Кроме того, часть этого соединения превращается также в ацетоацетат (свободную кислоту) и ацетил-СоА. Ацетоацетат ферментативно восстанавливается до β-гидроксибутирата, а также неферментативным путем может декарбоксилироваться до ацетона. Если эти процессы идут достаточно интенсивно, то в крови появляются аномально высокие количества этих соединений, называемых кетоновыми телами. Развитие этого состояния может перейти в кому и привести к смерти.Синтез кетоновых тел (кетогенез) происходит в матриксе митохондрий печени. Жирные кислоты сначала расщепляются до ацетил-СоА в процессе β-окисления. Ацетил-СоА, прежде всего, используется как источник энергии для метаболических процессов, протекающих в печени. Часть ацетил-СоА может вовлекаться в кетогенез (рис. 7.1).
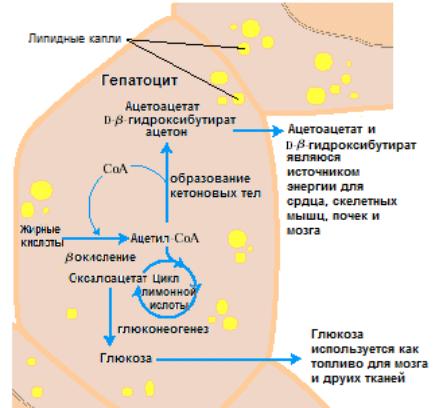
Рис. 7.1. Образование и экспорт кетоновых тел из печени
Химизм процесса кетогенеза в клетках печени приведен на рис. 7.2.
• В реакции (1) осуществляется конденсация 2-х молекул ацетил-СоА при участии тиолазы. Образуется ацетоацетил-СоА и удаляется HSCoA.
• На второй стадии происходит включение третьей молекулы ацетил-СоА, но уже при участии другого фермента гидроксиметилглутарил-СоА-синтазы (ГМГ-СоА-синтазы) (2).
• Образующийся β-гидрокси-β-метилглутарил-CoA далее расщепляется под действием ГМГ-СоА-лиазы (3), регенерирующей ацетил-СоА и образующей продукт ацетоацетат.

Рис.7.2. Синтез кетоновых тел в гепатоцитах
Ацетоацетат может восстанавливаться до D-β-гидроксибутирата при участии D-β-гидроксибутиратдегидрогеназы.
Кетонемия и кетонурия.
В следствии недостаточности инсулина, что характерно для сахарного диабета, а так же при голодании, имеется относительная избыточность глюкагона (гормон панкреатической железы). По этой причине печень постоянно функционирует в режиме, который характерен для здоровых людей в постадсорбционном периоде. В это период в печени интенсивно окисляются жирные кислоты и интенсивно продуцируются кетоновые тела. Однако скорость синтеза кетоновых тел может превышать даже увеличенное в этих условиях потребление тканями. Развивается кетонемия. В норме кетоновых тел в крови меньше 2мг/дцл. При голодании может достигать до 30 а, при диабете до 350. При такой кетонемии развивается кетонурия. С мочой может выделяться до 5 гр кетоновых тел в сутки.Кетоновые тела являются кислотами и поэтому снижают буферную емкость крови, а при высоких концентрациях снижают и рН крови. Возникает кетоацидоз. В норме рН крови = 7,4. При котонемии рН крови может уменьшаться до 7, что приводит к резкому нарушению функций головного мозга вплоть до потери сознания и развития тяжелейшей комы. Необходима интенсивная терапия.
4.Синтез холестирина: опишите реакции до мевалоной кислоты,укажите этапы,объясните регуляцию этого процесса.
Ответ-Синтез ХС происходит в цитоплазме и микросомах. Исходным веществом для синтеза стеролов является ацетил-СоА, который транспортируется из митохондрий в цитоплазму 3-гидрокси-3-метилглутарил-СоА редуктазная (ГМГ-СоА редуктаза) реакция первая, практически необратимая реакция в цепи биосинтеза ХС.
Она протекает со значительной потерей свободной энергии. Установлено,что данная реакция лимитирует скорость биосинтеза холестерина.Реакции фосфорилирования требуются для солюбилизации изопреноидных интермедиатов данного пути.Биосинтез холестерола осуществляется в несколько этапов. I этап(рис. 8.) включает образование 3-гидрокси-3-метилглутарил-СоА (ГМГ-
СоА) из ацетил-СоА и превращение ГМГ-СоА в мевалонат. В результате двух последовательно протекающих реакций (тиолазной и гидроксиметил-глутарил-СоА-синтазной) из трех молекул ацетил-СоА образуется одна молекула 3-гидрокси-3-метилглутарил-СоА.
Следующая реакция – превращение ГМГ-СоА в мевалонат. Она катализируется ГМГ-СоА редуктазой. Процесс восстановления требует затраты двух молекул NADPH. Источником NADPH является пентозофосфатный путь окисления глюкозы, а также NADP+-зависимые цитозольные малатдегидрогеназная и изоцитратдегидрогеназная реакции.
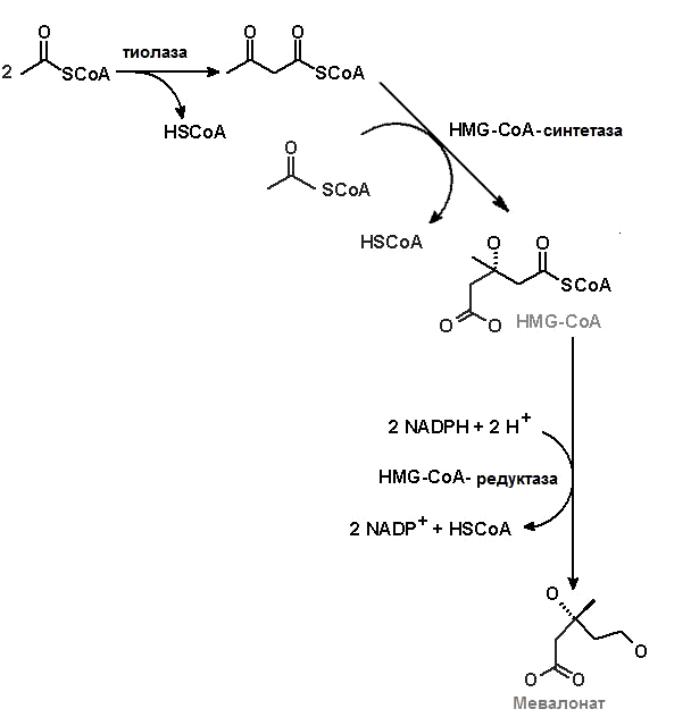
Рис.8. Первый этап биосинтеза холестерола
II этап (рис. 8.1) – превращение мевалоната в фарнезилпирофосфат. Мевалонат дважды подвергается фосфорилированию по 5-ОН-группе при участии киназ. Донором фосфатных групп в этих реакциях служит АТР. Пирофосфомевалонат подвергается декарбоксилированию и дегидратированию,превращаясь в изопентенилпирофосфат (ИПФ, С5). Изопентенилпирофосфат активная изопреноидная единица, широко распространенная в природе и участвующая не только в синтезе ХС, но в смниезе каротиноидов, боковых цепей убихинонов, витаминов К и Е.ИПФ изомеризуется в диметилаллилпирофосфат (ДПФ, С5). Взаимодействие ИПФ с молекулой диметилаллилпирофосфата, катализируемое изопентенилтрансферазой, приводит к образованию геранилпирофосфата (С10).Изопентенилтрансфераза осуществляет перенос диметилаллильного радикала на раскрывающуюся двойную связь в молекуле ИПФ. При этом происходит миграция двойной связи и потеря одной молекулы пирофосфата.
Рис.
8.1. Превращение мевалоната в
фарнезилпирофосфат 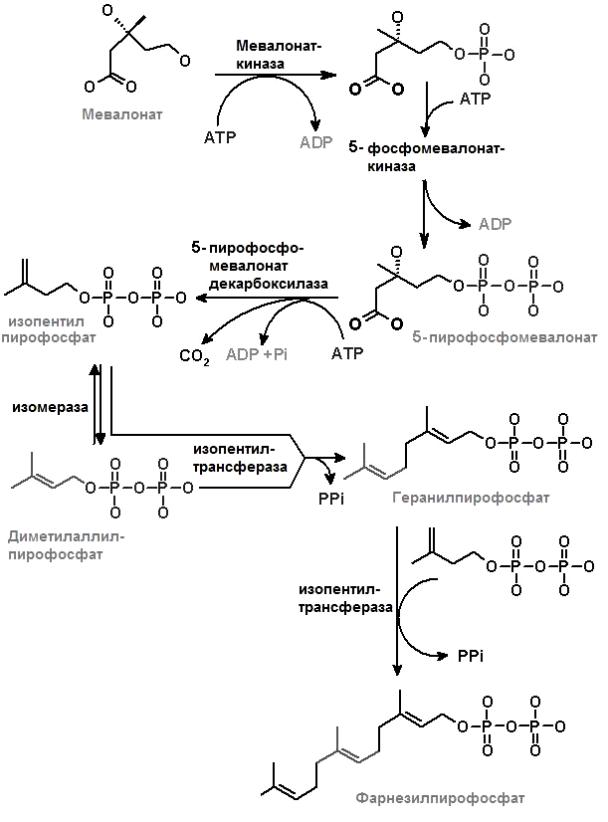
К геранилпирофосфату вновь присоединяется ИПФ, в результате образуется фарнезилпирофосфат (С15) и освобождается пирофосфат, получающий атом водорода от близлежащей метиленовой группы. Эта конденсация является NADPН-зависимым процессом.Этот же фермент катализирует реакцию переноса радикала геранила от геранилпирофосфата к следующей молекуле ИПФ. Освобождающийся в этой и в предыдущей реакции пирофосфат гидролизуется неорганической пирофосфатазой, что обеспечивает необратимость биосинтетического процесса.Продуктом данного этапа биосинтеза холестерола служит фарнезилпирофосфат (С15).
III этап (рис. 8.2, рис. 8.3) образование сквалена из фарнезилпирофосфата и превращение сквалена в ланостерол.
Рис.8.2 Образование сквалена Рис.8.3.Превращение сквалена в
ланостерол
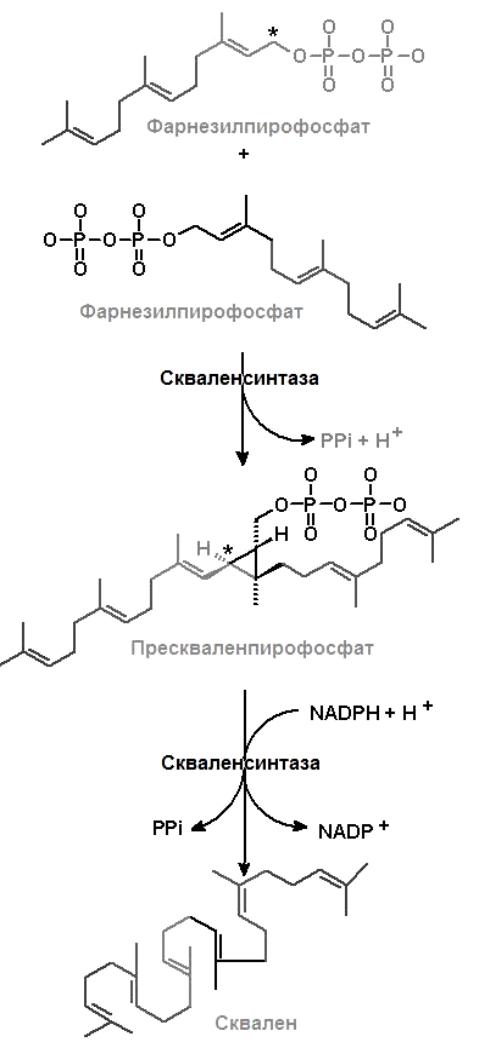

Две молекулы фарнезилпирофосфата, соединяясь «голова к голове» и теряя каждая свой пирофосфат, образуют сквален, содержащий 30 втомов углерода. Сквален образуется из прескваленпирофосфата под действием фермента скваленсинтазы, локализованной в эндоплазматическом ретикулуме. Источником атомов водорода в этой реакции является NADPH. Сквален непредельный углеводород, состоящий их шести изопреноидных единиц (С30). Молекула сквалена легко принимает пространственную конфигурацию, близкую к пространственной конфигурации стеролов. На стадии образования сквалена завершается анаэробная фаза биосинтеза ХС. Последующая фаза биосинтеза ХС является аэробной. На первом этапе при участии сквален-эпоксидазы, являющейся монооксигеназой, сквален легко окисляется с образованием сквален-2,3-эпоксида. Ланостерол-синтаза осуществляет замыкание шести и пятичленных циклов в результате протонирования эпоксидной группы и смещения электронной плотности в системе двойных связей сквалена. По такому пути протекает образование ланостерола в клетках печени. У растений и других организмов в циклизации сквален-2,3-эпоксида принимают участие другие циклизующие ферментные системы с образованием продуктов иных, нежели ланостерол. Ланостерол уже имеет гидроксильную группу в положении 3 и три лишние по сравнению с ХС метильные группы. Они окисляются до карбоксильных, которые затем удаляются декарбоксилированием.
IV этап (рис.8.4) – превращение ланостерола в холестерол. Преобразование ланостерола многоступенчатый процесс, в ходе которого образуются разнообразные индивидуальные стеролы (зимостерол, десмостерол), характерные для животного и растительного мира.
Рис.8.4.
Трансформация
ланостерола в холестерол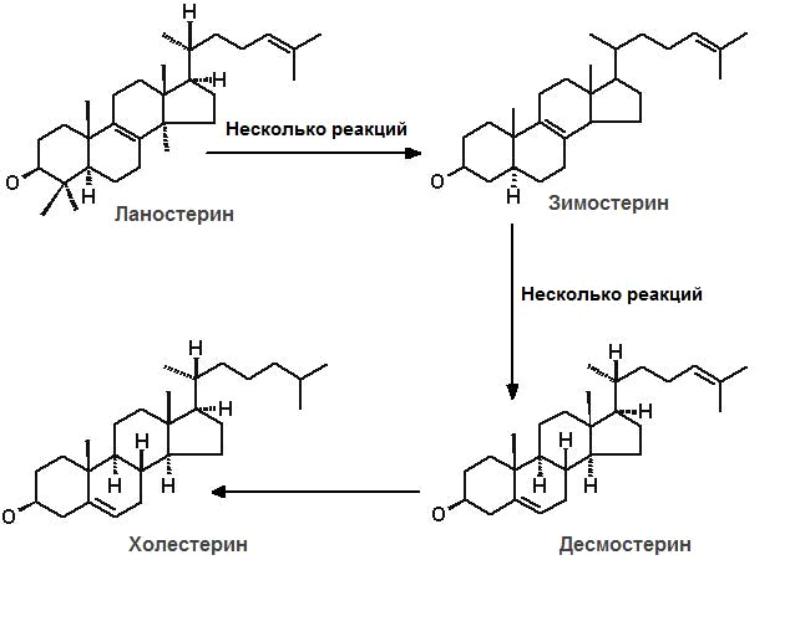
Хотя ланостерол и похож по структуре на холестерол, для его превращения в ХС требуется 20 дополнительных реакций. Ферменты, ответственные за эту трансформацию, локализованы в ЭПР. Преобразование ланостерола в ХС может идти двумя путями. Один из них восстановление десмостерола (приведен на рис. 8.4). Другой путь включает образование 7-дегидролхолестерола как предпоследнего интермедиата при синтезе холестерина.Независимо от заключительного пути преобразования ланостерола,суммарный итог всех реакций биосинтеза ХС выглядит следующим образом:
18 СН3СОSСоА + 10 Н+ + ½ О2→ С27Н46О + 9СО2 + 18 HSСоА
Источником углеродного скелета холестерола служит ацетил-СоА, до-нором водорода являются вода и NADPН. Начиная со сквалена и заканчивая холестеролом, все промежуточные продукты биосинтеза нерастворимы в водной среде. Поэтому они участвуют в конечных реакциях биосинтеза ХС,будучи связанными со стеринпереносящими белками. Это обеспечивает их растворимость в цитозоле клетки и протекание соответствующих реакций. Стеринпереносящие белки обеспечивают также перемещение ХС внутри клетки, что имеет важное значение для вхождения его в клеточные мембраны, окисления в желчные кислоты, превращения в стероидные гормоны.Эфиры холестерола принципиальная форма циркулирующего ХС образуются на цитоплазматической стороне ЭПР.
Скорость синтеза ХС регулируется по принципу отрицательной обратной связи. Основной пункт регуляции синтез мевалоновой кислоты ГМГ-СоА редуктазой. Холестерол подавляет ее синтез. При содержании 2-3 г холестерола в суточной пище человека синтез собственного ХС почти полностью прекращается.Предполагается, что ХС или продукты его окисления в клетке могут угнетать непосредственно синтез редуктазы или индуцировать синтез ферментов, участвующих в ее деградации. При этом тормозится восстановление ГМГ-СоА в мевалоновую кислоту и синтез ХС в целом.Скорость синтеза ГМГ-СоА редуктазы в печени подвергается четким суточным колебаниям. Максимум ее приходится на полночь, минимум на утренние часы. Активность ГМГ-СоА редуктазы возрастает при введении инсулина и тиреоидных гормонов. Угнетение активности фермента наблюдается при голодании, введении глюкагона и глюкокортикоидов.
5.Методы разделения липопротеинов(по электрофоретической подвижности и плотности). Дислопопротеинемии: классификация(по Фредриксону), возможные биохимические причины возникновения и последствия.
Ответ- Принцип метода основан на способности передвижения липопротеидных частиц в электрическом поле. Скорость движения липопротеидов зависит от величины их заряда, который определяется количеством белка: чем больше белка, тем больше скорость передвижения. При электрофорезе липопротеидные частицы распределяются так, начиная от линии старта: хиломикроны, липопротеиды очень низкой плотности-пре-бета-липопротеидами,ЛНП-бета-липопротеидами,ЛВП-альфа-липопротеидами.
Диагностическое значение: Классификация по Фредриксену
Классы липопротеидов |
|
II тип |
IIб тип |
III тип |
IV тип |
V тип |
ХМ |
|
- |
- |
- |
- |
|
ЛПОНП(пре-бета-ЛП |
N |
N |
|
- |
|
|
ЛПНП ( бета-ЛП) |
N |
|
|
- |
N |
N |
Флотирующие бета ЛП |
- |
- |
- |
|
- |
- |
Соотношение классов позволяет диагностировать или оценить риск развития таких заболеваний как атеросклероз, ИБС и др.
6.Тесты NN: 193,202,211,220,229. Ситуационные задачи NN: 90,100,106

 I
тип
I
тип