
- •Учреждение образования
- •Управляемая самостоятельная работа № 3
- •Принципы и механизмы ферментативного катализа
- •Глава 1. Принципы ферментативного катализа 3
- •Глава 2. Механизм действия фермента 6
- •Глава 1. Принципы ферментативного катализа
- •Глава 2. Механизм действия фермента
- •2.1 Модель стерического соответствия
- •2.2 Теория индуцированного соответствия
- •2.3 Активация субстрата в фермент-субстратном комплексе
- •Список используемой литературы
Глава 2. Механизм действия фермента
 Исторически
первыми моделями, учитывающими образование
фермент-субстратного комплекса ES,
были модель «ключ-замок» Эмиля Фишера
(Emil Fischer),
предложенная в 1890 г, и модель «рука-перчатка»
Даниэля Кошланда (Daniel E.
Koshland), предложенная в 1958
г.
Исторически
первыми моделями, учитывающими образование
фермент-субстратного комплекса ES,
были модель «ключ-замок» Эмиля Фишера
(Emil Fischer),
предложенная в 1890 г, и модель «рука-перчатка»
Даниэля Кошланда (Daniel E.
Koshland), предложенная в 1958
г.
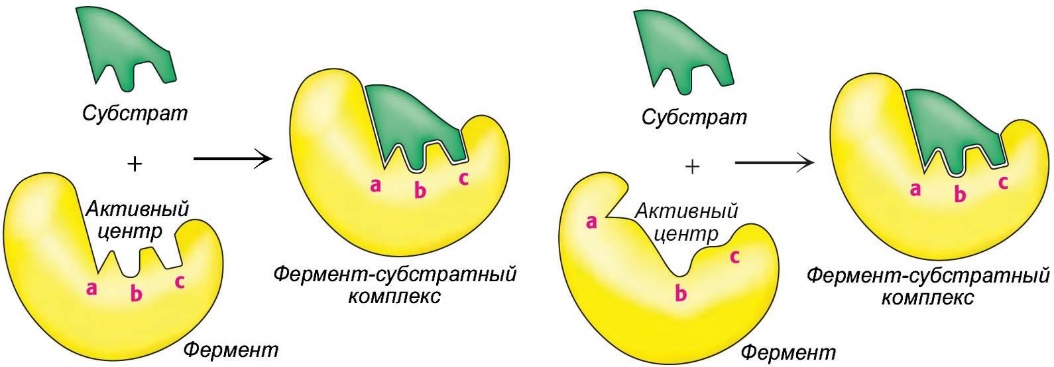
Рисунок 3 – модель «ключ-замок» (слева), модель «рука-перчатка» (справа)
2.1 Модель стерического соответствия
В модели «ключ-замок» Фишера субстрат-ключ подходит только к определённому замку-ферменту. Такие стерические соответствия реализуются за счёт геометрического и химического соответствия (комплементарности) поверхности молекулы субстрата и поверхности активного центра. Такая стерическая комплементарность включает в себя как геометрическую комплементарность, когда выступы на поверхности одной молекулы точно совпадают с впадинами на поверхности другой молекулы (сайты связывания a, b и c на рисунке), так и «химическую комплементарность», при которой в нужных позициях оказываются именно те атомы и функциональные группы, которые и формируют водородные связи или электростатическое притяжение.

Рисунок 4 – Связывание циклического
АМФ (субстрата) в активном центре
2.2 Теория индуцированного соответствия
 Даниэль
Кошланд предложил модель «рука-перчатка»,
которая учитывала тот факт, что связывание
субстрата S на ферменте E само по себе
должно приводить к существенному
изменению пространственной организации
фермента. В результате обеспечивается
возможность пространственной настройки
отдельных участков активного центра
фермента на соответствующие (связываемые
ими) фрагменты сорбируемой молекулы
субстрата. Сорбционный участок активного
центра фермента способен принять
конфигурацию, отличную от равновесной
(то есть термодинамически устойчивой
в отсутствие субстрата), чтобы обеспечить
наибольший контакт фермента с субстратом.
В результате такого электронно-
конформационного взаимодействия
фермента с субстратом и формируется
активный центр, в котором фермент и
субстрат «подстроились» друг к другу,
как перчатка и рука «подстраиваются»
друг к другу при надевании.
Даниэль
Кошланд предложил модель «рука-перчатка»,
которая учитывала тот факт, что связывание
субстрата S на ферменте E само по себе
должно приводить к существенному
изменению пространственной организации
фермента. В результате обеспечивается
возможность пространственной настройки
отдельных участков активного центра
фермента на соответствующие (связываемые
ими) фрагменты сорбируемой молекулы
субстрата. Сорбционный участок активного
центра фермента способен принять
конфигурацию, отличную от равновесной
(то есть термодинамически устойчивой
в отсутствие субстрата), чтобы обеспечить
наибольший контакт фермента с субстратом.
В результате такого электронно-
конформационного взаимодействия
фермента с субстратом и формируется
активный центр, в котором фермент и
субстрат «подстроились» друг к другу,
как перчатка и рука «подстраиваются»
друг к другу при надевании.
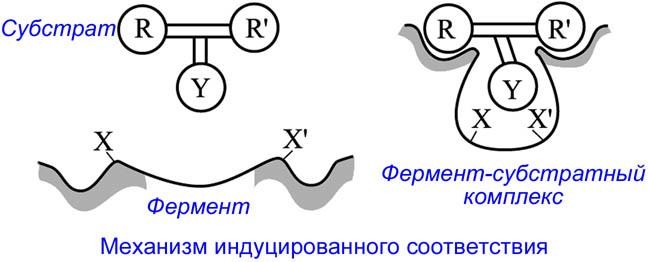
Рисунок 5 – Механизм индуцированного соответствия
Такое индуцированное соответствие происходит вследствие того, что субстрат связывается с активным центром двумя или большим числом точек. Образованию таких «многоточечных» (хелатных) комплексов способствует то, что в свободном ферменте полипептидные цепи белка и особенно боковые группы аминокислотных остатков, находящихся в поверхностном слое, не зафиксированы слишком жёстко и обладают определённой подвижностью (гибкостью). При этом каталитически активные группы Х и Х' расположены так, что они не могут одновременно взаимодействовать с субстратным фрагментом Y.
Поскольку молекула фермента довольно гибкая, а субстрат имеет жёсткую структуру, энергетически менее предпочтительная, но каталитически активная конформация активного центра образуется лишь в фермент-субстратном комплексе. На образование её тратится часть свободной энергии сорбции.
Впоследствии опыт полностью подтвердил эту гипотезу, но только для тех белков, которым нужно скрыть субстрат от конкурирующей с ним молекулы воды.
Для действия трипсина, например, этого не нужно, и в нём индуцированного соответствия субстрату не наблюдается: трипсин (а также – химотрипсин, эластаза, субтилизин и др.) не деформируется и опознает субстрат по простейшему принципу «ключ-замок».
Индуцированное соответствие достигается смещением либо крупных блоков, либо целых белковых доменов, а не полной перестройкой укладки белковой цепи. Эти смещения происходят, в основном, путём мелких локальных деформаций.
