
- •Учреждение образования
- •Управляемая самостоятельная работа № 3
- •Принципы и механизмы ферментативного катализа
- •Глава 1. Принципы ферментативного катализа 3
- •Глава 2. Механизм действия фермента 6
- •Глава 1. Принципы ферментативного катализа
- •Глава 2. Механизм действия фермента
- •2.1 Модель стерического соответствия
- •2.2 Теория индуцированного соответствия
- •2.3 Активация субстрата в фермент-субстратном комплексе
- •Список используемой литературы
Учреждение образования
”ПОЛЕССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ“
Факультет биотехнологический
Кафедра биохимии и биоинформатики
Управляемая самостоятельная работа № 3
на тему:
Принципы и механизмы ферментативного катализа
Подготовил |
|
Децук Валерия Петровна |
|||
Студент 2 курса, гр.22БХ-1 |
(подпись) __________________2023 |
||||
|
|
|
|
||
Проверил |
|
Аль Меселмани Моханад Али |
Доцент |
(подпись) ___________________2023 |
|
ПИНСК 2023
ОГЛАВЛЕНИЕ
Глава 1. Принципы ферментативного катализа 3
Глава 2. Механизм действия фермента 6
2.1 Модель стерического соответствия 6
2.2 Теория индуцированного соответствия 7
2.3 Активация субстрата в фермент-субстратном комплексе 8
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ 10
Глава 1. Принципы ферментативного катализа
 Протекание
любой химической реакции в принципе
возможно, если суммарная энергия
продуктов меньше общей энергии исходных
веществ, т.е. если реакция термодинамически
выгодна. Однако на практике далеко не
всякая термодинамически выгодная
реакция протекает (точнее, она протекает,
но очень и очень медленно). Это связано
с тем, что значение энергии активации
(т.е. величине энергетического барьера,
которые надо предолеть системе, чтобы
реакция прошла) очень велико. Понизить
величину этого барьера, и, как следствие,
увеличить скорость реакции позволяет
катализатор (Рисунок 1).
Протекание
любой химической реакции в принципе
возможно, если суммарная энергия
продуктов меньше общей энергии исходных
веществ, т.е. если реакция термодинамически
выгодна. Однако на практике далеко не
всякая термодинамически выгодная
реакция протекает (точнее, она протекает,
но очень и очень медленно). Это связано
с тем, что значение энергии активации
(т.е. величине энергетического барьера,
которые надо предолеть системе, чтобы
реакция прошла) очень велико. Понизить
величину этого барьера, и, как следствие,
увеличить скорость реакции позволяет
катализатор (Рисунок 1).
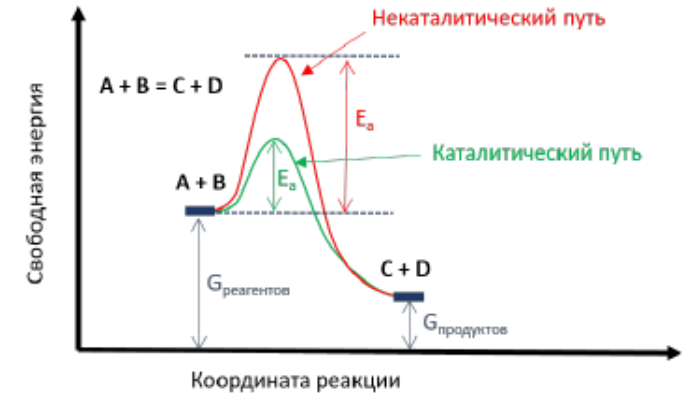
Рисунок 1 - Энергетическая диаграмма реакции.
 Если
говорить точнее, на самом деле при
добавлении катализатора несколько
изменяется путь реакции, но для общего
понимания и упрощения достаточно
сказать, что катализатор просто понижает
энергию активации.
Если
говорить точнее, на самом деле при
добавлении катализатора несколько
изменяется путь реакции, но для общего
понимания и упрощения достаточно
сказать, что катализатор просто понижает
энергию активации.
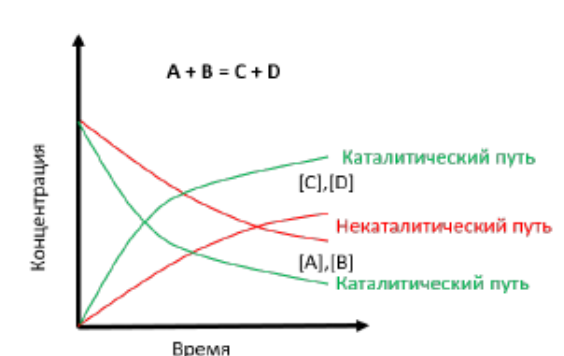
Рисунок 2 – Изменение скорости реакции при добавлении катализатора
То состояние системы, в котором системе сообщена энергия активации, вследствие чего сила связей в исходных веществах (субстратах) уже уменьшилась, но образующиеся новые связи ещё не сформировались окончательно, называется переходным состоянием системы. Переходное состояние соответствует вершине барьера на энергетическом профиле реакции (жёлтые флажки на рисунке). Молекула субстрата S * в переходном состоянии далее спонтанно переходит в продукт реакции. При этом происходит выделение соответствующего количества свободной энергии.
Существует две основные возможности преодоления энергетического барьера реакции, то есть перевода молекулы субстрата в переходное состояние.
Внешнее воздействие. Можно сообщить молекуле субстрата дополнительное количество энергии за счёт внешнего воздействия, например, нагревания, облучения, воздействия давлением и т. д.
Использование катализатора. При внесении в реакционную смесь катализа- тора под его влиянием изменяется путь реакции и происходит эффективное снижение энергетического барьера реакции.
В первом случае внешнее воздействие на свободную молекулу субстрата и является активатором реакции
S S* P .
Во втором случае при использовании фермента (катализатора) E молекула субстрата S связывается с активным центром фермента и формирует фермент-субстратный комплекс ES .
