
- •1.Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •4.Основные признаки классификации органических веществ. Основные классы органических веществ.(с 5)
- •5.Номенклатура органических соединений. Основные принципы построения названий органических соединений. С 27
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8.Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •10.Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа)
- •11.Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13.Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.(с 26)
- •14.Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15.Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •17.Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18.Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20.Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •22.Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23.Номенклатура, классификация, изомерия диеновых углеводородов.
- •25.Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26.Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27.Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28.Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова)
- •29.Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30.Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами:
- •60. Реакции енольных форм карбонильных соединений: a-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных a-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
В органических соединениях углерод всегда четырехвалентен. Преобладающим типом связи в молекулах органических соединений является ковалентная связь.
В случае, когда углерод связан с более электроотрицательным атомом (галогены, кислород, азот), связь может быть в значительной степени поляризована, а на атомах могут образовываться частичные положительные (на углероде) и отрицательные (на атомах галогенов, кислорода, азота) заряды. Однако степень ионности такой связи минимальна.
Вследствие неполярности связи С-С и С-Н преимущественным способом ее разрыва является гомолитический, когда пара электронов делится поровну между атомами. При таком разрыве связи образуются незаряженные, но очень реакционно-способные частицы с неспаренными электронами, называемые радикалами. Для алканов очень характерны реакции с промежуточным образованием радикалов.
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными). Между двумя атомами возможна только одна σ-связь.
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу. π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
Гибридизация орбиталей — это изменение формы и энергии некоторых электронов при образовании ковалентной связи, приводящее к более эффективному перекрыванию орбиталей и повышению прочности связей. Гибридизация орбиталей происходит всегда, когда в образовании связей участвуют электроны, принадлежащие к различным типам орбиталей.
8.Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
МЕХАНИЗМ РЕАКЦИИ. Понятие используется в основном в двух смыслах. Для сложных реакций, состоящих из нескольких стадий, механизм реакции-это совокупность стадий, в результате которых исходные вещества превращаются в продукты.
Гомолитический разрыв связи — разрыв, когда каждому атому отходит по одному электрону. Характерен для обменного механизма образования ковалентной связи.
Гетеролитический разрыв связи — разрыв, когда в результате образуются положительно и отрицательно заряженные частицы, т.к. оба электрона из общей электронной пары остаются при одном из атомов. Характерен для донорно-акцепторного механизма образования ковалентной связи.
Радикал - группа атомов, переходящих без изменения из одного соединения в другое. Свободные радикалы — атомы или группы связанных между собой атомов, характеризующиеся наличием неспаренных электронов.
Карбкатион — частица, в которой на атоме углерода сосредоточен положительный заряд, атом углерода имеет вакантную p-орбиталь. Карбкатион — сильная кислота Льюиса, обладает электрофильной активностью.
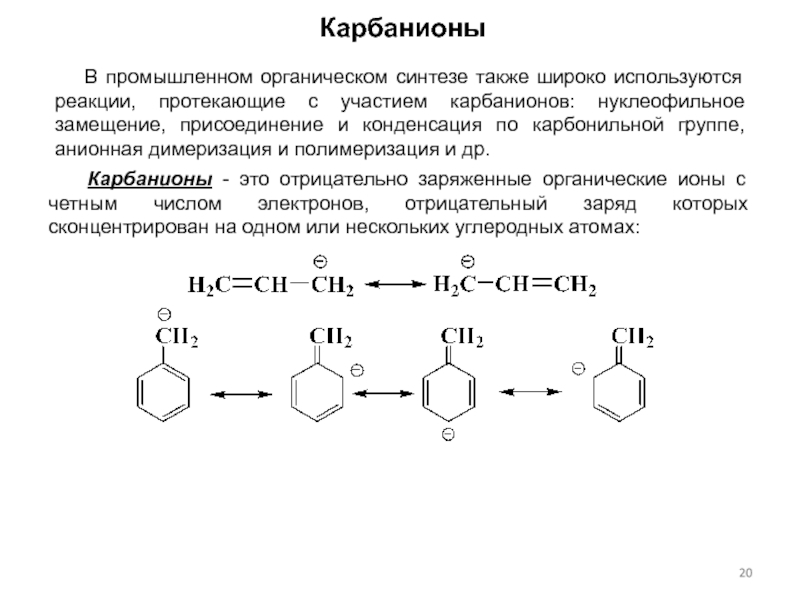
Нуклеофил — реагент, образующий химическую связь с партнером по реакции (электрофилом) по донорно-акцепторному механизму, предоставляя электронную пару, образующую новую связь. Вследствие того, что нуклеофилы отдают электроны, они по определению являются основаниями Льюиса. В роли нуклеофилов теоретически могут выступать все ионы и нейтральные молекулы с неподеленной электронной парой.
Электрофил — реагент или молекула, имеющая свободную орбиталь на внешнем электронном уровне. Все электрофилы являются кислотами Льюиса.
!9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
Энергетический профиль реакции - график зависимости потенциальной энергии от координаты реакции Активация вызывается повышением температуры, действием электрического поля, действием квантов света и т.д. Энергия активации Еа постоянна в данном температурном интервале и определяется механизмом реакции.
Разность между средним энергетическим уровнем молекулы и энергетическим уровнем реакции называется энергией активации или энергетическим барьером. Чем больше энергия активации (энергетический барьер), тем медленнее идет реакция. Энергия активации, разность между значениями средней энергии частиц (молекул, радикалов, ионов и др.), вступающих в элементарный акт химической реакции, и средней энергии всех частиц, находящихся в реагирующей системе. Переходное состояние — состояние системы, при котором уравновешены разрушенные и созданные связи. В переходном состоянии система находится в течение небольшого (10−15 с) времени. Энергия, которую необходимо затратить, чтобы привести систему в переходное состояние, называется энергией активации. В многоступенчатых реакциях, которые включают в себя несколько переходных состояний, энергия активации соответствует наибольшему значению энергии. После преодоления переходного состояния молекулы вновь разлетаются с разрушением старых связей и образованием новых или с преобразованием исходных связей. Оба варианта возможны, так как происходят с высвобождением энергии (это хорошо видно на рисунке, поскольку оба положения лежат энергетически ниже энергии активации). Существуют вещества, способные уменьшить энергию активации для данной реакции. Такие вещества называют катализаторами. В биологических реакциях в качестве катализаторов выступают ферменты. Тепловой эффект реакции — это энергия, которая выделяется или поглощается, когда химические вещества претерпевают превращения в процессе химической реакции. Этот параметр отражает изменение содержания энергии при превращении реактантов в продукты. Реакция может быть экзотермической (с выделением тепла) или эндотермической (с поглощением тепла). Очень часто одно то же вещество в данных условиях реакции может подвергаться конкурентным реакциям с образованием различных продуктов. Такие реакции отображаются диаграммой (рис. 6.):
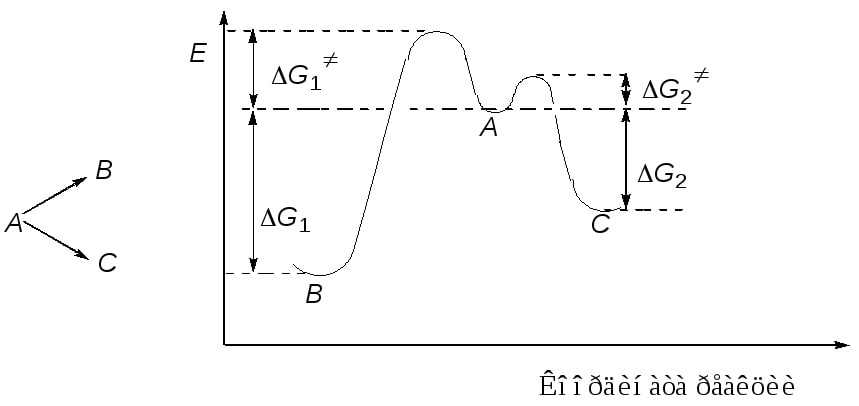 Диаграмма свободной энергии конкурирующих
реакций: А – исходные вещества; В и С –
продукты реакций.
Если ни одна из
конкурентных реакций не является
обратимой, то продукт С должен получаться
в большом количестве. Такой продукт
называют кинетически контролируемым.
Если
реакции обратимы, соотношение продуктов
может быть иным. Если остановить реакцию
задолго до наступления положения
равновесия, то в смеси будет больше
продукта, который образуется быстрее,
т.е. С. Такую реакцию называют кинетически
контролируемой.
Если позволить
реакции достичь равновесия, то
преобладающим или единственным продуктом
будет термодинамически более стабильный
(продукт В). В этом случае продукт С,
образующийся первым, претерпевает
обратное превращение в А и затем в В. В
таких случаях продукт В называют
термодинамически контролируемым.
Диаграмма свободной энергии конкурирующих
реакций: А – исходные вещества; В и С –
продукты реакций.
Если ни одна из
конкурентных реакций не является
обратимой, то продукт С должен получаться
в большом количестве. Такой продукт
называют кинетически контролируемым.
Если
реакции обратимы, соотношение продуктов
может быть иным. Если остановить реакцию
задолго до наступления положения
равновесия, то в смеси будет больше
продукта, который образуется быстрее,
т.е. С. Такую реакцию называют кинетически
контролируемой.
Если позволить
реакции достичь равновесия, то
преобладающим или единственным продуктом
будет термодинамически более стабильный
(продукт В). В этом случае продукт С,
образующийся первым, претерпевает
обратное превращение в А и затем в В. В
таких случаях продукт В называют
термодинамически контролируемым.
