
- •1.Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •4.Основные признаки классификации органических веществ. Основные классы органических веществ.(с 5)
- •5.Номенклатура органических соединений. Основные принципы построения названий органических соединений. С 27
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8.Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •10.Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа)
- •11.Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13.Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.(с 26)
- •14.Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15.Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •17.Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18.Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20.Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •22.Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23.Номенклатура, классификация, изомерия диеновых углеводородов.
- •25.Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26.Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27.Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28.Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова)
- •29.Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30.Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами:
- •60. Реакции енольных форм карбонильных соединений: a-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных a-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Простыми эфирами называют органические соединения общей формулы R–O–R'.
Названия простых эфиров по радикало-функциональной номенклатуре обычно образуют из названий углеводородных радикалов R и R´ (в алфавитном порядке), суффикса -овый и слова эфир:
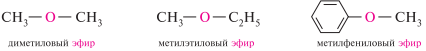
В заместительной номенклатуре IUPAC простые эфиры рассматривают как производные углеводородов, в которых один из атомов водорода замещен R-оксигруппой (RO—). за родоначальную структуру принимается более сложный по структуре радикал:
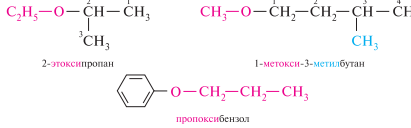
Изомерия простых эфиров обусловлена изомерией радикалов, связанных с атомом кислорода:
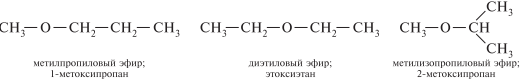
Образование оксониевых солей. Простые эфиры образуют с концентрированными минеральными кислотами (HCl, H2SO4, HNO3 и др.) оксониевые соли. Протон кислоты присоединяется за счет неподеленной пары электронов атома кислорода:
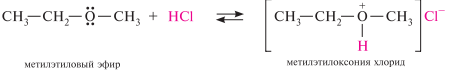
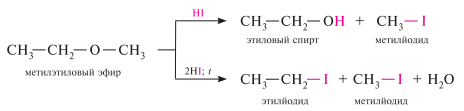
Расщепление под действием кислот (ацидолиз). реакцию расщепления органических соединений под действием кислот называют ацидолиз. концентрированные кислоты (HI, HBr, H2SO4) уже при комнатной температуре расщепляют простые эфиры. в реакции с йодоводородной кислотой при эквимолярном соотношении реагентов образуются галогенуглеводород и спирт, в избытке кислоты — только галогенуглеводороды.
Циклические простые эфиры содержат внутримолекулярную эфирную связь и по структуре представляют собой гетероциклические кислородсодержащие соединения. Они могут быть классифицированы в зависимости от размера цикла и числа кислородных атомов. Для названия циклических простых эфиров применяются заместительная, радикало-функциональная, заменительная номенклатуры.
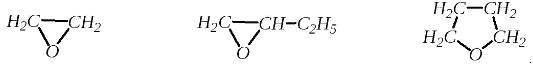
1,2-эпоксиэтан, 1,2-эпоксибутан, 1,4-эпоксибутан,
этиленоксид, бутиленоксид, тетраметиленоксид,
оксиран этилоксиран тетрагидрофуран
Диоксан. Прозрачная бесцветная жидкость (т. пл. 11,8 °с, т. кип. 101,5 °с), смешивается с водой, горит голубым пламенем. Эффективный растворитель органических веществ. ядовит.
52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
Эпоксиды (оксираны) — насыщенные трёхчленные гетероциклы, содержащие в цикле один кислородный атом. Эпоксиды являются циклическими простыми эфирами, однако вследствие напряжённости трёхчленного цикла обладают высокой реакционной способностью в реакциях раскрытия цикла.
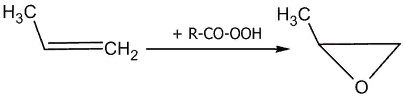
Наиболее общими методами синтеза эпоксидов являются селективное окисление алкенов (эпоксидирование) и циклизация при дегидрогалогенировании галогенгидринов под действием оснований.
Лабораторным методом эпоксидирования алкенов является реакция Прилежаева — взаимодействие алкенов с перкарбоновыми кислотами в инертных неполярных или слабополярных растворителях:
Взаимодействие с водой:
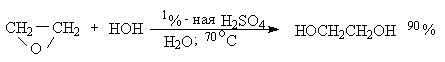
При взаимодействии оксирана с аммиаком, в зависимости от соотношения реагентов, образуются моно-, ди- и триэтаноламины:

При действии на оксиран алифатических аминов образуются N-алкиламиноэтанолы:

с магнийорганическими соединениями оксиран образует продукты присоединения, которые легко подвергаются гидролизу с образованием соответствующих спиртов:
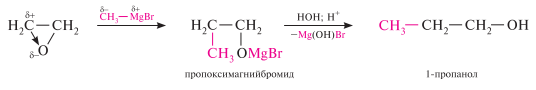
Краун-эфиры (краун-соединения) — макрогетероциклические соединения, содержащие в своих циклах более 11 атомов, из которых не менее четырёх — гетероатомы, которые связаны между собой этиленовыми мостиками.
Краун-эфиры используются для концентрирования, разделения, очистки и регенерации металлов, в том числе редкоземельных; для разделения нуклидов, энантиомеров; как лекарственные препараты, антидоты, пестициды; для создания ион-селективных датчиков и мембран; как катализаторы в реакциях с участием анионов. Показано применение некоторых краун-эфиров для усиления проницаемости лекарств через слизистые оболочки глаз.
