- •1.Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •4.Основные признаки классификации органических веществ. Основные классы органических веществ.(с 5)
- •5.Номенклатура органических соединений. Основные принципы построения названий органических соединений. С 27
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8.Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •10.Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа)
- •11.Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13.Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.(с 26)
- •14.Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15.Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •17.Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18.Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20.Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •22.Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23.Номенклатура, классификация, изомерия диеновых углеводородов.
- •25.Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26.Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27.Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28.Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова)
- •29.Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30.Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами:
- •60. Реакции енольных форм карбонильных соединений: a-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных a-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
К ароматическим углеводородам относят соединения, молекулы которых содержат одно или несколько бензольных колец. В зависимости от числа бензольных циклов, входящих в состав молекулы, различают одноядерные (моноциклические) и многоядерные (полициклические) арены. Многоядерные арены подразделяются на арены с конденсированными циклами (аннелированные) и изолированными циклами.
По заместительной номенклатуре IUPAC одноядерные арены рассматривают как продукты замещения бензола: метилбензол, этилбензол, винилбензол и т. д. При наличии в бензольном кольце двух и более заместителей их положение указывают цифрами. Нумерацию атомов углерода бензольного кольца осуществляют таким образом, чтобы заместители имели возможно меньшие номера. В дизамещенных бензола положение заместителей наряду с локантами отражают также обозначениями: орто- (о-) положение — 1,2; мета- (м-) положение — 1,3 и пара- (п-) положение — 1,4. Кроме систематических названий, в ряду одноядерных аренов сохранились и тривиальные названия: толуол, ксилол, кумол и др. Ниже приведены отдельные представители аренов (тривиальные названия даны в скобках):
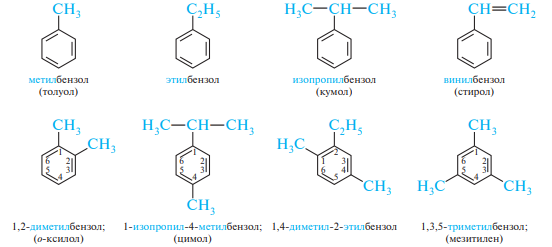
Изомерия гомологов бензола обусловлена разным строением, положением и количеством заместителей в бензольном кольце. Однозамещенные гомологи бензола не имеют изомеров положения, поскольку все атомы углерода в бензольном кольце равноценны. Вместе с тем для них характерна изомерия, связанная с разной структурой заместителя:
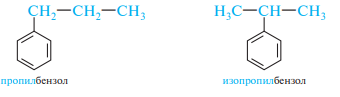
Дизамещенные бензолы существуют в трех изомерных формах, имеющих разное положение заместителей в бензольном кольце (изомеры положения):

Многоядерные арены с конденсированными циклами содержат в своем составе два или более бензольных ядра, имеющие общие атомы углерода. В зависимости от способа сочленения циклов различают два основных типа конденсированных систем:
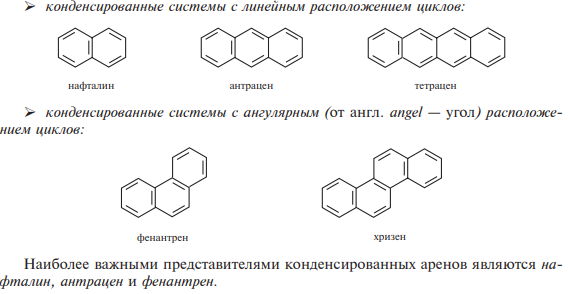
Ароматические соединения, в молекуле которых бензольные кольца имеют два общих атома углерода, называются конденсированными. Примерами таких углеводородов могут служить следующие соединения этого ряда: нафталин, антрацен, фенантрен и т.д. По современным представлениям нафталин представляет собой систему из двух бензольных колец, в которой все углероды sp2-гибридизованы и лежат в одной плоскости. В отличие от бензола, у которого все связи между углеродами имеют одинаковую длину, в нафталине он отличаются друг от друга.
33. Ароматичность, критерии ароматичности. Правило Хюккеля.
На каждую углерод-углеродную связь, помимо двух σ-электронов, приходится электронная плотность одного π-электрона. Такую связь называют ароматической. Если длина простой связи C—C в алканах составляет 0,154 нм, длина двойной связи в алкенах — 0,134 нм, то длина углерод-углеродной связи в молекуле бензола равна 0,139 нм, то есть является промежуточной между длиной одинарной и двойной связи. Делокализация π-электронной плотности и выравненность связей в бензольном кольце графически изображается в виде окружности внутри правильного шестиугольника
Однако наряду с таким изображением в химии широко используется и формула Кекуле, которая особенно удобна для описания механизмов реакций. Но, применяя формулу Кекуле, необходимо подразумевать делокализацию π-электронной плотности и выравненность связей в бензольном кольце. Совокупность специфических свойств бензола, а именно высокая стабильность, инертность в реакциях присоединения и склонность к реакциям замещения, получила общее название «ароматичность», или «ароматические свойства». В 1931 году немецкий ученый Эрих Хюккель на основе квантово-химических расчетов с помощью метода МО сформулировал правило стабильности циклических сопряженных систем, которое представляет собой теоретически обоснованный метод, позволяющий предсказать, будет ли циклическая сопряженная система ароматической или нет. Согласно правилу Хюккеля критерием ароматичности органического соединения является наличие в его структуре плоского цикла, содержащего замкнутую сопряженную систему, включающую (4n + 2) π-электронов, где n = 0,1,2,3 и т. д. К наиболее распространенным ароматическим системам, содержащим 6π-электронов (n = 1), относится бензол и его производные. Правило Хюккеля применимо и к системам с конденсированными ядрами, такими как нафталин, антрацен и фенантрен:

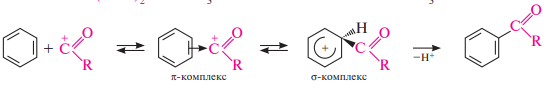
35. Реакции электрофильного замещения в бензоле (галогенирование, нитрование, сульфирование, алкилирование, ацилирование). Представление о механизме реакций электрофильного замещения в ароматическом ряду (π- и σ-комплексы).
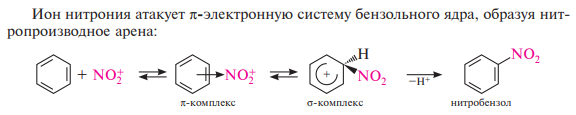
К наиболее важным реакциям электрофильного замещения в бензольном ядре относятся реакции нитрования, сульфирования, галогенирования, алкилирования и ацилирования. нитрование.
Нитрованием называют процесс введения в молекулу органического соединения нитрогруппы —NO2. В качестве нитрующих агентов в реакции нитрования чаще используют концентрированную азотную кислоту или смесь концентрированных азотной и серной кислот (нитрующая смесь). С концентрированной азотной кислотой арены реагируют медленно, поэтому для их нитрования наиболее широко используется нитрующая смесь:
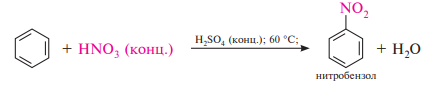
Сульфирование. Сульфированием называют процесс введения в молекулу органического соединения сульфогруппы —SO3H. Для сульфирования бензола и его гомологов чаще применяют концентрированную серную кислоту или дымящую серную кислоту (олеум). В результате взаимодействия образуются аренсульфокислоты:
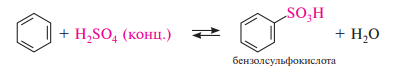
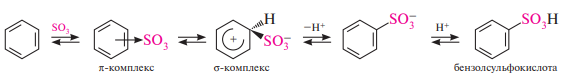
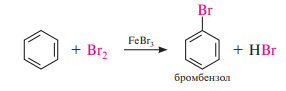
Галогенирование. Бензол и его гомологи хлорируются, бромируются и йодируются. Замещение атома водорода в бензольном ядре на атом хлора или брома осуществляют действием свободного хлора или брома в присутствии катализаторов — кислот Льюиса (AlCl3, FeBr3, ZnCl2 и др.):
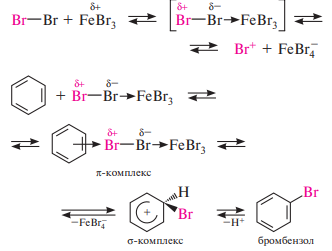
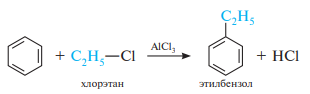
Алкилирование по Фриделю—крафтсу. Для введения алкильной группы в молекулу бензола и его гомологов в качестве электрофильных реагентов чаще всего используют галогеналканы. Взаимодействие аренов с галогеналканами происходит в присутствии катализаторов — кислот Льюиса (AlCl3, FeCl3, ZnCl2, BF3 и др.), из которых наиболее часто применяют алюминия хлорид AlCl 3:
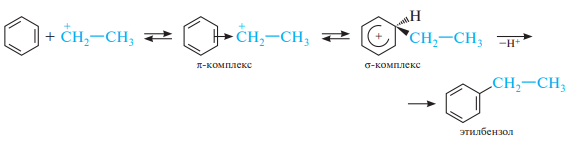
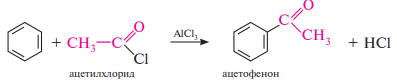
Ацилирование по Фриделю—крафтсу. Ацилированием называют процесс введения в молекулу органического соединения ацильной группы O R—C . Ацилирование бензола и его гомологов по Фриделю—Крафтсу обычно осуществляют галогенангидридами или ангидридами карбоновых кислот в присутствии кислот Льюиса. Данная реакция служит общим методом получения ароматических кетонов.