
- •Предмет, задачи общей и неорганической химии. Роль химии в естественных науках.
- •Основные понятия химии
- •Основные стехиометрические законы.
- •4. Важнейшие классы и номенклатура неорганических веществ.
- •5. Строение атома; развитие учения о строении атома; модели Томсона, Резерфорда, Бора.
- •6. Строение электронных оболочек атомов.
- •7. Периодический закон и периодическая система элементов.
- •8. Периодичность свойств химических элементов.
- •9. Природа химической связи. Основные типы химической связи.
- •10. Ковалентная химическая связь. Способы образования ковалентной связи. Основные характеристики.
- •11. Свойства ковалентной связи. Степень окисления атома.
- •12. Геометрия структур с ковалентным типом связи (гибридизация sp, sp2, sp3)
- •13. Основы метода валентных связей и метода молекулярных орбиталей.
- •14. Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие
- •15. Кристаллическое, жидкое и аморфное состояние веществ.
- •16. Скорость химических реакций. Константа скорости и ее физические свойства
- •17. Влияние температуры на скорость химических реакций. Основные положения теории активации Аррениуса.
- •18. Катализ. Влияние катализаторов на скорость химических реакций.
- •19. Необратимые и обратимые реакции. Принцип Ле Шателье.
- •20. Дисперсные системы и их характеристика. Коллоидные растворы
- •3. По агрегатному состоянию дисперсионной среды и дисперсной фазы.
- •21. Растворение как физико-химический процесс.
- •22. Растворимость веществ. Состав растворов.
- •23. Основные положения теории электролитической диссоциации.
- •24. Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •25. Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •26. Константа диссоциации слабых электролитов. Закон разбавления Оствальда
- •27. Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •28. Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •29. Произведение растворимости. Условия образования и растворения осадков
- •30. Гидролиз солей. Количественные характеристики гидролиза.
- •31. Теория окислительно-восстановительных реакций. Важнейшие окислители и восстановители. Составление уравнений окислительно-восстановительных реакций. Метод электронного баланса.
- •32. Ионно-электронный метод (метод полуреакций). Классификация окислительно-восстановительных реакций.
- •33. Электрохимические процессы. Электродный потенциал. Стандартные электродные потенциалы. Водородный электрод.
- •34. Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
- •35. Основные положения координационной теории. Строение комплексного соединения.
- •36. Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
- •37. Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
- •38. Галогены. Общая характеристика элементов. Особенности фтора. Свойства простых веществ галогенов.
- •39. Галогеноводороды. Галогениды. Особенности плавиковой кислоты. Соляная кислота. Роль соляной кислоты и хлоридов в живых организмах.
- •40. Кислородсодержащие соединения галогенов. Кислородные кислоты хлора и их соли. Хлорная известь. Бертолетова соль. Перхлораты. Кислородосодержащие кислоты брома, иода и их соли.
- •41. Общая характеристика элементов via группы. Особенности кислорода. Аллотропия и изоморфизм серы. Свойства простых веществ. Применение и биологическое значение халькогенов.
- •42. Гидриды типа н2э. Ассоциация молекул воды. Токсичность сероводорода и других халькогеноводородов, их физиологическое действие.
- •43. Вода. Клатраты. Вода как растворитель. Вода в природе и ее роль в жизнедеятельности организмов. Пероксид водорода.
- •44. Халькогениды. Растворимость и гидролиз сульфидов металлов. Полисульфиды.
- •45. Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
- •52. Фосфорные удобрения. Сложные минеральные удобрения.
- •1. Мышьяк
- •2. Сурьма
- •3. Висмут
- •54.Общая характеристика элементов iva группы. Способность
- •56.Кислородсодержащие соединения углерода. Оксиды углерода.
- •57. Угольная кислота и ее соли. Временная жесткость воды и
- •57.Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •59.Общая характеристика металлов. Общая характеристика валентных состояний металлов а и в групп. Значение и роль металлов в жизнедеятельности живых организмов.
57.Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
Слабая двухосновная кислота, известная в водных растворах, образующихся при растворении углекислого газа в воде. Кислота слабая очень непрочная, разлагается на углекислый газ и воду:
CO2+H2O↔H2CO3
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём равновесие сильно сдвинуто в сторону разложения кислоты.
Угольная кислота – слабая неустойчивая кислота, которую в свободном состоянии из водных растворов выделить нельзя.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию.
СВОЙСТВА УГОЛЬНОЙ КИСЛОТЫ
Угольная кислота диссоциирует ступенчато. На первой ступени образуется гидрокарбонат-ион и ион водорода:
H2CO3⇄HCO−3+H+.
Гидрокарбонат-ион частично распадается на карбонат-ион и ещё один ион водорода:
HCO−3⇄CO2−3+H+.
СОЛИ УГОЛЬНОЙ КИСЛОТЫ - КАРБОНАТЫ И ГИДРОКАРБОНАТЫ
Основным источником гидрокарбонатных и карбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, мергелей, доломитов, например:
CaCO3 + CO2 + H2O <–> Сa2+ + 2HCO3-;
MgCO3 + CO2 + H2O <–> Mg2+ + 2HCO3-.
Они легко разлагаются, выделяя углекислый газ и вновь образуя карбонат. Так возникают сталактиты и сталагмиты.
Среди карбонатов важное значение в технике играет известняк, сода: стиральная и питьевая.
Преимущественный тип связи в солях угольной кислоты - ионный (между катионами металла и карбонат- или гидрокарбонат-ионами). Карбонат-ион имеет форму правильного плоского треугольника.
Карбонаты относятся к средним солям, гидрокарбонаты - к кислым. Для них характерны общие свойства солей: они вступают в обменные реакции (протекают необратимо, в случае если образуется газ, осадок или малодиссоциирующее вещество).
При этом важно помнить:
угольная кислота неустойчива и всегда в уравнениях реакций записывается как CO2+H2O.
а) с сильными кислотами, качественная реакция на карбонаты и гидрокарбонаты:
Na2CO3+2HCl→2NaCl+H2O+CO2↑
NaHCO3+HNO3→H2O+CO2↑+NaNO3
б) с растворимыми солями и основаниям:
Na2CO3+Ba(OH)2→BaCO3↓+2NaOH
Na2CO3+CaCl2→CaCO3↓+2NaCl
в) реакции разложения:
Карбонаты металлов (кроме карбонатов натрия, калия, рубидия и цезия) при нагревании разлагаются:
CuCO3→tCuO+CO2
Гидрокарбонаты разлагаются с образованием карбонатов:
Ca(HCO3)2→t,∘CCaCO3↓+H2O+CO2↑
1) Для карбонатов характерны свойства средних солей: при пропускании углекислого газа из карбонатов образуются гидрокарбонаты (кислые соли):
CaCO3+CO2+H2O→Ca(HCO3)2
2) Для гидрокарбонатов характерны свойства кислых солей: реагируют со щелочами, образуя средние соли:
KHCO3+KOH→K2CO3+H2O
На разложении растворимых гидрокарбонатов кальция и магния при температуре основан метод уменьшения временной жесткости воды посредством кипячения.
Качественной реакцией на карбонат и гидрокарбонат ионы является их взаимодействие с сильной кислотой, наблюдается образование углекислого газа с характерным вскипанием:
Na2CO3+2HCl→2NaCl+H2O+CO2↑
CO32−+2H+→CO2+H2O
Вода, в которой содержание ионов Са2+ и Mg2+ незначительно, называется мягкой, вода с повышенным содержанием их - жесткой.
термический метод – кипячение воды.
При кипячении воды происходит разложение гидрокарбонатов кальция и магния с образованием углекислого газа и карбонатов этих металлов, которые выпадают в осадок:
Сa(HCO3)2 ![]() СaCO3
СaCO3 ![]() +
СО2
+
СО2![]() +
H2O,
+
H2O,
Mg(HCO3)2 MgCO3•H2O + СО2 .
Карбонаты осаждаются, и жесткость воды уменьшается. Также можно попробовать реагентное умягчение воды. В нее необходимо добавить кальцинированную соду или гашеную известь. При этом методе соли магния и кальция превращаются в нерастворимое соединение и выпадают в осадок. Оптимальным средством устранения жесткости считается ортофосфат натрия. Еще одним способом будет являться катионирование. В воду необходимо поместить ионообменную регулируемую загрузку. Чаще всего используют ионообменную смолу. При соприкосновении с водой она поглощает катионы солей. Забирая их у кальция, магния, железа и марганца, она отдает ионы натрия и водорода, а вода становится мягкой. Можно использовать обратный осмос. Нужно пропустить воду через полупроницаемые мембраны. При этом из воды уберутся большинство солей, в том числе и те, что отвечают за жесткость. Эффективность такого методашиногдаъдостигаетъпочтиъ100%. Жесткость, вызываемая содержанием в воде бикарбонатов кальция и магния, называется карбонатной или временной. Жесткость, обусловленная присутствием прочих солей кальция и магния и сохраняющаяся после кипячения воды, называется некарбонатной или постоянной.
Карбонат кальция (кальцит) - один из очень распространенных и важных минералов. Его судьба отражает сложные процессы, вызвавшие изменения в земной коре, особенно связанные с концентрацией углекислоты в гидросфере.
Ряд реакций, которые ведут от растворенного углекислого газа к карбонату, быстро достигает динамического равновесия, состояния, в котором прямой и обратный процессы этой реакции происходят с равными скоростями. Добавление кислоты увеличит скорость обратной реакции и образования диоксида углерода, что приведет к диффузии большего количества диоксида углерода из раствора. Добавление основания, с другой стороны, увеличит скорость прямой реакции, вызывая образование большего количества бикарбоната и карбоната. Любое давление на эту систему вызывает компенсирующий сдвиг в направлении, которое восстанавливает равновесие. Буферная система продолжает работать до тех пор, пока ее концентрация велика по сравнению с количеством кислоты или основания, добавленных в раствор
58.Кислородсодержащие соединения кремния. Диоксид кремния. Особенность силоксановой связи Si-O-Si. Применение кремнийсодержащих полимеров. Кремниевые кислоты и их соли. Природные силикаты. Алюмосиликаты. Искусственные силикаты. Стекло. Керамика. Цемент.
Диоксид кремния Si02 (кислотный оксид, ангидрид кремниевой кислоты) имеет атомную кристаллическую решетку: каждый атом кремния окружен четырьмя атомами кислорода а каждый атом кислорода — двумя атомами кремния. Имеет несколько кристаллических модификаций (все минералы), важнейшие — кварц, три- димит и кристобалит. Тугоплавкий, при медленном охлаждении расплава образуется аморфная форма — кварцевое стекло.
Электроотрицательность кремния значительно меньше, чем у углерода. Поэтому связи Si – O полярнее, чем связи С – О.
В
различных модификациях кремнезёма
прочность d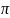 – p
-связей
неодинакова. Это влияет на величину
углов Si
– O
– Si
и расстояний Si
– O,
например угол связи Si
– O
– Si
в различных модификациях кремнезёма
изменяется от 120 до 180
– p
-связей
неодинакова. Это влияет на величину
углов Si
– O
– Si
и расстояний Si
– O,
например угол связи Si
– O
– Si
в различных модификациях кремнезёма
изменяется от 120 до 180 .
.
Оксид кремния(IV), или кремнезём SiO2 — твёрдое тугоплавкое вещество, нерастворимое в воде.
Oксид кремния(IV) образуется в виде пористого твёрдого вещества — силикагеля.
Химические свойства.
1. Практически не реагирует с водой. Реагирует со щелочами и плавиковой кислотой («травление» стекла):
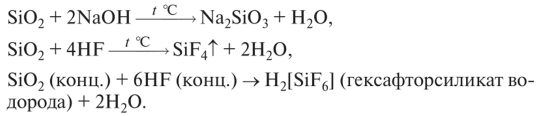
2. При сплавлении реагирует с основными оксидами, щелочами, карбонатами с образованием силикатов:

При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например, оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
Оксид кремния (IV) взаимодействует с неметаллами.
Например, оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
SiO2 + 2Н2 → Si + 2Н2O
Еще пример: оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
Кремнийорганические полимерные продукты (силиконы) находят применение во многих отраслях промышленности: в машино- и приборостроении, в электротехнике, строительстве, медицине, фармацевтике, производстве косметики, одежды, бумаги. Промышленность выпускает различные кремнийорганические продукты: мономеры и полимеры в виде жидкостей, лаков, смол, каучуков, а также композиции на их основе — пасты, вазелины, смазки, эмульсии, пластмассы. Силоксаны используются в качестве изоляционных материалов, антикоррозионных, приборных жидкостей, теплоносителей, покровных и защитных лаков и эмалей, смазочных материалов, и др. Применение их значительно улучшает качество материалов, увеличивает срок службы изделий и конструкций и в большинстве случаев дает заметный технико-экономический эффект. На основе кремнийорганических соединений готовят резины, предназначенные для работы в широком интервале температур, а также в условиях повышенной влажности, действия окислителей и при низком давлении. Высокомолекулярные каучуки широко применяются в авиационной, автомобильной, судостроительной и электротехнической промышленности, в электронике, фармацевтике и медицине. Низкомолекулярные каучуки могут быть использованы как термо- и влагостойкие электроизолирующие заливки для электроприборов, а также как термо- и вибростойкие прокладки для различных устройств. Кремнийорганические покрытия преимущественно применяют в строительстве для защиты кирпича, бетона, штукатурки от воздействия атмосферных факторов. Лаки и эмали используют для изоляции деталей оборудования в авиации, в радиотехнике и рентгеновском оборудовании, антеннах, аккумуляторных батареях и т. д. Кремниевые кислоты — очень слабые, малорастворимые в воде кислоты общей формулы nSiO2•mH2O. Из кремниевых кислот известны: метакремниевая H2SiO3, ортокремниевая H4SiO4, дикремниевые H2Si2O5 и H10Si2O9, пирокремниевая H6Si2O7 и поликремниевые nSiO2•mH2O. Соответствующие соли называют силикатами .
Кремниевая кислота настолько слабая, что её можно вытеснить из солей даже угольной кислотой:
Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3.
Кремниевая кислота настолько слабая, что её можно вытеснить из солей даже угольной кислотой:
Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3.
Кремниевая кислота не растворяется в воде, не диссоциирует, не изменяет окраску индикаторов. Как все кислоты, она реагирует с основными и амфотерными оксидами и гидроксидами. В результате реакций образуются соли силикаты
Из силикатов растворимы только соли щелочных металлов, и их называют растворимым или жидким стеклом. Силикаты натрия и калия входят в состав силикатного клея.
Силикаты – это, как правило, твердые и тугоплавкие вещества. Чтобы расплавить, их нужно нагреть до температур от 1000 до 2000 градусов Цельсия. Они не разлагаются под действием кислот и обычно не растворяются в воде.
Природные силикаты – минералы, такие как глина, асбест, слюда, роговая обманка, титанит, турмалин, гранат.
Наиболее распространенными являются кварц и группа полевых шпатов. Стекло, цемент, керамика, плавленые флюсы, кирпичи тоже являются силикатами, но характеризуются искусственным происхождением. Их изготавливают на основе глины, кварцевого песка, известняка, соды и других веществ, подвергая их различным способам обработки.
Алюмосиликаты, соли алюмокремниевых кислот, к которым в природе относится большая группа минералов класса силикатов. В кристаллич. структуре А. атомы алюминия, подобно атомам кремния, окружены четырьмя атомами кислорода (тетраэдрическая координация) и входят в состав анионной части.
Алюмосиликаты синтетические получают для технических целей из природных оксидов алюминия Al2O3 и кремния SiO2 и оксидов соответствующих металлов путём спекания или сплавления, а также гидротермальным синтезом (в автоклавах в перегретых водных растворах под давлением).
Синтетические алюмосиликаты обладают высокой механической прочностью, огнеупорностью, стойкостью к действию кислот и щелочей, а также окислителей и восстановителей, в том числе при высоких температурах.
Примером искусственного силикатного материала является портландцемент, один из наиболее распространенных видов минеральных вяжущих веществ. Цемент используется для связывания строительных деталей при получении массивных строительных блоков, плит, труб и кирпича. Цемент является основой таких широко применяемых строительных материалов, как бетон, шлакобетон, железобетон.
Его вяжущие свойства обусловлены способностью цементных минералов взаимодействовать с H2O и SiO2 и при этом затвердевать, образуя прочную камневидную структуру. При схватывании цемента происходят сложные процессы: гидратация минералов с образованием гидросиликатов и гидроалюминатов, гидролиз, образование коллоидных растворов и их кристаллизация. Исследования процессов твердения цементного раствора и минералов цементного клинкера сыграли большую роль в становлении науки о силикатах и их технологии.
Керамика. Кирпич, кафель, глиняная, фаянсовая посуда, осколки древнегреческой амфоры — все это керамика (от греческого «керамон» — глина). Сырьем для производства керамических изделий являются глина и минеральные добавки. Глина состоит из мельчайших кристаллов минерала каолинита Аl2О3 • 2SiO2 • 2НО2. Процесс изготовления керамики сводится к следующему: подготовка сырья, формовка, сушка, обжиг. При подготовке сырья глину смешивают с водой. При этом образуется тестообразная масса, способная сохранять приданную ей форму. После сушки и обжига изделие приобретает камневидное состояние. Керамическое производство развивается в трех направлениях: строительная керамика, керамика для быта, техническая керамика.
Стекло. Состав обычного оконного стекла выражается формулой Na2O • CaO • 6SiO2. Стекло получают в специальных печах спеканием соды, известняка и белого песка. Схематично химизм процесса можно показать таким образом:
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
SiO2 + CaCO3 = CaSiO3 + CO2↑
Na2SiO3 + CaSiO3 + 4SiO2 = Na2O • CaO • 6SiO2
Стекло открыто очень давно. Еще в IV тысячелетии до н. э. в некоторых странах Востока умели выплавлять стекло. Это твердый аморфный хрупкий прозрачный материал. Переход из жидкого состояния в твердое происходит постепенно, это дает возможность прокатывать стеклянную массу в листы, выдувать из нее различные изделия, получать нити, листовое стекло.
Стекла могут быть различными по составу. Если заменить соду на поташ К2СО3, получают специальное тугоплавкое стекло, которое идет на изготовление химической посуды. Если же заменить известняк на оксид свинца (II) РbО, а соду на поташ, то получится хрусталь — стекло с высоким коэффициентом преломления. Добавляя в стеклообразную массу различные оксиды, можно придавать стеклу различную окраску: оксид кобальта (II) СоО — синюю, оксид хрома (III) Сr2O3 — ярко-зеленую, оксид марганца (IV) МnO2 — красновато-лиловую и т. д.
Цемент. Сырьем для производства цемента являются глина и известняк. При их спекании происходит разложение известняка и образование силикатов и алюминатов кальция. Полученную массу (клинкер) перемалывают в зеленовато-серый порошок — портландцемент. При смешивании цемента с водой образуется тестообразная масса, которая со временем затвердевает. Происходит «схватывание» цемента.
