
- •Предмет, задачи общей и неорганической химии. Роль химии в естественных науках.
- •Основные понятия химии
- •Основные стехиометрические законы.
- •4. Важнейшие классы и номенклатура неорганических веществ.
- •5. Строение атома; развитие учения о строении атома; модели Томсона, Резерфорда, Бора.
- •6. Строение электронных оболочек атомов.
- •7. Периодический закон и периодическая система элементов.
- •8. Периодичность свойств химических элементов.
- •9. Природа химической связи. Основные типы химической связи.
- •10. Ковалентная химическая связь. Способы образования ковалентной связи. Основные характеристики.
- •11. Свойства ковалентной связи. Степень окисления атома.
- •12. Геометрия структур с ковалентным типом связи (гибридизация sp, sp2, sp3)
- •13. Основы метода валентных связей и метода молекулярных орбиталей.
- •14. Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие
- •15. Кристаллическое, жидкое и аморфное состояние веществ.
- •16. Скорость химических реакций. Константа скорости и ее физические свойства
- •17. Влияние температуры на скорость химических реакций. Основные положения теории активации Аррениуса.
- •18. Катализ. Влияние катализаторов на скорость химических реакций.
- •19. Необратимые и обратимые реакции. Принцип Ле Шателье.
- •20. Дисперсные системы и их характеристика. Коллоидные растворы
- •3. По агрегатному состоянию дисперсионной среды и дисперсной фазы.
- •21. Растворение как физико-химический процесс.
- •22. Растворимость веществ. Состав растворов.
- •23. Основные положения теории электролитической диссоциации.
- •24. Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •25. Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •26. Константа диссоциации слабых электролитов. Закон разбавления Оствальда
- •27. Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •28. Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •29. Произведение растворимости. Условия образования и растворения осадков
- •30. Гидролиз солей. Количественные характеристики гидролиза.
- •31. Теория окислительно-восстановительных реакций. Важнейшие окислители и восстановители. Составление уравнений окислительно-восстановительных реакций. Метод электронного баланса.
- •32. Ионно-электронный метод (метод полуреакций). Классификация окислительно-восстановительных реакций.
- •33. Электрохимические процессы. Электродный потенциал. Стандартные электродные потенциалы. Водородный электрод.
- •34. Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
- •35. Основные положения координационной теории. Строение комплексного соединения.
- •36. Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
- •37. Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
- •38. Галогены. Общая характеристика элементов. Особенности фтора. Свойства простых веществ галогенов.
- •39. Галогеноводороды. Галогениды. Особенности плавиковой кислоты. Соляная кислота. Роль соляной кислоты и хлоридов в живых организмах.
- •40. Кислородсодержащие соединения галогенов. Кислородные кислоты хлора и их соли. Хлорная известь. Бертолетова соль. Перхлораты. Кислородосодержащие кислоты брома, иода и их соли.
- •41. Общая характеристика элементов via группы. Особенности кислорода. Аллотропия и изоморфизм серы. Свойства простых веществ. Применение и биологическое значение халькогенов.
- •42. Гидриды типа н2э. Ассоциация молекул воды. Токсичность сероводорода и других халькогеноводородов, их физиологическое действие.
- •43. Вода. Клатраты. Вода как растворитель. Вода в природе и ее роль в жизнедеятельности организмов. Пероксид водорода.
- •44. Халькогениды. Растворимость и гидролиз сульфидов металлов. Полисульфиды.
- •45. Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
- •52. Фосфорные удобрения. Сложные минеральные удобрения.
- •1. Мышьяк
- •2. Сурьма
- •3. Висмут
- •54.Общая характеристика элементов iva группы. Способность
- •56.Кислородсодержащие соединения углерода. Оксиды углерода.
- •57. Угольная кислота и ее соли. Временная жесткость воды и
- •57.Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •59.Общая характеристика металлов. Общая характеристика валентных состояний металлов а и в групп. Значение и роль металлов в жизнедеятельности живых организмов.
54.Общая характеристика элементов iva группы. Способность
углерода к образованию гомоатомных цепей Э-Э и кратных связей.
Гетероцепи Si-O-Si. Простые вещества. Строение и свойства аллотропных
модификаций углерода. Строение и физические свойства кремния, германия,
олова и свинца. Роль в биологических процессах.
Общая характеристика элементов IVA группы
Элементы группы IVA
Символ элемента |
C |
Si |
Ge |
Sn |
Pb |
Русское название |
Углерод |
Кремний |
Германий |
Олово |
Свинец |
Латинское название |
Carboneum |
Siliclum |
Germanium |
Stannum |
Plumbum |
Год открытия |
Известен с древних времен |
1811 |
1886 |
Известен с древних времен |
Известен с древних времен |
Автор открытия |
- |
Ж. Л. Гей-Люссак, Л. Ж. Тернер |
К. А. Вииклер |
- |
- |
Содержание в земной коре, массовая доля, % |
0,14 |
27,6 |
7.10-4 |
4.10-3 |
1,6.10-3 |
Основные природные соединения (в скобках - названия минералов) |
В свободном состоянии – алмаз, графит; в связанном – уголь, нефть, карбонаты и т.д. |
SiO2(кремнезем); полевые шпаты А [AlSi3O8], где А=Na, K, Ba |
Ag8GeS6 (аргиродит); Сu3(Fe, Ge)S4 (германит) |
SnO2 (класситерит); Cu2FeSnS4 (станнин) |
PbS (галенит); PbSO4(англезит); PbCO3 (церуссит) |
Электронные конфигурации атомов в основном состоянии
6С – 1s22s22p2
14Si – 1s22s22p63s23p2
32Ge – 1s22s22p63s23p63d104s24p2
50Sn – 1s22s22p63s23p63d104s24p64d105s25p2
82Pb – 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p2
Строение внешних электронных оболочек атомов
ns np
↑↓ |
↑ |
↑ |
|
n(номер периода) = 2, 3, 4, 5, 6
Атомные характеристики элементов
|
|
|
|
|
|
|
Элемент |
С |
Si |
Ge |
Sn |
Pb |
Атомный номер |
6 |
14 |
32 |
50 |
82 |
Массовые числа природных изотопов (в скобках – массовая доля, %, в природной смеси) |
12(98,89) 13(1,11) |
28(92,27) 29(4,68) 30(3,05)
|
70(20,55) 72(27,37) 73(7,67) 74(36,75) 76(7,67) |
116(14,24) 117(7,57) 118(24,01) 119(8,58) 120(32,97) 122(4,71) 124(5,98) |
204(1,48) 206(23,6) 207(22,6) 208(52,3) |
Относительная атомная масса |
12,011 |
28,0855 |
72,61 |
118,710 |
207,2 |
Ковалентный радиус атома, нм |
0,077 |
0,118 |
0,122 |
0,141 |
0,154 |
Металлический радиус атома, нм |
0,091 |
0,134 |
0,139 |
0,162 |
0,175 |
Радиус иона, нм, Э2+* Э4+ |
- 0,016 |
- 0,040 |
0,093 0,053 |
0,112 0,071 |
0,119 0,078 |
Первый потенциал ионизации, В |
11,2604 |
8,1517 |
7,900 |
7,3439 |
7,4168 |
Сродство к электрону, эВ |
1,27 |
1,36 |
1,74 |
1,03 |
1,03 |
Электроотрицательность |
2,50 |
1,74 |
2,02 |
1,72 |
1,55 |
Степени окисления элемента в соединениях** |
-4, +2, +4 |
-4, +2, +4 |
+2, +4 |
+2, +4 |
+2, +4 |
*Здесь Э = С, Si, Ge, Sn, Pb. **Наиболее характерные степени окисления выделены
Способность углерода к образованию гомоатомных цепей Э-Э и кратных связей.
Как углерод образует кратные связи? sp2 - гибридизация атома углерода
13 июня
570 дочитываний
50 сек.
В предыдущей серии мы рассмотрели теорию гибридизации атома углерода и первый вид гибридизации - sp3. Прежде чем приступать к работе над материалом данной статьи настоятельно рекомендую освежить в памяти основные моменты предыдущей части.
Итак, как мы уже говорили о том, что в sp3-гибридизации участвуют одна s- и три p- электронных орбитали внешнего энергетического уровня возбуждённого состояния атома углерода (об этом Вы можете прочесть здесь).
А что, если в гибридизации, в выравнивании электронных орбиталей по энергии, примет участие меньшее число электронных орбиталей?
Мы получим другие виды гибридизации. Так в sp2-гибридизации участвует одна s- и 2 p- электронных орбитали:
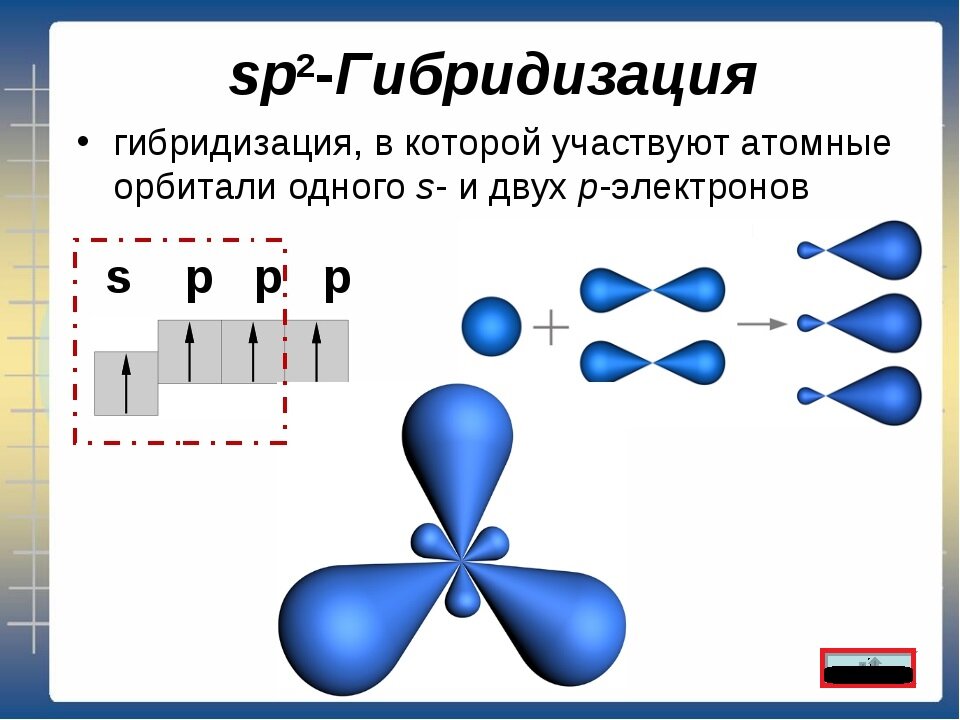
Как результат - три sp2 - электронных орбитали с гибридным электронным облаком
При этом одна p-электронная орбиталь остаётся негибридизованной и сохраняет классическую гантелеобразную форму электронного облака.
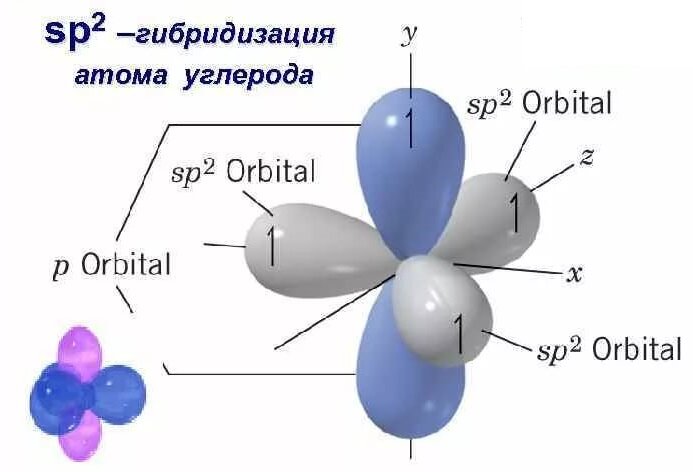
Электронная "картина" sp2-гибридного атома углерода
А электронная конфигурация sp2-гибридного атома углерода принимает вид:
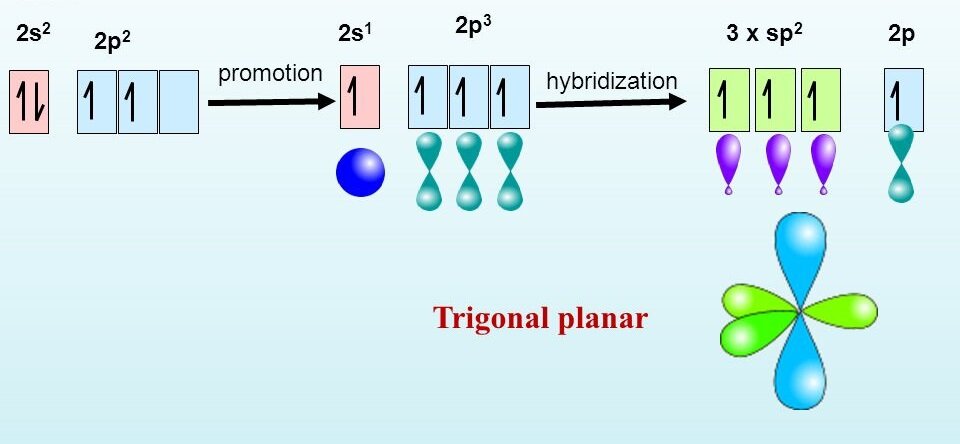
Негибиридизованная p-электронная орбиталь занимает перпендикулярное положение по отношению к трём гибридным sp2-электронным орбиталям.
Чтобы понять, в каком случае мы имеем дело с sp2-гибридным атомом углерода, познакомимся с молекулой такого вещества, как этилен:
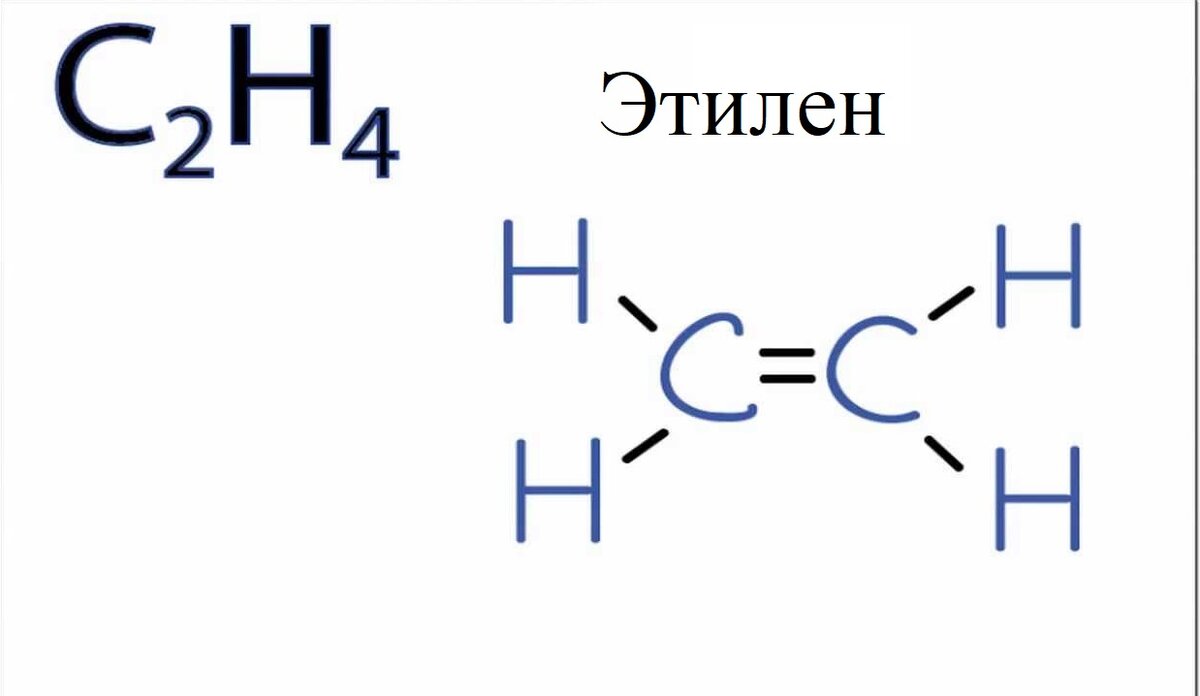
Слева - молекулярная формула этилена, справа - структурная
Между двумя атомами углерода в составе этилена мы наблюдаем наличие двойной связи. Интересный момент заключается в том, что каждая из этих двух связей между атомами углерода в составе этилена имеет разное происхождение.
Так одна связь образована за счёт перекрывания двух sp2-гибридных электронных орбиталей, а вторая - за счёт перекрывания негибридизованных p-электронных орбиталей:
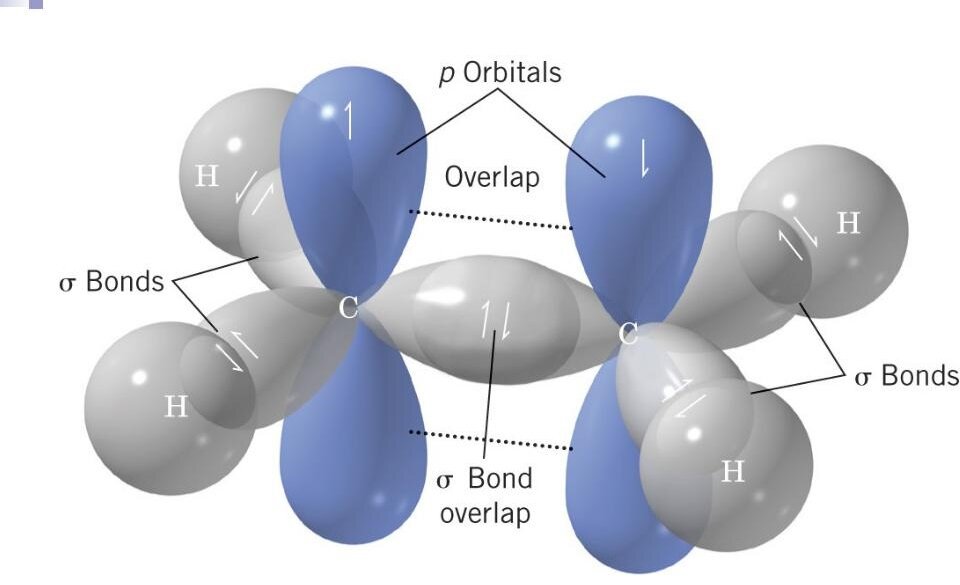
Электронное строение молекулы этилена
То есть, в составе обозначенной двойной связи одна образована за счёт перекрывания электронных орбиталей на прямой, соединяющей центры атомов - это так называемая сигма-связь, а вторая - за счёт перекрывания негибирдных p-электронных орбиталей вне плоскости молекулы - это так называемая пи-связь.

Слева - прописная буква сигма, справа - пи
Таким образом мы рассмотрели пример образования кратной связи, в данном случае двойной связи. Определили, что внутри этой кратной двойной связи каждая из связей отличается друг от друга по происхождению, а в дальнейшем мы скажем, что и по свойствам, в связи с чем этим связям даже присвоены разные названия - сигма и пи.
В следующих частях мы поговорим, за счёт чего возможно образование кратной тройной связи, познакомимся с молекулой ацетилена и разберёмся, в чём же принципиальное отличие связей, обозначенных как сигма и пи.
Гетероцепи Si-O-Si.
Особая роль в структурах силикатов принадлежит связям Si-O и Si-O-Si (силоксановая связь).
Связь Si-O является ковалентно-ионной с преобладанием доли ковалентной связи. По данным Л.Полинга, ионность связи в SiO2 составляет около 35 %. У.Брэгг на основе рентгеноструктурных исследований кварца SiO2 оценивает эффективный заряд атомов кислорода -1е-, а кремния – +2е-. На преимущественное преобладание в SiO2 ковалентной связи указывают также данные о распределении электронной плотности, отсутствие заметной электрической проводимости в кристаллических модификациях SiO2 и кварцевом стекле.
Рис. 2.13. Схема распределения электронов в атоме кремния
Атом кремния в невозбужденном состоянии имеет электронную конфигурацию 1s22s22p63s23p2. Схема распределения электронов в атоме кремния показана на рис. 2.13. В возбужденном состоянии кремний имеет 4 неспаренных электрона – один на 3s и три на 3р орбитах, что отвечает состоянию 1s22s22p63s13p3. Устойчивое валентное состояние соответствует sp3-гибридизаци валентных орбиталей. При этом у атома кремния остаются незанятыми электронами все 3d-орбитали (5 квантовых ячеек).
В некоторых соединениях кремний использует часть 3d-орбиталей, но не более двух. Поэтому координационное число кремния не превышает шести.
У атома кислорода энергетические уровни 2s- и 2р-орбиталей близки друг к другу, что способствует их гибридизации, причем возможными вариантами для атома кислорода являются sp3-, sp2- и sp-гибридизации орбиталей, а в образовании связей могут принимать участие все шесть электронов внешнего (второго) электронного слоя. В этом слое у атома кислорода находятся два неспаренных электрона, которые могут образовывать связь по обменному механизму, и две пары спаренных электронов. Последние могут образовывать связь по обменному механизму, однако для этого у атомов-партнеров по связи должны иметься свободные орбитали. Такими орбиталями у атома кремния могут служить вакантные 3d-орбитали.
При образовании связи с кислородом атом кремния использует свои 4 гибридные связи sp3-орбиталей, тетраэдрически расположенные в пространстве. За счет перекрывания этих орбиталей с одной из двух 2р-орбиталей атома кислорода с неспаренными электронами образуются четыре равноценные одинарные -связи, т.е. возникает тетраэдрическая группа [SiO4] с углом связи Si-O, равным 109о28, причем каждый кислород использует на эту связь один из своих неспаренных электронов на 2р-орбитали.
Фактическое межъядерное расстояние Si-O, т.е. длина связи в различных силикатах, меньше суммы ковалентных и ионных радиусов кремния и кислорода. С квантово-механической позиции сокращение длины связи Si-O объясняется образованием дополнительной прочной p-d связи с использованием спаренных пар электронов 2р-орбитали атома кислорода и свободных d-орбиталей атома кремния, т.е. повышением кратности связи Si-O.
В ряде вполне устойчивых фаз кремний оказывается пятикоординированным. В соединениях, содержащих группу [SiA5], первая координационная сфера атома кремния содержит по меньшей мере один высокоотрицательный атом (не считая кислорода), такой как углерод, азот, хлор или фтор. В фазах, содержащих пятикоординированный кремний, координационный полиэдр обычно представляет слегка искаженную тригональную бипирамиду.
Простые вещества
Основные физико-химические свойства
|
Элемент |
С |
Si |
Ge |
Sn |
Pb |
|
|||||
|
Основная форма существования при обычных условиях. Цифрами обозначены номера аллотропных модификаций (в скобках – тип кристаллической решетки) |
Неметалл с атомной кристаллической решеткой
|
Неметалл с кристаллической решеткой (кубическая типа алмаза) |
Элемент атомной кристаллической решеткой (кубическая типа алмаза) |
Металл 1. α-Модификация (кубическая типа алмаза). 2. Β-Модификация(тетрагональная) (выше 140С) |
Металл (кубическая гранецентрированная) |
|
|||||
|
Цвет |
|
Серебристо-серый с металлическим блеском |
Серовато-белый |
|
Синевато-серый |
|
|||||
|
Плотность p, г/см3 (293 К) |
|
2,328 |
5,323 |
|
11,336 |
|
|||||
|
Температура плавления tпл., 0С |
3547 |
1410 |
937 |
231,7 |
327,4 |
|
|||||
|
Температура кипения tкип.,0С |
4827 (суб.) |
2355 |
2830 |
2270 |
1740 |
|
|||||
|
Удельное электрическое сопротивление p*, мкОм∙м |
|
2,3∙102 |
6∙102 |
2. 0,135 |
0,24 |
|
|||||
Относительная электропроводность* (Hg – 1) |
|
_ |
_ |
2,72 |
4,0 |
|||||||
Стандартная энтальпия атомизации элементов 0298, кДж/(моль ∙К) |
715,6 |
468,9
|
383,1 |
301,4 |
196,1 |
|||||||
Стандартная энтропия S0298 , Дж/(кг ∙ К) |
|
18,95 |
31,09 |
|
64,81 |
|||||||
Удельная теплоемкость с0p , Дж/(кг ∙ К) |
|
714 |
323 |
|
127,6 |
|||||||
Стандартный электродный потенциал E0,В , процессов Э4+ + 4e-= Э Э2+ +2e- = Э |
─ ─ |
_ - 0,808 |
_ - 0,247 |
0,009 - 0,13 |
0,80 - 0,126 |
|||||||
*Данный приведены для температуры 298
**Существует в форме двух линейных структур вида ─ С ( полимин, α-карбин ) и (поликумулен, β-ккарбин)
Способы получения. Углерод в форме древесного угля известен с древних времен. Он может быть получен при нагревании древесины без доступа воздуха, при обугливании животных остатков, неполном сгорании органических соединений (сажа). Графит и алмаз встречаются в природе, но в последнее время в основном их получают искусственным путём: графит – из смеси кокса и каменноугольной смолы, а алмаз – при очень высоком давлении и температуре из графита.
Карбин получают синтетически при каталитическом окислении ацетилена и является наиболее стабильной формой углерода, а алмаз –наименее стабильная форма.
В 1990 г. из сажи, образованной при испарении графита в электрической дуге в атмосфере гелия, была выделена еще одна новая форма углерода, так называемые фуллерены. Это многогранники (своеобразные круглые молекулы), содержащие от 60 до 110 и более атомов углерода. Наиболее изученным является фуллерен С60, состоящий, как и футбольный мяч, из 13 пятиугольников и 20 шестиугольников.
Si – восстановление из SiO2 магнием:
SiO2+Mg→ t Si+2MgO
или углеродом в электрической печи:
SiO2+2C→ t Si+2CO.
Высокой чистоты Si получают восстановлением SiCI4 цинком или водородом:
SiCI4+2Zn→ t Si+2ZnCI2 .
Ge, Sn и Pb – термическое восстановление их оксидных соединений с помощью H2, C, CO:
GeO2+2H2 → t Ge+2H2O ,
SnO2+2C→ t Sn+2CO ,
PbO+CO → t Pb+CO2 .
Химические свойства. По химическим и физическим свойствам углерод и образуемые их соединения резко отличаются от остальных элементов группы.
Будучи типичным неметаллом, углерод в форме простого вещества, а также в соединениях с кислородом, азотом и серой способен образовывать кратные связи в группах типа С=С , ─С≡C─ , C=0, О=С=О, ─С≡N, C=S.
Для Siи Ge соединений с подобными группировками не установлено. Sn и Pb образуют соединения, характерные для металлов.
При обычных условиях все аллотропные модификации углерода весьма инертны, другие элементы группы химически достаточно активны и взаимодействуют со многими веществами, как простыми, так и сложными. При увеличении температуры химическая активность всех веществ, образованных элементами группы, резко возрастает.
В соединения углерод и кремний проявляют степени окисления -4, +2, +4, Ge, Snи Pb уменьшается.
Реакции с простыми веществами
С → карбиды;
Si → силициды;
Ge, Sn, Pb → сплавы
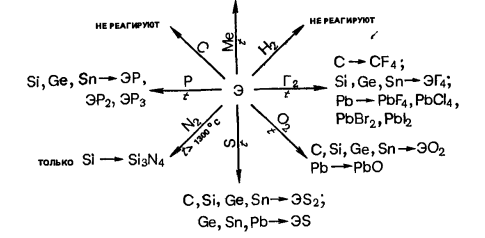
Реакции с важнейшими реагентами.
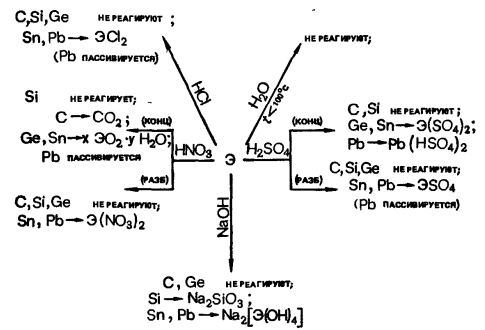
Si+H2O → SiO2+H2 ,
Si+2NaOH+H2O → Na2SiO3+2H2 ,
Sn+NaOH → Na2SnO2+H2O ,
Ge+4HNO3(конц) → GeO2+4NO2+2H2O ,
3Pb+8HNO3(разб) → 3Pb(NO3)2+2NO+4H2O ,
Sn+4H2SO4(конц) → Sn(SO4)2+2SO2+4H2O ,
Pb+3H2SO4(конц) → Pb(HSO4)2+SO2+2H2O .
Строение и свойства аллотропных модификаций углерода.
Соединения, образованные атомами углерода, но отличающиеся строением и свойствами, называются аллотропными модификациями углерода. Основными модификациями углерода являются графит, алмаз, карбин.
Классификация
Возможность присоединять четыре атома делает углерод активным элементом. Помимо присоединения атомов других элементов углерод может образовывать различные модификации, отличающиеся структурой и свойствами.
Рис. 1. Строение атома углерода.
Выделяют два вида углерода в зависимости от образования модификаций:
кристаллический – входит в состав твёрдых веществ;
аморфный – образует мягкие вещества.
Кристаллические формы углерода:
Скрыть объявление
алмаз;
лонсдейлит;
наноалмаз;
графит;
графен;
карбин;
фуллерены;
фуллерит;
углеродное волокно;
углеродные нановолокна;
углеродные нанотрубки.
В соответствии с геометрическим строением кристаллической решётки выделяют три типа аллотропных модификаций:
тетраэдрическая (sp3-гибридизация) – один атом углерода, находящийся в центре, связан с атомами в узлах тетраэдра;
тригональная (sp2-гибридизация) – атомы углерода образуют шестиугольники, связанные друг с другом послойно;
линейная (sp-гибридизация) – атомы углерода образуют цепочки, связанные одинарными, двойными, тройными связями.
Образовака 🧪 Химия 9 класс Неметаллы
Аллотропные модификации углерода
Соединения, образованные атомами углерода, но отличающиеся строением и свойствами, называются аллотропными модификациями углерода. Основными модификациями углерода являются графит, алмаз, карбин.

Классификация
Возможность присоединять четыре атома делает углерод активным элементом. Помимо присоединения атомов других элементов углерод может образовывать различные модификации, отличающиеся структурой и свойствами.

Рис. 1. Строение атома углерода.
Выделяют два вида углерода в зависимости от образования модификаций:
кристаллический – входит в состав твёрдых веществ;
аморфный – образует мягкие вещества.
Кристаллические формы углерода:
Скрыть объявление
алмаз;
лонсдейлит;
наноалмаз;
графит;
графен;
карбин;
фуллерены;
фуллерит;
углеродное волокно;
углеродные нановолокна;
углеродные нанотрубки.
В соответствии с геометрическим строением кристаллической решётки выделяют три типа аллотропных модификаций:
тетраэдрическая (sp3-гибридизация) – один атом углерода, находящийся в центре, связан с атомами в узлах тетраэдра;
тригональная (sp2-гибридизация) – атомы углерода образуют шестиугольники, связанные друг с другом послойно;
линейная (sp-гибридизация) – атомы углерода образуют цепочки, связанные одинарными, двойными, тройными связями.
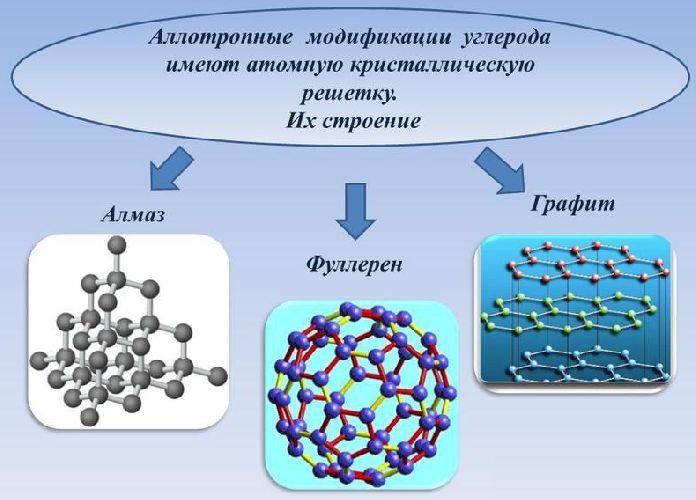
Рис. 2. Строение кристаллических решёток углерода.
Аморфный углерод образует следующие модификации:
активированный уголь;
древесный уголь;
ископаемый уголь;
кокс каменноугольный;
стеклоуглерод;
углеродная нанопена;
техуглерод;
сажа.
Лонсдейлит является гексагональной модификацией алмаза. Наноалмазы, фуллерены, нанотрубки, нанографиты объединены в семейство наноуглеродных кластеров. Они образованы вложенными друг в друга углеродными сферами.
Основные модификации
Наиболее изучены твёрдые формы углерода – алмаз, графит и карбин. Особенности строения и свойства аллотропных модификаций углерода представлены в таблице.
Модификация |
Строение решётки |
Свойства |
Применение |
Графит |
Тригональное |
Относительно мягкий жирный минерал, обладающий электропроводностью. Имеет серый цвет, металлический блеск. Плотность – 2,23 г/см3. Не плавится. Реагирует со щелочными металлами, солями, кислородом |
Смазка в прокатном производстве. За счёт отслоения тригональной решётки используется в качестве стержня карандаша |
Карбин |
Линейное |
Мелкокристаллический порошок с небольшой плотностью. Полупроводник |
Используется в фотоэлементах |
Алмаз |
Тетраэдрическое |
Прозрачный минерал, обладающий наибольшей твёрдостью. Обладает теплопроводностью, является полупроводником. Имеет большой показатель преломления. Плавится при температуре 3700°C |
Драгоценный камень, абразив. Из алмаза изготавливают свёрла, ножи, резцы |

Рис. 3. Графит, карбин и алмаз.
При сильном нагревании графит переходит в алмаз, а алмаз – в графит.
Строение и физические свойства кремния, германия, олова и свинца.
Т а б л и ц а 1. Свойства углерода, кремния, германия, олова и свинца.
Свойство |
C |
Si |
Ge |
Sn |
Pb |
Атомный радиус, нм |
0,077 |
0,118 |
0,139 |
0,158 |
0,175 |
Плотность, г/см3 |
3,51 (алмаз) |
2,33 |
5,35 |
b-Sn 7,29 a-Sn 5,85 |
11,34 |
Относительная электроотрицательность по шкале Полинга (по шкале Олдреда-Рохова) |
2,55 (2,50) |
1,90 (1,74) |
2,01 (2,02) |
1,96 (1,72) |
2,33 (1,55) |
Твёрдость по шкале Мооса* |
10 |
7 |
6,3 |
1,8 |
1,5 |
Температура плавления, 0С |
|
1415 |
958,5 |
231,8 |
327,4 |
Температура кипения, 0С |
|
3249 |
2700 |
2362 |
1725 |
Сравнительная электропроводность (Hg=1) |
- |
полупро- водник |
полупро- водник |
7,2 |
4,6 |
Потенциал ионизации, эВ: Э0 Þ Э+ + е- Э+ Þ Э2+ + е- Э2+ Þ Э3+ + е- Э3+ Þ Э4+ + е- |
11,26 24,38 47,87 64,19 |
8,15 16,34 33,46 45,13 |
8,13 15,95 34,20 45,70 |
7,30 14,56 30,70 39,40 |
7,42 14,91 31,97 42,10 |
Стандартные ОВ потенциалы, В Э2+ + 2е- Þ Э0 ЭО2 + 4Н+ + 4е - Þ Э0 + 2Н2О ЭО2 + 4Н+ + 2е - Þ Э2+ + 2Н2О |
- +0,169 - |
- -0,86 - |
+0,247 -0,15 -0,3 |
-0,14 -1,06 +0,125 |
-0,125 +0,666 +1,47 |
Валентность |
(II),(III), IV |
(II), IV, VI |
(II), IV, VI |
II, IV, VI |
II, (IV), (VI) |
Содержание в земной коре, мас.% |
0,48 |
27,6 |
7,0×10-4 |
8,0×10-3 |
1,6×10-3 |
Массовые числа природных изотопов |
12, 13 |
28, 29, 30 |
74, 72, 70, 73, 76 |
120, 118, 116, 119, 117, 124, 122, 112, 114, 115 |
208, 206, 207, 204 |
* Шкала твёрдости минералов предложенная немецким учёным Фридрихом Моосом. В ней минералы группируются в соответствии с относительной твёрдостью по десятибалльной шкале. Каждый минерал, занимающий определённое место на шкале, царапается минералами, стоящими выше него, т. е. более твёрдыми. Так алмаз (твёрдость 10) царапает рубин (9), рубин царапает топаз (8), топаз царапает кварц (7) и т. д.. Минералы с твёрдостью 1 и 2 считаются мягкими, 3–6 – средней твёрдости, выше 6 – твёрдыми.
Применение и биологическая роль
Углерод наиболее широко применяется в металлургии как восстановитель в доменном процессе. В атомной энергетике и электротехнике используется графит.
Кремний находит применение в так называемых кремниевых приборах (радиоэлектроника, вычислительная техника, оптика, электротехника и т.д.).
Карбид кремния SiC по твердости уступает только алмазу, в связи с чем используется как образцовый материал, а также как полупроводниковый. Широко применяется кварцевое стекло SiO2 . Кремний входит в состав многих сплавов железа и цветных металлов.
Германий используется в качестве полупроводникового материала. На основе GeO2 готовят специальные оптические стекла.
Олово применяется для производства различных сплавов и белой жести для консервной промышленности.
Свинец используется в свинцовых аккумуляторах, в производстве кабелей и химической промышленности в качестве защитного покрытия, в антифрикционных и типографических сплавах, а атомной энергетике и рентгенотехнике как поглотитель излучений. Оксид свинца используется при производстве красок и хрусталя.
Углерод – главный элемент всех органических соединений, известен на земле и в космосе. Благодаря углероду возникло все богатство и разнообразие видов растений и животных. На углеродной основе построена вся жизнь в биосфере.
Кремний играет большую роль в биологической круговороте, никакой организм не может существовать без кремния. Избыток и недостаток кремния в организме болезненно сказывается на его развитии.
Германий и олово являются биологически активными элементами, однако их физические и биохимические свойства изучены пока недостаточно.
Велика также биогенная роль свинца. Он входит в состав многих растений и животных (от тысячных до миллионных долей процента). Вместе с тем соединения свинца ядовиты и при длительном взаимодействии даже следовых количеств может привести к тяжелым заболеваниям, так как избыточный свинец накапливается в организме.
55.Гидриды типа ЭН4.
Ввиду близости значений ЭО связи Э-Н являются ковалентными, малополярными. Гидриды ЭН4 при обычных условиях представляют собой газы, плохо растворимые в воде.
СН4 - метан; SiH4 - силан; GeH4 - герман; SnH4 - станнан; PbH4 - не получен.
Прочность молекул ↓
Химическая активность ↑
Восстановительная способность ↑
Метан химически малоактивен, остальные гидриды очень реакционноспособны, они полностью разлагаются водой с выделением водорода:
ЭН4 + 2Н2O = ЭO2 + 4Н2↑
ЭН4 + 6Н2O = Н2[Э(ОН)6] + 4Н2↑
Гидриды ЭН4 получают косвенным путем, так как прямой синтез из простых веществ возможен только в случае СН4, но и эта реакция протекает обратимо и в очень жестких условиях.
Обычно для получения гидридов используют соединения соответствующих элементов с активными металлами, например:
Аl4С3 + 12Н2O = ЗСН4↑ + 4Al(OH)2
Mg2Si + 4HCl = SiH4↑ + 2MgCl2
Углерод с водородом, кроме СН4, образует бесчисленное множество соединений СxНy - углеводородов (предмет изучения органической химии).Получены также кремневодороды и германоводороды общей формулы ЭnН2n+2. Практического значения не имеют.
По значимости 2 элемента главной подгруппы IV группы занимают особое положение. Углерод является основой органических соединений, следовательно - главным элементом живой материи. Кремний - главный элемент всей неживой природы.
