
Цитология (Э.К.Гасымов)
.pdf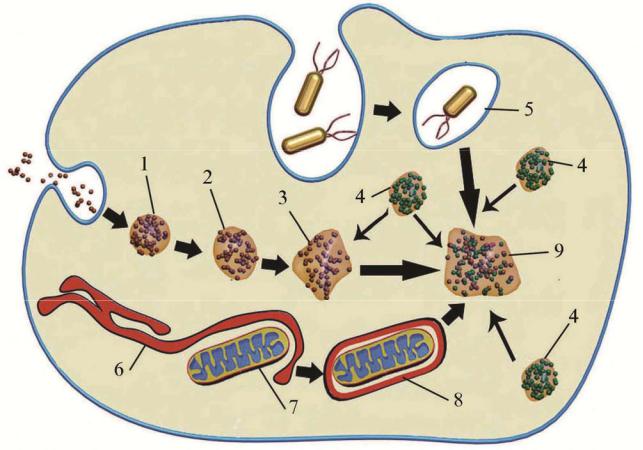
151
белков, имеющих кислые свойства и богатых олигасахаридами, благодаря чему они оказываются устойчивыми к воздействию протеаз. Еще одной особенностью мембран, окружающих лизосомы и поздние эндосомы, является наличие в них, наряду с холестерином, большого количества редко встречающегося фосфолипида –
лизобифосфатидной кислоты.
Тот факт, что лизобифосфатидная кислота располагается в основном на внутренней поверхности мембраны, свидетельствует о том, что она является устойчивой к гидролитическому воздействию ферментов, расположенных в стенках лизосом и поздних эндосом.
В норме оболочка, окружающая лизосомы и поздние эндосомы препятствует поступлению в цитозоль гидролаз, находящихся в их полости. Важную роль в защите цитоплазматических структур от воздействия лизосомальных ферментов играет также нейтральная среда (рН7.0-7.3) цитозоля, которая резко снижает активность гидролаз.
Однако при воздействии на организм определенных факторов (высокая температура, ионизированное облучение, гипоксия, частицы пыли, некоторые канцерогены, некоторые лекарственные средства и т.д.), нарушается проницаемость мембраны лизосом, в результате чего активные гидролазы поступают в цитозоль и являются причиной как функциональных изменений в клетке, так и ее смерти. Также предполагается, что дегенеративные изменения, именуемые аутолизом, протекающие в клетке после биологической смерти, образуются в результате воздействия лизосомальных ферментов. Не случайно, что некоторые авторы называют лизосомы “бочкой-самоубийцей”.
152
Рис.4.23. Взаимоотношение первичных и вторичных лизосом со структурами, сформировавшихся при эндоцитозе, фагоцитозе и аутофагии. Схема.
1- эндоцитоз; 2- первичная эндосома; 3- зрелая эндосома; 4- первичная лизосома; 5- гетерофагосома; 6- гладкая ЭПС; 7- митохондрия; 8- аутофагосома; 9- вторичная лизосома.
Лизосомы участвуют в клеточном переваривании производных как экзогенной (поступившие в цитоплазму извне) так и эндогенной (составляющие части цитоплазмы) природы (рис.4.23). Первый процесс именуется –гетерофагией, а второй – аутофагией. В обоих процессах материал, подвергаемый расщеплению находится в цитоплазме в виде структур окруженных оболочкой – фагосом, соответственно гетерофагосом и аутофагасом. С момента когда одна или несколько первичных лизосом соединяются с гетероили аутофагасомами и высвобождают активированные ферменты гидролаз в их полость, начинается процесс внутриклеточного пищеварения. В это время при электоронной микроскопии в цитозоле обнаруживаются имеющие гетерогенную структуру фаголизосомы (различной формы и плотности) – вторичные лизосомы (рис. 4.23).
Конечные продукты расщепления биополимеров, образовавшиеся под воздействием гидролаз, поступают в цитозоль при помощи белков-переносчиков, расположенных в мембране фаголизосом и используются в синтезе новых биологических макромолекул. После завершения процесса переваривания в составе лизосом остаются не подвергшиеся перевариванию остатки: липидные пигменты, миелиноподобные тельца, асбест, частицы силиката, обломки клетки и т.д., которые называются остаточные тельца. Т.к. остаточные материалы в них постепенно уплотняются, остаточные тельца имеют более маленькие по сравнению с фаголизосомами размеры. Материал, находящийся в полости остаточных телец либо выводятся из клетки при помощи экзоцитоза, либо, соединяясь друг с другом, скапливается в виде агрегатов различимых в световой микроскоп. Примером могут служить богатые липидами и имеющие желтовато-золотистый оттенок гранулы липофусцина (пигмент старения), обнаруживающиеся в клетках с продолжительным сроком жизни (нервные клетки, клетки печени и сердечной мышцы).
В составе гетерофагосом, образовавшихся при помощи эндоцитоза, обнаруживаются бактерии, грибки, клетки окончившие жизнедеятельность, частицы клеток, утративших свою целостность, межклеточные структуры, частицы пыли и т.д. А в составе аутофагосом наряду с веществами растворенными в цитозоле, обнаруживаются также гранулы гликогена, рибосомы, части шероховатой эндоплазматической сети и т.д. Аутофагосомы в цитозоле образуются при помощи двух способов: микроаутофагии и макроаутофагии.
Во время микроаутофагии в отдельных местах мембраны эндосом или лизосом образуются пузырьки или впячивания с веществами растворенными в окружающем цитозоле.
А во время макроаутофагии относительно крупные образования расположенные в цитозоле (см.выше), окутываясь при помощи выростов периферических участков гладкой эндоплазматической сети, образуют аутофагосому, окруженную со всех сторон двухслойной мембраной.
153
Имеется еще один вид доставки к лизосомам производных, расположенных в цитозоле – криниофагия. В этом случае первичные лизосомы соединяются непосредственно с секреторными гранулами, расположенными в клетке, и расщепляют биологически активные вещества до конечных продуктов. Во время криниофагии расщеплению подвергаются с одной стороны не использованные секреторные гранулы, а с другой стороны – секреторные, по каким либо причинам изменившие свой состав. Примером может служить расщепление лизосомами гранул гормона пролактина в маммотропных клетках передней доли гипофиза матери, после прекращения грудного вскармливания ребенка.
Лизосомы |
некоторых |
клеток с помощью экзоцитоза |
доставляют |
ферменты, |
находящиеся в |
их составе |
в межклеточное пространство. |
Примером может служить |
|
поступление в межклеточную среду фермента коллагеназы, синтезируемого костеразрушающими клетками (остеокластами), которые участвуют в расщеплении коллагеновых волокон в межклеточной среде в процессе формирования костей. В то же время чрезмерное поступление лизосомальных ферментов в межклеточную среду является причиной начала воспалительного процесса в суставах (артритов).
Роль лизосомальных ферментов в клеточном метаболизме отчетливо видна во время патологических процессов, возникших в результате нарушения их синтеза. В настоящее время известно две группы болезней, связанных с лизосомами. Одна из них – болезнь клеточных включений (inclusion cell disease), вторая – лизосомные болезни накопления
(lysosomal storage disorders).
Вслучае болезни клеточных включений ( ее также называют I- клеточная болезнь), изза отсутствия в комплексе Гольджи фермента трансферазы в составе прогидролаз отсутствует группа манноза-6-фосфат (см.ранее). Поэтому несмотря на то, что ферменты гидролаз при помощи экзоцитоза покидают клетку, они не могут поступать в состав лизосом.
Утаких больных в клетках начинают скапливаться зернистые включения, которые приводят к их функциональным нарушениям. Клинически у таких больных наблюдается физическое недоразвитие и отставание интеллекта.
Вслучае лизосомных болезней накопления, в результате мутации генов не синтезируется один или несколько лизосомных ферментов. Поэтому макромолекулы, которые должны были расщепляться данными ферментами, накапливаются в клетке. Количество лизосом с нерасщепленными макромолекулами постепенно возрастает, что приводит вначале к функциональным нарушениям, а в итоге и к деструктивным изменениям в клетке. В настоящее время известно около 30-ти лизосомных болезней накопления, передающихся по наследству. Среди них всесторонне изученными являются – болезнь Тей-Сакса и болезнь Помпе.
Во время болезни Тей-Сакса в лизосомах наблюдается нехватка фермента гексоаминидазы А, вследствие чего в нервных клетках накапливаются лизосомы, имеющие в своем составе много нерасщепленных GM2-ганглиозидов. У детей, страдающих данной болезнью наблюдается недоразвитие нервной системы и продолжительность их жизни составляет не более 3х лет.
Во время болезни Помпе в составе лизосом не обнаруживается фермент α-глюкозидаза, участвующий в расщеплении молекул гликогена до глюкозы. В результате этого в

154
поперечнополосатых мышцах, сердце и мозге обнаруживается большое количество скопившегося гликогена. Данная болезнь обнаруживается в раннем возрасте и проявляется увеличением печени (гепатомегалия).
Протеасомы
Если лизосомы участвуют в переваривании различных биополимеров, то протеасомы расщепляют лишь отдельные молекулы белков. К последним относятся – нормальные белки, завершившие свою функцию (обладающие непродолжительным сроком жизни), либо белки, подвергшиеся денатурации, принявшие неверную конфигурацию, не свойственные клетке (антигены) и т.д. В отличие от лизосом протеасомы располагаются как в циоплазме, так и в нуклеоплазме. В одной клетке насчитывается около 30 тыс. протеасом.
Протеасомы состоят из больших белковых комплексов (26S), имеют в центре цилиндрическую сердцевину (20S), а на концах с одной или с обеих сторон, располагаются верхушки неопределенной формы (рис. 4.24). У млекопитающих длина сердцевины составляет 15 нм, диаметр – 11 нм, в центре находится полость размером 5 нм, имеющая 4 сужающиеся части. При помощи данных сужений полость разделяется на три части. Ферменты, имеющие протеолитическую активность и расщепляющие белки до пептидов располагаются в β-субъединицах, окружающих центральную камеру (см.ниже).
Рис.4.24. Модель пространственного строения протеасомы (26S). Сверху и снизу располагаются верхушки (красного цвета). В центре находится сердцевина (20S), состоящая из α – субъединиц ( желтого цвета) и β – субъединиц (синего цвета).
Стенку сердцевины составляют 4 белковых кольца, каждый из которых состоит из 7 субъединиц. В двух центральных кольцах расположены β-субъединицы (рис.4.24, синего цвета), а в крайних – α-субъединицы (рис. 4.24,желтого цвета).
Верхушечная часть протеасом состоит из регулирующих белковых комплексов. Она участвует в доставке белков, предназначенных для расщепления, к каналу внутри сердцевины, а также в выводе пептидов, являющихся продуктами расщепления.
155
Следует отметить что белки, предназначенные для расщепления (белки-мишени), могут образовывать связи с протеасомами лишь после соединения (мечения) их с белком убиквинтином. Он был выявлен многими авторами и описывался под различными названиями. Однако в 1980-ом году К.Д. Вилкинсон с сотрудниками предложили назвать его убиквинтин (Ubique – везде, повсюду).
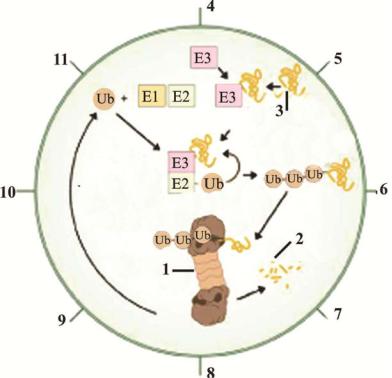
Рис.4.25. Схематический рисунок механизма убиквинтин-опосредованного расщепления белка и участия данного процесса в жизнедеятельности клетки. The Nobel Prize in Chemistry 2004 Advanced information http://nobelprize.org/chemistry/laureates/2004/chemadv04.pdf
1- протеасома; 2- пептиды; 3- белок-мишель; 4- определение транскрипции; 5- репарация ДНК; 6- модуляция рецепторов; 7- метаболизм; 8- контроль за качеством; 9- передача сигнала; 10иммунный ответ; 11клеточный цикл.
Убиквинтин является небольшим белком, состоит из 76 аминокислот и имеет неизменную структуру. Мечение белков-мишеней убиквинтином называется процессом убиквинации и протекает этот процесс в три этапа (рис.4.25).
На первом этапе фермент Е1 (Е – взято от начальной буквы английского слова enzym,
обозначающего фермент) с помощью энергии АТФ присоединяет убиквинтин (Ub) к своей сульфгидрильной группе (SH), тем самым активировав его (Е1- S- Ub). Поэтому фермент Е1 называют - убиквинтин связывающий фермент. Далее, без участия АТФ, фермент Е1
замещается Е2- убиквинтин переносящим ферментом (Е2- S- Ub).
На втором этапе фермент Е3 соединяется сначала с белком-мишенью, а после с Е2- S- Ub. Фермент Е3, имеющий убиквинтин-лигазную активность, соединяет находящийся в составе данного комплекса убиквинтин с белком-мишенью. Т.к. данный процесс повторяется, фермент Е3, играющий роль катализатора, обеспечивает присоединение нескольких молекул убиквинтина к белку-мишени. (рис 4.24). Следует отметить, что белки-
156
мишени, соединившиеся лишь с одной молекулой убиквинтина, не образуют связь с протеасомами.
Во время третьего этапа подвергшиеся убиквинации белки-мишени теряют связь с ферментом Е3 и с этого момента они называются “меченными” белками. Метки (полиубиквинтиновая цепь) носят различные названия (“поцелуй смерти”, “метка смерти”, “черная метка”), но основной смысл заключается в том, что белки меченные подобным образом связываются с протеасомами и расщепляются до коротких пептидов.
Из представленного материала следует, что в мечении белков принимают участие три вида ферментов (Е1, Е2, Е3). В клетках млекопитающих функционируют один или несколько Е1 ферментов, несколько различных Е2 фермента, и несколько сотен различных Е3 фермента. Также была разработана технология возможности протекания данных процессов вне клетки.
После того как белки подвергшиеся полиубиквинации опознаются регулирующей частью верхушки протеасомы, фермент, имеющий изопептидазную активность отделяет убиквинтиновую цепь от белка-мишени и помогает ему переместиться в канал, расположенный в сердцевине протеасомы. Как было сказано выше белки-мишени, расщепляясь в канале сердцевины до пептидов, состоящих из 7-9 аминокислот, поступают в цитозоль.
Убиквинтин-опосредованное расщепление белков принимает активное участие (рис.4.24) практически во всех процессах, обеспечивающих жизнедеятельность клетки (проведение сигналов, иммунные ответные реакции, клеточный цикл, регуляция процесса транскрипции, восстановление ДНК, модуляция рецепторов, процессы метаболизма и т.д.) Также было установлено, что 30% вновь синтезированных белков избирательно расщепляются протеасомами до пептидов. Это указывает на то, что последние являются системой контроля качества.
Учитывая особые заслуги в изучении механизма убиквинтин-опосредованного расщепления белков, все три автора - А.Чехановер, А.Гершко и И.Роуз, были в 2004-м году удостоены Нобелевской премии. Подробно с данной информацией можно ознакомиться в статье комитета Нобелевской премии в области химии Шведской Королевской Академии Наук (см. список литературы).
Пероксисома
Пероксисомы окружены одним слоем мембраны, их матрикс представлен гомогенными зернистыми структурами, имеющих различную плотность (рис. 4.26). Они имеют шарообразную или овальную форму с диаметром от 0.2 до 1.5мкм. Самое большое количество пероксисом, имеющих диаметр 0.5 мкм и выше, встречается в основном в клетках печени и почек.
157
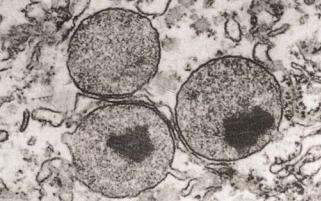
Рис.4.26. Электронно-микроскопическое строение пероксисом в клетках печени крысы. В составе двух из трех пероксисом имеется фермент урат окидаза, обладающий плотной кристалоидной консистенцией.
В мембране и матриксе пероксисом встречаются белки, свойственные лишь данным органеллам. Большинство этих белков синтезируются в полирибосомах цитозоля, имеют особые сигнальные участки, которые способны связываться с рецепторными белками стенки пероксисом, результатом чего становится поступление их в состав мембраны, либо в матрикс. Малая часть белков, входящих в состав мембраны пероксисом, синтезируется в шероховатой эндоплазматической сети.
В матриксе пероксисом имеется более 50-ти ферментов участвующих в процессах окисления. Во время протекающих здесь окислительных процессов происходит не синтез АТФ, как в митохондриях, а процессы внутриклеточного синтеза (анаболического) и расщепления (катаболического). К анаболическим процессам относится синтез в пероксисомах желчных кислот и холестерина, а к катаболическим – β-окисление цепи жирных кислот.
Окислительные ферменты, расположенные в матриксе пероксисомы (гидроксид оксидаза, D- и L-оксидаза, каталаза, урат оксидаза и т.д.), отделяют протон водорода из состава различных биополимеров и соединяют его с молекулярным кислородом (О2). В результате этого образуется пероксид водорода (Н2 О2), представляющий опасность и для самой клетки. Однако присутствующий в матриксе пероксисом фермент каталаза поддерживает концентрацию пероксида водорода в пределах нормы. Т.о. при помощи фермента каталазы из 2 молекул пероксида водорода образуется либо вода и молекулы кислорода (2 Н2 О2 каталаза 2 Н2 О + О2), либо происходит окисление другого органического вещества (Н2О2 + XH2 каталаза 2 Н2 О + X ; X- какое – либо органическое вещество). Пероксид водорода играет важную роль в детоксикации многих веществ, представляющих организму угрозу, а также в уничтожении микроорганизмов.
В пероксисомах присутствуют ферменты принимающие участие в β-окислении длинных цепей жирных кислот. Под действием данных ферментов происходит расщепление жирных кислот с образованием описанного выше пероксида водорода и ацетил-коэнзима А (СоА). Молекулы ацетил – СоА в клетке используются для разных целей, в том числе при синтезе АТФ. Определенная часть ацетил – СоА покидает клетку и может использоваться соседними клетками.
158
Средняя продолжительность жизни пероксисом составляет 5-6 дней. Несмотря на то, что пероксисомы не имеют собственного генома, они, как и митохондрии увеличивают свое количество путем деления. Т.о. пероксисомы, увеличиваясь из-за поступления в них синтезированных в цитозоле белков, делятся на две части.
Цитоплазматические включения
В цитоплазме наряду с органеллами обнаруживаются структуры, встречающиеся не во всех типах клеток и характеризующиеся своей нестабильностью (то появляются, то пропадают). Их называют включениями. Раньше включения рассматривались как скопления производных синтезированных в клетке, либо поступивших в нее другими способами и не имеющих значения для ее жизнедеятельности. В данное время нет никаких сомнений, что включения являются важными структурами, обеспечивающими нормальную деятельность определенных групп клеток. Большинство из них имеют эндогенную природу и синтезируются самими клетками. В качестве примера можно указать гликоген, жировые капли, проферменты, некоторые пигменты и кристаллы. Наряду с ними существует также экзогенная (поступившие в клетку извне) группа включений. Среди них относящийся к липохромным включениям каротин (окрашивающий липиды), тяжелые металлы (напр. серебро и свинец), частички пыли асбеста, силиката, углерода и т.д.
Многие авторы относят к включениям скопления продуктов питания, некоторых пигментов и кристаллов, не зависимо от метода их поступления в клетку.
К включениям, имеющим в своем составе белки, относятся секреторные пузырьки. Подробная информация о них была дана при описании комплекса Гольджи.
Являющиеся продуктами питания углеводы накапливаются в клетках в виде гликогена, а липиды – в виде жировых капель. Гликоген образуется в результате полимеризации всосавшейся в кишечнике глюкозы и скапливается в основном в клетках печени, в волокнах поперечнополосатых мышц и в корковом веществе надпочечников. В результате того, что гликоген легко растворяется в воде, его невозможно обнаружить при помощи обычных гистологических методов, а лишь с помощью особых методов окраски. К ним относится окрашивание кармином по Бесту и методом Шиффа – йодной кислотой. Кармин Беста окрашивает гранулы гликогена в красный, а реактивы йодной кислоты Шиффа – в ярко красный или малиновый цвет.
При электронной микроскопии гранулы гликогена, по своим размерам |
и |
топографическому положению, делятся на два вида: α-гранулы и β- гранулы (рис. 4.27). |
|
159
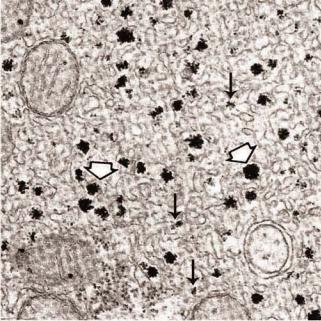
Рис.4.27. Электронно-микроскопический снимок гранул гликогена, расположенных возле трубочек гладкой эндоплазматической сети клеток печени. Белой стрелкой показаны α-
гранулы, а черной стрелкой – β-гранулы (Cardell RR Jr. Smooth endoplasmic reticulum in rat hepatocytes during glycogen deposition and depletion. İnt Rev Cytol. 1977, 48, p.221-79).
α- гранулы имеют большие размеры (80-90 нм) и плотно прилегают друг к другу образуя структуру, напоминающую гроздь или розетку (рис. 4.27, указаны белой стрелкой).
β- гранулы отличаются от α- гранул меньшими размерами (около 30 нм) и тем, что располагаются они не в виде скоплений, а по отдельности (рис. 4.27, указаны черной стрелкой).
α- гранулы встречаются в печени, а β- гранулы – в клетках мышц. Гранулы гликогена часто располагаются возле трубчатых цистерн гладкой эндоплазматической сети.
Капли жира – являются производными, имеющими в своем составе скопления триглицеридов, жирных кислот, холестерина и эфиров холестерина. Кроме жировых клеток (адипоцитов) они встречаются также в клетках печени и в органах синтезирующих стероидные гормоны (в корковом веществе надпочечников и половых железах). Если в случае жировых клеток вся цитоплазма представлена одной крупной жировой каплей, то в других группах клеток встречаются жировые капли различных размеров и количества.
Жировые капли не имеют мембрану, но наличие элементов цитоскелета по всему периметру капли, препятствует их соединению друг с другом (рис. 4.28).
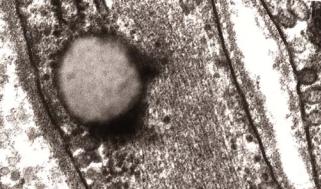
160
Рис.4.28. Электронно-микроскопический снимок капли жира в клетке гладкой мышцы.
Т.к. липиды растворяются в органических растворителях, используемых во время приготовления гистологических препаратов, видны бывают не сами жировые капли, а пустые вакуолеподобные структуры на месте занимаемого ими пространства. Чтобы предотвратить экстракцию липидов, необходимо произвести фиксацию исследуемых структур в осмиевой кислоте (OsO4). В этом случае липидные капли окрашиваются в черный или темно каштановый цвет. Жировые капли также обнаруживаются при окрашивании замороженных и фиксированных в формалине срезов с помощью Судана черного, Судана III-IV, Шарлаха красного.
Основной запас энергии организма представляют липиды. Количество молекул АТФ, образованных при использовании 1 грамма жира, в два раза больше, чем при использовании равного количества гликогена.
Внутриклеточные компоненты, обнаруживаемые благодаря своему природному цвету, без помощи какого-либо способа окраски, называются пигментными включениями. К ним относятся все экзогенные (см.выше) и некоторые эндогенные (гемоглобин и продукты его распада, меланин, липофусцин) включения.
Т.к. экзогенные включения растворяются в липидах (липохромы), они окрашивают компоненты находящиеся с ними в контакте в свойственный им цвет. Примером экзогенных включений растительного происхождения может служить каротин. Окрашивание жира человека и желтка яиц в желтый цвет, связано с присутствием в них каротина. Некоторые формы каротина участвуют в синтезе витамина А в организме.
Широко распространенными среди экзогенных пигментных включений являются частички пыли (уголь, асбест, силикат и т.д.) Они поступают в организм в основном с воздухом и окрашивают воздухоносные пути в свойственный им цвет, а также являются причиной развития различных патологических процессов в органах.
Среди неорганических веществ, скопления серебра и свинца могут являться причиной изменения цвета органов. Скопление солей серебра в коже, является причиной окрашивания ее в сероватый цвет. При увеличении количества свинца в организме, на деснах образуется каемка синего цвета.
Самыми широко распространенными среди эндогенных пигментных включений являются находящиеся в составе эритроцитов пигменты гемоглобина и продукты его
